Эколого-физиологические исследования фотосинтеза и сопряженных процессов в лишайниках (обзор)
Автор: Головко Т.К., Шелякин М.А.
Журнал: Известия Коми научного центра УрО РАН @izvestia-komisc
Рубрика: Научные статьи
Статья в выпуске: 9 (75), 2024 года.
Бесплатный доступ
Лишайники - древнейшие симбиотические организмы. Их талломы представляют собой структуру, созданную микобионтом для популяции клеток фотобионта, присутствие которой превращает грибной гетеротрофный организм в автотрофную ассоциацию. В статье обобщены результаты эколого-физиологических исследований лишайников таежной зоны европейского Северо-Востока России. Представлены и проанализированы данные о фотосинтетической активности, влиянии факторов внешней среды на поглощение СО2 и реакциях, направленных на тонкую настройку функциональной структуры и метаболизма лишайников к условиям обитания. Продемонстрирована значимость типа фотобионта для функционирования всей ассоциации. Показано, что цианобионтные лишайники отличались более высоким содержанием азота и интенсивным метаболизмом по сравнению с хлоролишайниками. У большинства исследованных видов лишайников содержание хлорофилла а варьировало в пределах 0,4-0,8 мг/г сухой массы таллома, концентрация каротиноидов была в 2,5-3 раза меньше. Максимум нетто-поглощения СО2 наблюдался при температуре +15...+20 оС и относительном содержании воды в талломах около 60 %. Насыщение фотосинтеза светом отмечали при плотности потока ФАР в четыре-пять раз меньше полной солнечной. Выявлены эффекты воздействия на талломы УФ-радиации и загрязнения среды бокситовой пылью. Намечены перспективные направления дальнейших исследований лихенобиоты.
Лишайники, биология, физиология, фотосинтез, таежная зона, европейский северо-восток России
Короткий адрес: https://sciup.org/149147252
IDR: 149147252 | УДК: 582.29+581.1+581.132+58.01/.07 | DOI: 10.19110/1994-5655-2024-9-5-12
Текст научной статьи Эколого-физиологические исследования фотосинтеза и сопряженных процессов в лишайниках (обзор)
Лишайники – древнейшие организмы, они известны с докембрийских времен. Более 200 млн лет назад талломы лишайников уже представляли собой высокоразвитые
1 По материалам пленарного доклада на Международной конференции «Лишайники: от молекул до экосистем» (Сыктывкар, 1–5 июля, 2024).
листоватые и кустистые формы [1]. Известный русский ботаник, один из основоположников отечественной физиологии растений А. С. Фаминцын видел в лишайниках пример происхождения более сложной растительной формы через соединение и взаимодействие более простых [2]. Он фактически положил начало физиологическим исследо- ваниям этих уникальных фототрофных организмов и получил ценный материал для понимания их биологии.
Согласно современным представлениям, лишайники – устойчивый симбиоз генетически обособленных организмов. Их талломы представляют собой структуру, созданную микобионтом для популяции клеток фотобионта. Присутствие фотобионта превращает грибной гетеротрофный организм в автотрофную ассоциацию. Наиболее распространенными группами лишайниковых фотобионтов являются зеленые водоросли и цианопрокариоты, способные к осуществлению оксигенного фотосинтеза [3].
Зеленые водоросли поставляют клеткам микобион-та сахароспирты, тогда как цианобактерии – глюкозу и продукты биологической азотфиксации [4, 5]. Благодаря этому талломы цианолишайников содержат больше азота по сравнению с талломами хлоролишайников. По нашим данным [6], концентрация азота в сухой массе талломов цианолишайников составляла в среднем 3,5 %, тогда как у хлоролишайников была в четыре раза меньше. У лишайников с обоими типами фотобионта зеленые водоросли, как правило, осуществляют фотосинтез, а цианобактерии – азотфиксацию. Содержание азота в лишайниках с зеленой водорослью и цианопрокариотами составляет в среднем около 2,3 %. Так, например, у трехкомпонентного лишайника Lobaria pulmonaria на долю сахароспиртов приходилось 75 % пула сахаров, а содержание азота было немногим выше 2 % сухой массы таллома [7]. Лишайники с высоким содержанием азота характеризовались повышенным накоплением белковых и свободных аминокислот [8], что коррелировало с их более высокой метаболической активностью и способностью к быстрому росту. Микобионт может регулировать численность популяции клеток фотобионта, стимулировать синтез и выделение продуктов ассимиляции. Однако механизмы такой регуляции доподлинно неизвестны. По некоторым оценкам, микобионт получает 40–50 % всего ассимилированного клетками фотобионта углерода, значительная часть которого используется грибным компонентом для дыхания и синтеза лишайниковых веществ. Лишайниковые вещества концентрируются на поверхности гиф микобионта и могут составлять от 1 до 5 % сухой массы таллома [9].
Фотосинтетический аппарат (далее – ФСА) зеленых водорослей практически идентичен таковому высших растений [10]. Процесс фотосинтеза протекает с участием трех основных компонентов: светособирающей антенны (далее – ССК), фотохимических реакционных центров (далее – РЦ) и электрон-транспортной цепи (далее – ЭТЦ). Фотосинтетическими пигментами водоросли являются хлорофиллы а (Хл а ) и b (Хл b ). Практически весь Хл b находится в наружных антеннах фотосистемы II, тогда как большая часть Хл а принадлежит РЦ. У цианобактерий функцию Хл b в антенных структурах (фикобилисомах) выполняют билиновые пигменты, имеющие, в отличие от циклической структуры Хл, незамкнутую цепь тетропи-роллов. Каротиноиды присутствуют у всех фотосинтезирующих организмов.
Диапазон концентраций Хл а в талломах исследованных нами двух десятков видов лишайников находился в пределах от 0,16 до 1,3 мг/г сухой массы [11]. Виды с низким и высоким содержанием хлорофилла были обнаружены как среди хлоро-, так и среди цианолишайников. У большинства лишайников количество Хл а составляло 0,4–0,8 мг/г при медианном значении около 0,60 мг/г. Концентрация каротиноидов была в 2,5-3 раза меньше, чем зеленых пигментов. При этом талломы с высоким содержанием хлорофиллов накапливали больше каротиноидов. Между накоплением зеленых и желтых пигментов существует прямая связь (r=0,96). Так как подавляющая часть (85–90 %) биомассы талломов представлена гетеротрофными клетками микобионта, то по содержанию фотосинтетических пигментов лишайники сильно уступают листьям высших растений. Например, у лишайника L. pulmonaria четко очерченный альгальный слой составлял ~17 % (46±6 мкм) толщины таллома, клетки зеленой водоросли имели в диаметре 4,5±0,7 мкм [7].
Лишайники принято относить к фототрофным организмам со сравнительно низкой фотосинтетической активностью. У гидратированных и адаптированных в оптимальных условиях исследованных нами видов лишайников скорость видимого поглощения СО2 (Фн) варьировала в широких пределах – от 0,5 до 5 мг/г сухой массы ч. При этом лишайники с высоким содержанием азота характеризовались более интенсивным фотосинтезом.
Анализ с использованием метода главных компонент показал, что функциональные параметры исследованных нами 16 видов лишайников группируются относительно двух компонент, которые суммарно описывают 76 % их изменчивости (рис. 1). Результаты анализа свидетельствуют о тесной взаимосвязи между интенсивностью нет-то-фотосинтеза, содержанием азота и типом фотобионта (главная компонента 1). Взаимосвязь между содержанием зеленых и желтых пигментов определялась принад-
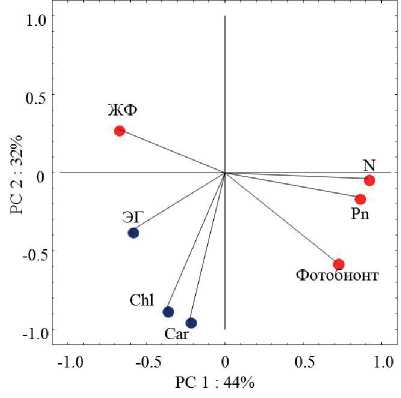
Рисунок 1. Анализ функциональных параметров 16 видов лишайников с использованием метода главных компонент.
Условные обозначения. Pn – нетто-поглощение СО2; N – азот; Chl – хлорофилл; Car – каротиноиды; ЖФ –жизненная форма; ЭГ – экологическая группа; РС1 - главная компонента 1( в ); РС2 - главная компонента 2 ( • ).
Figure 1. The analysis of functional parameters for 16 lichen species using the method of principal components.
Keys:Pn –СО2netuptake; N– nitrogen;Chl–chlorophyll;Car–carotenoids; ЖФ– life form; ЭГ - ecological group; РС1 - principal component ]( • ); РС2 -principal component 2 ( • ).
лежностью лишайников к экологической группе по типу субстрата (главная компонента 2). Кластерный анализ функциональных параметров (переменных), вносящих основной вклад в главные компоненты, разделил изученные виды на две группы (рис. 2). В первую вошли все циано-бионтные виды (1), а вторая группа разделилась еще на два кластера: хлоролишайники (2) и лишайники с двумя типами фотобионтов (3). Эти результаты свидетельствуют об определяющей значимости типа фотобионта для функционирования всей лишайниковой ассоциации.
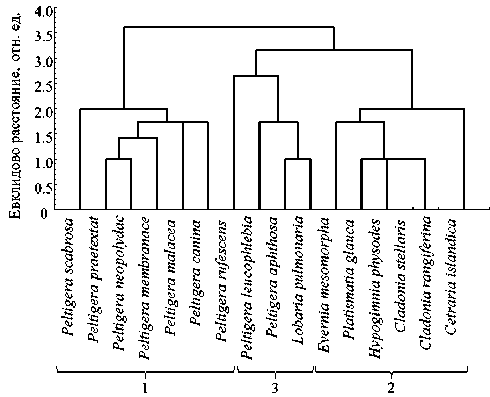
Рисунок 2. Кластерное распределение изученных видов лишайников на основе значений функциональных параметров, вносящих основной вклад в дисперсию при анализе главных компонент (см. рис. 1). Изученные виды подразделились на две группы: первая объединила все циа-нобионтные виды (1), вторая группа разделилась еще на два кластера: хлоролишайники (2) и лишайники с обоими типами фотобионтов (3).
Figure 2. Cluster distribution of the study lichen species by the values of functional parameters that mainly contribute to dispersion during the principal component analysis (see Figure 1). The study species divided into two groups. The first group unified all cyanobionts (1), the second group subdivided into the further two clusters: chlorolichens (2) and lichens with both types of photobionts (3).
Лишайники являются пойкилогидрическими организмами и устойчивы к действию неблагоприятных факторов [12, 13]. Они доминируют в крайних местообитаниях (Арктика, Антарктида, пустыни, высокогорья), но наиболее благоприятными для обитания лишайников являются леса, о чем свидетельствует высокое биологическое разнообразие лихенобиоты в бореальной зоне [14].
Результаты наших исследований зависимости нет-то-поглощения СО2 от температуры, освещенности и содержания воды в талломах согласуются с отмеченными ранее другими авторами фактами повышения метаболической активности и роста бореальных видов лишайников в весенний и осенний периоды с умеренно теплой и влажной погодой. Летом при высокой температуре и низкой влажности среды талломы быстро теряют влагу и в дневные часы у них часто наблюдается выделение СО2, что обусловлено преобладанием дыхания микобионта над ассимиляционной активностью клеток фотобионта. Максимальные величины нетто-поглощения СО2 были зарегистрированы нами при температуре талломов +15...+20 оС, относительном содержании в них воды около 60 % и плот- ности потока ФАР почти на порядок ниже полной солнечной [15, 16].
Прямой солнечный свет с высокой долей УФ-излучения, особенно в сочетании с повышенной температурой, неблагоприятен для жизнедеятельности лишайников. Для защиты от избыточной радиации лишайники используют целый ряд механизмов, включая синтез защитных пигментов [17–19]. Нами проведено сравнительное изучение влияния УФ-B облучения на про-/антиоксидантный метаболизм трехкомпонентного лишайника Peltigera aphthosa и цианолишайника P. rufescens [20]. P. rufescens – по-лизональный вид с более широким географическим распространением, чем P. aphthosa , являющаяся циркумполярным видом. Талломы P. rufescens были отобраны на лугу, где они подвергались действию высокой инсоляции и температуры. В природных местообитаниях талломы P. rufescens получали на порядок более высокие дозы УФ-радиации, чем P. aphthosa , обитающая в затененных и влажных участках леса. Ежедневное в течение 10 дней облучение лишайников биологически эффективной дозой УФ-B радиации (14 кДж) приводило к накоплению в талломах продуктов перекисного окисления липидов, что является одним из показателей нарушения про-/антиоксидант-ного баланса клеток и развития окислительного стресса. Следует отметить, что, по сравнению с P. aphthosa, талломы P. rufescens изначально отличались более высоким содержанием продуктов липопероксидации и накапливали гораздо меньшее их количество с увеличением суммарной дозы УФ-B радиации. Это свидетельствует о более высокой способности P. rufescens поддерживать окислительно-восстановительный баланс, что, вероятно, обусловлено адаптацией к более жестким свето-температурным условиям обитания. Облучение P. rufescens вызывало дозозависимое усиление активности суперок-сиддисмутазы (далее – СОД), фермента, катализирующего реакцию дисмутации агрессивного супероксидного ани-он-радикала до молекулярного кислорода и стабильного пероксида водорода. Талломы P. aphthosa в контроле и опыте проявляли низкую активность СОД.
У обоих видов лишайников отмечали дозозависимое увеличение активности и повышение доли дыхания по энергетически малоэффективному альтернативному пути (далее – АП). Цитохромное дыхание, функционирование которого сопряжено с образованием энергии, снижалось. При этом эффект УФ-B на дыхание был более выражен у P. aphthosa, в талломах которой под влиянием облучения интенсивно накапливались продукты перекисного окисления липидов и не происходило усиления активности СОД. На возможное участие АП дыхания в адаптации лишайников к действию стресса указывали и некоторые другие исследователи [21]. По нашему мнению, вовлечение АП под действием УФ-B радиации может быть обусловлено его функцией в качестве компонента антиоксидантной системы, предотвращающего перевосстановление дыхательной электрон-транспортной цепи и, следовательно, генерацию избыточного количества активных форм кислорода. С другой стороны вовлечение АП может способствовать поддержанию активности цикла ди- и трикар- боновых кислот как источника образования множества метаболитов, участвующих в различных биосинтезах, связанных с процессами репарации, и защитных экранирующих веществ. Поскольку подавляющая часть массы таллома лишайников приходится на грибной компонент, то изменения в соотношении дыхательных путей под влиянием УФ-B мы связываем с реакцией микобионта. Исследования, выполненные на клетках зеленой водоросли, изолированных после облучения талломов P. aphthosa, подтвердили это предположение [22]. Полученные данные прямо указывают на участие антиоксидантной системы и дыхания в формировании устойчивости лишайников к УФ-B излучению и, следовательно, сохранении способности к фотосинтезу.
На примере модельного вида L. pulmonaria нами установлены закономерности изменения функциональных параметров ФСА фотобионта и адаптивные реакции энерго-пластического метаболизма лишайника в годичном цикле [23]. Показано, что отобранные в зимний период (январь) образцы проявляли фотохимическую активность и способность ассимилировать СО2 после кратковременной гидратации и акклимации в комнатных условиях. Уже в первые минуты потенциальный квантовый выход фотосистемы II ( F v/ F m) превышал 0,5 отн. ед, а спустя 1 ч достигал 0.7 отн. ед., что близко к максимальным значениям F v/ F m, зарегистрированным у хлоробионтных лишайников [24]. Скорость нетто-поглощения СО2 восстанавливалась медленнее, и только спустя 20 ч с начала акклимации достигала величин, свойственных гидратированным талломам в оптимальных свето-температурных условиях. Полученные результаты свидетельствуют о высокой сохранности ФСА в зимний период и способности к быстрому восстановлению фотосинтеза с наступлением благоприятных условий среды.
Лишайники являются наиболее распространенными объектами биоиндикации [25]. При лихеноиндикации чаще всего оценивают видовое разнообразие, обилие и жизненное состояние лишайников. Снижение численности, встречаемости, репродуктивности, появление некрозов и хлорозов и, наконец, исчезновение лишайников – результат крайнего загрязнения среды. Применение эколого-физиологических методов и подходов позволяет уловить первые признаки нарушения процессов жизнедеятельности еще до появления видимых повреждений талломов. На примере лишайников, обитающих в зоне бокситового рудника, было показано, что содержание в их талломах железа и алюминия превышало фоновые значения в десятки раз. При этом подавляющая часть поллютантов была локализована на поверхности верхнего корового слоя талломов в виде слабозакреплен-ных твердых пылевых частиц. Относительно небольшая часть проникала в таллом и была ассоциирована с гифами медуллярного слоя микобионта [26]. Оседание твердых частиц бокситовой пыли на поверхности талломов приводило к снижению скорости ассимиляции CO2, что, по всей видимости, обусловлено физическим затенением, нежели прямым негативным влиянием поллютантов на клетки фотобионта. Это подтверждается отсутствием влияния загрязнения на содержание фотосинтетических пигментов и функциональные параметры ФС II. При этом у лишайников в импактной зоне отмечали усиление вовлечения энергетически малоэффективного альтернативного дыхания, накопление продуктов липоперо-ксидации, увеличение содержания пероксида водорода и повышение уровня активности ферментов, участвующих в нейтрализации активных форм кислорода [27, 28]. Такие симптомы можно рассматривать как предупредительный сигнал о негативных изменениях в окружающей среде для лихенобиоты как важного компонента лесных экосистем. Следовательно, функциональные показатели могут служить чувствительным индикатором стресса и нарушения процессов жизнедеятельности лишайников в условиях антропогенного загрязнения среды задолго до появления видимых повреждений талломов.
Заключение
Полученные нами результаты существенно дополняют информацию об эколого-биологических свойствах и современном состоянии лихенобиоты таежной зоны, углубляют представления о защитных реакциях лишайников и влиянии факторов среды на функциональную активность компонентов лишайникового симбиоза, свидетельствуют о значимости типа фотобионта для всей ассоциации.
К настоящему времени нашими исследованиями было охвачено немногим более 20 видов лишайников, преимущественно листоватой жизненной формы. Учитывая богатый видовой состав лихенобиоты, ее роль в растительных сообществах и экосистемах таежной зоны, представляется целесообразным продолжить исследования лишайников, сочетая классические эколого-физиологические методы и подходы с молекулярными. Актуальными, на наш взгляд, являются следующие направления: 1) сравнительное изучение фотосинтеза и сопряженных процессов у лишайников с разным типом фотобионтов; 2) выявление физиологических и молекулярных механизмов адаптации симбионтов и оценка их вклада в формирование устойчивости лишайников; 3) изучение систем сигналинга и взаимодействия между компонентами лишайникового симбиоза; 4) характеристика метаболома и изучение вторичного метаболизма лишайников, выявление роли лишайниковых веществ в поддержании устойчивости симбиоза.
Список литературы Эколого-физиологические исследования фотосинтеза и сопряженных процессов в лишайниках (обзор)
- Флора лишайников России: биология, экология, разнообразие, распространение и методы изучения лишайников / под ред.: М. П. Андреева и Д. Е. Гимельбрант. – Москва ; Санкт-Петербург: Товарищество научных изданий КМК, 2014. – 392 с.
- Манойленко, К. В. Академик А. С. Фаминцын: от фундаментальной науки к запросам сельского хозяйства / К. В. Манойленко // Сельскохозяйственная биология. – 2010. – Т. 45, № 1. – С. 117–121.
- Войцeхович, А. А. Фотобионты лишайников. I: Разнообразие, экологические особенности, взаимоотношения и пути совместной эволюции с микобионтом / А. А. Войцeхович, Т. И. Михайлюк, Т. М. Дариенко // Альгология. – 2011. – Т. 21. – С. 3–26.
- Honegger, R. Metabolic interactions at the mycobiontphotobiont interface in lichens / R. Honegger // Plant Relationships / eds. G. C. Carroll, P. Tiudzynsk. – Berlin Heidelberg: Springer, 1997. – P. 209–221.
- Nash III, T. H. Nitrogen, its metabolism and potential contribution to ecosystems / T. H. Nash III // Lichen biology / ed. T. H. Nash III. – Cambridge Univ.Press, 2008. – P. 216–251.
- Табаленкова, Г. Н. Элементный состав биомассы некоторых лишайников бореальной зоны на европейском Северо-Востоке / Г. Н. Табаленкова, И. В. Далькэ, Т. К. Головко // Известия Самарского научного центра Российской академии наук. – 2016. – Т. 18, № 2. – С. 221–225.
- Функциональная экология лишайника Lobaria pulmonaria (L.) Hoffm. в таежной зоне на европейском северо-востоке России / Т. К. Головко, И. В. Далькэ, О. В. Дымова [и др.] // Известия Коми научного центра УрО РАН. – 2018. – № 3 (35). – С. 23–33. – DOI: 10.19110/1994-5655-2018-3-23-33
- Табаленкова, Г. Н. Аминокислотный состав биомассы некоторых лишайников таежной зоны на европейском Северо-Востоке / Г. Н. Табаленкова, И. В. Далькэ, И. Г. Захожий // Известия Самарского научного центра Российской академии наук. – 2017. – Т. 19, № 2 (3). – С. 556–560.
- Радлане, Т. Особенности вторичного метаболизма и хемосистематика лишайников / Т. Рандланг, А. Сааг // Флора лишайников России: биология, экология, разнообразие, распространение и методы изучения лишайников. – Москва ; Санкт-Петербург: Товарищество научных изданий КМК, 2014. – С. 142–160.
- Blankenship, R. E. Molecular mechanisms of photosynthesis / R. E. Blankenship. – Blackwell Science Ltd., 2002. – 321 p.
- Фотосинтетические пигменты и азот в талломах лишайников бореальной флоры / Т. К. Головко, О. В. Дымова, Г. Н. Табаленкова [и др.] // Теоретическая и прикладная экология. – 2015. – № 4. – С. 74–80.
- Oliver, M. J. Desiccation-tolerance of plant tissues: A mechanistic overview / M. J. Oliver, J. D. Bewley // Horticultural Reviews. – John Wiley & Sons, Ltd, 1996. – P. 171–213. – DOI: 10.1002/9780470650608.ch3
- Kappen, L. Opportunistic growth and desiccation tolerance: the ecological success of poikilohydrous autotrophs / L. Kappen, F. Valladares // Handbook of Functional Plant Ecology / eds. F. Pugnaire, F. Valladares. – New York: Marcel Dekker, Inc., 1999. – P. 9–80.
- Пыстина, Т. Н. Лишайники таежных лесов европейского Северо-Востока: подзоны южной и средней тайги / Т. Н. Пыстина. – Екатеринбург: Уральское отделение РАН, 2003. – 239 с.
- Устойчивость лишайников бореальной зоны к воздействию природных и антропогенных факторов / Т. К. Головко, И. Г. Захожий, И. В. Далькэ [и др.] // Биологические аспекты распространения, адаптации и устойчивости растений: материалы Всероссийской научной конференции (с международным участием) (15–18 мая 2016 г., Саранск). – Саранск: Изд-во Мордовского ун-та, 2016. – С. 94–97.
- Головко, Т. К. Эколого-биологические и функциональные свойства лишайников таежной зоны европейского северо-востока России (обзор) / Т. К. Головко, М. А. Шелякин, Т. Н. Пыстина // Теоретическая и прикладная экология. – 2020. – № 1. – С. 6–13. – DOI: 10.25750/1995-4301-2020-1-006-013
- Photoprotection in lichens: adaptations of photobionts to high light / R. P. Beckett, F. Minibayeva, K. A. Solhaug, T. Roach / Lichenologist. – 2021. – Vol. 53. – P. 21–33. – DOI: 10.1017/S0024282920000535
- Beckett, R. P. Adaptations of lichens to fluctuating light – gaps in forest, gaps in our knowledge / R. P. Beckett, F. V. Minibayeva // Лишайники: от молекул до экосистем: материалы докладов Международной конференции (1–5 июля 2024 г., Сыктывкар) [Электронное издание]. – Сыктывкар, 2024. – C. 9–11. – DOI: 10.5281/zenodo.13284771
- Минибаева, Ф. В. Пигменты лишайников: «цветная» стратегия стрессовой устойчивости / Ф. В. Минибаева // Лишайники: от молекул до экосистем: материалы докладов Международной конференции (1–5 июля 2024 г., Сыктывкар) [Электронное издание]. – Сыктывкар, 2024. – C. 59–61. – DOI: 10.5281/zenodo.13284771
- Shelyakin, M. A. The effect of UV-B radiation on the antioxidant system in the Peltigera aphthosa and Peltigera rufescens lichens / M. A. Shelyakin, E. V. Silina, T. K. Golovko // J. Sib. Fed. Univ. Biol. –2021. – Vol. 14, N 3. – P. 328–338. – DOI: 10.17516/1997-1389-0359
- Beckett, R. P. Stress physiology and the symbiosis / R. P. Beckett, I. Kranner, F. V. Minibayeva // Lichen biology / ed. T.H. Nash III. – Cambridge: Cambridge University Press, 2008. – P. 134–151.
- UV-B induced changes in respiration and antioxidant enzyme activity in the foliose lichen Peltigera aphthosa (L.) Willd. / M. Shelyakin, R. Malyshev, E. Silina [et al.] // Acta Physiologiae Plantarum. – 2022. – Vol. 44. – Р. 116. – DOI: 10.1007/s11738-022-03457-9
- Photosynthetic and respiratory capacity of foliose lichen Lobaria pulmonaria throughout the annual cycle / M. A. Shelyakin, I. G. Zakhozhiy, I. V. Dalke [et al.] // Russian Journal of Plant Physiology. – 2021. – Vol. 68, N 6. – P. 1048–1058. – DOI: 10.1134/S1021443721060182
- Rasche, U. Evaluation of instant light-response curves of chlorophyll fluorescence parameters obtained with a portable chlorophyll fluorometer on site in the field / U. Rascher, M. Liebig, U. Lüttge // Plant Cell Environ. – 2000. – Vol. 23. – P. 1397. – DOI: 10.1046/j.1365-3040.2000.00650.x
- Бязров, Л. Г. Лишайники в экологическом мониторинге / Л. Г. Бязров. – Москва: Научный мир, 2002. – 336 с.
- Zakhozhiy, I. G. Accumulation and localization of metals in lichen thallus under conditions of dust pollution during open mining of boxite deposits / I. G. Zakhozhiy, M. A. Shelyakin // Russian Journal of Ecology. – 2024. – Vol. 55, N 1. – Р. 32–41. – DOI: 10.1134/S106741362401009
- Effects of dust pollution on photosynthesis and respiration parameters of lichens in the bauxite mine area / M. A. Shelyakin, I. G. Zakhozhiy, I. V. Dalke [et al.] // Russian Journal of Plant Physiology. – 2024. – Vol. 71. – Р. 116. – DOI: 10.1134/S1021443724605536
- Реакция лишайников на загрязнение среды при добыче бокситовой руды в таежной зоне / Т. К. Головко, М. А. Шелякин, И. Г. Захожий [и др.] // Теоретическая и прикладная экология. – 2018. – № 2. – С. 44–53. – DOI: 10.25750/1995-4301-2018-2-044/2-053/1


