Эколого-популяционные особенности окуня-клювача Sebastes mentella (Scorpaenidae) Норвежского моря на основе анализа его паразитофауны
Автор: Бакай Юрий Иванович, Попов Виктор Иванович
Журнал: Вестник Мурманского государственного технического университета @vestnik-mstu
Рубрика: Ихтиология
Статья в выпуске: 2 т.20, 2017 года.
Бесплатный доступ
Использованы результаты исследований, проведенных по итогам полного паразитологического вскрытия 669 особей окуня-клювача Sebastes mentella, выловленных в апреле - августе 1996-2009 гг. в десяти районах батиали и пелагиали Норвежского и Баренцева морей на глубине 100-600 м. На основе представленного ранее эколого-географического анализа фауны паразитов, встречаемости эктопоражений и половой зрелости S. mentella из этих районов подтвержден существовавший вывод о пополнении его скоплений в батиали (район Копытова) созревающими особями с востока и севера. Установлена взаимосвязь скоплений окуня-клювача в пелагиали и батиали севера Норвежского моря при доминировании миграции рыбы в пелагиаль. Состав фауны паразитов указывает на значительное ослабление связи пелагического окуня-клювача с придонными биоценозами. Это свидетельствует о его обитании в пелагиали Норвежского моря бóльшую часть годового жизненного цикла. Обосновано существование, в отличие от североатлантической популяции, массового возврата особей окуня-клювача из пелагиали в батиаль Норвежского моря, предполагаемого некоторыми исследователями. Сделан вывод о том, что скопления S. mentella в пелагиали Норвежского моря представляют собой пелагическую экологическую группу, формируемую рано созревающими особями. Придонную экологическую группу в батиали составляют поздно созревающие особи окуня-клювача. Особенности фауны паразитов и характеристики двух фенов свидетельствуют о самостоятельности норвежско-баренцевоморской популяции S. mentella. Однако установлено массовое проникновение в Норвежское море особей окуня-клювача из пелагиали моря Ирмингера (северная Атлантика), которые при последующем продвижении на северо-восток смешиваются с особями, происходящими из Баренцева моря.
Норвежское и баренцево моря, фауна паразитов, фены, миграции
Короткий адрес: https://sciup.org/14295005
IDR: 14295005 | УДК: 597.585.2-115(268.43) | DOI: 10.21443/1560-9278-2017-20-2-412-421
Текст научной статьи Эколого-популяционные особенности окуня-клювача Sebastes mentella (Scorpaenidae) Норвежского моря на основе анализа его паразитофауны
Окунь-клювач Sebastes mentella Travin, 1951 в последние десятилетия по интенсивности исследований и научных споров не уступает традиционным объектам промысла северо-восточной Атлантики. Имея обширный ареал (от побережья Канады до Баренцева моря и архипелага Шпицберген), он обитает на шельфе, в батиали и мезопелагиали [1]. Этот филогенетически молодой придонно-пелагический с внутренним оплодотворением живородящий медленно растущий вид имеет сложную популяционную структуру, обусловленную особенностями океанографических факторов и жизненного цикла [1–3]. Ему присущи разобщенность районов обитания молоди и половозрелых особей, протяженные миграции, широкий диапазон глубины обитания (100–1 250 м), наличие устойчивых экологических групп, приуроченных к различным биотопам [1; 2; 4].
Первая схема миграций S. mentella норвежско-баренцевоморской популяции предложена В. П. Сорокиным [5] и основана на материалах промысла окуня, распределения половозрелых и неполовозрелых особей [6], биологии размножения [7]. Согласно этой схеме после спаривания в шельфовых районах нагула в Баренцевом море созревающие самки окуня-клювача мигрируют на юго-запад и юг в район Копытова и, предположительно, выметывают личинок юго-западнее этого района в пелагиали. Затем они смещаются в обратном направлении в районы нагула. Позже уточнены районы вымета самками личинок: они расположены вдоль континентального склона от Медвежинской и Финмаркенской банок (северное побережье Норвегии) на севере до Шетландских о-вов на юге [8; 9]. Согласно другим данным [1; 10; 11] пелагическая молодь S. mentella дрейфует из районов нерестилищ в струях Северо-Атлантического течения в выростные районы в Баренцевом море и у архипелага Шпицберген. С возраста пяти лет начинается возвратная миграция окуня-клювача на континентальный склон, где доминируют его половозрелые особи.
Однако о популяционном статусе окуня-клювача, обитающего в мезопелагиали Норвежского моря в слое 150–800 м [1] над глубинами 2–3 тыс. м, имеются противоречивые данные. Согласно одним данным не найдено достоверных различий в составе и характере распределения аллелей ферментных локусов в пробах S. mentella из мезопелагиали морей Ирмингера (северная Атлантика) и севера Норвежского [12]. По другим – установлены значимые различия в частотах аллелей некоторых аллозимных локусов, таких как малик-энзим ( MEP* ) у окуня-клювача этих районов [13]. По данным микросателлитного анализа структуры ДНК высказано мнение о генетической близости пелагического S. mentella морей Ирмингера и Норвежского, склонов Фарерских о-вов и Норвегии [14], на основании которого предположена их принадлежность к единой метапопуляции [1; 15]. Существует мнение о происхождении пелагического окуня-клювача из Баренцева моря [2]. Нами [4; 16] установлена высокая мера сходства фауны паразитов S. mentella из пелагиали
Норвежского моря и баренцевоморского склона и отмечен вымет личинок самками окуня-клювача в пелагиали Норвежского моря в апреле на значительном удалении от континентального склона. Поэтому пока нет единого представления о популяционном статусе, структуре скоплений, жизненном цикле, миграциях, условиях формирования и взаимодействия между группировками S. mentella в Норвежском море.
Результаты наших исследований окуня-клювача позволяют продвинуться на пути к решению указанных проблем посредством применения эколого-паразитологических данных. Известно, что паразиты служат "естественными метками", используемыми для выделения локальных стад, познания особенностей питания, популяционной биологии, миграций и филогенетики рыб [17–19].
Цель настоящей работы – использование результатов анализа географического своеобразия фауны паразитов и эктопоражений окуня-клювача Норвежского моря и сопредельных вод в качестве индикаторов его популяционной структуры.
Материалы и методы
Использованы результаты собственных исследований [4], проведенных по итогам полного паразитологического вскрытия [20] 669 особей S. mentella, выловленных в апреле – августе 1996–2009 гг. в 10 районах Норвежского и Баренцева морей (рис. 1) на глубине 100–600 м. Регистрация эктопоражений (зараженность копеподой Sphyrion lumpi с учетом остатков ее инвазии, встречаемость кожных пигментных образований) проведена от 16 тыс. особей окуня-клювача в 1982–2016 гг. по оригинальной методике [21].
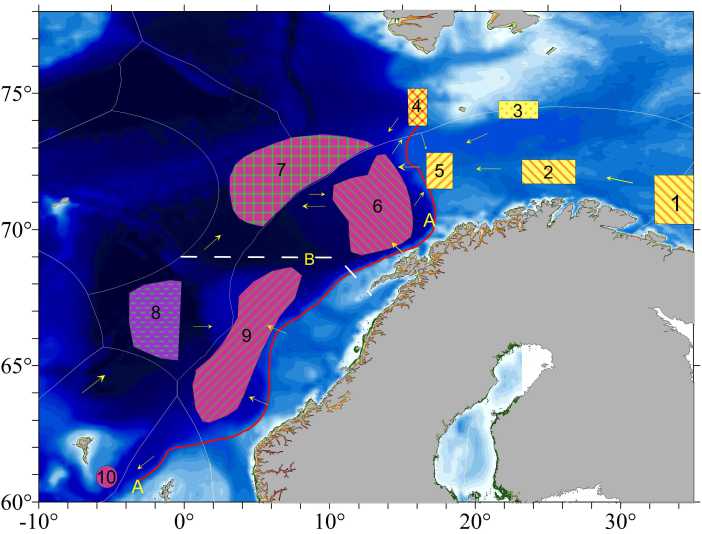
Рис. 1. Районы исследований придонного (1–5) и пелагического (6–10) окуня-клювача в Норвежском и Баренцевом морях.
А – изобата 500 м (основные участки вымета личинок самками окуня-клювача в батиали);
В – условная граница северной и южной частей Норвежского моря
Fig. 1. Areas surveyed for the near-bottom (1–5) and pelagic (6–10) beaked redfish in the Norwegian and Barents Seas.
А – 500 m isobath (main sites of larva extrusion by the beaked redfish females in the bathyal waters);
В – conventional boundary between the northern and southern parts of the Norwegian Sea
Показателями степени заражения паразитами служили: экстенсивность инвазии (ЭИ) – доля (%) рыб, зараженных паразитом данного вида, и индекс обилия (ИО) – число паразитов данного вида, приходящихся на одну исследованную рыбу [22]. Значимость различий в ЭИ определяли по тесту критерия значимости (χ2) при уровне 0,05 [23]. Для оценки принадлежности видов паразитов к зоогеографическим и экологическим комплексам применены материалы литературных источников [24] и собственных исследований [4; 16]. Мера сходства (L0) фауны паразитов по районам установлена по "взвешенному парно-групповому методу" [25]. Использованы обоснованные фены (в понимании А. В. Яблокова) [26] пелагического S. mentella североатлантической популяции [4; 27; 28], обитающего в мезопелагиали (100–1 000 м) морей Ирмингера и Лабрадор (северная Атлантика) [15; 16]. Для указания принадлежности к экологическим группам окуня-клювача, полученного из уловов донным тралом в районах батиали и шельфа, мы называем "придонным", а из уловов разноглубинным тралом в мезопелагиали – "пелагическим". Выполнен анализ темпов полового созревания по длине и возрасту, соответственно у 59485 и 19420 экз. S. mentella за период 1990–2016 гг.1
Результаты и обсуждение
В результате исследований S. mentella из 10 районов Норвежского и Баренцева морей, материалы которых представлены ранее [4], нами обнаружены паразиты 22 видов, относящихся к шести классам: Myxosporea (6 видов), Cestoda (3), Trematoda (6), Nematoda (4), Palaeacanthocephala (1), Crustacea (2). В фауне паразитов окуня-клювача как в батиали, так и в пелагиали северной части Норвежского моря и смежных вод отмечается устойчивое доминирование (60–62 % от общего числа) видов арктическо-бореального комплекса. Так, у S. mentella в юго-западной части Баренцева моря (районы 1–3) среди 13 видов паразитов, относимых к арктическо-бореальному комплексу, пять (38,5 %) являются для него обычными, из которых три (60,0 %) представляют "ядро" фауны паразитов этого хозяина. В меньшей степени она представлена видами бореального комплекса (13–26 %) и видами-космополитами (15–19 %). В пелагиали юго-запада моря (район 8) доля видов арктическо-бореального комплекса составила 50 % [4].
Состав фауны паразитов окуня-клювача имеет географическую изменчивость, варьируя от 10 до 19 видов в конкретном районе. Максимальная мера сходства ( L 0 ) состава паразитофауны окуня-клювача установлена в парах районов 6 и 7 (97 %), 1 и 2 (95 %), 3–5, 4 и 7, а также 5 и 6 (по 94 %). При этом значимые различия в зараженности паразитами отсутствовали ( p > 0,05) в первой паре районов, а в других указанных парах они отмечены по двум-четырем общим видам паразитов. Минимальная (78,5 %) мера сходства фауны паразитов окуня получена для районов 7 и 8 (рис. 2) при значимых различиях в зараженности паразитами пяти общих видов. Более сходна (87,0 %) оказалась фауна паразитов S. mentella районов 9 и 10 при отсутствии значимых различий в степени инвазии общими паразитами [4]. За многие годы исследований не встречено молоди окуня на первых годах жизни в пелагиали Норвежского моря в апреле – августе.
Р айоны
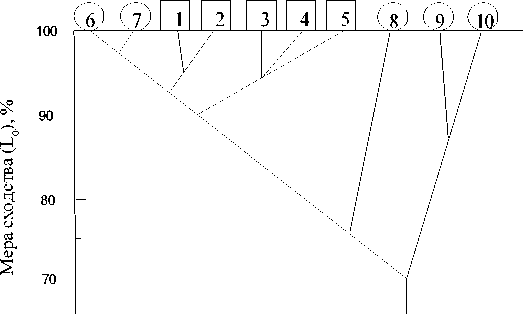
Рис. 2. Дендрограмма степени сходства фауны паразитов придонного (районы 1–5) и пелагического (районы 6–10) окуня-клювача в Норвежском и Баренцевом морях [4]. Обозначение районов, как на рис. 1 Fig. 2. Dendrogram of the parasite fauna similarity of the near-bottom (areas 1–5) and pelagic (areas 6–10) beaked redfish in the Norwegian and Barents Seas [4]. The areas are designated as in Fig. 1
Высокая степень сходства фауны паразитов, географические особенности ее динамики, а также половой зрелости и размерного состава S. mentella от шельфа Баренцева моря (районы 1–3) к батиали (район 5) и пелагиали (районы 6–7) Норвежского моря, представленные нами ранее [4], подтверждают вывод [5; 13] о пополнении скоплений S. mentella в районе Копытова (район 5) его созревающими особями с востока и севера. Они также доказывают тесную взаимосвязь скоплений окуня в пелагиали и батиали Норвежского моря при пополнении пелагических скоплений из сопредельного района батиали (рис. 1).
При этом у окуня-клювача в пелагиали Норвежского моря наблюдается относительное обеднение фауны паразитов за счет снижения показателей зараженности всеми видами Myxosporea и Trematoda, исчезновения некоторых видов гельминтов мезобентального и эпиконтинентального комплексов. Напротив, у окуня в пелагиали наблюдается прогресс инвазии паразитами мезопелагического и полизонального комплексов [4]. Это свидетельствует о значительном ослаблении связи пелагического окуня-клювача с придонными биоценозами и его обитании в пелагиали Норвежского моря в течение большей части своего годового жизненного цикла.
Наличие процесса спаривания у S. mentella как в батиали и на шельфе Баренцева моря [5], так и в пелагиали Норвежского моря в районе 7 в июле–августе (по собственным наблюдениям), а также вымета личинок как в батиали вдоль изобаты 500 м на участках от северного (районы 4–5 и 2) до юго-западного побережья Норвегии [8; 9], так и в пелагиали (районы 6 и 9 – по собственным наблюдениям в апреле) указывают на существование в норвежско-баренцевоморской популяции окуня-клювача устойчивых пелагической и придонной группировок, аналогичных таковым в море Ирмингера [29]. Особи окуня этих группировок, как и в море Ирмингера, отличаются темпом полового созревания (рис. 3). Так, пелагическую группировку (районы 6–7) пополняют рано созревающие особи окуня-клювача с массовым (50 и 75 %) созреванием при длине соответственно 29,7 и 31,4 см при малой (3,3 %) доле неполовозрелых рыб. У особей S. mentella придонной группировки (район 5) длина такого созревания больше соответственно на 3,1 и 3,6 см (1,3 и 2,0 года), а доля неполовозрелых рыб составляет 39,4 %.
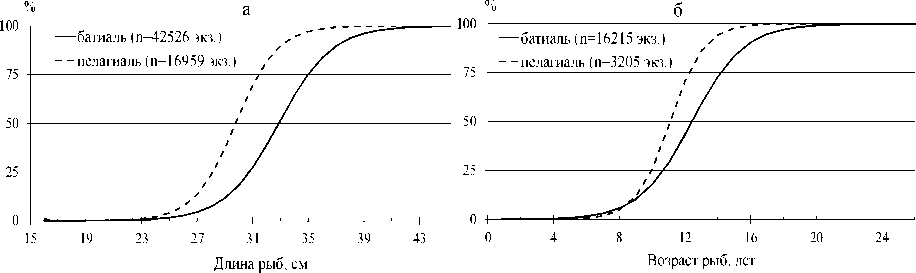
Рис. 3. Огивы полового созревания окуня-клювача в батиали и пелагиали севера Норвежского моря по длине ( а ) и возрасту ( б )
Fig. 3. Sexual maturation ogives of the beaked redfish in the bathyal waters and pelagic waters of the northern Norwegian Sea by length ( а ) and age ( б )
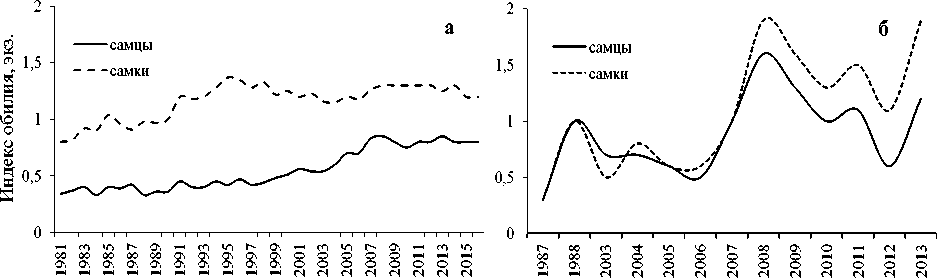
Ранее установлено существование в ареале окуня-клювача двух независимых центров инвазии его копеподой Sphyrion lumpi , приуроченных соответственно к мезопелагиали морей Норвежского и Ирмингера [4]. Об этом свидетельствуют долговременные стабильные половые особенности инвазии S. mentella этим паразитом в указанных районах (рис. 4), обоснованные нами в качестве его популяционного фена [27]. Так, в пелагиали и батиали севера Норвежского моря до 2008 г. самцам и самкам окуня всех размерных групп была свойственна примерно равная зараженность этой копеподой (табл.). Однако в 2008–2013 гг. у окуня-клювача в пелагиали северной части моря отмечаем рост и половую дифференциацию степени заражения копеподой S. lumpi (рис. 4, б ) при значимо более высоких показателях ЭИ и ИО у самок окуня. Аналогичная тенденция половой дифференциации зараженности клювача копеподой S. lumpi наметилась и на участках батиали Норвежского моря (районы 5 и 4) в 2015–2016 гг. Такая специфика инвазии этим паразитом свойственна окуню-клювачу только в мезопелагиали северной Атлантики [4; 27] во все годы исследований (рис. 4, а ) и отмечена нами на юго-западе Норвежского моря (район 8) в 2006–2007 гг. (табл.).
Год Год
Рис. 4. Межгодовая динамика индекса обилия инвазии окуня-клювача копеподой Sphyrion lumpi в пелагиали моря Ирмингера ( а ) и северной части Норвежского моря ( б ) в 1981–2016 гг. Fig. 4. Interannual dynamics of abundance index of the beaked redfish invasion with copepod Sphyrion lumpi in the pelagic waters of the Irminger Sea ( а ) and the northern part of the Norwegian Sea ( б ) in 1981–2016
Таблица. Встречаемость копеподы Sphyrion lumpi и кожных пигментных образований у окуня-клювача в пелагиали северного и юго-западного районов Норвежского моря в 1987–2013 гг.
Table. Occurrence of copepod Sphyrion lumpi and dermal pigmented lesions in the beaked redfish in the pelagic waters of the northern and southwestern areas of the Norwegian Sea in 1987–2013
|
Район |
Период |
n , экз. |
Копепода Sphyrion lumpi* |
Пигментные пятна, % |
Значимость различий ( р ) |
||||
|
самцы |
самки |
оба пола |
самцы |
самки |
оба пола |
||||
|
Северный |
апрель – август 1987–2007 гг. |
6110 |
50,1 1,1 |
50,6 1,1 |
50,4 1,1 |
2,3 |
2,2 |
2,3 |
> 0,05 |
|
(районы 6–7) |
апрель – август 2008–2013 гг. |
2506 |
53,6 1,1 |
67,4 1,6 |
60,5 1,3 |
3,4 |
5,8 |
4,5 |
< 0,05 |
|
Юго-западный (район 8) |
июль 2006–2007 гг. |
759 |
64,8 1,3 |
71,2 1,8 |
67,2 1,6 |
7,0 |
14,1 |
10,2 |
< 0,05 |
Примечание. * – с учетом остатков инвазии паразитом; над чертой – ЭИ, %; под чертой – ИО, экз./особь; n – число исследованных рыб.
Кроме того, мы наблюдаем синхронное межгодовое колебание зараженности окуня-клювача копеподой S. lumpi в батиали и пелагиали Норвежского моря (рис. 5) отсутствующее в море Ирмингера (рис. 4, а ).
m
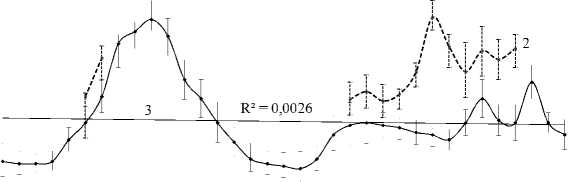
Год
Рис. 5. Межгодовая динамика экстенсивности инвазии (%) окуня-клювача копеподой Sphyrion lumpi в феврале – мае (* ноябрь) в батиали (1) с линией тренда (3) и пелагиали (2) севера Норвежского моря Fig. 5. Interannual dynamics of the beaked redfish prevalence (%) with copepod Sphyrion lumpi in February – May (* November) in the bathyal waters (1) with lines of trend (3) and pelagic waters (2) in the northern Norwegian Sea
Другим популяционным феном S. mentella служит относительно высокая, долговременная и стабильная в пространстве встречаемость у него кожных пигментных образований с неизменной половой спецификой их частоты (в среднем в 1,8 раза чаще у самок) и локализации, свойственная окуню-клювачу в пелагиали северной Атлантики во все годы (рис. 6, а ) и юго-запада Норвежского моря в 2006–2007 гг. [4; 28]. В пелагиали и батиали севера Норвежского моря до 2008 г. регистрировали примерно равную частоту этого явления у самцов и самок окуня (табл.). В 2008–2013 гг. в пелагиали севера Норвежского моря число особей S. mentella с пигментными пятнами увеличилось в 1,7 раза при значимом доминировании среди них самок (рис. 6, б ) [28]. Схожий процесс отмечен у окуня-клювача и в районе баренцевоморского склона ( айон 5) в 2015–2016 гг
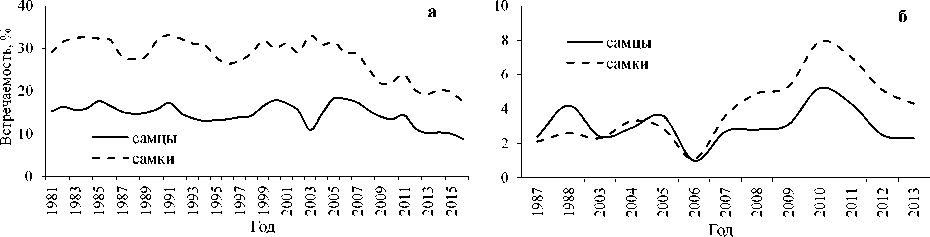
Рис. 6. Встречаемость (%) пигментных образований у самцов и самок окуня-клювача в пелагиали моря Ирмингера ( а ) и севера Норвежского моря ( б ) в 1981–2016 гг. Fig. 6. Occurrence (%) of dermal pigmented lesions in the beaked redfish males and females in the pelagiс waters of the Irminger Sea ( а ) and the northern Norwegian Sea ( б ) in 1981–2016
Таким образом, при оригинальности фауны паразитов в пелагиали юго-западной части Норвежского моря (рис. 2) [4] особи окуня-клювача в этом районе обладают указанными выше фенотипическими признаками, свойственными S. mentella пелагической группировки его североатлантической популяции, обитающей в морях Ирмингера и Лабрадор [4; 16; 27–29].
Заключение
Устойчивое доминирование в фауне паразитов окуня-клювача видов арктическо-бореального комплекса подтверждает его приуроченность к районам смешения потоков вод атлантического и арктического происхождения, вопреки мнению некоторых исследователей [1; 3], указывающих на обитание S. mentella в бореальных водах северной Атлантики и Северного Ледовитого океана.
Высокая степень сходства фауны паразитов, пространственные особенности ее динамики, половой зрелости и размерного состава S. mentella на участках шельфа Баренцева моря (районы 1–3), батиали (районы 4–5) и пелагиали (районы 6–7) северной части Норвежского моря [4] указывают на взаимосвязь окуня-клювача указанных районов в составе отдельной совокупности его особей. Эти экологопаразитологические характеристики подтверждают вывод [5; 11] о пополнении придонных скоплений окуня в районе Копытова (район 5) за счет миграции созревающих особей с востока и севера. Они также свидетельствуют о тесной взаимосвязи скоплений окуня-клювача в пелагиали и батиали северной части Норвежского моря при пополнении его пелагических скоплений особями окуня из сопредельного района батиали. Результаты сравнительного анализа фауны паразитов указывают на обитание S. mentella в пелагиали Норвежского моря бóльшую часть своего годового жизненного цикла.
Имея значимые отличия от фауны паразитов районов 6–8, фауна паразитов окуня-клювача районов 9 и 10 позволяет предположить происхождение S. mentella этих районов со смежных участков батиали у западного побережья Норвегии.
Отсутствие в пелагиали Норвежского моря молоди окуня на первых годах жизни подтверждает приуроченность выростной области S. mentella к шельфу Баренцева моря и архипелага Шпицберген [1; 2; 5–7; 9–11]. Наличие спаривания и массового вымета личинок самками окуня-клювача как в батиали, так и в пелагиали Норвежского моря указывает на существование в его норвежско-баренцевоморской популяции устойчивых воспроизводящихся придонной и пелагической экологических групп. Как и в североатлантической популяции S. mentella [29], они пополняются за счет соответственно поздно и рано созревающих особей из единой выростной области. Дивергентное формирование внутрипопуляционных групп окуня-клювача как вектора его эволюции отражает присущую этому филогенетически молодому и экологически пластичному виду стратегию на расширение своего ареала путем экспансии мезопелагиали.
Более высокая мера сходства (92,7 %) фауны паразитов окуня-клювача пелагической и придонной группировок в северной части Норвежского моря [4], по сравнению с таковой (79,8 %) в его североатлантической популяции [29], указывает на меньшую обособленность таких группировок S. mentella в Норвежском море. Кроме этого, синхронность межгодовой динамики инвазии окуня копеподой S. lumpi в обоих биотопах Норвежского моря подтверждает существование, в отличие от окуня-клювача североатлантической популяции, массового возврата его особей из пелагиали в районы батиали Норвежского моря на осенне-зимний период, что предполагали некоторые исследователи [3].
Особенности фауны паразитов [4; 29] и характеристик двух фенов окуня-клювача [27; 28] свидетельствуют о самостоятельности его норвежско-баренцевоморской популяции . Однако результаты анализа межгодовой динамики характеристик фенов указывают на проникновение в пелагиаль Норвежского моря через его юго-западную часть особей S. mentella североатлантической популяции (море Ирмингера). Данные фены демонстрируют, что эта миграция окуня-клювача достигла в 2008 г. северной части пелагиали, а в 2015 г. – и батиали Норвежского моря. Значимое нарушение половой гомогенности степени инвазии копеподой S. lumpi и встречаемости особей окуня с кожными пигментными образованиями в его скоплениях в северной части Норвежского моря свидетельствует, что эта миграция явилась массовой. Наличие такой невозвратной миграции S. mentella может служить причиной необъясненного значительного снижения численности пелагического окуня-клювача североатлантической популяции в 2007–2013 гг. 2
Список литературы Эколого-популяционные особенности окуня-клювача Sebastes mentella (Scorpaenidae) Норвежского моря на основе анализа его паразитофауны
- Monitoring beaked redfish (Sebastes mentella) in the North Atlantic, current challenges and future prospects/B. Planque //Aquatic Living Resources. 2013. V. 26. P. 293-306.
- Drevetnyak K. V., Nedreaas K. H., Planque B. Redfish//The Barents Sea: ecosystem, resources, management. Half a century of Russian-Norwegian cooperation/IMR, PINRO; eds. T. Jakobsen, V. Ozhigin. Trondheim, 2011. Chap. 5.7. P. 292-307.
- Барсуков В. В. Морские окуни (Sebastinae) Мирового океана -их морфология, экология, распространение, расселение и эволюция: автореф. дис.. д-ра биол. наук. Л., 1981. 50 с.
- Бакай Ю. И. Эколого-паразитологическая характеристика окуня-клювача Sebastes mentella (Scorpaeniformes: Sebastinae) Норвежского моря и смежных вод//Вопросы ихтиологии. 2011. Т. 51, № 1. С. 97-104.
- Сорокин В. П. О миграциях морского окуня Sebastes mentella Медвежинско-Шпицбергенского стада//Советские рыбохозяйственные исследования в морях Европейского Севера. М., 1960. С. 285-298.
- Бараненкова А. С. Материалы к распределению морских окуней рода Sebastes//Доклады Академии наук. 1957. Т. 2. С. 113-118.
- Сорокин В. П. О биологии размножения морских окуней Sebastes marinus L. и Sebastes mentella Travin в Баренцевом и Норвежском морях//Ихтиологическая комиссия. Труды совещ. по физиологии рыб. 1958. Вып. 8. С. 158-170.
- Mukhina N. V., Drevetnyak K. V., Dvinina E. A. Redfish spawning grounds in the Barents Sea and adjacent waters//ICES CM 1992/G: 54. 21 p.
- Saborido-Rey F., Nedreaas K. Population structure of Sebastes mentella in the North-East Arctic//ICES CM 1998/AA: 2. 18 p.
- Сорокин В. П., Шестова Л. М. Рост и половое созревание окуня-клювача норвежско-баренцевоморского стада//Биология рыб в морях Европейского Севера: сб. науч. тр. Мурманск: Изд-во ПИНРО, 1988. С. 97-111.
- Drevetnyak K. V., Nedreaas K. H., Kluev A. I. Spatial migration pattern of deep-sea redfish (Sebastes mentella Travin) of the Norwegian-Barents population from survey data//ICES CM 2004/K: 31. 28 p.
- Строганов А. Н., Лепесевич Ю. М., Мельников С. П. Биолого-генетическая характеристика окуня-клювача Sebastes mentella (Scorpaenidae) открытой части Норвежского моря//Вопросы ихтиологии. 2009. Т. 49, № 3. С. 333-340.
- Johansen T., Danielsdottir A., Meland K., Nævdal G. Studies of the genetic relationship between deep-sea and oceanic Sebastes mentella in the Irminger Sea//Fisheries Research. 2000. V. 49, N 2. P. 179-192.
- Stefansson M., Reinert J., Sigurđsson T. Depth as a potential driver of genetic structure of Sebastes//ICES Journal of Marine Science. 2009. V. 66. P. 680-690.
- Population structure of beaked redfish, Sebastes mentella: evidence of divergence associated with different habitats/S. Cadrin //ICES Journal of Marine Sciences. 2010. V. 67, Iss. 8. P. 1617-1630.
- Бакай Ю. И. Паразиты как индикаторы популяционной структуры окуня-клювача (Sebastes mentella)//Фауна, биология, морфология и систематика паразитов: материалы междунар. науч. конф. (19-21 апр. 2006 г., Москва). М.: Институт паразитологии РАН. 2006. C. 25-27.
- Гаевская А. В., Ковалева А. А. Паразитологический метод в популяционных исследованиях рыб Атлантического океана и его морей//Биологические ресурсы Атлантического океана. М.: Наука, 1986. С. 329-338.
- Williams H., MacKenzie K., McCarthy A. Parasites as biological indicators of the population biology, migrations, diet and phylogenetics of fish//Review of Fish Biology and Fisheries. 1992. V. 2. P. 144-176.
- MacKenzie K., Abaunza P. Parasites as biological tags//Stock identification methods: applications of fisheries science/ed. Cadrin S. . NY: Elsevier acad. press, 2005. Р. 211-226.
- Быховская-Павловская И. Е. Паразиты рыб. Руководство по изучению. Л.: Наука, 1985. 120 с.
- Бакай Ю. И., Карасев А. Б. Диагностика и регистрация эктопоражений морских окуней (методическое руководство). Мурманск: Изд-во ПИНРО, 1995. 22 с.
- Bush A., Lafferty K., Lotz J., Shostak A. Parasitology meets ecology on its own terms: Margolis et al. revisited//Journal of Parasitology. 1997. V. 83, Iss. 4. P. 575-583.
- Бреев К. А. Применение математических методов в паразитологии//Известия ГосНИОРХ. 1976. Т. 105. С. 109-126.
- Lile N. K., Halvorsen O., Hemmingsen W. Zoogeographical classification of the macroparasite faunas of four flatfish species from the northeastern Atlantic//Polar Biology. 1994. V. 14. P. 137-141.
- Бейли Н. Математика в биологии и медицине. М.: Мир, 1970. 326 с.
- Яблоков А. В. Состояние исследований и некоторые проблемы фенетики популяций//Фенетика популяций. М.: Наука, 1982. С. 3-14.
- Бакай Ю. И. Заражение копеподой Sphyrion lumpi как фен североатлантической популяции окуня-клювача Sebastes mentella (Sebastinae)//Паразитология в изменяющемся мире. Материалы V съезда паразитол. об-ва РАН: всерос. конф. с междунар. участ. Новосибирск: Гарамонд, 2013. С. 20.
- Бакай Ю. И. Кожные пигментные образования как фен североатлантической популяции окуня-клювача Sebastes mentella Travin, 1951 (Scorpaenidae)//Биология моря. 2015. Т. 41, № 2. С. 145-148.
- Мельников С. П., Бакай Ю. И. Пополнение запаса окуня-клювача Sebastes mentella (Scorpaeniformes: Scorpaenidae) в пелагиали моря Ирмингера и смежных вод//Вопросы ихтиологии. 2009. Т. 49, № 5. С. 669-680.
- Sebastes mentella, Norwegian and Barents Seas, parasite fauna, phenes, migrations.


