Экспериментальная модель дентальной имплантации
Автор: Тодер Михаил Семенович, Шевела Александр Андреевич, Шевела Андрей Иванович, Майбородин Игорь Валентинович
Журнал: Морфологические ведомости @morpholetter
Рубрика: Оригинальные исследования
Статья в выпуске: 3 т.25, 2017 года.
Бесплатный доступ
Испытания новых дентальных имплантов, сравнение их с уже используемыми, отработка новых методов имплантации проводят на экспериментальных животных. Лучше всего для этой цели подходят кролики. В частности проксимальный мыщелок их большеберцовой кости по своей структуре сходен с костями челюстей. Кроме того, данный отдел конечности у этих животных легкодоступен. В связи с вышеизложенным представлена подробная методика по экспериментальному внедрению дентальных имплантов в большеберцовую кость кроликов. Подробно и поэтапно описан ход наркоза, хирургического вмешательства по внедрению имплантов, выведения животных из эксперимента, забора материала для последующего морфологического исследования, а также этапы подготовки биопсии объектов к изучению методами световой микроскопии. Приведенная методика облегчит работу с экспериментальными животными, позволит стандартизовать указанную процедуру и даст возможность получения рандомизированных данных.
Зубные импланты, модели на животных
Короткий адрес: https://sciup.org/143177194
IDR: 143177194 | DOI: 10.20340/mv-mn.17(25).03.22-25
Текст научной статьи Экспериментальная модель дентальной имплантации
Тодер М.С., Шевела А.А., Шевела А.И., Майбородин И.В. Экспериментальная модель дентальной имплантации// Морфологические ведомости.- 2017.- Том 25.- № 3.- С. 22-25. (25).03.22-25
Toder MS, Shevela AA, Shevela AI, Mayborodin IV. The experimental model of the dental implantation. Morfologicheskie Vedomosti – Morphological Newsletter. 2017 Sep 30;25(3):22-25. (25).03.22-25
Введение. Постоянно работая с лабораторными животными и проводя экспериментальные исследования, мы сталкиваемся с невозможностью повторить тот или иной эксперимент из-за отсутствия описания деталей в оригинальных статьях авторов. В то же время мелкие и кажущиеся несущественными детали могут играть важную в трактовке результатов. Например, во многих статьях указывается об имплантации различных материалов в мыщелок большеберцовой кости кроликов. При попытке исследования других имплантов необходимо отрабатывать все детали, от наркоза, к которому эти животные очень чувствительны, до особенностей подготовки биоптатов к морфологическим методам исследования. Все это послужило основанием для написания этой статьи, которая может, как мы надеемся, облегчить работу других авторских коллективов, приступающих к аналогичным экспериментальным исследованиям. Дентальная имплантация — это метод вживления искусственного корня зуба (импланта) в верхнюю или нижнюю челюсть. Импланты используют в качестве опор, на которые фиксируют либо коронки (полноценно заменяющие утраченные зубы), либо съемные зубные протезы (в этом случае импланты способствуют адекватной фиксации протеза в полости рта). Конструкция импланта состоит из двух основных частей — самого имплантата, который представляет собой титановый винт, вживляемый в челюсть хирургическим путем и абатмента (наружной части имплантата — по форме напоминает обточенный зуб), который присоединяется к имплантату после периода приживления. Испытания новых изделий, сравнение их с уже применяемыми, отработка новых методов имплантации проводят на экспериментальных животных. Лучше всего для этой цели подходят кролики, в частности проксимальный мыщелок их большеберцовой кости, который по своей структуре очень близко соответствует челюстным костям. Кроме того, данный отдел конечности у этих животных легкодоступен. В связи с этим очень многие исследователи используют такую модель для экспериментальной имплантации. Однако, в таких работах только констатируется факт использования указанной модели и содержатся результаты экспериментов. Точные и мелкие подробности работы с кроликами по внедрению в их костные ткани различных имплантов в современной литературе явно недостаточны, хотя эти детали могут значительно облегчить работу исследователей, только начинающих экспериментальное изучение взаимодействие инородных тел с тканями живого организма. Следует отметить, что костные структуры, сходные по своему строению с костями челюстей, также присутствуют в лопатках и тазовых костях. Однако доступ к ним сопряжен с обширным хирургическим вмешательством и значительной сопутствующей травмой, которая может значимо влиять на полученные результаты. Кроме того, исходя из собственного опыта, следует отметить, что попытки сделать отверстие для внедрения имплантата на лопатке часто завершаются ее разрушением, фрагментацией на несколько частей. Также пригодны для моделирования дентальной имплантации и мыщелки большеберцовых костей лабораторных минисвиней. Но хирургический доступ к мыщелкам у этих животных более труден, чем у кроликов, это обусловлено более толстой и плотной кожей, выраженной подкожной клетчаткой и особенностями расположения там кровеносных сосудов. В связи с вышеизложенным целью исследования является представление подробной методики по экспериментальному внедрению дентальных имплантов в большеберцовую кость кроликов с последующей подготовкой образцов тканей для морфологических исследований.
Материалы и методы исследования . В проксимальный мыщелок большеберцовой кости 10 кроликов имплантировали шероховатый имплант с пескоструйной обработкой и протравленной кислотой поверхностью (3S, Израиль) и с гладкой полированной поверхностью для бикортикальной имплантации (3S, Израиль). Все манипуляции с животными не были связаны с причинением им боли с и проведены с соблюдением «Правил проведения работ с использованием экспериментальных животных» (Приказ МЗ СССР № 755 от 12 августа 1977 г.; Приказ Министерства высшего и среднего специального образования СССР № 742 от 13 ноября 1984 г.). Имплантацию проводили с соблюдением всех правил асептики и антисептики в условиях операционной под общим наркозом на основе тотальной внутривенной анестезии пропофолом. На начальном этапе пунктировали и катетеризировали краевую вену ушной раковины катетером 24G, который фиксировали пластырем. Проводили внутривенную премедикацию: атропина сульфат 0,1% - 0,22-0,27 мг/кг; димедрол 1% -4,6-5,2 мг/кг; дроперидол 0,25% -1,25 мг; кеторолака триметамин 1% - 10 мг. В качестве индукции анестезии использовали пропофол 1% - 15 мг/кг внутривенно, для поддержания анестезии также применяли пропофол 1% - 25-30 мг/кг/час внутривенно. Инфузионную терапию осуществляли 0,9% раствором натрия хлорида 15-25 мл\кг, в зависимости от выраженности кровопотери. Респираторную поддержку, при необходимости, проводили масочным способом с инсуфляцией 100% кислорода.
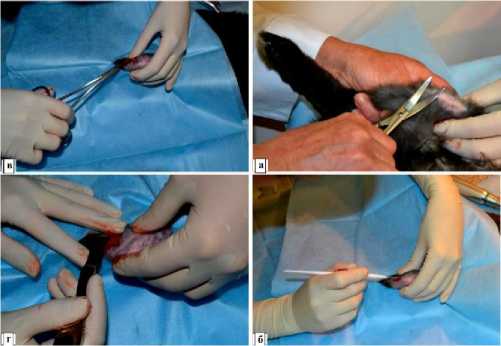
Рис. 1. Доступ к проксимальному мыщелку большеберцовой кости кролика (месту экспериментальной имплантации): а - удаление волосяного покрова; б - разрез кожи по передней линии ниже коленного сустава; в - мягкие ткани раздвинуты браншами зажима; г - обнажение распатором поверхности проксимального мыщелка большеберцовой кости на передне-медиальной поверхности.
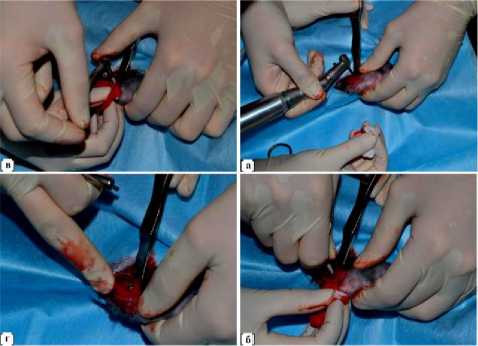
Рис. 2. Внедрение импланта с шероховатой поверхностью в проксимальный мыщелок большеберцовой кости кролика; а - начало высверливания стоматологическим бором отверстия для имплантации; б - начало вкручивания импланта; в - применение ключа с динамометрической шкалой; г -имплант полностью внедрен в костную ткань.
Результаты исследования и обсуждение.
Под общей анестезией ножницами проводили удаление волосяного покрова в месте предполагаемого хирургического вмешательства на обеих конечностях в области коленных суставов (рис. 1-а). После манипуляции кожу обрабатывали спиртом, операционное поле накрывали стерильной салфеткой с отверстием. Для имплантации изделий с шероховатой поверхностью была выбрана левая конечность, для внедрения полированных имплантов. Необходимо отметить, что внедрение каждого типа импланта в одну и ту же конечность, во-первых, дает возможность ускорить саму процедуру имплантации, так как не требуется регистрировать, какому животному в какую конечность имплантировали то или иное изделие; во-вторых, облегчает последующее наблюдение и обследование животных. Последовательность манипуляций для внедрения имплантов с шероховатой поверхностью (рис. 1, 2): 1) - слева по передней линии несколько ниже коленного сустава одноразовым скальпелем производили разрез кожи (рис. 1-б); 2) -тупым способом (сомкнутыми браншами зажима) раздвигали ткани до надкостницы (рис. 1-в); 3) - распатором обнажали поверхность проксимального мыщелка большеберцовой кости на передне-медиальной стороне (рис. 1-г); 4) - стоматологическим бором, до ощущения «провала», делали отверстие в выбранном участке, использовали 2 бора возрастающего диаметра (рис. 2-а); 5) - в созданное отверстие вкручивали имплант с шероховатой поверхностью сначала руками, затем ключом с динамометрической шкалой, позволяющей контролировать создаваемое усилие. Головка импланта выступала над поверхностью кости не более, чем на 1 мм (рис. 2-б, 2-г); 6) послойно викрилом 5-0 ушивали операционную рану; 7) -обрабатывали кожные швы 5% спиртовым раствором йода. Для внедрения полированных имплантов точно такие же
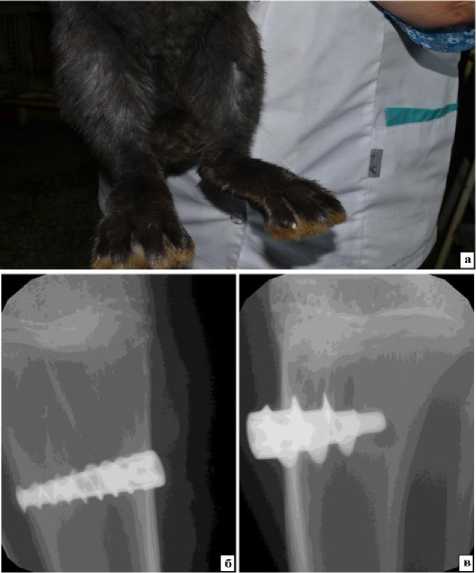
Рис. 3. Результаты имплантации через 2 недели:
а - на месте хирургического вмешательства видимых признаков воспаления нет, швы отсутствуют; б - имплант с шероховатой поверхностью, согласно результатам рентгенографического исследования, расположен в проксимальном мыщелке большеберцовой кости, симптомов остеомиелита и раздражения надкостницы нет; в - полированный имплант внедрен в правый мыщелок,
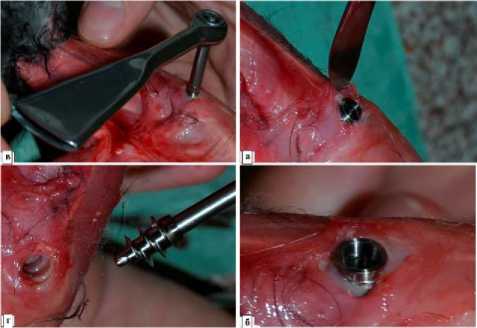
Рис. 4. Удаление полированного изделия из места имплантации. Животное выведено из эксперимента передозировкой эфирного наркоза. Кожа с сегмента конечности удалена: а - разрез тканей над головкой импланта; б - обнажена головка импланта, признаков воспаления нет; в - выкручивание импланта ключом с динамометрической шкалой; г - после удаления импланта в тканях проксимального мыщелка большеберцовой кости остается отверстие с ровными краями и следами от резьбы.
манипуляции производили на правой конечности. В течение 1-2 недель после операции животные самостоятельно избавляются от швов, визуально на коже в месте хирургического вмешательства признаков острого воспалительного процесса нет (рис. 3-а). В большинстве случаев на все сроки импланты были расположены в месте внедрения: в проксимальном мыщелке большеберцовой кости (рис. 3-б, 3-в). Необходимо отметить, что через 4 недели после имплантации в месте головок имплантов (контакт с надкостницей) появляются симптомы ее раздражения (утолщение), спустя 2 месяца эти признаки стали более выраженными.
В целом по группе было отмечено по одному случаю развития остеомиелита после имплантации шероховатого и полированного имплантов (разные животные). В последнем наблюдении обнаружили перелом конечности в месте имплантации, осложнение было найдено уже спустя 1 неделю после операции и, скорее всего, произошло непосредственно во время или непосредственно после внедрения инородного тела. Эти животные выбраковывались и в дальнейших исследованиях не участвовали.
Животных выводили из эксперимента через 2 и 6 месяцев после имплантации передозировкой ингаляционного эфирного наркоза. В связи с тем, что перед удалением инородных тел необходимо оценить состояние окружающих тканей и определить наличие гнойных осложнений вокруг, целесообразно предварительное полное удаление кожного покрова с конечности от паховой складки до лодыжки. В тех случаях, когда головка импланта была закрыта тканями, скальпелем освобождали ее (рис. 4-а, 4-б). Затем накладывали ключ с динамометрической шкалой и постепенно выкручивали имплант, регистрируя усилие при начале его вращения (рис. 4-в, 4-г). После удаления инородного тела в тканях оставалось отверстие с ровными краями и следами от граней резьбы (рис. 4-г).
После вывинчивания имплантов необходимо макро- и микроскопическими методами установить наличие и объем тканевых фрагментов на их поверхности (рис. 5-а, 5-г). Для последующего морфологического исследования большеберцовую кость после максимального удаления мягких тканей целиком фиксировали в 4% растворе параформальдегида на фосфатном буфере не менее 1 суток [1-4] . Затем кость подвергали декальцинации раствором на основе ЭДТА, который, по сравнению с кислотной декальцинацией, в меньшей степени повреждает ткани. Длительность обработки определяли, пытаясь проколоть кость препаровальной иглой вдали от отверстия после удаления имплантата. Декальцинацию прекращали, когда кость становилась мягкой и упругой и легко резалась скальпелем [2, 3]. Все манипуляции с объектом, приводящие к повреждению его, лучше проводить после фиксации с целью исключения сомнений в прижизненности изменений [5].

Последующая декальцинация делает кость мягкой и облегчает вырезание необходимого фрагмента для последующей обработки, кроме того, дегидратированная кость при этом не растрескивается. Далее фрагменты кости с отверстием дегидратировали при постоянном перемешивании в этаноле возрастающей концентрации, просветляли в ксилоле и заключали в пластифицированный парафин по следующей схеме [1-4]: 1 - этанол 50% - 2 часа; 2 - этанол 70% - 2 часа; 3 - этанол 80% - 2 часа; 4 - этанол 90% - 2 часа; 5 - этанол 96% (на этом этапе и далее возможна замена этанола чистым бутанолом, пропанолом или изопропанолом) - 2 часа; 6 -этанол 96% в смеси с бензолом 1:1 (наэтом этапе и далее возможна замена бензола ксилолом или толуолом, при этом следует учитывать, что бензол дает лучший результат, но вместе с этим, более летуч и токсичен) - 2 часа; 7 - этанол 96% в смеси с бензолом 1:1 - 2 часа; 8 -бензол – 2 часа; 9 - бензол – 2 часа; 10 -бензол в смеси с парафином 1:1 – 2 часа (при нагревании до температуры плавления смеси); 11- бензол в смеси с парафином 1:1 – 2 часа (при нагревании до температуры плавления смеси); 12 - парафин – 2 часа (при нагревании до температуры плавления парафина, но не более 67ºС).
При необходимости можно прервать процедуру на время не более 1 суток на стадии деградации в спиртах, на других этапах увеличение времени обработки нежелательно. Такая процедура по времени занимает не более суток, легко автоматизируется и дает возможность
Рис. 5. Изучение окружающих тканей и поверхности имплантов через 2 месяца после их внедрения: а – удаленный имплант с шероховатой поверхностью через 2 месяца после внедрения; фрагменты тканей присутствуют на различных структурах изделий, особенно много на резьбе имплантов; б – резьба изделия с шероховатой поверхностью содержит большой объем тканей животного; микрофото в отраженном свете без окраски; в - удаленный полированный имплант спустя 2 месяца после операции; поверхность изделия блестящая, практически чистая; г - фрагментов тканей животного на структурах полированного импланта очень мало; микрофото в отраженном свете без окраски; д -через 2 месяца после имплантации полированного изделия в костной ткани проксимального мыщелка большеберцовой кости присутствуют следы от граней винтовой резьбы; полости, сформированные после удаления инородного тела, заполнены кровью или фибрином; окраска гематоксилином и эозином; е - следы от граней винтовой резьбы полированного импланта на противоположной стенке мыщелка. Окраска гематоксилином и эозином.
inostr. lit., 1964.
-
4. Sarkisov D.S., Perov Yu.L. Mikroskopicheskaya tekhnika: Rukovodstvo dlya vrachey i laborantov. M.: Meditsina, 1996.
-
5. Voyno-Yasenetskiy M.V., Zhabotinskiy Yu.M. Istochniki oshibok pri morfologicheskikh issledovaniyakh. L.: Meditsina, 1970.
получения гистологических срезов хорошего качества толщиной не более 5 мкм, пригодных для последующего окрашивания и изучения на светооптическом уровне при увеличении до 1200 (рис. 5-д, 5-е).
Заключение . Таким образом, приведенная методика по внедрению стоматологических изделий кроликам с целью испытания новых имплантов, сравнения новых с широко применяемыми, отработки и обучения новым методам имплантации облегчит работу с экспериментальными животными, в какой-то мере позволит стандартизовать указанную процедуру и даст возможность получения рандомизированных данных, пригодных для статистической обработки.
Список литературы Экспериментальная модель дентальной имплантации
- Елисеев В.Г., Субботин М.Я., Афанасьев Ю.И., Котовский Е.Ф. Основы гистологии и гистологической техники. М.: Медицина, 1967.
- Лилли P. Патогистологическая техника и практическая гистохимия. М.: Мир, 1969.
- Пирс Э. Гистохимия теоретическая и прикладная. М.: Изд-во иностр. лит., 1964.
- Саркисов Д.С., Перов Ю.Л. Микроскопическая техника: Руководство для врачей и лаборантов. М.: Медицина, 1996.
- Войно-Ясенецкий М.В., Жаботинский Ю.М. Источники ошибок при морфологических исследованиях. Л.: Медицина, 1970.


