Экспериментальная модель грибкового кератоувеита с язвой роговицы, основанная на анализе этиологии клинических наблюдений грибкового кератита
Автор: Давлетшина Н.И., Самойлов А.Н.
Журнал: Вестник Национального медико-хирургического центра им. Н.И. Пирогова @vestnik-pirogov-center
Рубрика: Оригинальные статьи
Статья в выпуске: 3 т.18, 2023 года.
Бесплатный доступ
Обоснование. Большинство рекомендаций по лечению грибкового кератита основаны на неконтролируемых клинических исследованиях или экспериментах на лабораторных моделях кератомикоза. Отсутствие качественных воспроизводимых моделей грибкового кератита и язвы роговицы, а также средств количественной оценки терапевтического ответа затрудняет создание таких рекомендаций. Предлагаемый нами способ моделирования грибкового кератита основан на анализе этиологии грибковых агентов в серии клинических наблюдений микотических кератитов, обладает достоверной воспроизводимостью, что позволит применять его в целях изучения природы развития кератомикозов, течения патологического процесса, исходов, а, главное способов его лечения. Цель. Создать воспроизводимую экспериментальную модель грибкового поражения роговицы с учетом клинически значимой грибковой флоры. Материалы и методы. Проведено экспериментальное исследование на кроликах породы «шиншилла», в результате которого разработана модель грибкового поражения роговицы, учитывающая клинически значимую в практике флору. В результате моделирования получен грибковый кератоувеит с гипопионом, изъязвлением роговицы. Контроль микрофлоры производился культуральным, цитологическим, морфологическим способом. Забор материала производился непосредственно перед заражением, далее в процессе моделирования. Результаты. Новый способ экспериментального моделирования позволяет достичь картины грибкового кератоувеита с гипопионом, язвой роговицы за 5-6 процедур на 12-14-е сутки. Без лечения, начиная с 16-х суток эксперимента, у 40% животных сформировалась перфорация роговицы, что на наш взгляд, сопоставимо с течением агрессивного кератомикоза у пациентов без адекватного и своевременного лечения.
Грибковый кератит, миотический кератит, кератомикоз, экспериментальная модель
Короткий адрес: https://sciup.org/140301226
IDR: 140301226 | DOI: 10.25881/20728255_2023_18_3_100
Текст научной статьи Экспериментальная модель грибкового кератоувеита с язвой роговицы, основанная на анализе этиологии клинических наблюдений грибкового кератита
Objective. Develop a reproducible experimental model of fungal infection of the cornea, taking into account the clinically significant fungi.
Methods. An experimental study was carried out on rabbits of the “chinchilla” breed, as a result of which a model of fungal infection of the cornea was developed, taking into account the flora that is clinically significant in practice. As a result of modeling, fungal keratouveitis with hypopyon, corneal ulceration was obtained. Microflora control was carried out by cultural, cytological, morphological methods. The material was taken immediately before infection, then during the modeling process.
Results. A new method of experimental modeling allows to achieve a picture of fungal keratouveitis with hypopyon, corneal ulcer in 5-6 procedures on the 12th-14th day. Without treatment, starting from the 16th day of the experiment, 40% of the animals developed corneal perforation, which, in our opinion, is comparable to the course of aggressive keratomycosis in patients without adequate and timely treatment.
Keyword: mycotic keratitis, fungal keratitis, keratomycosis, Fusarium. experimental model.
Экспериментальные модели грибкового поражения роговицы необходимы для изучения антимикробного действия, эффективности и токсичности на животных моделях инфекции. Отсутствие качественных воспроизводимых моделей грибкового кератита и язвы роговицы, а также средств количественной оценки терапевтического ответа затрудняет создание таких рекомендаций [1].
По сообщениям исследователей из разных стран мира, частота заболеваемости грибковым кератитом может достигать более 50% всех глазных микозов, особенно в тропических регионах. Если предположить, что все случаи с отрицательным микробиологическим посевом являются грибковыми, ежегодная заболеваемость составит 1,480,916 случаев (1,036,641–1,925,191) [2].
Известно более чем о 100 преобладающих видах грибов, способных вызвать окуломикозы, в зависимости от изучаемого географического района. Патогены включают
-
2 основные формы: Мицелиарные (особенно — Fusarium и Aspergillus), которые обычно встречаются в тропических и субтропических зонах и Дрожжевые (в частности, Candida) [2; 3]. Большинство грибковых организмов, вызывающих поражения органа зрения, являются распространенными, сапрофитными организмами, и их инфекционная значимость описывается только в офтальмологической литературе [4].
Нами проведен анализ этиологии и противогрибковой чувствительности грибов в серии клинических случаев кератитов, резистентных к лекарственной терапии. Ретроспективный анализ включал 12 случаев (12 глаз), находившихся на лечении с августа 2018 по январь 2020 гг. (18 месяцев). Грибы были обнаружены в 12 случаях кератитов с резистентностью к терапии. Идентификацию возбудителя проводили методом прямой микроскопии, культуральным исследованием в микологической лабора-

Давлетшина Н.И., Самойлов А.Н.
ЭКСПЕРИМЕНТАЛЬНАЯ МОДЕЛЬ ГРИБКОВОГО КЕРАТОУВЕИТА С ЯЗВОЙ РОГОВИЦЫ, ОСНОВАННАЯ НА АНАЛИЗЕ ЭТИОЛОГИИ КЛИНИЧЕСКИХ НАБЛЮДЕНИЙ ГРИБКОВОГО КЕРАТИТА тории, а также клиническими проявлениями. В 10 случаях обнаружены Fusarium spp, в 1 случае — Penicillinum spp, в 1 случае — Candida spp. 100% грибов имели устойчивость к флуконазолу и амотерицину В [5].
Цель: Создание воспроизводимой экспериментальной модели кератомикоза in vivo для изучения механизмов заражения, течения патологического процесса, патологических исходов, разработки новых методик лечения.
Материалы и методы
Экспериментальное моделирование проводилось на кроликах породы «советская шиншилла» с применением культуры грибов Fusarium spp. 1,0x10 6 КОЕ/мл. Инокулюм изготавливался из чистых, пяти суточных культур грибов Fusarium solani, выращенных на плотной питательной среде Сабуро. Инокулят предварительно растёрт в ступке. В стерильном изотоническом растворе хлорида натрия приготовлена взвесь микроорганизмов с конечной плотностью 1,0x10 6 клеток/мл, что соответствует 0,5 MF (измерение денситометром согласно данным изготовителя стандартов мутности bioMerieux). Эксперименты in vivo одобрены ЛЭК ФГБОУ ВО «Казанский ГМУ» МЗ РФ (№1 от 4.02.2020 года).
До начала эксперимента определена нормобиота конъюнктивы и роговицы кролика, которая включала Aspergillus flavus 102 КОЕ/мл; Penicillium expansum 102 КОЕ/мл; S. aureus 101 КОЕ/мл; Enterobacteriaceae 101 КОЕ/мл.
Методика моделирования заключается в том, что под местной анестезией 0,4% оксибупрокаина на роговицу накладывали смоченный в 5% спиртовом растворе формалина стерильный диск из гемостатической губки размером 10x10 мм. Далее надевали мягкую контактную линзу (МКЛ) и оставляли на 24 часа. На следующий день удаляли МКЛ и диск гемостатической губки, а на поверхность роговицы в течение 3 суток инстилировали 0,1% раствор дексаметазона 4 раза в сутки. На 3-и дсутки под местной инфильтрационной анестезией производили скарификацию эпителия роговицы размером 10x10 мм, инсулиновым шприцем с интегрированной иглой 29G производили интрастромальную инъекцию 0,1 мл 106 КОЕ/мл клинической суспензиии грибковых изоля-тов Fusarium spp . На роговицу инстилировали 2–3 капли 99% концентрата димексида. Следующим шагом производили орошение конъюнктивальной поверхности 106 КОЕ/мл клинической суспензией грибковых изолятов Fusarium spp., включающей фрагменты мицелия, а также наносили на внутреннюю поверхность МКЛ 0,2–0,3 мл этой же суспензии. В завершении надевали МКЛ на роговицу, далее через 1 сутки за 5–6 процедур производили дополнительное заражение роговицы, орошая 99% концентратом димескида, свежей клинической суспензией грибковых изолятов Fusarium spp . 106 КОЕ/мл совместно с интрастромальной инъекцией, таким образом на 12-й-14-й день получали грибковый кератоувеит с гипопионим, язвой роговицы (Рис. 1, 2) [6; 7].
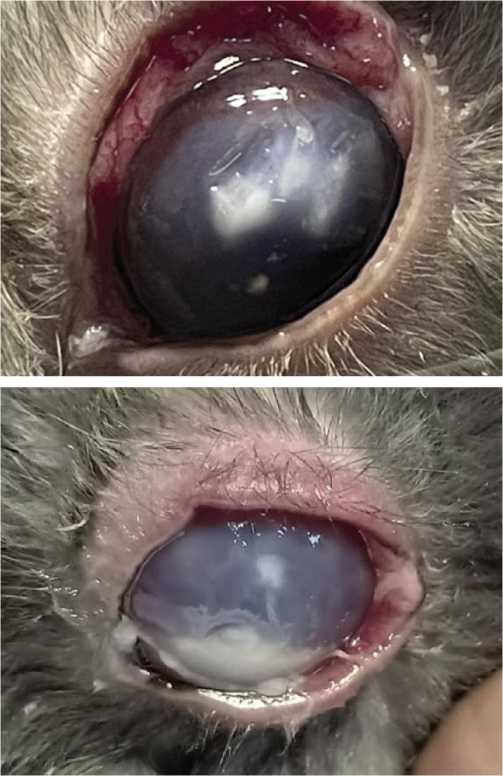
Рис. 1, 2. Кератоувеит с изъязвлением роговицы у кролика в результате экспериментального заражения по описанной методике.
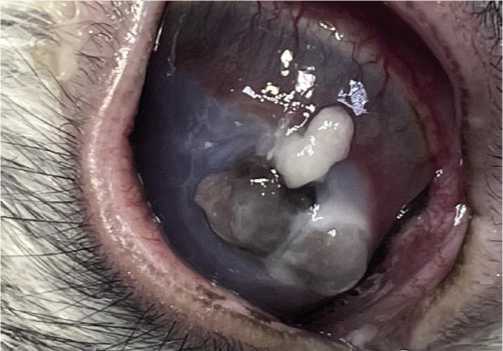
Рис. 3. Перфорация язвы роговицы у кролика на 14-е сутки эксперимента.
На 16-е сутки эксперимента получена перфорация язвы роговицы, что, на наш взгляд, соответствует исходу патологического процесса в клинических случаях без адекватного и своевременно лечения (Рис. 3).
Давлетшина Н.И., Самойлов А.Н.
ЭКСПЕРИМЕНТАЛЬНАЯ МОДЕЛЬ ГРИБКОВОГО КЕРАТОУВЕИТА С ЯЗВОЙ РОГОВИЦЫ, ОСНОВАННАЯ НА АНАЛИЗЕ ЭТИОЛОГИИ КЛИНИЧЕСКИХ НАБЛЮДЕНИЙ ГРИБКОВОГО КЕРАТИТА
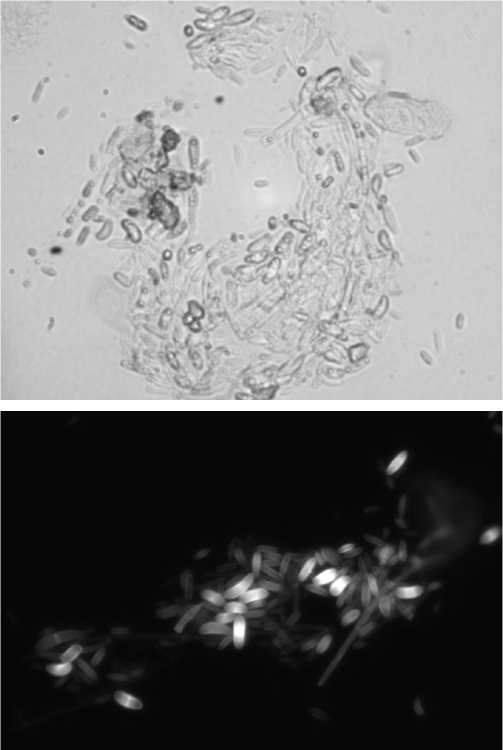
Рис. 4, 5. Морфологические элементы живых грибов Fusarium spp. при электронной прямой микроскопии (ув. 400).
Применение спиртового раствора формалина позволило полностью санировать конъюнктивальную полость экспериментальных животных, что было подтверждено культуральными данными в начале исследования. Получив химический ожог легкой степени, мы получили асептическое воспаление. Стоит отметить, что запустить инфекционно-воспалительный процесс в роговице здорового кролика оказалось крайне сложно ввиду высоких репаративных способностей. Инстиляции дексаметазона позволили снизить местные компенсаторные возможности, подавить активность иммунной защиты и предотвратить самостоятельную санацию условно-патогенного Fusarium spp. При электронной микроскопии соскобов с роговицы выявлено, что применение димексида способствовало повышению адгезии грибковых элементов к эпителию, боуменовой оболочке и строме, что позволило улучшить результативность контаминации (Рис 4–6).
Отсутствие мягкой контактной линзы приводило к самопроизвольной санации даже при выполнении вышеописанных условий. Интрастромальные инъекции позволили достичь картины агрессивного течения кератита, сопоставимого с клиническим. Все травмирующие этапы произведены под местной анестезией 0,4% оксибупрокаином. Ситуационно проводилась нейро-лептаналгезия внутримышечной инъекцией ксилазина гидрохлорида.
Результаты
Заявленная методика позволяет воспроизвести глубокий грибковый кератоувеит с изъязвлением роговицы у кроликов с применением микроинвазивной травмы у экспериментальных животных.
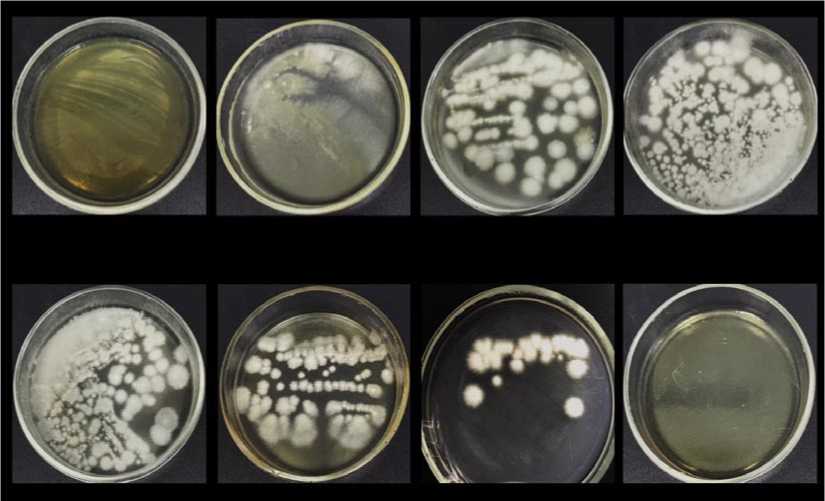
Рис. 6. Динамика культивирования Fusarium spp. в процессе моделирования.

Давлетшина Н.И., Самойлов А.Н.
ЭКСПЕРИМЕНТАЛЬНАЯ МОДЕЛЬ ГРИБКОВОГО КЕРАТОУВЕИТА С ЯЗВОЙ РОГОВИЦЫ, ОСНОВАННАЯ НА АНАЛИЗЕ ЭТИОЛОГИИ КЛИНИЧЕСКИХ НАБЛЮДЕНИЙ ГРИБКОВОГО КЕРАТИТА
Выводы
Fusarium spp. является наиболее частый возбудителем грибковых кератитов в нашем регионе и представляет собой повышенный исследовательский интерес. Этапы подготовки оказались необходимы ввиду спонтанной санации и эпителизации, в том числе по причине условной патогенности Fusarium spp.
Авторы заявляют об отсутствии конфликта интересов (The authors declare no conflict of interest).
Список литературы Экспериментальная модель грибкового кератоувеита с язвой роговицы, основанная на анализе этиологии клинических наблюдений грибкового кератита
- Kaufman H., Barron B., McDonald M. The Cornea, Second Edition. Boston: Butterworth-Heinemann, 1998. Р.247-303.
- Brown L., Leck AK, Gichangi M., Burton MJ, Denning DW. The global incidence and diagnosis of fungal keratitis. Lancet Infect Dis. 2021; 21(3): e49-e57.
- Al-Hatmi AMS, Castro MA, Hoog GS, Badali H., Alvarado VF, Verweij PE, Meis JF, Zago VV. Epidemiology of Aspergillus species causing keratitis in Mexico. Mycoses. 2019; 62(2): е144-151.
- Blindness and vision impairment. https://www.who.int/news-room/fact-sheets/detail/blindness-and-visualimpairment.
- Самойлов А.Н., Давлетшина Н.И. Анализ этиологии и антимикробной чувствительности возбудителей грибковых кератитов в серии клинических случаев // Офтальмохирургия. - 2020. - №1. - С.71 -76. 10.25276/0235-4160-2020-1 -71.
- Патент РФ на изобретение № 2746647. МПК G09B 23/28 A61F 9/00. Самойлов А.Н., Давлетшина Н.И., Шакирова Ф.В., Давлетшина Н.И., Самойлова П.А. Способ создания экспериментальной модели грибкового кератита у кроликов.
- Патент РФ на изобретение № 2768476. МПК G09B 23/28 A61F 9/00. Самойлов А.Н., Давлетшина Н.И., Валиева Р.И., Лисовская С.А., Исаева Г.Ш., Шакирова Ф.В., Давлетшина Н.И., Самойлова П.А. Способ создания экспериментальной модели грибкового кератоувеита у кроликов.


