Экспериментальная модель тендинопатии пяточного сухожилия на фоне локального введения аутологичной обогащенной тромбоцитами плазмы
Автор: Маланин Д. А., Рогова Л. Н., Григорьева Н. В., Ласков И. Г., Демещенко М. В., Воронина А. В.
Журнал: Волгоградский научно-медицинский журнал @bulletin-volgmed
Статья в выпуске: 4 (68), 2020 года.
Бесплатный доступ
В эксперименте на 20 половозрелых крысах линии Wistar проведена оценка морфологических изменений в структуре пяточного сухожилия в условиях экспериментальной тендинопатии. При моделировании тендинопатии выявлены характерные для этого состояния гистологические признаки: дезорганизация коллагеновых структур, мукоидная и липоидная дегенерация, неоваскуляризация, лимфоидно-гистиоцитарная инфильтрация в прилежащих к сухожилию мягких тканях и в меньшей степени - непосредственно в самом сухожилии. Введение ОТП в область пяточного сухожилия на фоне тендинопатии уменьшает проявления воспалительного процесса, способствует сохранению и, возможно, восстановлению его нарушенной структуры.
Тендинопатия, тендинит, тендиноз, гиалуроновая кислота, обогащенная тромбоцитами плазма
Короткий адрес: https://sciup.org/142225969
IDR: 142225969 | УДК: 616-01/09
Текст научной статьи Экспериментальная модель тендинопатии пяточного сухожилия на фоне локального введения аутологичной обогащенной тромбоцитами плазмы
Современные теории возникновения тен-динопатий ставят под сомнение традиционное объяснение этиологических факторов и патофизиологических механизмов только с позиций воспалительного процесса и приписывают им более сложный уровень взаимодействия [11, 13].
Этиология тендинопатий остается не совсем понятной, а большинство известных причин, таких как гипоксия, гипертермия, апоптоз, воздействие медиаторов воспаления, молочной кислоты («окислительный стресс»), дисбаланс матричных металлопротеиназ и других остаются предметом теоретических рассуждений [2, 11, 13, 16].
Имеющиеся данные морфологических исследований свидетельствуют о преобладании при тендинопатиях дегенеративных изменений в ткани сухожилий над воспалительными. Причем последние прослеживаются в основном в тех случаях, когда сухожилия окружены и тес- но взаимодействуют с синовиальной тканью паратенона или слизистой сумки [8, 10, 13].
В основе традиционного лечения тендино-патий лежит назначение противовоспалительных препаратов, которые, очевидно, не решают проблемы изменений структуры и репаративного процесса, маскируя их хронизацию и прогрессирование [7].
Как показывает клиническая практика, применение ортобиологических методов лечения и, в частности, локальное инъекционное введение аутологичной обогащенной тромбоцитами плазмы при отдельных нозологических формах тендинопатий и паратендинопатий показало обнадеживающие результаты. Однако патогенетические механизмы происходящих при этом процессе, морфогенез тканей сухожилий на фоне введения ОТП изучены еще не достаточно [1, 3, 6, 12, 15].
ЦЕЛЬ РАБОТЫ
Получение новых данных о влиянии аутологичной обогащенной тромбоцитами плазмы на морфогенез ткани сухожилия в условиях экспериментальной модели тендинопатии.
МЕТОДИКА ИССЛЕДОВАНИЯ
Проведенное исследование носило экспериментальный характер и предполагало работу с лабораторными животными. При этом были соблюдены все требования, изложенные в правилах лабораторной практики (GLP), «Международных рекомендациях по проведению медико-биологических исследований с использованием животных» (1985) и приказе МЗ РФ № 267 от 19.06.2003 «Об утверждении правил лабораторной практики».
В исследование было включено 20 половозрелых крыс линии Wistar весом 250–350 г. Все манипуляции с животными проводили под общим обезболиванием с использованием препарата «Рометар» (Bioveta, Чешская республика) по методике, описанной производителем.
Лабораторные животные были распределены на 5 групп (G1-G5) по 4 крысы в каждой. Первая группа (G1) являлась контрольной и оставалась интактной на протяжении всего исследования. Во всех остальных группах (G2– G5) осуществляли моделирование тендинопа-тии пяточного сухожилия путём внутри- и око-лосухожильного введения 0,5 мл 10%-й суспензии стерильного талька в течение 6 недель по 2 инъекции в неделю (см. табл.).
Характеристика экспериментальных групп животных
|
Порода животных |
Крысы линии Wistar |
||||
|
Возраст |
Половозрелые |
||||
|
Масса |
265 ± 2,2 г |
||||
|
Вводимый препарат Группы |
10%-я суспензия стерильного талька, 0,5 мл |
0,9%-й раствор NaCl, 0,2 мл |
ОТП, 0,2 мл |
Гиалуроновая кислота, 0,2 мл |
ОТП + гиалуроновая кислота, 0,2 мл |
|
Контрольная (G1) |
- |
||||
|
Экспериментальная (G2) |
+ |
+ |
|||
|
Экспериментальная (G3) |
+ |
+ |
|||
|
Экспериментальная (G4) |
+ |
+ |
|||
|
Экспериментальная (G5) |
+ |
+ |
|||
|
Сроки выведения животных из эксперимента |
- |
10 недель |
10 недель |
10 недель |
10 недель |
После формирования патологического процесса у животных экспериментальных групп с лечебной целью проводили введение 0,2 мл сравниваемых препаратов в область пораженного сухожилия. В группе G2 вводили физиологический раствор NaCl, в G3 – аутологичную обогащенную тромбоцитами плазму (ОТП), в G4 – препарат гиалуроновой кислоты (ГК) «Русвиск» (Русвиск, Россия) с молекулярным весом 3–3,5 × 106 Да, в G5 – комбинацию ОТП и ГК. В каждой группе было выполнено 3 инъекции с интервалом в 1 неделю, а в группе G5 – 2 инъекции ОТП и 1 инъекция ГК. Все вышеуказанные препараты, равно как и суспензию стерильного талька во время моделирования патологического процесса, вводили в область пяточного сухожилия на 0,5 см от места его прикрепления к кости (рис. 1).
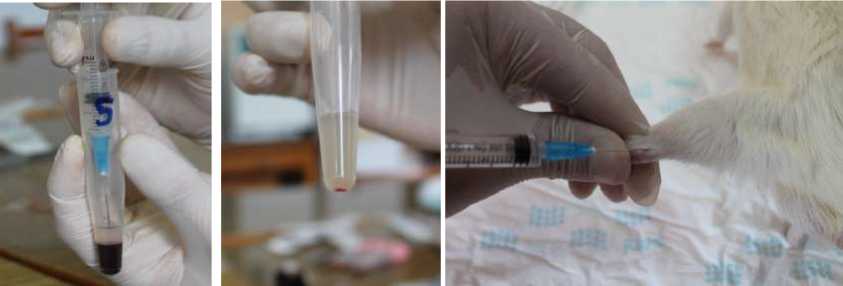
а б
Рис. 1. Моделирование тендинопатии: получение аутологичной ОТП (а) и введение её в область пяточного сухожилия (б)
Для получения ОТП забирали 1,2 мл цельной крови из бедренной вены животных в шприц с предварительно набранными 0,4 мл 5%-го раствора цитрата натрия. Полученную кровь сливали в герметично закрывающуюся стерильную стеклянную полупрозрачную емкость и помещали в центрифугу «RotoFix 32А» (Hettich, Германия) с соответствующим противовесом. Первое центрифугирование проводили в течение 5 минут со скоростью 1 500 об./мин. Затем забирали 0,8 мл надосадочной жидкости, которую помещали в другую аналогичную стерильную емкость и выполняли второе центрифугирование со скоростью 1 000 об./мин в течение 5 минут. Затем удаляли 0,6 мл надосадочной жидкости, а оставшуюся в пробирке ОТП объемом 0,2 мл несколько раз встряхивали и забирали с помощью шприца.
В ходе наблюдения за животными экспериментальных групп в процессе формирования модели тендинопатии, последующего лечения отмечали изменения общего состояния, локальные изменения в области инъекций и степень участия вовлеченной конечности в нагрузке и движениях.
Через неделю с момента последней лечебной инъекции в G3–G5-группах, через 4 недели после завершения моделирования тендинопатии в G2-группе и спустя 10 недель с момента начала эксперимента в G1-группе, животных выводили из исследования, введением летальной дозы препарата «Рометар». Таким образом, завершающим сроком эксперимента во всех группах животных явились 10 недель. Для гистологического анализа вычленяли костно-сухожильно-мышечные блоки, которые фиксировали в 10%-м нейтральном растворе забуференного формалина. Далее ткани, проведенные по батареи спиртов возрастающей концентрации, заливали в парафин. После чего изготавливали срезы толщиной 5–6 мкм и окрашивали их гематоксилином и эозином, толуидиновым синим по Масону.
Световую микроскопию выполняли на микроскопе «MICROS» (Австрия) при увеличении ×100 и ×400 с последующим фотографированием фотокамерой «OLYMPUS» (Япония).
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ И ИХ ОБСУЖДЕНИЕ
Основное заключение, состояло в том, что ОТП, введенная в область пяточного сухожилия в условиях экспериментальной модели тендинопа-тии, обладает противовоспалительным эффектом, способствуя сохранению и, возможно, восстановлению его нарушенной структуры. Спустя 10 недель после начала эксперимента общее состояние животных всех групп не претерпевало каких-либо отрицательных изменений, их физиче- ская активность оставалась на уровне, зафиксированном в начале исследования. Вовлеченная конечность у животных контрольной группы (G1-группа) и из групп сравнения (G2–G5-группы) сохраняла опороспособность и подвижность. Изменения на местном уровне проявлялись лишь небольшой отечностью мягких тканей в области инъекций только в тех случаях, когда проводили моделирование тендинопатии путем введения стерильной 10%-й суспензии талька (G2–G5-группы). Патоморфологические изменения структуры сухожильной ткани, выявленные после завершения моделирования тендинопатии у животных G2-группы, заключались в возникновении очагового разволокнения коллагеновых волокон и дезорганизация их пучков. Наряду с этим, имели место признаки мукоидной и липоидной дегенерации, проявляющиеся метахромазией при окраске по Масону и толуидиновым синим, а также неоваскуляризации. Последняя, равно как и лимфоидно-гистиоцитарная инфильтрация с участками скопления нейтро-фильных лейкоцитов, наблюдалась в прилежащем к сухожилию паратеноне, а также жировой и мышечной тканях и в меньшей степени – непосредственно в самом сухожилии (рис. 2).
Отмеченные изменения в ткани пяточного сухожилия и в прилежащих мягких тканях в основном объяснялись вызванными тальком микроповреждениями, активирующими механизмы воспаления, включая цитокиновый каскад, металлопротеиназы, играющие, как известно, важную роль в метаболизме, деструкции и ремоделировании матрикса большинства соединительнотканных структур [5, 11, 16]. Подобные структурные нарушения на микроскопическом уровне в настоящее время рассматриваются в контексте механической теории развития патологии сухожилий, а для их обозначения используются термины тендинопатия, тендиноз или тендинит [7, 10]. Выявление характерных гистологических признаков указанных патологических процессов в нашей экспериментальной модели подтверждало её адекватность для решения поставленных в исследовании задач.
Локальное введение ОТП (G3-группа), гиалуроновой кислоты (G4-группа) или их сочетания между собой (G5-группа) кратностью 1 раз в неделю в течении 3 недель показало изменение морфологического профиля ткани в области смоделированной тендинопатии. Проявления дезорганизации и дегенерации коллагенового матрикса, воспалительного процесса в окружающих сухожилие мягких тканях имели меньшую выраженность по сравнению этими процессами, наблюдавшимися в препаратах у животных G2-группы, которым лечение не проводили (рис. 3).
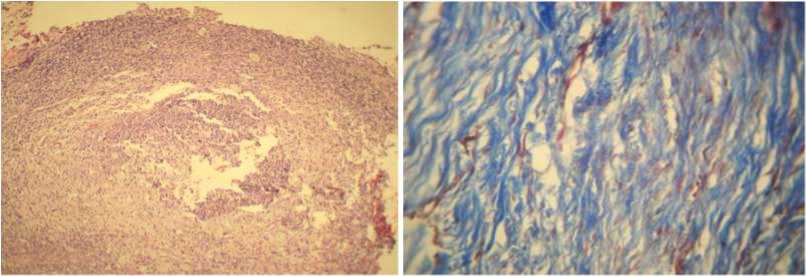
а б
Рис. 2. Модель тендинопатии пяточного сухожилия: участки разволокнения, мукоидной дегенерации, околосухожильной очаговой лимфогистиоцитарной инфильтрации. Окр. гематоксилином и эозином, ув. ×100 (а) и по Масону, ув. ×400 (б)
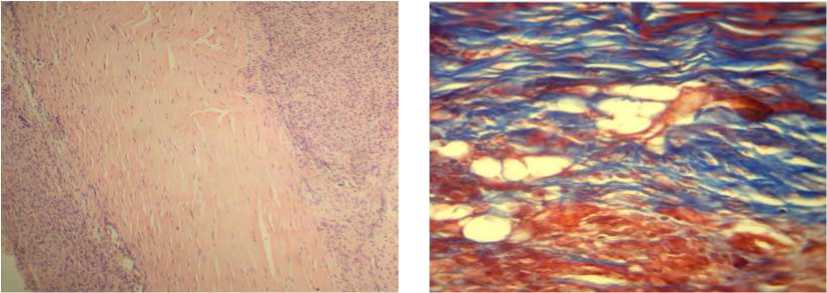
а б
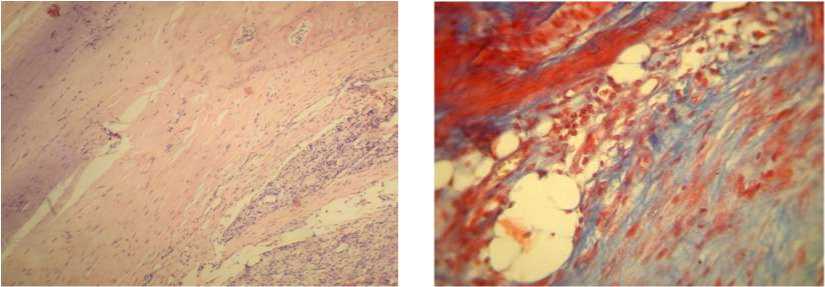
в г
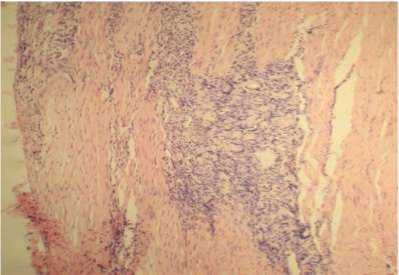
д
Рис. 3. Модель тендинопатии пяточного сухожилия в условиях локального введения ОТП (а, б), ГК (в, г), ОТП+ГК (д, е). Окр. гематоксилином и эозином, ув. ×100 (а, в, д) и по Масону, ув. ×400 (б, г, е)
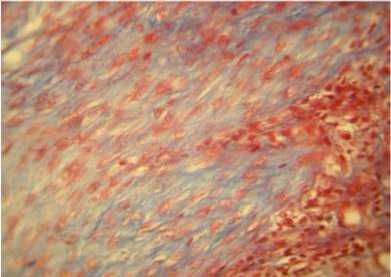
е
В наибольшей степени положительная динамика характеризовала морфогенез тендино-патии в условиях введения ОТП или ОТП и ГК.
Противовоспалительное действие ОТП, отмеченное в нашем исследовании, было вполне ожидаемым явлением, обусловленным, главным образом, факторами роста, содержащимися в α-гранулах тромбоцитов, способными оказывать регулирующее воздействие на все три фазы воспалительного процесса посредством взаимодействия с трансмембранными рецепторами клеток и инициации внутриклеточных сигналов [12, 14].
Не меньшего, а может быть и большего внимания достойно еще одно свойство ОТП, которое проявилось в виде защиты ткани сухожилия от разрушения, дегенерации (тендопротек-тивный эффект) и восстановления его после повреждений (репаративный эффект). Развитие репаративных процессов в этом случае также находит объяснение с позиций участия факторов роста тромбоцитов ОТП, которые влияют на экспрессию генов в ядрах клеток с усилением синтеза белков, регулирующих их пролиферативную и синтетическую активность. Кроме этого, факторы роста тромбоцитов стимулируют хемотаксис, дифференциацию клеток и локальный ангиогенез, что имеет непосредственное отношение к процессам восстановления поврежденных сухожилий [12, 17]. В результате взаимодействия ОТП с тканью сухожилий рядом авторов отмечалось усиление пролиферации фибробластов, синтеза коллагена 1-го и 3-го типов теноцитами, фибробластами, миграция клеток-предшественников из костного мозга в область повреждения сухожилий, увеличение размеров и прочности регенерата, улучшение гистологических и механических характеристик костно-сухожильного прикрепления [4, 3, 7, 12, 17].
В качестве альтернативного ОТП ортобио-логического препарата у животных G4-группы была выбрана гиалуроновая кислота, также известная своим противовоспалительным действием и способностью стимулировать синтез протеогликанов – одного из компонентов матрикса ткани сухожилия [4, 9]. Вероятно, благодаря этим свойствам проявился, наблюдавшийся в нашем исследовании, тендопротектив-ный эффект ГК.
Дегенерация сухожилия у животных G4-группы достигала меньшей степени по сравнению с подобными процессами, отмеченными через 10 недель после моделирования тенди-нопатии в группе G2, но отличалась в худшую сторону от гистологической картины структурной организации сухожилий после инъекций
ОТП или ОТП и ГК. Причем изучение защитных и восстановительных возможностей последней комбинации при тендинопатиях представляется перспективным для последующих экспериментальных и клинических исследований.
ЗАКЛЮЧЕНИЕ
Экспериментальная модель, основанная на введении в область пяточного сухожилия крысы 0,5 мл 10%-й суспензии стерильного талька в течение 6 недель по 2 инъекции в неделю, характеризуется возникновением гистологических признаков тендинопатии – нарушением структуры тканей, очаговым воспалением и сосудистой пролиферацией.
Введение ОТП в область пяточного сухожилия в качестве монотерапии или в сочетании с гиалуроновой кислотой в условиях экспериментальной модели тендинопатии уменьшает проявления воспалительного процесса, способствует сохранению и, возможно, восстановлению его нарушенной структуры.
Список литературы Экспериментальная модель тендинопатии пяточного сухожилия на фоне локального введения аутологичной обогащенной тромбоцитами плазмы
- Применение PRP-терапии при тендинопатиях вращательной манжеты и длинной головки двуглавой мышцы плеча / Д. A. Маланин, А. И. Нор-кин, А. С. Трегубов [и др.] // Травматология и ортопедия России. - 2019. - № 25 (3). - С. 57 -66. - Текст: непосредственный.
- A longitudinal study of industrial and clerical workers: predictors of upper extremity tendonitis / R. A. Werner, A. Franzblau, N. Gell [et al.] // J. Occup. Rehabil. - 2005. - Vol. 15. - P. 37 - 46. - Direct text.
- A single dose of platelet-rich plasma improves the organization and strength of a surgically repaired rotator cuff tendon in rats / O. Dolkart, O. Chechik, Y. Zarfati [et al.] // Arch. Orthop. Trauma Surg. - 2014. - Vol. 134 (9). - P. 1271 - 1277. - Direct text.
- Anti-Inflammatory effects of intra-articular hyaluronic acid: a systematic review / R. Altman, A. Bedi, A. Manjoo [et al.] // Cartilage. - 2019. - Vol. 10 (1). - P. 43 - 52. - Direct text.
- Bestwick, C. S. Reactive oxygen species and tendon problems: review and hypothesis / C. S. Bestwick, N. Maffulli // Sports Med. Arthroscopy Rev. -2000. - Vol. 8. - P. 6 - 16. - Direct text.
- Centeno, C. J. C. Past, current and future interventional orthobiologics techniques and how they relate to regenerative rehabilitation: a clinical commentary / C. J. C. Centeno, S. M. Pastoriza // Int. J. Sports Physical Therapy - 2020. - Vol. 15 (2). -P. 301 - 325. - Direct text.
- Current opinions on tendinopathy / J. F. Kaux, B. Forthomme, C. I. Goff [et al.] // J. Sports Sci. Med. - 2011. - Vol. 10 (2). - P. 238 - 253. - Direct text.
- Histopathology of common tendinopathies. update 13 and implications for clinical management / K. M. Khan, J. I. Cook, F. Bonar [et al.] // Sports Med. - 1999. - Vol. 27 (6). - P. 393 - 408. - Direct text. 14
- Hyaluronic acid in inflammation and tissue regeneration / M. Litwiniuk, A. Krejner, M. Speyrer [et al.] // Wounds. - 2016. - Vol. 28. - P. 78 - 88.-Direct text.
- Maffulli, N. Types and epidemiology of tendinopa- 15. thy / N. Maffulli, J. Wong, I. C. Almekinders // Clin. Sports Med. - 2003. - Vol. 22 (4). - P. 675 -692. - Direct text.
- Matrix metalloproteinase activities and their relationship with collagen remodelling in tendon pa- 16 thology / G. P. Riley, V. Curry, J. De Groot [et al.] // Matrix Biol. - 2002. - Vol. 21 (2). - P. 185 - 195. -Direct text. 17
- Platelet-rich plasma: from basic science to clinical applications / T. E. Foster, B. I. Puskas, B. R. Mandelbaum [et al.] // Am. J. Sports Med. - 2009. -Vol. 37 (11). - P. 2259 - 2272. - Direct text.
- Sharma, P. Biology of tendon injury: healing, modeling and remodeling / P. Sharma, N. Maffulli // J. Musculoskelet. Neuronal Interact. - 2006. - Vol. 6 (2). - P. 181 - 190. - Direct text
- The antiinflammatory and matrix restorative mechanisms of platelet-rich plasma in osteoarthritis / E. A. Sundman, B. J. Cole, V. Karas [et al.] // Am. J. Sports Med. - 2014. - Vol. 42 (1). - P. 35 41. - Direct text
- The clinical impact of platelet-rich plasma on tendi-nopathy compared to placebo or dry needling injections: a meta-analysis / К. Tsicopoluos, I. Tsicopoluos, E. Simeonidis [et al.] // Phys. Ther. Sports. 2016. - Vol. 17. - P. 87 - 94. - Direct text
- Yuan, J. Cell death and tendinopathy / J. Yuan, M. X. Wang, G. A. Murrell // Clin. Sports Med. 2003. Vol. 22 (4). - P. 693 - 701. - Direct text
- Zhang, J. Platelet-rich plasma releasate promotes differentiation of tendon stem cells into active tenocytes / J. Zhang, J. H. Wang // Am. J. Sports Med. - 2010. - Vol. 38 (12). - P. 2477 - 2486. -Direct text


