Экспериментальная оценка отдаленных последствий токсического действия цитостатических препаратов на мужскую репродуктивную функцию
Автор: Боровская Татьяна Геннадьевна, Гольдберг Виктор Евгеньевич, Полуэктова Марина Евгеньевна, Щемерова Юлия Александровна, Вычужанина Анна Владимировна, Григорьева Валерия Александровна, Коллантай Олеся Вадимовна, Камалова Светлана Ивановна
Журнал: Сибирский онкологический журнал @siboncoj
Рубрика: Лабораторные и экспериментальные исследования
Статья в выпуске: 1 т.19, 2020 года.
Бесплатный доступ
Целью исследования явилась сравнительная оценка отдаленных токсических эффектов цитостатических препаратов (антрациклиновых антибиотиков, ингибиторов топоизомеразной активности, комплексных соединений платины и таксанов) на мужскую репродуктивную функцию. Материал и методы. Эксперименты проведены на крысах-самцах сток Вистар, возраст 2,5 мес. Животным вводили в максимально-переносимой дозе следующие цитостатические препараты: Вепезид (этопозид, Теуа, Израиль), Иринотекан (Кампто, Rhone-Poulens, Великобритания), Карбоплатин (кемокарб, Дабур Индия Лтд, Индия), Паклитаксел (митотакс, Dr. Reddy's, Индия), Платидиам (Lachema, Чехия), Фарморубицин (Farmitalia, Carlo Erba). Оценка репродуктивного статуса проводилась через 90 и 180 сут после их введения, что соответствует токсическому действию на сперматогонии. Оценивались способность к зачатию, продуктивность сперматогенеза, жизнеспособность оплодотворенной яйцеклетки. Для определения чувствительности разных типов сперматогоний к действию препаратов проводилось изучение динамики численности их клеточной популяции через 2, 5, 10, 15, 30, 90 и 180 сут после начала эксперимента. Результаты. В отдаленные сроки после введения крысам-самцам фарморубицина и паклитаксела выявлялось полное (фарморубицин) или частичное (паклитаксел) снижение способности к зачатию, обусловленное олигоспермией. Снижение продуктивности сперматогенеза носило обратимый характер. У крыс, получавших ингибиторы топоизомеразной активности, способность к зачатию сохранялась, но наблюдалась, судя по общему количеству сперматозоидов, недостаточность сперматогенеза. В отдаленные сроки после введения комплексных соединений платины воспроизводящая функция не снижалась, продуктивность сперматогенеза соответствовала контрольным значениям. Степень выраженности токсических эффектов на гонады определялась чувствительностью разных типов сперматогоний к действию препаратов. Фарморубицин и паклитаксел оказывали выраженное токсическое действие на стволовые сперматогониальные клетки. Паклитаксел и карбоплатин индуцировали доминантные летальные мутации в сперматогониях, но с течением времени вероятность появления гамет, несущих генетические повреждения, несовместимые с жизнью, снижалась.
Цитостатические препараты, состояние репродуктивной системы, отдаленные токсические эффекты, крысы
Короткий адрес: https://sciup.org/140254323
IDR: 140254323 | УДК: 616.64:615.28:615.017]-092.9 | DOI: 10.21294/1814-4861-2020-19-1-64-72
Текст научной статьи Экспериментальная оценка отдаленных последствий токсического действия цитостатических препаратов на мужскую репродуктивную функцию
Успехи химиотерапевтического метода лечения злокачественных новообразований и наличие высокого риска утраты репродуктивной функции послужили основанием для развития в медицине направления, которое изучает возможность сохранения способности к деторождению у пациентов, перенесших химиотерапию [1]. Оно получило название онкофертильность и существует уже более 10 лет. Создан консорциум онкофертильности, который представляет собой межнациональный междисциплинарный проект, предназначенный для изучения репродуктивного здоровья пациентов, выживших после лечения онкологического заболевания [2]. Задачами этого проекта является прогнозирование репродуктивных рисков различных видов химиотерапевтических воздействий; изучение механизмов их гонадотоксического действия; поиск методов сохранения фертильности у пациентов, получавших противоопухолевые препараты.
Криоконсервация семенной жидкости перед химиотерапией как способ сохранения возможности деторождения у мужчин уже достаточно давно используется в клинической практике. Несмотря на надежды, связанные с безопасностью эффективной заморозки тканей половых желез, она оправдывает себя далеко не во всех случаях [3, 4]. Следует отметить невысокую комплаентность этого метода, которую связывают с необходимостью принятия пациентом решения о криоконсервации до начала лечения, когда все его устремления направлены на излечение основного заболевания [5]. Другие стратегии управления онкофертильностью пока находятся на стадии разработки [6]. Одним из способов сохранения фертильности пациентов после химиотерапии является использование менее токсичных цитостатических препаратов, не снижающих эффективность лечения [7]. Этот способ уже применяется в клинической практике, в частности при лечении болезни Ходжкина [4]. В настоящее время проводится активный поиск лекарственных средств для снижения гонадотоксических эффектов цитостатических препаратов [4, 8, 9].
Основой для решения задач онкофертильности являются экспериментальные исследования. Они позволяют выявить степень выраженности гонадотоксичности отдельного препарата, чего нельзя сделать в условиях полихимиотерапии; получить информацию о механизмах гонадотоксического действия каждого из них, что может служить основанием для поиска патогенетически обоснованных путей фармакологической коррекции. Экспериментальная оценка степени выраженности инфертильности на фоне разных видов цитостатического воздействия позволяет сделать прогноз репродуктивных рисков используемого вида химиотерапии, что является актуальным при решении вопроса о криоконсервации и для модификации химиотерапии.
Установлено, что основной причиной инфер-тильности мужчин после химиотерапии является азооспермия [4]. В исследованиях M.L. Meistrich [10] показано, что азооспермия в отдаленные сроки после химиотерапии связана с гибелью либо цитогенетическими нарушениями сперматогоний, в том числе стволовых сперматогониальных клеток (ССК). Окончательное восстановление процесса созревания мужских половых клеток зависит от выживания ССК, способности их к регенерации и дифференцировке. В настоящее время получены убедительные экспериментальные доказательства того, что наиболее гонадотоксичными являются алкилирующие соединения, к которым ССК проявляют высокую чувствительность [11–13]. Отдаленные репродуктивные эффекты многих других препаратов (комплексных соединений платины, антрациклинов, ингибиторов топоизомеразной активности и др.), широко применяемых в настоящее время в клинике, являются недостаточно изученными [8].
Целью исследования явилась сравнительная оценка отдаленных токсических эффектов цитостатических препаратов (антрациклиновых антибиотиков, ингибиторов топоизомеразной активности, комплексных соединений платины и таксанов) на мужскую репродуктивную функцию.
Материал и методы
Эксперименты проведены на аутбредных крысах-самцах сток Вистар (n=435), возраст 2,5 мес. Для изучения способности к зачатию дополнительно использовались крысы-самки (n=480). Животные были получены из отдела экспериментальных биологических моделей «НИИ фармакологии им. Е.Д. Гольдберга», г. Томск. Крыс содержали в соответствии с правилами, принятыми Европейской конвенцией по защите позвоночных животных, используемых для экспериментальных и иных научных целей (Страсбург, 1986), а также в соответствии с требованиями Приказа МЗ РРФ от 01.04.2016 № 199 «Об утверждений Правил надлежащей лабораторной практики».
Оценивались отдаленные последствия на сперматогенез цитостатических средств с различным механизмом действия: а) алкилирующих молекулу ДНК (комплексные соединения платины – КСП, платидиам, карбоплатин); б) интеркалирующих между двумя парами оснований (антрациклиновые антибиотики, фарморубицин); в) ингибирующих топоизомеразную активность (ИТА, вепезид, иринотекан); г) индуцирующих образование дефектных микротрубочек (таксаны, паклитаксел). Оценка репродуктивного статуса проводилась через 90 и 180 сут после их введения, что соответствует токсическому воздействию на сперма-тогонии. Определялись способность к зачатию, продуктивность сперматогенеза, жизнеспособность оплодотворенной яйцеклетки. Для сравнения чувствительности разных типов сперматогоний к действию препаратов проводилось исследование динамики численности клеточной популяции нормальных сперматогоний через 2, 5, 10, 15, 30, 90 и 180 сут после цитостатического воздействия.
Животные были разделены на 7 групп (по 10–15 особей в каждой), одна из которых составила группу интактных животных (фон). Цитостатические препараты вводили однократно внутривенно в максимально переносимых дозах (МПД), которые составили для Вепезида (этопозид, Теvа, Израиль) – 30 мг/кг, Иринотекана (Кампто, Rhone-Poulens, Великобритания) – 30 мг/кг, Карбоплатина (кемокарб, Дабур Индия Лтд, Индия) – 60 мг/кг, Паклитаксела (митотакс, Dr. Reddy`s, Индия) – 4,6 мг/кг, Платидиама (Lachema, Чехия) – 4 мг\кг, Фармору-бицина (Farmitalia, Carlo Erba) – 7,5 мг/кг.
Способность к зачатию оценивалась с помощью индекса беременности. С этой целью крыс-самцов, получавших препараты, подсаживали к интактным крысам-самкам на протяжении 10 дней в соотношении 1 самец : 2 самки. Спаривание регистрировали с помощью вагинальных мазков. На 20-й день после ссаживания крыс-самок подвергали эвтаназии, вскрывали, устанавливали факт беременности. Индекс беременности вычисляли как процентное отношение числа беременных самок к числу оплодотворенных. Для определения наличия в мужских половых клетках генетических повреждений, несовместимых с жизнью (доминантных летальных мутаций, ДМЛ), у беременных крыс-самок подсчитывали количество желтых тел в яичниках, мест имплантации в матке, количество живых и мертвых плодов (из расчета на 1 самку). Далее определяли показатели постимплантационной смертности [14].
Продуктивность сперматогенеза определяли по общему количеству сперматозоидов (ОКС), приходящихся на хвостовую часть придатка семенника. С этой целью часть крыс-самцов (по 5 в каждой группе) подвергали эвтаназии, извлекали хвостовую часть придатка семенника. Для определения ОКС, приходящегося на придаток, использовали гомогенизированную клеточную взвесь хвостовой части придатка семенника в дозированном количестве физиологического раствора с применением лейкоцитарного меланжера и камеры Горяева [14]. Определение количества источников пролиферативного пула сперматогенеза проводили путем
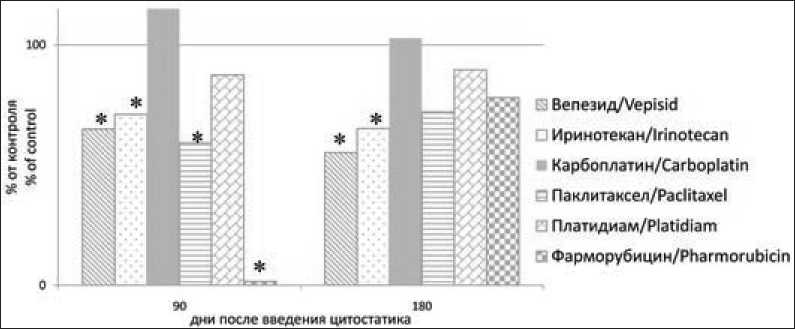
Рис. 1. Общее количество сперматозоидов в отдаленные сроки после введения цитостатических препаратов. Примечание: * – различия статистически значимы по сравнению с контролем.
Fig. 1. The total sperm number in the long-term follow-up after injection of cytotoxic drugs.
Notes: * – statistically significant differences compared to control.
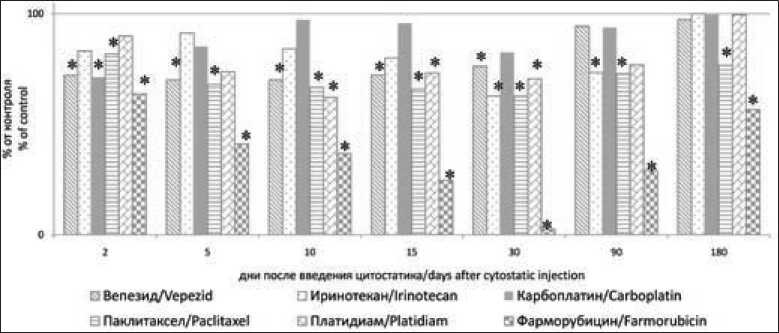
Рис. 2. Численность клеточной популяции нормальных сперматогоний в ранние и отдаленные сроки после введения цитостатических препаратов. Примечание: * – различия достоверны по сравнению с контролем Fig. 2. The number of cell populations of normal spermatogonia in the early and long-terms after injection of cytotoxic drugs. Notes: * – statistically significant differences are significant compared to control
подсчета на гистологических срезах численности клеточной популяции нормальных сперматогоний. С этой целью после эвтаназии у крыс-самцов извлекали семенники, фиксировали их в жидкости Карнуа, готовили парафиновые срезы, толщиной 5 мкм, затем окрашивали их гематоксилин-эозином. На срезе семенника определяли численность клеточной популяции нормальных сперматогоний (расчет проводили на 100 канальцев) [14].
Статистическую обработку полученных экспериментальных данных проводили с использованием U-критерия Манна–Уитни и углового преобразования Фишера. Различия считали значимыми при р≤0,05.
Результаты
Результаты оценки интегральных показателей генеративной функции крыс-самцов в отдаленные сроки после воздействия различных цитостатиков представлены в таблице. Установлено, что способность к зачатию через 60 и 90 сут сохранялась на уровне фоновых значений в группах крыс, получавших КСП (платидиам, карбоплатин) и ИТА (вепезид, иринотекан). У животных, которым вводили антрациклиновый антибиотик и таксан-содержащий препарат, выявлялся промежуток временной стерильности (полной, частичной). Так, через 60 сут после введения фарморубицина инфертильность выявлялась в 100 % случаев. В группе животных, которые получали паклитаксел, этот эффект наблюдался у 31 % крыс. Через 6 мес после начала опыта способность к зачатию восстанавливалась.
Продуктивность сперматогенеза оказалась сниженной на 90-е сут после введения фарморубици-на, паклитаксела и ингибиторов топоизомеразной активности (рис. 1). Особенно низкие значения этого показателя (1,56 % от контрольных значений) выявлялись у животных, получавших фармору-бицин. После введения паклитаксела ОКС у крыс составляло 55 % от контроля, вепезида и иринотекана – 65 и 71 %. Продуктивность сперматогенеза у крыс, получавших КСП, в отдаленные сроки после их введения не снижалась. Через 180 сут после начала эксперимента недостаточность сперматогенеза невысокой степени выраженности сохранялась у животных, получавших ИТА. При подсчете количества нормальных сперматогоний (рис. 2) в ранние и отдаленные сроки после введения фарморубицина наблюдалось их прогрессирующее снижение (на 75 % от контроля) вплоть до 30-го дня опыта. Впоследствии этот показатель медленно возрастал и через 180 сут после начала опыта так и не достигал контрольных значений. В семенниках крыс, получавших паклитаксел, количество нормальных сперматогоний оказалось сниженным (на 30–35 % от контрольных значений) как в ранние, так и в отдаленные сроки (90 и 180 сут) после начала эксперимента (рис. 2).
Сходные значения этого показателя выявлялись в течение первых 30 сут эксперимента у животных, которым вводили вепезид, но впоследствии ОКС восстанавливалось до контрольного уровня (рис. 2). На фоне использования иринотекана количество нормальных сперматогоний достоверно сокращалось к 30-му дню опыта и осталось сниженным через 90 сут после его введения. Введение КСП приводило к сокращению количества спер-матогоний только в ранние сроки после введения (рис. 2).
Показатели постимплантационной гибели у интактных крыс-самок, скрещенных с крысами-самцами в отдаленные сроки после введения исследуемых антибластомных средств, представлены в табл. 1. Установлено, что постимплантационная смертность возрастала (в 2–3,4 раза) через 90 сут после введения паклитаксела и карбоплатина. Через 6 мес после начала эксперимента значение этого показателя в экспериментальных группах не отличались от контрольных значений.
Обсуждение
Анализ полученных данных позволяет заключить, что исследуемые виды цитостатических воздействий не приводили к необратимой инфер-тильности, как это характерно для большинства алкилирующих соединений. В этой связи следует отметить, что в отдаленные сроки после введения КСП, которые по своему механизму действия также алкилируют молекулу ДНК, риск снижения способности к зачатию, судя по результатам настоящего исследования, не подтвердился. Частичная, либо полная временная инфертиль-ность наблюдалась у животных, получавших ан-трациклиновый антибиотик и таксансодержащий препарат. Судя по ОКС, угнетение способности к зачатию после использования фарморубицина и паклитаксела обусловлено выраженной олиго-спермией. Обращает на себя внимание тот факт, что в отдаленные сроки после введения ИТА также выявлялась олигоспермия. Однако это не при- водило к снижению способности к зачатию. Это обусловлено, очевидно, незначительной степенью выраженности этого эффекта и высокой степенью надежности репродуктивной системы, которая обеспечивается многочисленным дублированием мужских половых клеток.
Судя по индексам беременности и ОКС, токсичность исследуемых цитостатических средств убывала в следующем порядке: фарморуби-цин→паклитаксел→вепезид→иринотекан – и не выявлялась после использования КСП. Сопоставляя значения ОКС с динамикой количества нормальных сперматогоний, можно утверждать, что олиго-спермия обусловлена токсическим действием на источники пролиферативного пула сперматогенеза. Прогрессирующее существенное опустошение (в течение 30 сут после начала опыта) численности клеточной популяции нормальных сперматогоний выявлялось в семенниках животных, получавших фарморубицин, что является, очевидно, результатом существенного повреждения и гибели ССК. По данным H. Beaud et al. [15], сходным действием на ССК обладает другой антрациклиновый антибиотик – доксорубицин. Паклитаксел также приводил к сокращению количества источников пролиферативного пула сперматогенеза (в меньшей степени, чем фарморубицин). Этот токсический эффект проявлялся на протяжении всех сроков исследований, что также свидетельствует о повреждении ССК. Эти данные подтверждают результаты исследований, проведенных Сухачевой и соавт. [16]. ИТА вызывали длительное (до 90 сут) сокращение (до 30 %) численности клеточной популяции нормальных сперматогоний, что также является результатом повреждения ССК. После введения КСП этот показатель снижался только в ранние сроки после их введения, следовательно, существенному токсическому действию подвергались только дифференцированные сперматогонии. Обобщая сказанное, можно отметить, что чувствительность ССК к действию исследуемых препаратов убывала в следующем порядке: фарморубицин→паклитак-сел→вепезид→иринотекан. В такой же последовательности убывала способность к зачатию. Это позволяет заключить, что чувствительность разных типов сперматогоний к действию препарата имеет прогностическую значимость для заключения о возможных его отдаленных последствиях для воспроизводящей функции, что подтверждает результаты исследований, полученных Meistrich [10] .
Факт повышения эмбриональной смертности, обусловленной мужским фактором, выявленный на фоне использования паклитаксела и карбоплатина, свидетельствует о сокращении репродуктивного потенциала животных за счет наличия в сперми-ях генетических повреждений, несовместимых с жизнью. Их выявление в отдаленные сроки после начала опыта является результатом генотоксических эффектов на сперматогонии. Способность
|
Таблица/table Состояние генеративной функции крыс-самцов в отдаленные сроки (90 и 180 сут) после введения цитостатических препаратов Generative function of male rats 90 and 180 days after injection of cytotoxic drugs |
|||||
|
Название препарата/ Name of the drug |
Способность к зачатию, % (индекс беременности, опыт/контроль)/ Ability to get pregnant, % (fertility index, study/con-trol groups) 90 сут/ 180 сут/ days days |
Постимплантационная смертность, % (опыт/контроль)/ Postimplantation mortality, % (study/ control groups) 90 сут/ 180 сут/ days days |
Прогноз в отношении состояния репродуктивной функции. Оценка влияния на сперматогонии/ The prognosis regarding the state of reproductive function. Assessment of the effect on spermatogonia |
||
|
Фарморубицин/ Farmorubicin |
0,00* 100,00 |
95,00 100,00 |
«---» |
4,19 ± 1,34 5,12 ± 2,40 |
Временная инфертильность (в 100 % случаев) с последующим длительным восстановлением. Значительное повреждение ССК/Temporary infertility (in 100 % of cases) with subsequent long-term recovery. Significant damage to spermatogonial stem cells (SSCs). |
|
Паклитаксел/ Paclitaxel |
78,95* 95,00 |
100,00 94,12 |
17,59 ± 4,94* 5,16 ± 1,71 |
4,39 ± 2,79 2,93 ± 1,54 |
Временная инфертильность (в 30 % случаев) с длительным восстановлением, повышенная вероятность самопроизвольного прерывания беременности. Повреждение ССК средней степени выраженности/ Temporary infertility (in 30 % of cases) with prolonged recovery, increased likelihood of spontaneous abortion. Damage to SSCs of moderate severity |
|
Платидиам/ Platidiam |
94,90 90,00 |
94,40 90,00 |
5,41 ± 1,86 5,63 ± 1,55 |
7,16 ± 1,55 4,51 ± 3,62 |
Фертильность сохранена. Повреждение дифференцированных спермато-гоний/Fertility preservation, damage to differentiated spermatogonia |
|
Карбоплатин/ Carboplatin |
82,30 95,00 |
95,00 100,00 |
21,69 ± 6,79* 10,91 ± 4,81 |
10,74 ± 3,62 6,51 ± 3,32 |
Фертильность сохранена, есть вероятность самопроизвольного прерывания беременности. Повреждение ССК (ДЛМ)/Fertility preservation, likelihood of spontaneous abortion. Damage to SSCs |
|
Вепезид/ Vepezid |
87,50 89,47 |
78,57 94,74 |
21,18 ± 7,20 10,92 ± 3,70 |
26,44 ± 13,8 8,33 ± 3,21 |
Фертильность сохранена. Частичное повреждение ССК незначительной степени выраженности/Fertility preservation, partial damage to SSCs of mild severity |
|
Иринотекан/ Irinotecan |
88,24 89,47 |
80,00 94,74 |
13,48 ± 3,06 10,92 ± 3,70 |
19,39 ± 8,00 8,33 ± 3,21 |
Фертильность сохранена. Частичное повреждение ССК незначительной степени выраженности/Fertility preservation, partial damage to SSCs of mild severity |
Примечания: * – статистически значимые различия по сравнению с контролем; «---» – данные отсутствуют, т.к. зачатия не зафиксировано/ Notes: * - statistically significant differences compared to control; «—» - no dates, due to no conceiving.
к индукции ДМЛ у цитостатических препаратов описана в литературе [17-19]. В человеческой популяции гибель оплодотворенной яйцеклетки будет проявляться в виде самопроизвольного прерывания беременности. Тот факт, что с течением времени (6 мес) уровень постимплантационной гибели снижается, является, безусловно, чрезвычайно позитивным.
Анализ полученных данных позволяет сделать репродуктивные прогнозы в отношении каждого из исследуемых препаратов (табл. 1). Эти прогнозы являются во всех случаях благоприятными с точки зрения возможности восстановления способности к деторождению. Степень выраженности и характер отдаленных последствий действия цитостатических препаратов на воспроизводящую функцию не зависят от их принадлежности к определенному классу химических соединений, а определяются индивидуальным химическим строением препарата. Они могут различаться и в пределах одного класса химических соединений.
Заключение
В отдаленные сроки после введения крысам-самцам фарморубицина и паклитаксела выявляется полная (фарморубицин) или частичная (паклитаксел) инфертильность, носящая обратимый характер. Инфертильность животных обусловлена олигоспермией. У крыс, получавших ИТА, способность к зачатию сохраняется, но наблюдается
Список литературы Экспериментальная оценка отдаленных последствий токсического действия цитостатических препаратов на мужскую репродуктивную функцию
- Сидоров С.В., Браве Ю.И., Чернусь Н.Ю. Правовые аспекты осуществления репродуктивной функции больных раком молочной железы. Сибирский онкологический журнал. 2018; 17(3): 72-76. DOI: 10.21294/1814-4861-2018-17-3-72-76
- De Vos M., Smitz J., Woodruff T.K. Fertility preservation in women with cancer. Lancet. 2014; 384(9950): 1302-10. DOI: 10.1016/S0140-6736(14)60834-5
- Боярский К.Ю., Гайдуков С.Н. Онкофертильность: возможность сохранения репродуктивной функции у онкологических больных. Вопросы онкологии. 2013; 59(5): 555-564.
- Kenney L.B., Cohen L.E., Shnorhavorian M., Metzger M.L., Lockart B., Hijiya N., Duffey-LindE., Constine L., Green D., Meacham L. Male reproductive health after childhood, adolescent, and young adult cancers: a report from the children's oncology group. J Clin Oncol. 2012 Sep 20; 30(27): 3408-16. DOI: 10.1200/JCO.2011.38.6938
- Achille M.A., Rosberger Z., Robitaille R., Lebel S., Gouin J., Bultz B.D., Chan P.T. Facilitators and obstacles to sperm banking in young men receiving gonadotoxic chemotherapy for cancer: the perspective of survivors and health care professionals. Human Reproduction. 2006; 21(12): 3206-3216. DOI: 10.1093/humrep/del307


