Экспериментальная оценка радиомодифицирующих свойств солей кальция
Автор: Иванов В.Л., Панфилова В.В., Чибисова О.Ф.
Рубрика: Научные статьи
Статья в выпуске: 2 т.28, 2019 года.
Бесплатный доступ
Несмотря на многолетний поиск высокоэффективных средств противолучевой защиты, интерес к ним не снижается, так как опасность для жизни и здоровья людей и животных представляют не только открытые источники ионизирующего излучения, но и продукты питания, загрязнённые радионуклидами природного или искусственного происхождения. Известен ряд публикаций, свидетельствующих о достаточно высокой радиозащитной роли кальция при внешнем остром и хроническом поражении организма, а также при действии инкорпорированных радиоактивных веществ. Как отмечают авторы публикаций, действие радиации, наряду со снижением уровня кальция в крови, вызывает резкое (в 15 раз) увеличение его в структурах тканей, а это свидетельствует не о недостаточности элемента в организме, а о нарушении механизма его обмена. Целью настоящей работы являлось выяснение влияния на радиорезистентность белых беспородных мышей (облучённых в дозе 8 Гр при мощности дозы 2 Гр/мин) вводимых с кормом солей кальция (глюконата и углекислого) как отдельно, так и с включением в рацион витаминов А и Д2 в виде очищенного для внутреннего применения рыбьего жира. Установлено, что препараты кальция, введённые в корм из расчёта 0,1 г на одно животное в сутки в течение 3-7 суток до и 6-10 суток после гамма-облучения повышают радиорезистентность животных, увеличивая 30-суточную выживаемость животных до 80% (при 31,7% выживаемости в группе облучённого контроля). Включение в рацион рыбьего жира (витамин А составляет 10 МЕ, а витамин Д2 - 1 МЕ на 1 животное в сутки) дополнительно увеличивает выживаемость к 30 суткам после облучения на 10,5-15,0%, которая составляет 90,5% и 95,0%. Интересно отметить, что отсроченное применение кальция углекислого, начиная с 4 дня после облучения, также статистически значимо повышает выживаемость животных до 80% по отношению к облучённому контролю. Есть основания полагать, что дополнительное включение препаратов кальция в рацион животных в качестве биологического адаптогена способствует корреляции гомеостатических механизмов при радиационном поражении.
Гамма-излучение, беспородные белые мыши, адаптогены, углекислый кальций, глюконат кальция, витамин а (ретинол), витамин д2 (эргокальциферол), кормовой рацион, радиорезистентность, масса тела животных
Короткий адрес: https://sciup.org/170171486
IDR: 170171486 | УДК: 615.849.1.015.25:546.41-38 | DOI: 10.21870/0131-3878-2019-28-2-51-60
Текст научной статьи Экспериментальная оценка радиомодифицирующих свойств солей кальция
Широкие масштабы мирного использования атомной энергии в медицине, сельском хозяйстве, энергетике, промышленности, исследовании космоса, а также возникновение аварийных ситуаций на атомно-энергетических комплексах представляет потенциальную опасность для жизни людей и сельскохозяйственных животных как в настоящее время, так и в будущем. Поэтому, несмотря на многолетний поиск высокоэффективных средств противолучевой защиты, интерес к ним не снижается, а, наоборот, возрастает. Опасность для жизни и здоровья людей и животных представляют не только открытые источники ионизирующего излучения, но и продукты питания, загрязнённые радионуклидами природного и искусственного происхождения.
Из многочисленных средств противолучевой защиты организма: физико-химических (цистеамин, цистамин, мексамин, цистофос, амитурон и др.), биологических (пересадка костного мозга, гипоксия, препараты элеутерококка, женьшеня, лимонника, витаминно-аминокислотный
Иванов В.Л.* – ст. научн. сотр., к.в.н.; Панфилова В.В. – научн. сотр., к.б.н.; Чибисова О.Ф. – научн. сотр. МРНЦ им. А.Ф. Цыба – филиал ФГБУ «НМИЦ радиологии» Минздрава России.
комплекс, микроэлементы, вакцины (брюшнотифозная, протейная), продигиозан (микробный полисахарид), дедоксинат (деградированная ДНК), индралин, интерлейкин-3 и др., а также комбинированных методов защиты с помощью физических (экранирование отдельных участков тела) и химических средств не всякий препарат, зарекомендовавший себя положительно в опытах на животных, может быть использован в медицинской практике в качестве индивидуального средства защиты людей [1-4]. Как отмечают авторы [1], к препаратам, предназначенным в качестве индивидуальных радиозащитных средств, должны быть предъявлены, как минимум, следующие требования:
-
• препарат должен быть достаточно эффективным и не вызывать выраженных побочных эффектов;
-
• действовать быстро и сравнительно продолжительно, как минимум 4-8 часов;
-
• быть не токсичным, с терапевтическим коэффициентом не менее 3;
-
• не должен вызывать даже кратковременного снижения, а тем более потери трудоспособности, не ослаблять приобретённые навыки в управлении;
-
• иметь удобную для приёма лекарственную форму (таблетка, шприц-тюбик, драже, пилюля, капсула);
-
• не должен оказывать вредного влияния на организм при многократных повторных приёмах, не должен обладать кумулятивным действием;
-
• не должен снижать устойчивость организма к другим неблагоприятным факторам внешней среды;
-
• должен быть устойчивым при хранении: защитные и фармакологические его свойства не должны уменьшаться при хранении не менее 3 лет.
Несмотря на значительные успехи, достигнутые в области профилактики лучевых поражений в экспериментальных условиях, реальная возможность использования химических средств для защиты человека окончательно не решена. В качестве основной причины, препятствующей практическому применению препаратов, авторы отмечают их высокую токсичность, определяющую малую терапевтическую широту (диапазон между токсичными и эффективными дозами) препаратов. Кратковременность защитного эффекта также следует отнести к существующим недостаткам радиопротекторов. Это фармакологическое свойство затрудняет их использование при пролонгированном облучении.
Препараты биологической защиты, в отличие от радиопротекторов, не обладают специфическим действием, а способны только повышать общую сопротивляемость организма к различным неблагоприятным факторам, в том числе к радиационному воздействию. Такого рода вещества (адаптогены) должны быть безвредными для организма, обладать большой широтой терапевтического действия, вызывать минимальные сдвиги в нормальных функциях организма или вовсе их не изменять и проявлять своё адаптогенное действие только на соответствующем фоне. Действие адаптогена должно быть неспецифично в том смысле, что должна повышаться сопротивляемость организма к вредному влиянию широкого набора физических, химических и биологических факторов. Оно должно быть тем более выражено, чем неблагоприятные сдвиги в организме. И, наконец, адаптоген должен обладать нормализующим действием независимо от направленности предшествующих сдвигов [5].
Анализ многочисленных публикаций по экспериментальной апробации различных фарм-и биопрепаратов в качестве модификаторов лучевого поражения позволил нам остановиться на адаптогенах, в состав которых входит кальций. Биологическая роль Са в организме весьма значительна. Помимо того, что этот элемент составляет основу скелета (98%), его присутствие обнаруживается в составе всех тканей и крови, значительная его часть входит в комплексы с белками. Концентрация кальция в тканях, особенно в сыворотке крови, стабильна, отклонения содержания Са2+ в крови хотя бы на 2-3 мг в ту или иную сторону приводят к нарушениям, зачастую не совместимым с жизнью [6]. Однако, следует отметить, что избыточное поступление кальция в организм или недостаток его находятся под постоянным контролем костной ткани, обладающей способностью мгновенно поглощать избыток кальция, поступающего в кровь из ЖКТ, тем самым, поддерживать его гомеостатический уровень в крови. Эти процессы происходят при участии паратгормона паращитовидной железы и тиреокальцитонина щитовидной железы [6, 7]. Участвуя в физиологических процессах, кальций понижает возбудимость нервной системы, уменьшает способность связывать воду тканевыми коллоидами, понижает клеточную проницаемость, возбуждает деятельность сердца, участвует в процессах свёртывания крови, активирует ферменты актомиозин-АТФазу и лецитиназу, тормозит функции енолазы, дипептидаз и других ферментов [8].
Многочисленные публикации свидетельствуют о достаточно высокой радиозащитной роли кальция при внешнем остром и хроническом поражении организма источниками ионизирующего излучения, а также при действии инкорпорированных радиоактивных веществ [6, 9-14].
С учётом вышеизложенного, целью настоящего исследования явилось выяснение влияния вводимых с кормом солей кальция в виде глюконата кальция (СКГ) и углекислого кальция (СКУ), как отдельно, так и в сочетании с витаминами А и Д 2 (рыбий жир), на течение и исход лучевой болезни мышей.
Материалы и методы
Эксперимент проведён на 249 беспородных мышах-самках в возрасте 2,5 мес. массой 25,0-27,5 г. Животные содержались в условиях вивария при комфортном тепловом режиме и получали стандартный рацион на основе брикетированного корма. Однократное общее облучение животных гамма-лучами 137Сs проводили на установке «Гамма-Панорама» в дозе 8,0 Гр при мощности дозы 2,0 Гр/мин.
Препараты кальция (глюконат и углекислый) в виде порошка тщательно смешивали с размельчённым и слегка увлажнённым брикетированным кормом из расчёта 0,1 г на одно животное в сутки. Витамины А (ретинол) и Д 2 (эргокальциферол) в виде очищенного для внутреннего применения рыбьего жира ( oleum jecoris depuratum pro usum interno ) вводили per os по 1 капле ежедневно в соответствии с временем применения кальциевых препаратов. Суточная доза витамина А приблизительно составляла 10 МЕ (международные единицы), а витамина Д 2 – 1 МЕ на животное.
Из экспериментальных животных было сформировано 7 групп:
-
1 группа (57 особей) – биологический контроль;
-
2 группа (13 особей) – соль кальция углекислого (СКУ) вводили в корм в течение10 дней (5 дней до и 5 дней после условного дня облучения);
-
3 группа (63 особи) – облучение в дозе 8 Гр;
-
4 группа (45 особей) – СКУ в течение 3-7 дней до и 6-10 дней после облучения;
-
5 группа (20 особей) – СКУ + рыбий жир в течение 4 дней до и 6 дней после облучения;
-
6 группа (21 особь) – соль кальция глюконата (СКГ) + рыбий жир в течение 4 дней до и 6 дней после облучения;
-
7 группа (30 особей) – СКУ в течение 6 дней, начиная с 4 дня после облучения.
В динамике эксперимента регистрировали следующие показатели: массу тела животных, как интегрального показателя, отражающего уровень и интенсивность обменных процессов в организме животных, и 30-суточную выживаемость животных, показатели которой достаточны для оценки эффективности действия препаратов в экспериментах на лабораторных животных.
Результаты экспериментов обработаны статистически с использованием параметрических и непараметрических критериев вариационной статистики, в частности, альтернативного критерия Х 2 , а также был использован анализ таблиц сопряжённости 2 x 2. Проведён сравнительный анализ выживаемости в группах наблюдений i=4-7 c данными наблюдений i=3, где присутствовал только фактор облучения и отсутствовали препараты кальция и витамины, то есть в качестве контроля использовалась группа 3. Данные наблюдений за определённый период времени представлены в табл. 1, в ней показано отношение шансов (OR) выжить в сериях опытов по отношению к контролю (i=3), которое равно OR=a*d/(b*c). Различия признавали значимыми при р<0,05 [15, 16].
Таблица 1
Таблица сопряжённости 2 x 2
|
i>3 |
i=3 (контроль) |
||
|
Выжившие |
а |
b |
a+b |
|
Умершие |
с а+с |
d b+d |
c+d a+b+c+d |
Доверительные 95% пределы для OR определялись из приближения Корнфельда (Cornfield) [16].
Результаты и обсуждение
Динамика массы тела мышей, как интегральный показатель, отражающий уровень и интенсивность обменных процессов в организме подопытных животных в условиях облучения и применения радиомодифицирующих веществ, представлена в табл. 2.
Таблица 2
Динамика средней массы тела мышей после общего гамма-облучения в дозе 8,0 Гр на фоне применения препаратов Са (% к исходному значению)
|
№ группы |
Число мышей |
Время после облучения, сут |
|||||
|
5 |
10 |
15 |
20 |
25 |
30 |
||
|
1 |
57 |
110,8 |
111,6 |
116,8 |
121,6 |
121,8 |
122,8 |
|
2 |
13 |
100,0 |
107,6 |
109,2 |
120,4 |
124,0 |
128,0 |
|
3 |
63 |
97,7 |
98,5 |
104,4 |
105,9 |
107,3 |
106,8 |
|
4 |
45 |
98,0 |
101,6 |
106,3 |
109,9 |
113,4 |
119,4 |
|
5 |
20 |
98,9 |
92,1 |
95,7 |
98,9 |
104,3 |
107,9 |
|
6 |
21 |
92,4 |
90,2 |
93,8 |
97,1 |
101,1 |
102,4 |
|
7 |
30 |
108,6 |
109,8 |
112,0 |
113,9 |
114,2 |
116,2 |
Примечание: группа 1 – биологический контроль; группа 2 – СКУ в течение 10 дней (5 дней до и 5 дней после условного дня облучения); группа 3 – облучение в дозе 8 Гр; группа 4 – облучение в дозе 8 Гр + СКУ в течение 3-7 дней до и 6-10 дней после облучения; группа 5 – облучение в дозе 8 Гр + СКУ в течение 4 дней до и 6 дней после облучения + витамины Д и А (рыбий жир); 6 группа –облучение в дозе 8 Гр + СКГ в течение 4 дней до и 6 дней после облучения + витамины Д и А (рыбий жир); 7 группа – облучение в дозе 8 Гр + СКУ в течение 6 дней с 4 дня после облучения.
Результаты исследования показывают, что прирост живой массы мышей в течение 30 суток наблюдения достаточно динамичен. Однако, следует отметить, что применение СКУ (2 группа) к 30 суткам на 5,2% увеличивает прирост живой массы по сравнению с биологическим контролем, а некоторое снижение прироста живой массы в период наблюдения (5 и 6 группа), очевидно, связано с включением в корм рыбьего жира (витаминов А и Д). Однако, как будет отмечено ниже, препарат способствует некоторому повышению выживаемости животных по сравнению с введением в рацион только препаратов кальция.
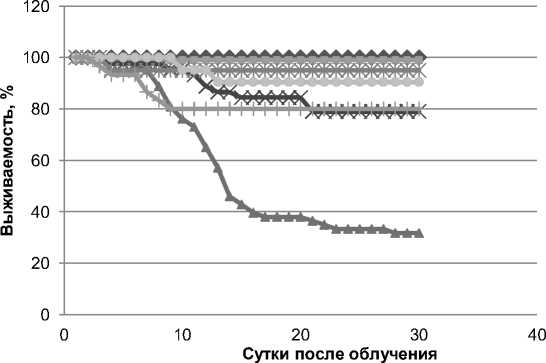
Основным интегральным показателем эффективности любого противолучевого средства, как радиопротектора, так и лечебного препарата, является показатель выживаемости биообъекта. Результаты исследования представлены на рис. 1.
Группа 1
Группа 2
Группа 3
)|( Группа 5
Группа 6
Группа 7
Рис. 1. Выживаемость белых мышей в динамике экспериментов. Условия эксперимента представлены в «Примечании» к табл. 2.
На рис. 1 видно, что модель жёсткого лучевого воздействия (доза 8,0 Гр при мощности дозы 2,0 Гр/мин) приводит к более ранней гибели животных (с 3-5 суток после облучения). Применение препарата СКУ (2 группа) не вызывает каких-либо нежелательных эффектов у подопытных животных и сохраняет к 30-м суткам 100%-ую выживаемость. Введение в рацион СКУ, согласно схеме эксперимента (4 группа), на фоне лучевого воздействия увеличивает выживаемость животных на срок 30-е сутки после облучения с 31,7% (3 группа) до 80,0% (р<0,01). Дополнительное включение в рацион, кроме солей кальция, рыбьего жира (группы 6 и 5) увеличивает выживаемость мышей, которая составляет соответственно 90,5% и 95% (р<0,01). Интересно отметить, что отсроченное применение СКУ с кормом, начиная с 4 дня после облучения (7 группа), также достаточно значимо (р<0,01) повышает выживаемость подопытных животных по отношению к облучённому контролю (до 80%). С учётом того, что разгар острой лучевой болезни при данном уровне доз радиации регистрируется через 10-15 суток, представляет интерес анализ «ранней» зависимости от применённых лечебных подходов. Сравнительный статистический анализ выживаемости животных подопытных групп, проведённый на 15-е сутки после облучения, показал высокую значимость различий между группами с применением препаратов (группы 4-7) и облучённым контролем (группа 3). При этом значения критерия Х2 варьировали от 10,4 до 15,8 (р<0,01). Следует отметить, что при применении этого альтернативного критерия на 30-е сутки эта разница была ещё более выражена, Х2 имел значение от 15,5 до 22,7 (р<0,01).
Статистическая обработка с применением анализа таблиц сопряжённости 2 x 2 на периоды наблюдения (15 и 30 сутки) представлена в табл. 3.
Таблица 3
Значение OR
|
Номер опыта |
Период наблюдения 15 сут (95% ДП) |
Период наблюдения 30 сут (95% ДП) |
|
4 |
5,78 (2,47; 13,92) |
8,60 (3,69; 20,53) |
|
5 |
23,75 (3,80; 382,55) |
40,85 (6,44; 663,58) |
|
6 |
11,88 (2,86; 64,96) |
20,42 (4,85; 113,19) |
|
7 |
5,00 (1,92; 13,63) |
8,60 (3,23; 23,93) |
Как следует из табл. 3, во всех опытах с применением препаратов кальция и витаминов выживаемость статистически значимо выше, чем в контроле, и эффект применения препаратов достаточно велик.
Заключение
Результаты проведённого исследования свидетельствуют о том, что введение в рацион небольших количеств кальция приводит к повышению радиорезистентности организма. Известно, что под действием радиации, наряду со снижением уровня кальция в плазме крови, отмечается резкое (в 15 раз) увеличение его в структурах тканей [17], а это свидетельствует не о недостаточности кальция в организме, а о нарушении механизмов его обмена. Известные публикации и экспериментальные данные указывают не столько на прямую, сколько на опосредованную роль пищевого кальция в улучшении показателей лучевой патологии у животных, как при действии внешних факторов радиации, так и при действии инкорпорированных радиоактивных веществ [10, 13, 17]. Механизмы действия дополнительных количеств кальция, вводимых с рационом, очевидно, осуществляются через их действие на эндокринные клетки желудочнокишечного тракта [10]. А также в механизме радиозащиты важную роль играет система холинэ-стераза-ацетилхолин, и связанная с ней проницаемость клеточных мембран [18]. Поскольку имеются косвенные данные об активизации под влиянием кальция энтерохромофинных клеток ЖКТ [10], можно предположить, что определённый вклад в радиозащитный эффект вносит серотонин – секрет этих клеток.
Известно, что ионы кальция участвуют в процессах клеточного дыхания. Так, в больших количествах кальций действует как разобщитель процессов окислительного фосфорилирования в митохондриях клеток, а в малых количествах, напротив, стимулирует дыхательные процессы [19]. Возможно, этот механизм лежит в основе гипоксического состояния клеток при введении дополнительного количества кальция в облучённый организм и формирует радиомодифицирующий эффект.
Таким образом, в системе мер лечебно-профилактического характера, призванных обеспечить защиту организма в условиях внешнего или внутреннего облучения, определённую значимость могут иметь препараты кальция, вводимые в организм через ЖКТ. Эти препараты, на наш взгляд, в большей мере соответствуют тем требованиям [1], которые предъявляются как для индивидуальных, так и для коллективных радиозащитных средств.
Данная работа проводилась по Программе совместной деятельности по преодолению последствий чернобыльской катастрофы в рамках Союзного государства на период до 2016 года и в ходе выполнения тем государственного задания МРНЦ им. А.Ф. Цыба - филиала ФГБУ «НМИЦ радиологии» Минздрава России за 2015-2016 гг. и первую половину 2017 г., промежуточные итоги выполнения которых нашли отражение в обобщающей публикации [20].
Список литературы Экспериментальная оценка радиомодифицирующих свойств солей кальция
- Саксонов П.П., Шашков В.С., Сергеев П.В. Радиационная фармакология. М.: Медицина, 1976. 256 с.
- Баранов А.Е., Рождественский Л.М. Аналитический обзор схем лечения острой лучевой болезни, использованных в эксперименте и клинике //Радиационная биология. Радиоэкология. 2008. Т. 48, № 3. С. 287-302.
- Ярмоненко С.П., Вайнсон А.А. Радиобиология человека и животных. М: Высшая школа, 2004. 549 с.
- Ярмоненко С.П. Противолучевая защита организма. М.: Атомиздат, 1969. 264 с.
- Брехман И.И. Элеутерококк. Л.: Наука, 1968.
- Книжников В.А. Кальций и фтор. Радиационно-генетические аспекты. М.: Атомиздат, 1975. 200 с.
- Орлов А.Ф. Тиреокальцитонин - гипокальцемический гормон щитовидной железы //Проблемы эндокринологии. 1969. С. 109-117.
- Афонский С.И. Биохимия животных. М.: Высшая школа, 1964. 630 с.
- Comar C.L., Wasserman R.H. Mineral metabolism. Chapter 23. Strontium. New York: Academic press, 1964. P. 54-57.
- Казбекова Д.А., Калистратова В.С., Кулямин В.А. Радиозащитное действие кальция, вводимого с пищей, при поражении окисью трития //Радиобиология. 1979. Т. XIX, В. 3. С. 402-407.
- Белоусова О.И., Гроздовская В.А., Книжников В.А. Влияние стронция-90 на кроветворение у крыс в условиях повышенного поступления фтора и кальция с диетой //Радиобилогия. 1967. № 2. С. 297-300.
- Книжников В.А. Уменьшение накопления стронция-90 в организме с помощью добавления минеральных веществ в воду и пищу //Сборник рефератов по радиационной медицине. М.: Медгиз, 1962. С. 158.
- Книжников В.А., Гроздовская В.А. Влияние уровня кальция и фтора в рационе на устойчивость животных к комбинированному поражению внешним гамма-облучением и инкорпорированным стронци-ем-90 //Вопросы питания. 1968. № 4. С. 24-30.
- Перепёлкин С.Р. Защитное действие пищи и витаминов при лучевых поражениях организма. М.: Медицина, 1965. 81 с.
- Жаворонков Л.П. Основы прикладной медико-биологической статистики: Методическое пособие. Обнинск: ФГБУ НМИРЦ Минздрава России, 2012. 60 с.
- Breslow N.E., Day N.E. Statistical methods in cancer research. Vol. I: The analysis of case-control studies. IARC Scientific Publication No. 32. Lyon: IARC, 1980. 338 p.
- Гроздов С.П. Пострадиационные особенности обмена кальция в тканях крыс и их связь с состоянием обмена натрия и фосфора //Радиобиология. 1974. Т. XIV, № 3. С. 342-347.
- Кузнецова Н.Е. Восстановительные процессы при радиационных поражениях. М.: Атомиздат, 1964. С. 137-148.
- Волькенштейн М.В. Биофизика. М.: Наука, 1988. 431 с.
- Каприн А.Д., Галкин В.Н., Жаворонков Л.П., Иванов В.К., Иванов С.А., Романко С.Ю. Синтез фундаментальных и прикладных исследований - основа обеспечения высокого уровня научных результатов и внедрение их в медицинскую практику //Радиация и риск. 2017. Т. 26, № 2. С. 26-40.


