Экспериментальная оценка токсикорезистентности бентосной микроводоросли Thalassiosira excentrica Cleve 1903 (Bacillariophyta) при воздействии ионов меди
Автор: Петров А. Н., Неврова Е. Л.
Журнал: Вестник Мурманского государственного технического университета @vestnik-mstu
Рубрика: Биоэкология
Статья в выпуске: 1 т.26, 2023 года.
Бесплатный доступ
При усилении антропогенной нагрузки на экосистему прибрежных зон моря возрастает актуальность оценки состояния сообществ планктона и бентоса. В ходе исследования определена динамика численности клеток клоновой культуры Thalassiosira excentrica Cleve 1903 (Bacillariophyta) при воздействии CuSO4·5H2O разной концентрации (32–1 024 мкг·л –1) в условиях 10-суточных экспериментов. В контроле и при низкой концентрации Cu2+ доля живых клеток практически не изменяется. Пороговая концентрация ионов меди для выживания T. excentrica равна 128 мкг·л –1. При более высоких концентрациях Cu2+ (256–1 024 мкг·л –1) отмечено резкое угнетение и гибель культуры уже в течение 1–3-х суток. Прирост абсолютной численности клеток при низких концентрациях меди (32–64 мкг·л –1) описывается сигмоидной кривой отклика тест-объекта. Значения прироста возрастают в 1–5-е сутки в 4–8 раз и снижаются к 10-м суткам на 25–30 %. При концентрациях Cu2+ 128–256 мкг·л –1 положительный прирост численности клеток в 1–5-е сутки отсутствует, в последующие дни снижается в 2 раза либо падает до нуля. Интенсивность удельного прироста клеток достоверно снижается в зависимости от увеличения концентрации токсиканта. Установлено, что в 1–5-е сутки удельный прирост положительный в диапазоне концентраций меди 32–128 мкг·л –1 и отрицательный – при концентрациях 256 мкг·л –1 и выше. В период 5–10-х суток для всех концентраций токсиканта значения удельного прироста отрицательные. Полученные результаты позволяют рекомендовать T. excentrica в качестве перспективного тест-объекта для токсикологических экспериментов.
Токсикология, эксперимент, пороговые концентрации, бентосные диатомовые, клоновая культура, Черное море, toxicology, experiment, threshold concentrations, benthic diatom algae, clonal strain, Black Sea
Короткий адрес: https://sciup.org/142236770
IDR: 142236770 | УДК: 574.24+582.261 | DOI: 10.21443/1560-9278-2023-26-1-78-87
Текст статьи Экспериментальная оценка токсикорезистентности бентосной микроводоросли Thalassiosira excentrica Cleve 1903 (Bacillariophyta) при воздействии ионов меди
*Kovalevsky Institute of Biology of the Southern Seas RAS, Sevastopol, Russia; e-mail: , ORCID: 0000-0002-0137-486X
В современных условиях усиления антропогенной нагрузки на экосистему прибрежных зон моря, в том числе у берегов Крыма, возрастает актуальность оценки состояния сообществ планктона и бентоса. Одной из групп экологически наиболее опасных техногенных поллютантов являются тяжелые металлы, в частности медь, соединения которой накапливаются в донных отложениях, особенно в прибрежных и портовых акваториях. Ежегодно в водоемы с коммунальными и промышленными стоками поступает до 90 тыс. т меди ( Miazek et al., 2015 ). Значительная доля медьсодержащих поллютантов присутствует в противообрастающих красках-биоцидах, которыми покрывают днища судов и различные гидротехничекие объекты ( Burgess et al., 2009; Crespo et al., 2013; Неврова и др., 2015 ) .
Значимость соединений меди как в биогеохимических циклах в морской среде, так и в метаболизме гидробионтов определила выбор сульфата меди в качестве модельного токсиканта для экспериментов. В повышенных концентрациях ионы меди становятся остротоксичными для большинства морских и пресноводных гидробионтов, относясь к наиболее экологически опасным веществам, наряду с ионами Hg, Cd, Pb и Zn ( Проблемы химического загрязнения…, 1985; Принципы и методы…, 2016 ). В микроколичествах ионы меди являются необходимыми для гидробионтов эссенциальными элементами и играют ключевую роль в физиологических процессах в клетках водорослей (азотный обмен, перенос электронов в дыхательной цепи митохондрий), а также входят в состав активных центров многих ферментов (пластоцианин, цитохром оксидаза, аскорбатоксидаза, супероксиддисмутаза и др.) ( Levy et al., 2007; Принципы и методы…, 2016; Miazek et al., 2015 ).
Величина предельно допустимой концентрации (ПДК) соединений меди для морских донных осадков неизвестна, а для водных масс таковое значение принято равным 5 мкг·л –1. Отметим, что содержание меди в прибрежных морских акваториях может составлять 50–100 мкг·л –1 ( Маркина и др., 2019 ). Для бентосных диатомовых более значимым является содержание меди не в водных массах, а в донных отложениях, поскольку рыхлые грунты интенсивно аккумулируют поллютанты, а клетки микроводорослей либо прикрепляются к поверхности субстрата, либо обитают в его толще. В рыхлых грунтах черноморских акваторий содержание меди может достигать 0,4–11,2 мкг·г –1 ( Овсяный и др., 2003 ), а в закрытых и полузакрытых бухтах, загрязненных техногенными поллютантами – до 20–37 мкг·г –1 сухого осадка ( Петров и др., 2004; Burgess et al., 2009 ).
Вследствие этого медь, наряду с другими тяжелыми металлами в донных осадках, относится к ключевым факторам, оказывающим значимое влияние на структуру таксоцена и пространственное распределение донных диатомовых на илистых грунтах в техногенно загрязненных морских акваториях ( Петров и др., 2003; 2005; Неврова и др., 2015 ).
К настоящему времени накоплены данные по оценке воздействия соединений меди на морские микроводоросли, но в подавляющем большинстве они основаны на использовании планктонных форм (благодаря относительной простоте их учета в ходе экспериментов) ( Cid et al., 1995; Маркина и др., 2011; Crespo et al., 2013; Leung et al., 2017 ). В то же время бентосные диатомовые, в силу тесной приуроченности к субстрату и относительно малой подвижности, более объективно реагируют на степень загрязнения среды обитания. В связи с этим оценка изменений физиологических параметров донных диатомовых (рост клеток, размножение, количественное развитие популяций) под воздействием различных поллютантов с большей надежностью может отражать влияние неблагоприятных экологических факторов по сравнению с планктонными видами ( Маркина, 2009; Неврова и др., 2015; Романова и др., 2017 ). Указанные особенности определяют актуальность расширения исследований бентосных диатомовых как тест-объектов при опосредованной оценке качества морской среды ( Филенко и др., 2007; Markina et al., 2006; Маркина, 2009; Anantharaj et al., 2011; Принципы и методы…, 2016; Романова и др., 2017 ). Результаты оценки реакции планктонных водорослей Cylindrotheca closterium , Ditylum brightwellii , Phaeodactylum tricornutum, Porphyridium purpureum и др. на воздействие Cu2+ выявляют выраженную специфичность пороговой резистентности для различных видов ( Florence et al., 1986; Cid et al., 1995 ; Rijstenbil et al., 2002; Markina et al., 2006; Маркина и др., 2011; 2019 ).
Выбор для эксперимента диатомовой водоросли Thalassiosira excentrica Cleve 1903 обусловлен следующими причинами: крупный размер клеток, что облегчает их учет при фотофиксации и оценке прижизненного состояния; сравнительная простота при культивировании; высокая скорость вегетативного размножения и бенто-планктонный образ жизни. Ранее нами была подтверждена статистическая значимость ( p < 0,05) результатов оценки равномерности распределения клеток данного вида в экспериментальном сосуде и показателей развития микроводорослей на основе анализа небольшого количества полей зрения ( Петров и др., 2020 ).
Целью работы является определение пороговой концентрации ионов меди для выживания и прироста численности клеток клоновой культуры морской бентосной диатомовой водоросли T. excentrica и степени пригодности данного вида в качестве перспективного тест-объекта для экотоксикологии.
Материалы и методы
В токсикологических экспериментах использована клоновая культура бентосной диатомовой водоросли Thalassiosira excentrica , выращенная путем изолирования одиночной клетки под бинокуляром МБС-10 (Россия, ЛЗОС) при увеличении ×40 с последующей семикратной промывкой культуральной средой ( Гайсина и др., 2008; Романова и др., 2017; Петров и др., 2020 ). Клоновая линия выделена из состава микрофитобентоса рыхлого субстрата, отобранного в бухте Ласпи (юго-западная часть Крыма, 44o25'10"N, 33o42'27"E) на глубине 9 м. Вид морской, бенто-планктонный, встречается часто в прибрежных районах; образует колонии по 4–8 клеток, соединенных тонкими прозрачными тяжами. Створки дисковидные, диаметром около 40 μм. Структура створки состоит из округло-полигональных ареол, расположенных в тангентальных рядах, 8–9 в 10 μм (рис. 1). Размеры клеток указаны на момент начала культивирования.

Рис. 1. Морская диатомовая T. excentrica , использованная в эксперименте: 1 – колония живых клеток (CМ ×10); 2 – живая клетка (CМ ×60, масштаб 10 μм); 3 – створка, вид снаружи (СЭМ ×2 000) Fig. 1. Marine diatom T. excentrica used in the experiment: 1 – alive colony (LM ×10);
2 – alive cell (LM ×60, scale bar 10 μm); 3 – valve external view (SEM ×2 000)
Клоновую линию содержали на питательной среде Гольдберг, модифицированной для оптимального культивирования морских бентосных диатомовых, при естественном освещении и постоянной температуре 22 ± 2 ºC. Морскую воду для приготовления среды отбирали в 12-мильной зоне у побережья Крыма, фильтровали через фильтр 0,45 мкм, затем трижды пастеризовали при температуре 75 ºС и вносили питательные вещества в соответствии с протоколом ( Петров и др., 2020 ). В ходе культивирования и эксперимента фотографии живых и мертвых клеток получали под инвертированным световым микроскопом (СМ) Nicon Eclipse с объективом Plan Fluor ×60 OFN25 и камерой Infinity3-6URC (Nicon Corp., Япония). Идентификацию очищенных створок проводили под СМ Carl Zeiss Primostar Plus c объективом Plan-Achroplan ×100, а также под сканирующим электронным микроскопом (СЭМ) Hitachi SU3500 (Япония).
В каждую чашку Петри диаметром 90 мм вносили последовательно по схеме определенное количество питательной среды, стокового раствора CuSO 4 ·5H 2 O и 1 мл инокулята клоновой культуры T. excentrica , чтобы общий объем жидкости составил 30 мл. Протокол эксперимента подробно описан ранее ( Неврова и др., 2022 ). В ходе эксперимента проводили тестирование T. excentrica на воздействие возрастающих концентраций токсиканта: 32, 64, 128, 256, 320, 512 и 1 024 мкг·л –1 (в пересчете на ионы меди) по сравнению с контролем (питательная среда Гольдберг без добавления токсиканта). Чашки Петри герметизировали пленкой Рarafilm®, чтобы исключить контаминацию и испарение экспериментального раствора. Продолжительность экспериментов составляла 10 суток, периоды экспозиции – 1, 3, 5, 7 и 10 суток. Данные временные периоды выбраны с целью возможности оценить хронический аспект токсичности сульфата меди , а также детально рассмотреть динамику отклика клоновой культуры T. excentrica на воздействие различных концентраций токсиканта. Каждый вариант концентрации ионов меди исследовали в 3-кратной повторности, включая контроль.
Реакцию клоновой линии на воздействие разных концентраций Cu2+ определяли визуально по микрофотографиям на основе подсчета доли живых клеток (%). Контроль прижизненного состояния оценивали по форме и целостности панциря, неизменности структуры и цвета хлоропластов, разделению клеток после вегетативного деления; в случае же лизиса клеточного содержимого, резкого потемнения хлоропластов, раскрытия панциря – клетку определяли как мертвую (рис. 2). Численность живых и мертвых клеток в каждый период экспозиции определяли по усредненным данным, полученным при фотографировании 10–15 случайных полей зрения.
Для всех концентраций меди, включая контроль, также рассчитывали изменение абсолютной численности живых клеток на разных этапах эксперимента и удельную скорость прироста (отмирания) численности клеток (кл.·сут –1) как одного из базовых показателей, используемых в токсикологии для оценки состояния популяций микроводорослей ( Филенко и др., 2007; Маркина и др., 2019 ). Скорость прироста численности клеток ( v ), число клеточных делений в сутки рассчитывали по формуле
N ; t + a t ) - N t v =
AtN, где Nt – средняя численность клеток в культуре в момент времени t (первые сутки эксперимента); N(t + Δt) – средняя численность клеток в культуре в момент времени t + Δt (3, 5, 7 и 10-е сутки); Δt – период экспозиции (сутки).
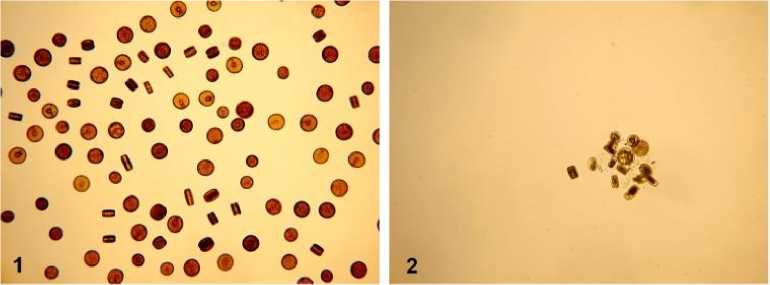
Рис. 2. Вид живых (1) и мертвых (2) клеток культуры T. excentrica в эксперименте
Fig. 2. Shape and condition of alive (1) and dead cells (2) of strain T. excentrica in the experiment
Для статистической обработки результатов экспериментов применены стандартные алгоритмы вариационного параметрического и рангового анализов1. Сравнение дисперсий и достоверности различий средних значений параметров проведено для уровня значимости p < 0,05 на основе параметрических критериев Фишера и Стьюдента (при нормальном распределении вариант в выборках). При распределении вариант, отличном от нормального, применены непараметрические критерии Холма – Сидака (Holm – Sidak test) и Данна (Dunn’s test). Значения параметров количественного развития культуры клеток представлены в виде средней арифметической со стандартной ошибкой средней (SE) по выборкам.
Результаты и обсуждение
Данная работа является продолжением наших исследований по оценке видоспецифичной резистентности культур черноморских бентосных диатомовых, принадлежащих к различным классам Bacillariophyta, и определению пороговых концентраций ионов меди в ходе 10-дневных токсикологических тестов ( Романова и др., 2017; Петров и др., 2020; Неврова и др., 2022 ). Отметим, что помимо получения новых данных о диапазонах толерантности разных видов бентосных Bacillariophyta, исследуются и мало разработанные методические вопросы по культивированию клоновых культур диатомовых, критериям визуального учета отклика живых клеток тест-объектов при различных сроках экспозиции и концентрациях токсиканта в культуральной среде.
По результатам 10-суточных тестов установлено, что на протяжении первых 5 суток в контроле и при концентрациях ионов меди 32 и 64 мкг·л –1 доля живых клеток T. excentrica практически не меняется, оставаясь на уровне 97–99 %, и только начиная с 7-х суток доля клеток немного снижается: до 91–92 % (в контроле и для концентрации 32 мкг·л –1) и до 77 % (для 64 мкг·л –1) (таблица).
На протяжении первых 7 суток эксперимента различия в средних значениях доли живых клеток (%) между контролем и чашками с концентрациями ионов меди 32 и 64 мкг·л –1 статистически незначимы (p = 0,27–0,53). Статистически высоко значимые отличия (p < 0,001) между контролем и концентрацией Cu2+ 64 мкг·л –1 отмечены только на 10-е сутки. Различия в значениях доли живых клеток между контролем и концентрацией 128 мкг·л –1 также были высоко значимыми (p < 0,0001) уже начиная с 5-х суток экспозиции. Именно при повышении концентрации ионов меди до 128 мкг·л –1 отмечалось резкое увеличение числа мертвых клеток в полях просмотра, а доля живых клеток на 7-е и 10-е сутки снижалась в среднем до 54 и 42 % соответственно. Данные результаты свидетельствуют о том, что статистически значимое (p < 0,008) токсическое действие ионов меди существенно сказывается на состоянии клеток T. excentrica уже начиная с концентрации 64 мкг·л –1. При 128 мкг·л –1 интенсивность отмирания клеток в тест-культуре резко усиливается, что позволяет считать данную концентрацию токсиканта пороговой для выживания данного вида диатомовых (см. таблицу).
Таблица. Изменение доли живых клеток (среднее значение ± SE, %) в культуре T. excentrica в ходе эксперимента при разных концентрациях токсиканта
Table. Change in the share of alive cells (mean value ± SE, %) in strain T. excentrica during the experiment at different concentrations of toxicant
|
Концентрации токсиканта Cu2+, мкг·л –1 |
Периоды экспозиции, сут |
||||
|
1 |
3 |
5 |
7 |
10 |
|
|
Контроль |
99 ± 3 |
99 ± 4 |
99 ± 4 |
96 ± 5 |
92 ± 4 |
|
32 |
99 ± 3 |
99 ± 3 |
97 ± 5 |
94 ± 4 |
91 ± 5 |
|
64 |
98 ± 7 |
97 ± 8 |
97 ± 6 |
89 ± 9 |
77 ± 8 |
|
128 |
95 ± 9 |
93 ± 10 |
72 ± 10 |
54 ± 12 |
42 ± 11 |
|
256 |
97 ± 13 |
14 ± 5 |
8 ± 3 |
0 |
0 |
|
320 |
98 ± 12 |
6 ± 2 |
3 ± 2 |
0 |
0 |
|
384 |
97 ± 6 |
0 |
0 |
0 |
0 |
|
512 |
96 ± 8 |
0 |
0 |
0 |
0 |
При концентрациях ионов меди 256 мкг·л –1 доля живых клеток в культуре уже на 3–5-е сутки снизилась в 6–10 раз, по сравнению с таковой при концентрациях в диапазоне 32–128 мкг·л –1. При промежуточных концентрациях 320 и 380 мкг·л –1 уже на 3-е сутки отмечено резкое угнетение клоновой культуры T. Excentrica . На 5-е сутки доля живых клеток в экспериментальных сосудах снижалась практически до 0 %. При повышении концентрации до 512 и 1 024 мкг·л –1 доля живых клеток составляла 0 % уже к 3-м суткам (см. таблицу).
При оценке токсического влияния меди на состояние культуры T. excentrica важным показателем также является изменение абсолютной численности живых клеток в ходе эксперимента (рис. 3). Отметим, что предшествующие результаты анализа культуры T. excentrica показали, что все попарные различия по средней численности клеток данного вида между тремя повторностями недостоверны как на 1-е, так и на 5-е сутки экспозиции, т. е. вариативность средней численности клеток в разных повторностях эксперимента не выходит за пределы статистической погрешности ( Петров и др., 2020 ). Данный факт позволяет рассматривать все повторности (случайные выборки клеток) как соответствующие одной исходно взятой совокупности со сходным характером вариативности показателей, что является важным условием для корректного сравнения отличий в абсолютной численности клеток в чашках на разных стадиях эксперимента и при разных концентрациях токсиканта.
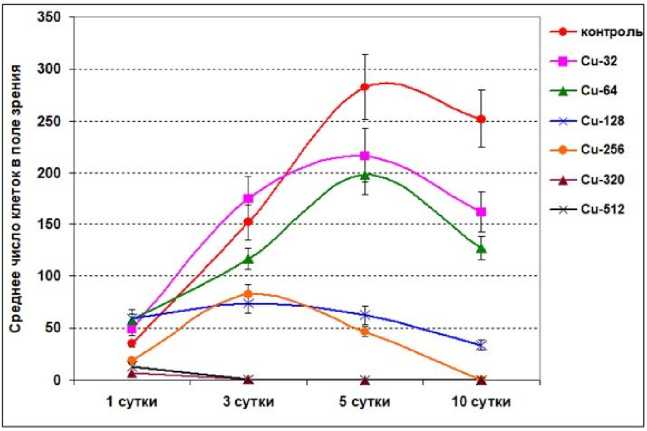
Рис. 3. Изменение абсолютной численности живых клеток T. excentrica (среднее значение ± SE) в ходе эксперимента при разных концентрациях токсиканта
Fig. 3. Change in the absolute number of live cells of T. excentrica (mean value ± SE) during the experiment at different concentrations of toxicant
Очевидно, что в контроле и при малых концентрациях меди (32–64 мкг·л –1) характер прироста численности клеток T. excentrica в целом соответствует классической сигмоидной кривой отклика тест- объекта в токсикологическом опыте. В период 1–5-х суток абсолютная численность клеток (среднее значение по 10–28 полям просмотра) возрастает в 4–8 раз, достигая максимума. В последующий период за счет негативного влияния токсиканта, а также старения культуры численность клеток несколько снижается: на 10 % (для контрольной чашки) и на 25–30 % (для концентраций 32–64 мкг·л –1). При более высоких концентрациях меди (128–256 мкг·л –1) статистически значимого устойчивого роста численности в период 1–5-х суток не наблюдается (0,07 < p < 0,72). В последующий период (5–10-е сутки) численность живых клеток двукратно снижается при концентрации 128 мкг·л –1 и падает до нуля (при 256 мкг·л –1). При наиболее высоких концентрациях 512 и 1 024 мкг·л –1 численность живых клеток в культуре снижается до нуля уже к 3-м суткам (см. рис. 3). На 5–10-е сутки различия между средними значениями численности клеток при сравнении концентраций 64 и 128 мкг·л –1 высоко значимы (p = 0,009–0,0004), что также служит подтверждением, что данный диапазон концентраций ионов меди является пороговым для выживания тестируемого вида диатомовой водоросли.
Исследован еще один тип отклика T. excentrica на токсическое воздействие ионов меди – изменение в ходе экспозиции среднего числа клеточных делений в сутки ( v ); сопоставлены средние значения ( v ± SE ) удельного прироста численности клеток в тест-культуре при разных концентрациях токсиканта (рис. 4).
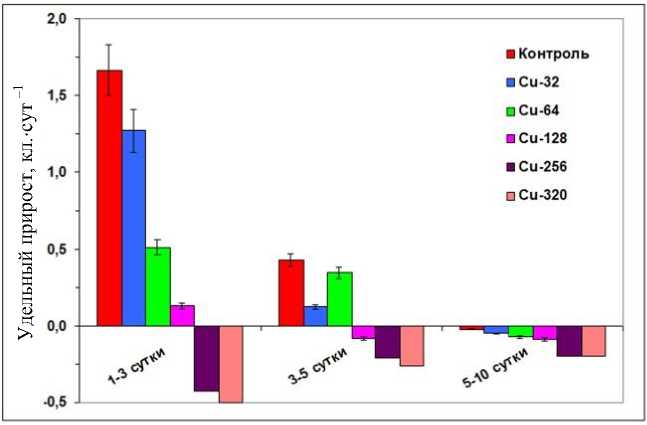
Рис. 4. Изменение удельного прироста численности клеток T. excentrica ( v , кл.·сут –1) при различных концентрациях ионов меди в разные периоды эксперимента Fig. 4. Change of the specific growth rate in the number of T. excentrica cells ( v , cells·day –1) at various concentrations of copper ions and in different stages of the experiment
Установлено, что в период до 3 суток культура клеток характеризуется положительным удельным приростом клеток в диапазоне концентраций Cu2+ от 32 до 128 мкг·л –1. Наибольший удельный прирост выявлен в контроле (1,67 делений в сутки) и при концентрациях меди 32 мкг·л –1 (1,27 делений в сутки). При пороговой концентрации токсиканта (128 мкг·л –1) скорость деления клеток T. excentrica в первые трое суток опыта еще сохраняла положительную динамику (0,13 делений в сутки), но была ниже в 12 раз по сравнению с контролем. При концентрации ионов меди 256 мкг·л –1 и выше прирост численности становится отрицательным (рис. 4).
В период 3–5-х суток величина удельного прироста сохранялась положительной только для низких концентраций меди (32–64 мкг·л –1), хотя и была в несколько раз ниже, чем в период 1–3-х суток. При концентрации 128 мкг·л –1 прирост уже становился отрицательным. Отметим, что удельная скорость прироста численности клеток снижалась в течение эксперимента даже в контроле, а к 10-м суткам падала практически до нуля, что объясняется старением культуры и истощением питательных веществ в экспериментальном сосуде. В период 5–10-х суток для всех тестируемых концентраций токсиканта выявлены отрицательные значения удельного прироста численности клеток T. excentrica в культуре (т. е. отмирает клеток больше, чем появляется новых в ходе делений).
По результатам наших экспериментов у бентосной диатомовой T. excentrica выявлена более высокая резистентность к воздействию ионов меди по сравнению с данными других авторов по тестированию преимущественно планктонных видов микроводорослей. Так, при изучении воздействия хлорида меди на выживание и размножение Scenedesmus quadricaudata (Turpin) Brebisson 1835 установлено, что заметное снижение общей численности и доли живых клеток наблюдалось при концентрации меди 10–100 мкг·л –1 на экспоненциальной фазе роста культуры (10–14-е сутки) (Филенко и др., 2007). Уже при концентрациях меди 1–10 мкг·л –1 доля активно размножающихся клеток не превышала 10 %, а остальная часть культуры находилась в покоящейся стадии, не изменяя показатели прироста численности клеток. При тестировании влияния ионов меди на микроводоросль Porphyridium purpureum (Bory) K. M. Drew et R. Ross 1965 показано (Маркина и др., 2019), что при концентрациях токсиканта 50–100 мкг·л –1 уже на 4-е сутки эксперимента наблюдалось выраженное угнетение роста популяции и снижение содержания в клетках фотосинтетических пигментов по сравнению с контролем. Для бентосной диатомовой Amphora coffeaeformis (C. Agardh) Kützing 1844 выявлено, что токсическое воздействие тяжелых металлов (медь, свинец, кадмий) наблюдается уже при концентрации 0,02 мкг·л –1, когда отмечается подавление роста клеток и разрушение клеточных мембран, что приводит к уменьшению содержания хлорофилла (Anantharaj et al., 2011).
Установлено, что техногенно загрязненные бухты региона Севастополя характеризуются высоким содержанием меди и кадмия в водной толще: от 7,07 до 22,56 мкг·л –1 Cu2+ и 0,13–1,74 мкг·л –1 Cd2+, вследствие чего в произрастающих в этом районе макрофитах накапливается значительное количество токсикантов: 3,38–14,96 мг Cu2+ на 1 кг и 0,12–1,13 мг Cd2+ на 1 кг сухой массы таллома ( Niemiec et al., 2015 ). Столь высокие значения уровней аккумуляции ионов тяжелых металлов могут нести потенциальные угрозы для гидробионтов, вовлеченных в трофические цепи прибрежной морской экосистемы, в которых бентосные диатомовые являются ведущим первичным звеном.
С учетом вышесказанного следует отметить, что угнетение роста численности и физиологического состояния клеток T. excentrica и других видов диатомовых может быть вызвано как негативным воздействием ионов меди на фотосинтетический аппарат и процессы синтеза аминокислот, влияющих на рост популяции ( Cid et al., 1995; Kim et al., 2017; Leung et al., 2017 ), так и подавлением вегетативного размножения клеток ( Филенко и др., 2007 ). При этом повышенная резистентность (по сравнению с планктонными видами) бентосной T. excentrica к токсическому эффекту меди может быть обусловлена наличием у клеток силифицированного панциря, снабженного сложной многоуровневой системой ареол, снижающих токсичное воздействие на клетку ионов меди, поступающих из внешней среды. Подобные морфологические адаптации могут обеспечивать устойчивое развитие колоний бентосных диатомовых на рыхлых субстратах, в которых уровни содержания токсиканта, как правило, значительно выше, чем в водной толще ( Levy et al., 2007; Niemiec et al., 2015; Kim et al., 2017 ). Выявленная у T. excentrica более высокая токсикорезистентность может быть также связана с ее обитанием при черноморской солености до 18 ‰, поскольку в морской воде атомы хлора могут замещать ионы меди в процессе образования хелатных комплексов, в целом менее токсичных по сравнению со свободными ионами металлов. Защитной реакцией на повышенное содержание меди в среде может служить и дополнительное выделение клетками диатомовых водорослей полисахаридной слизи, что является одним из универсальных механизмов детоксикации тяжелых металлов ( Crespo et al., 2013; Miazek et al., 2015 ).
Заключение
По результатам изучения отклика клоновой культуры морской бентосной диатомовой T. excentrica на воздействие широкого диапазона концентрации ионов меди установлено, что при концентрациях Cu2+ 32–64 мкг·л –1 доля живых клеток достоверно снижается по отношению к контролю только на 10-е сутки эксперимента. Характер прироста абсолютной численности клеток T. excentrica при данных концентрациях соответствует сигмоидной кривой "доза – эффект". Значения прироста достигают максимума к 5-м суткам эксперимента, а в период 5–10-х суток – снижаются за счет накопленного негативного влияния токсиканта и старения культуры. Для концентраций ионов меди 128–256 мкг·л –1 статистически значимого прироста численности живых клеток в период 1–5-х суток не отмечено, в последующий период 5–10-х суток значения снижаются до нуля. При высоких концентрациях токсиканта (320 мкг·л –1 и выше) численность живых клеток в культуре падает до нуля уже на 3-и сутки. В этот же период выявлено и достоверное снижение интенсивности удельного прироста клеток.
Для T. excentrica впервые установлена пороговая для выживания и роста концентрация Cu2+ (128 мкг·л –1), которая в 3–10 раз превышает известные в литературе значения, критичные для некоторых видов облигатных планктонных микроводорослей. Более высокая резистентность бенто-планктонной T. excentrica к токсическому воздействию меди может быть обусловлена морфофизиологическими адаптациями, которые обеспечивают устойчивое развитие данного вида при контакте с рыхлым донным субстратом, в котором поллютанты аккумулируются в значительно бóльших концентрациях, чем в водной толще.
Полученные результаты позволяют рекомендовать диатомовую водоросль T. excentrica для использования в качестве нового перспективного тест-объекта в токсикологических экспериментах по изучению влияния тяжелых металлов на эту ключевую группу одноклеточных автотрофов.
Работа выполнена в рамках госзадания ФИЦ ИнБЮМ РАН по теме "Закономерности формирования и антропогенная трансформация биоразнообразия и биоресурсов Азово-Черноморского бассейна" (госрегистрация № 121030100028-0). Авторы выражают благодарность коллегам из ИнБЮМ РАН вед. инженерам Трофимову С. А. и Литвину Ю. И. за помощь при содержании клоновых культур, проведении экспериментов и обработке экспериментальных данных, а также вед. инженеру Лишаеву В. Н. – за микрофотографирование на СЭМ Hitachi SU3500.


