Экспериментальная оценка возможности применения радиофармацевтического препарата 68Ga-цитрат для ПЭТ-визуализации воспалений
Автор: Лунв А.с, Клементьева О.Е., Ларенков А.А., Петросова К.А., Жукова М.В., Кодина Г.Е.
Журнал: Саратовский научно-медицинский журнал @ssmj
Рубрика: Физиология и патофизиология
Статья в выпуске: 4 т.10, 2014 года.
Бесплатный доступ
Цель: сравнить фармакокинетику радиофармацевтических препаратов 67Ga- и 88Са-цитрат, доказать сходство в их биораспределении и ускорить клиренс крови и накопление препаратов 67Ga- и 88Са-цитрат в очаге воспаления в первые часы после введения при использовании предварительного внутривенного введения физиологически приемлемого соединения железа — раствора цитрата железа (III). Материал и методы. Эксперимент выполнен на 110 нелинейных крысах-самках с моделью асептического воспаления мягких тканей. Животным внутривенно вводили препарат, меченный изотопами галлия 67Ga и 68Ga, с премедикацией цитратом железа (III) и без нее. Результаты. Предварительное введение цитрата железа (III) ускоряет клиренс крови, накопление препарата в очаге воспаления в первый час после введения и интенсивное выведение из организма. Заключение. Применение 68Са-цитрата отвечает заявленным требованиям современной ядерной медицины, связанным с оценкой патофизиологических изменений и отражением функционального статуса в поврежденных органах и тканях. Нет статистически достоверной разницы между биораспределением препаратов, меченных разными изотопами галлия, что благоприятно и перспективно сказывается на возможности применения 68Са-цитрата для ПЭТ-визуализации воспалений уже в первый час после введения.
88са-цитрат, пэт-визуализация, радиофармпрепарат, цитрат железа (iii)
Короткий адрес: https://sciup.org/14918052
IDR: 14918052
Текст научной статьи Экспериментальная оценка возможности применения радиофармацевтического препарата 68Ga-цитрат для ПЭТ-визуализации воспалений
Введение раствора цитрата трехвалентного железа. Для блокирования металлсвязывающей способности трансферрина и увеличения клиренса крови и накопления в очаге воспаления за 10–15 мин. до введения радиофармпрепарата крысам внутривенно вводили раствор цитрата трехвалентного железа (именуемый дальше по тексту блокадой).
Регистрация ионизирующего излучения. Лабораторных животных умерщвляли через 30, 60 и 120 мин после введения 67Ga- или 68Ga-цитрата для отбора проб крови и органов с последующим определением содержания в них препарата (%/орг или %/г органа) методом прямой радиометрии на автоматическом гамма-счетчике Wizard 2480 (PerkinElmer, USA) относительно счета эталона. Дизайн настоящего исследования представлен в табл. 1.
Статистическая обработка результатов. При статистической обработке результатов исследования определяли показатели средних арифметических значений (M), стандартных ошибок с учетом отклонения значений выборки от средних арифметических (±m). Нормальность распределения проверяли с использованием теста Колмогорова–Смирнова. При условии соответствия распределения нормальности достоверность полученных различий сопоставляемых величин оценивали с использованием t-критерия Стьюдента. При несоответствии нормальности распределения достоверность различий оценивали с использованием U-критерия Манна — Уитни. Частоты признаков сравнивались с использо-
Таблица 1
Дизайн настоящего исследования
|
РФП |
67Ga-цитрат |
68Ga-цитрат |
|
|
Премедикация раствором блокады |
Нет |
Да |
Да |
|
* – |
0,5 (n=10) |
0,5 (n=10) |
|
|
1 (n=10) |
1 (n=10) |
1 (n=10) |
|
|
Время отбора проб органов и тканей, ч |
* – |
2 (n=10) |
2 (n=10) |
|
5 (n=10) |
5 (n=10) |
– ** |
|
|
24 (n=10) |
24 (n=10) |
– ** |
|
|
Итого n=110 |
|||
П р и м еч а н ие : * — пробы органов и тканей не отбирались из-за нецелесообразности сравнения биораспределения для 67Ga-цитрата с и без премедикации раствором блокады; ** — пробы органов и тканей не отбирались по причине малого периода полураспада изотопа 68Ga по сравнению со сроками отбора проб. Данные значения о биораспределении (5 ч и 24 ч) аппроксимировались путем сравнения фармакокинетик двух препаратов с премедикацией раствором блокады.
Таблица 2
Влияние премедикации раствором блокады на накопление-выведение 67Ga-цитрата в организме крыс
|
Органы и ткани |
Пр. |
Содержание препарата, %/орг или %/г (%/мл) |
||||
|
Время отбора проб органов и тканей, ч |
||||||
|
0,5 |
1 |
2 |
5 |
24 |
||
|
Кровь, мл |
Да |
0,55±0,08 |
0,66±0,09 |
0,67±0,08 |
1,05±0,18 |
0,48±0,08 |
|
Нет |
— |
2,05±0,18 |
— |
2,59±0,13 |
0,70±0,18 |
|
|
Мышца, г |
Да |
0,16±0,05 |
0,16±0,08 |
0,16±0,03 |
0,08±0,01 |
0,06±0,01 |
|
Нет |
— |
0,24±0,07 |
— |
0,36±0,05 |
0,25±0,12 |
|
|
Очаг воспаления, г |
Да |
1,71±0,27 |
1,92±0,13 |
0,99±0,19 |
0,92±0,32 |
1,26±0,13 |
|
Нет |
— |
1,17±0,79 |
— |
2,31±0,57 |
2,15±0,83 |
|
|
Суммарное |
Да |
55,76±6,76 |
79,04±4,99 |
92,59±1,25 |
95,40±0,35 |
98,68±0,15 |
|
выведение |
Нет |
— |
3,95±2,01 |
— |
6,45±1,29 |
10,34±1,33 |
П р и м еч а н ие : Пр. — премедикация раствором блокады.
ванием критерия χ2. Различия считали достоверными при p<0,05.
Результаты. При вскрытии животных на третьи сутки после инокуляции ирританта были обнаружены развитие разлитого абсцесса в мышечной ткани, деформация соединительной ткани, небольшие участки некроза и прорыв капсулы очага воспаления. При морфологическом исследовании определяли воспалительный отек мягких тканей и гиперемию. При гематологическом исследовании крови у крыс с моделью воспаления отмечали повышение уровня лейкоцитов в 3,16±0,15 раза, лимфоцитов в 2,25±0,07 раза, гранулоцитов в 6,94±1,90 раза.
Результаты фармакокинетических исследований о накоплении препарата 67Ga-цитрата с предварительным введением раствора блокады (цитрата трехвалентного железа) и без него представлены в табл. 2.
Анализ полученных данных показал ожидаемую фармакокинетку 67Ga-цит рата без премедикации раствором блокады: препарат в больших количествах оставался в крови и только через сутки после введения снижался до приемлемых для визуализации концентраций (0,70±0,18%/мл крови) при достаточно высоком накоплении в очаге воспаления (2,15±0,83%/г ткани), о чем свидетельствуют коэффициенты дифференциального накопления «воспаление / кровь» в табл. 3 (3,07±0,18).
При предварительном введении раствора блокады удалось добиться результатов, не имеющих статистически достоверной разницы с описанными выше, уже через 30–60 мин после введения 67Ga-цитрата (см. табл. 2): увеличенный клиренс крови (рис. 1) и накопление в патологическом очаге (рис. 2) предполагают проведение ранней визуализации воспалительных процессов. Необходимо отметить, что премедикация раствором блокады благоприятно сказывается на более интенсивном выведении препа-
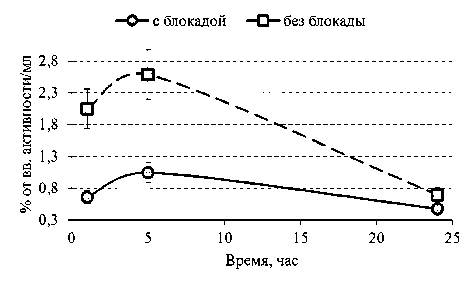
Рис. 1. Сравнение зависимостей накопления-выведения 67Ga-цитрата из крови с и без премедикации раствором блокады
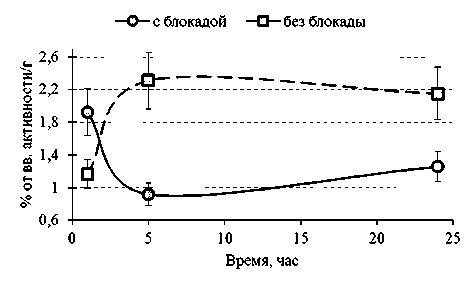
Рис. 2. Сравнение зависимостей накопления-выведения 67Ga-цитрата в очаге воспаления с и без премедикации раствором блокады
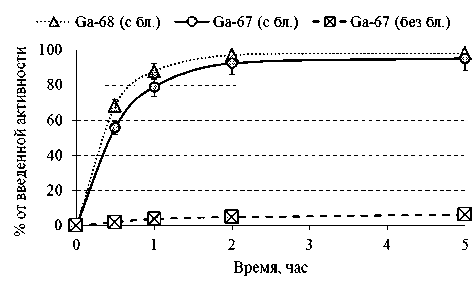
Рис. 3. Суммарное выведение препарата, меченного разными изотопами галлия. Примечание: Ga-68 (с бл.) — выведение 68Ga-цитрата с предварительным введением раствора блокады; Ga-67 (с бл.) — выведение 67Ga-цитрата с предварительным введением раствора блокады; Ga-67 (без бл.) — выведение 67Ga-цитрата без предварительного введения раствора блокады
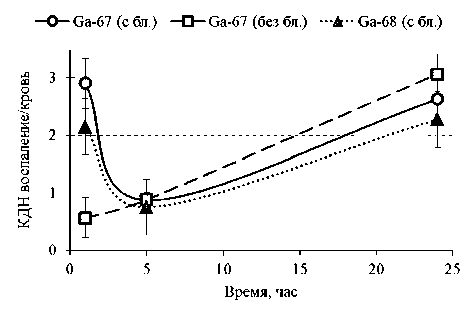
Рис. 4. Сравнение коэффициентов дифференциального накопления «воспаление / кровь» для препаратов, меченными разными изотопами галлия
рата мочевыделительной системой в 9,70±1,88 раза в течение суток после введения, что предполагает максимальное снижение получения лишних лучевых нагрузок (рис. 3).
Согласно полученным данным (см. табл. 3), действие раствора цитрата железа (III), как блокатора металлсвязывающей способности трансферрина, перестает работать уже через пять часов после введения, когда поведение препарата становится схожим с поведением без премедикации, о чем свидетельствует отсутствие статистически достоверной разницы между значениями результатов (рис. 4).
Использование премедикации раствором блокады не только благоприятно сказывается на ранней визуализации воспалений, но и предполагает применение потенциальной радиоактивной метки короткоживущего изотопа галлия-68, чьи результаты биораспределения максимально схожи с фармакокинетикой 67Ga-цитрата (табл. 4): препарат аналогичным образом активно накапливается в патологическом очаге (см. рис. 4) и интенсивно выводится из организма (см. рис. 3). Из-за нецелесообразности получения значений биораспределения в более отдаленные сроки после введения 68Ga-цитрата результаты для точек 5 ч и 24 ч были аппроксимированы, опираясь на данные фармакокинетики 67Ga-цитрата.
Таким образом, дополнительное внутривенное введение раствора цитрата железа (III) позволяет решить важные задачи, стоящие перед эмиссионной томографией:
-
1) приближение процедуры сканирования через 30–60 мин, вместо ее откладывания до 2–3 суток после введения препарата;
-
2) ускорение клиренса крови, выведения препарата из организма и, как следствие, снижение лучевых нагрузок на пациента;
-
3) применение более выгодного, с точки зрения ядерной медицины и радиобиологии по ядерно-фи-зическим характеристикам, изотопа галлия 68Ga для ПЭТ-визуализации воспалений.
Обсуждение. Выбранная модель асептического воспаления мягких тканей и дополнительное введение раствора блокады адекватно отвечает требованиям исследования: максимальное накопление в патологическом очаге по сравнению с кровью с приемлемыми для визуализации коэффициентами дифференциального накопления (рис. 5) уже в первый час после введения, интенсивном выведении препарата (см. рис. 4) для снижения лучевых нагрузок и, как следствие, применение короткоживущего изотопа галлия-68 для ПЭТ-визуализации, чья фармакокинетика максимально схожа с распределением 67Ga-цитрата. Следует отметить, что КДН для отношения «мягкие ткани / кровь» остается значительно меньше единицы (см. табл. 4), что не предполагает визуализацию мягких тканей без патологии, поэтому для увеличения информативности сцинтиграмм и идентификации точного расположения патологического локуса используют ПЭТ/КТ-визуализацию.
Заключение. ПЭТ-визуализация патологических очагов и совершенствование ранее применяемых РФП является актуальной задачей для нашей страны в связи с интенсивным развитием и открытием ПЭТ-центров в России. Применение 68Ga-цитрата отвечает заявленным требованиям современной ядер-ной медицины, связанным с оценкой патофизиологических изменений и отражением функционального статуса в поврежденных органах и тканях на ранней стадии развития процесса.
Коэффициенты дифференциального накопления для 67Ga-цитрата
Таблица 3
|
КДН |
Пр. |
Время отбора проб органов и тканей, ч |
||||
|
0,5 |
1 |
2 |
5 |
24 |
||
|
ОВ/М |
Да Нет |
10,69±2,17 — |
12,00±4,87 4,88±1,08 |
6,19±1,02 — |
11,50±0,70 6,42±1,52 |
21,00±1,40 8,60±1,74 |
|
ОВ/К |
Да Нет |
3,11±0,56 — |
2,91±0,63 0,57±0,16 |
1,48±0,63 — |
0,88±0,21 0,89±0,19 |
2,63±0,59 3,07±0,18 |
|
М/К |
Да Нет |
0,29±0,09 — |
0,24±0,14 0,12±0,04 |
0,24±0,12 — |
0,08±0,02 0,14±0,04 |
0,13±0,03 0,36±0,11 |
П р и м еч а н и е : КДН — коэффициент дифференциального накопления; ОВ/М — очаг воспаления / мягкие ткани; ОВ/К — очаг воспаления / кровь; М/К — мягкие ткани / кровь.
Таблица 4
|
Органы и ткани |
Содержание препарата, %/орг или %/г (%/мл) |
||||
|
Время отбора проб органов и тканей, ч |
|||||
|
0,5 |
1 |
2 |
5* |
24* |
|
|
Кровь, мл |
0,29±0,06 |
0,40±0,05 |
0,35±0,10 |
0,54 |
0,25 |
|
Мышца, г |
0,10±0,04 |
0,16±0,03 |
0,06±0,03 |
0,06 |
0,05 |
|
Очаг воспаления, г |
0,69±0,15 |
0,86±0,11 |
0,52±0,19 |
0,41 |
0,57 |
|
Суммарное выведение |
68,31±3,36 |
87,98±5,35 |
97,16±1,63 |
98,24 |
99,49 |
П р и м еч а н ие : * — аппроксимированные точки.
Коэффициенты дифференциального накопления для 68Ga-цитрата
Таблица 5
|
КДН |
Время отбора проб органов и тканей, ч |
||||
|
0,5 |
1 |
2 |
5* |
24* |
|
|
Оч. восп. / мышца |
6,90±1,56 |
5,38±1,23 |
8,67±1,86 |
6,83 |
11,40 |
|
Оч. восп. / кровь |
2,38±0,42 |
2,15±0,36 |
1,49±0,19 |
0,76 |
2,28 |
|
Мышца / кровь |
0,35±0,11 |
0,40±0,13 |
0,17±0,04 |
0,11 |
0,20 |
Биораспределение препарата 68Ga-цитрат с дополнительным введением раствора блокады
Список литературы Экспериментальная оценка возможности применения радиофармацевтического препарата 68Ga-цитрат для ПЭТ-визуализации воспалений
- Лишманов Ю.Б., Чернов В.И. Радионуклидная диагностика воспаления: руководство для врачей. Томск, 2004; с. 320-336
- Gelrud LG, Arsenau JC, Milder MS. The kinetics of 67Ga incorporation into inflammatory lesions: experimental and clinical studies. J Lab Clin Med 1974; 83: 489-495
- Audi G, Bersillon O, Blachot J, et al. The Nubase evaluation of nuclear and decay properties. Nucl PhysA2003; 729 (1): 3-128
- Lavender JP, Lowe J, Barker J. Gallium 67 citrate scanning in neoplastic and inflammatory lesions. Br J Radiol 1971; 44:361-366
- Harris WR, Pecoraro VL. Thermodynamic binding constants for gallium transferrin. Biochemistry 1983; 22: 292-299
- Larson SM, Rasey JS, Allen DR, Nelson NJ. A transfer-rin-mediated uptake of gallium-67 by EMT-6 sarcoma. I: Studies in tissue culture. J Nucl Med 1979; 20: 837-842
- Ando A, Nitta K, Ando I, et al. Mechanism of gallium 67 accumulation in inflammatory tissue. Eur J Nucl Med 1990; 17: 21-27
- Hayes RL, Byrd BL, Rafter J, Carlton JE. The Effect of Scandium on the Tissue Distribution of Ga-67 in Normal and Tumor-Bearing Rodents. J Nucl Med 1980; 21 (4): 361-365
- Kriegel H. Biokinetics and metabolism of radio gallium. Nucl Med 1984;23:53-57.
- Patent RU 2522892. Russian (Патент РФ № 2522892).


