Экспериментальная разработка нового препарата, содержащего фактор роста фибробластов, для лечения открытых переломов
Автор: Копылов Вадим Анатольевич, Сафронов Андрей Александрович
Журнал: Кафедра травматологии и ортопедии @jkto
Рубрика: Клинические исследования
Статья в выпуске: 1 (17), 2016 года.
Бесплатный доступ
Цель исследования - разработать новый препарат для лечения открытых переломов. Препарат создан на основе метаболитов Bacillus subtilis 804, содержащих фактор роста фибробластов. Материал и методы: выполнено экспериментальное моделирование открытых переломов и ран с дефектом кожи. При лечении переломов препарат вводили дважды в область перелома. При выполнении аутодермопластики гранулирующих ран препарат наносился на рану однократно во время операции. Выполнялись клинические наблюдения и морфологические исследования на разных сроках. Результаты: установлено, что при использовании метаболитов Bacillus subtilis 804 происходило ускорение консолидации переломов на 34-40% по сравнению с контролем. Использование метаболитов Bacillus subtilis 804 во время аутодермопластики снижало частоту некрозов кожного трансплантата на 25% по сравнению с контролем. Вывод: необходимо проведение дальнейших испытаний препарата на основе метаболитов Bacillus subtilis 804 для внедрения в клиническую практику.
Открытый перелом, фактор роста фибробластов, остеогенез
Короткий адрес: https://sciup.org/142211399
IDR: 142211399
Текст научной статьи Экспериментальная разработка нового препарата, содержащего фактор роста фибробластов, для лечения открытых переломов
Проблема лечения открытых переломов в настоящее время является актуальной для медицинских организаций, оказывающих помощь по профилю «травматология и ортопедия». При подобной травме особенно высока частота дефектов кожи, мягких тканей и костей, которые являются факторами риска для развития инфекционных осложнений, хронического остеомиелита, нарушений консолидации [1, 2]. Несращения особенно часто встречаются при политравме и при высокоэнергетичных механизмах переломов [3].
Важной причиной неблагоприятных исходов открытых переломов является нарушение механизмов репаративного гистогенеза. Одну из ключевых ролей для остеогенеза играет фактор роста фибробластов (ФРФ) [4]. В Оренбургском государственном медицинскомуниверситете был обнаружен штамм бактерий Bacillus subtilis 804, продуцирующий фактор роста фибробластов [5].
Выполненное исследование было посвящено разработке нового препаратадля локального стимулирующего воздействия на репаративный гистогенез костной ткани и кожи при лечении открытых переломов костей конечностей
Цель исследования – разработать новый лекарственный препарат, содержащий фактор роста фибробластов, для стимуляции репаративного гистогенеза при лечении открытых переломов кончностей.
Материалы и методы
Характеристика препарата. Ранее проведенными исследованиями профессора В.И. Никитенко [5] было установлено, что метаболиты жизнедеятельности бактерий штамма Bacillus subtilis 804 содержат фактор роста фибробластов. Обнаруженный фактор роста фибробластов – это комплекс термостабильных (до 128 ° С) четырех белков молекулярной массой от 11 до 14 кДа. В разведении 1:10 – 1:20 он оказывает почти такое же стимулирующее действие на рост культуры клеток эмбриональных фибробластов человека и опухолевых клеток С6 глиомы, как и 5% фетальная сыворотка (стандарт). Фактор роста чувствителен к протеолизу под действием трипсина, имеет изоэлектрическую точку в области 9,2 – 9,3. Мы применяли метаболиты штамма Bacillussubtilis 804 в виде стандартизированного препарата под названием «Винфар». Препарат представляет собой стерильную прозрачную жидкость, содержащую 5% метаболитов с новым фактором роста фибробластов и воду.
Содержание белка в нем – не менее 0,1%, а количество фактора роста - не менее 10 нанограмм в мл. pH препарата равен 7,1±0,2.
Экспериментальные модели. Все манипуляции с животными выполнены в соответствии с требованиями «Европейской конвенции по защите позвоночных животных, используемых для экспериментальных и других научных целей» (Страсбург, 1985), Хельсинской декларации от 2000 г. «О гуманном отношении к животным» и приложении №8 «Правил гуманного отношения к лабораторным животным», правил лабораторной практики в РФ (приказ МЗ РФ №267 от 19.06.2003).
Модель открытого перелома. Эксперименты выполнены на 112 белых крысах-самцах линии «Wistar» массой 185 – 215 г. Для наркоза 1% раствор тиопентала натрия вводился внутрибрюшинно в дозе 40 мг на 1 кг массы животного. Через передне-латеральный доступ 2 см была выполнена остеотомия средней трети бедра с последующим интрамедуллярным остеосинтезом спицей.Раны ушивались наглухо. 56 животным опытной группы дважды вводили в область перелома по 0,2 мл метаболитов Bacillus subtilis 804 (в виде препарата «Винфар») – непосредственно после наложения швов и через 24 часа. Крысы контрольной группы получали раствор натрия хлорида 0,9% в том же количестве.Ежедневно у животных этих двух групп оценивалось клиническое состояние ран, регистрировались потребление корма и воды, особенности поведения, масса тела животных. На 3, 7, 14, 21, 28, 44 и 61 сутки по 8 крыс каждой группы были подвергнуты эвтаназии путём декапитации под эфирным наркозом. Забирались ткани области перелома для морфологических исследований.
Модель раны с дефектом мягких тканей. Было использовано 70 белых крыс-самцов линии «Wistar» массой 185 – 215 г. Всем животным наносились глубокие скальпированные раны области спины, дном раны являлась фасция. Средние размеры ран 2,25±0,05 см2. На 12 сутки выполнена аутодермопластика расщеплённым свободным кожным лоскутом. 35 животным опытной группы перед укладкой трансплантата на гранулирующую рану наносился препарат. 35 крысам контрольной группы на рану капали 0,9 % раствор натрия хлорида. Выполнялись клинические наблюдения за животными. На 7, 10 и 20 сутки по 5 животных из каждой группы были подвергнуты эвтаназии путём декапитации под эфирным наркозом. За остальными животными обеих групп наблюдение продолжалось до 30 суток, затем они были выведены из опыта. Забирались ткани области ран для морфологических и иммуногистохимических исследований.
Гистологическое исследование включало окраску гематоксилином Майера и эозином. При проведении иммуногистохимического исследования для выявления экспрессии CD34 (маркер эндотелиоцитов), CD68 (маркер макрофагов, хондро- и остеокластов) и коллагена I типа использовались соответственно антитела anti-CD34 и anti-CD68 («SPRING Bioscience», США), anti-Collagene I Type («GeneTex», США). Используемаясисте-мадетекции - Reveal Polyvalent HRP – DAB Detection System («SPRING Bioscience», США). Подсчет клеток производился в абсолютных значениях (абсолютная численная плотность –
АЧП) при общем увеличении х 300 на площади соответствующего среза (поля зрения – п.з.) равной 0,077 мм2 минимум в 5 полях зрения для каждого показателя. Подсчет площади коллагеновых волокон производился в относительных значениях (относительная объёмная плотность – ООП), как отношение площади коллагена I типа к общей площади тканевых элементов в пределах исследуемого гистосреза на 1 микрофотографии (равной 1 полю зрения) при увеличении х 300 минимум в 5 полях зрения (микрофотографий) для каждого показателя.
Статистическая обработка производилась на персональном компьютере с помощью лицензированного пакета прикладных программ приложения Microsoft Office в операционной системе Microsoft Windows 7. Для оценки достоверности различий между количественными показателями групп использовали однофакторный дисперсионный анализ. Различия считали достоверно значимыми, при уровне вероятности р≤0,05.
Результаты и обсуждение
Лечение открытых переломов. При сравнении средней толщины периостальной костной мозоли у животных контрольной и опытной групп выявлены различия в динамике репаративного остеогенеза (таблица 1).
Таблица 1
Средняя толщина центральной части периостальной мозоли, мм
|
Сроки |
Контрольная группа |
Опытная группа |
|
3 сутки |
0,26±0,015 |
0,79±0,020 |
|
7 сутки |
1,25±0,07 |
1,64±0,09 |
|
14 сутки |
2,15±0,09 |
1,82±0,05 |
|
21 сутки |
2,48±0,11 |
1,80±0,04 |
|
28 сутки |
2,11±0,09 |
1,65±0,08 |
|
44 сутки |
0,27±0,02 |
0,10±0,03 |
|
61 сутки |
0,18±0,01 |
0,04±0,005 |
На всех сроках исследования наблюдается достоверное различие (p≤0,05) между показателями толщины периостальной костной мозоли животных опытной и контрольной групп. У крыс опытной группы отмечается более быстрый рост мозоли на 7-е сутки, но в целом её толщина значительно меньше, чем в контрольной группе. Это говорит о большей стабильности перелома у животных опытной группы. Так как метод остеосинтеза у всех животных был одинаковый – интрамедулляр-наяфиксация, то большая стабильность перелома достигалась за счёт лучшего формирования эндостальной костной мозоли. Это доказано при гистологическом исследовании, результаты которого приводятся далее.
Было обнаружено, что на 3 сутки в опытной группе воспалительная реакция менее выражена, по сравнению с контролем. У крыс опытной группы на 3 сутки начинала формироваться периостальная хрящевая мозоль. Также наблюдалась значительная активация неоангиогенеза (абсолютная численная плотность (АЧП) эндотелиоцитов 42,0±6,0/п.з., в контрольной группе данный показатель равен 7,0±2,0/п.з.). На 7 сутки в группе контроля периостальная мозоль находилась ещё в стадии формирования хряща (рис. 1). А в опытной группе на 7 сутки периостальная костная мозоль уже деградировала с замещением хряща на хорошо васкуляризованную волокнистую соединительную ткань и формированием остеогенных островков ретикулофиброзной кости (рис. 2). В тканях интермедиар-ной зоны у крыс опытной группы было больше волокнистого матрикса и остеогенных клеток, впериостальной зоне более развита грануляционная ткань по сравнению с контролем.
На 14 сутки различия между двумя группами стали ещё более заметными. В интермедиарной зоне перелома у животных контрольной группы на фоне остатков редуцирующейся грануляционной ткани только появлялся волокнистый матрикс, относительная объёмная плотность (ООП) коллагена I типа составила 9,24±2,14%.В опытной группе на 14 сутки интер-медиарная костная мозоль была представлена остатками деградирующего хряща и очагами формирования пластинчатой кости, состоящими преимущественно из остеобластов, а также значительного числа остеоцитов и незрелого внеклеточного остеоидного матрикса. При этом центральный отдел интерме-диарной мозоли был представлен небольшим участком волокнистого матрикса, ООП коллагена I типа в котором составляла 15,61±2,89%.
При дальнейшем наблюдении выявлено более быстрое формирование костной мозоли у животных опытной группы. На 44 сутки у крыс контрольной группы интермедиарная костная мозоль состояла из небольших очагов деградирующего хряща и формирующихся балок ретикулофиброзной кости (рис. 3).Подобная картина наблюдалась в опытной группе на 28 сутки после перелома. На 44 день в опытной группе уже заметно ремоделирование интермедиарной костной мозоли в диафиз трубчатой кости (рис. 4). Из балок пластинчатой кости, хаотично расположенных на более ранних сроках, начинали формироваться компактное и губчатое вещество. В составе компактного вещества присутствовало небольшое количество костномозговых полостей.
На 61 сутки у животных опытной группы наблюдалась полная консолидация перелома с полноценной перестройкой костной мозоли в диафиз трубчатой кости с органотипичным строением периоста, компактного вещества и эндоста. В контрольной
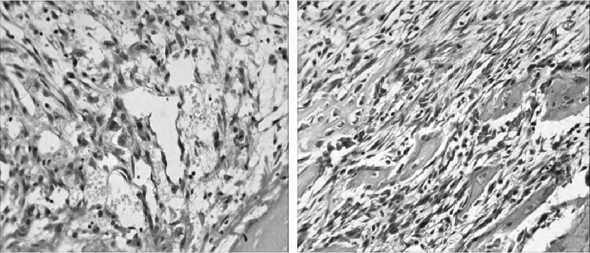
Рис. 1. Контрольная группа, 7 сутки. Гематоксилин-эозин. Ув. 300. АЧП (абсолютная численная плотность) остеобластов 33,0±5,0/п.з.
Рис. 2. Опытная группа. 7 сутки.
Гематоксилин-эозин. Ув. 300. АЧП остеобластов 173,0±17,0/п.з.
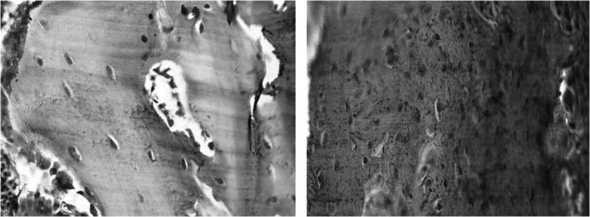
Рис. 3. Контрольная группа, 44 сутки. Иммуногистохимическая реакция на выявление экспрессии коллагена I типа. ООП коллагена I типа составляет 21,23±4,13%. Ув. 500
Рис. 4. Опытная группа. 44 сутки. Иммуногистохимическая реакция на выявление экспрессии коллагена
I типа. ООП коллагена I типа составляет 42,43±2,21%. Ув. 500
группе гистологическая картина костной мозоли сходна с таковой, наблюдавшейся в опытной группе на 44 сутки.
На основании сопоставления морфологической картины костной мозоли в опытной и контрольной группах на разных сроках исследования выявлено, что консолидация в опытной группе происходила быстрее в среднем на 34-40% по отношению к времени консолидации в контрольной группе.
Сравнительные данные о содержании коллагена I типа в области интермедиарной костной мозоли приведены в таблице 2. Сравнительные данные о численности остеогенных клеток в области костной мозоли представлены в таблице 3.
На всех сроках наблюдается достоверное различие в относительном содержании коллагена, p≤0,05.
При анализе видно, что на ранних сроках (3 и 7 сутки после перелома) наблюдалась значительная разница между опытной и контрольной группами в содержании остеобластов и остео-цитов. Резкое увеличение численности остеогенных клеток в опытной группе (в пять и более раз по сравнению с группой контроля) свидетельствует о стимуляции процессов репарации кости под воздействием метаболитов Bacillussubtilis 804.
Лечение ран с дефектом кожи.В опытной группе приживление трансплантата произошло у всех животных. В группе контроля у 7 из 35 животных (20%) произошел некроз кожных трансплантатов (p<0,005). На 3 сутки некроз лоскута наблюдался у двух крыс, на 5 сутки – у одного животного, на 7 сутки – у двух крыс, на 9 сутки – у двух крыс. У остальных 28 животных аутотрансплантаты прижились.
При гистологическом исследовании ран выявлено следующее. На 7 сутки в опытной группе пересаженный участок кожи на всём протяжении хорошо прикреплён к подлежащему ложу, представленному редуцирующейся грануляционной тканью, с резко уменьшенным плотным фибриллярным матриксом и уже напоминающей рыхлую неоформленную соединительную ткань гиподермы. В контрольной группе на 7 сутки после пластики в процессе приживления аутодермотрансплантата на месте глубоких гранулирующих раневых дефектов кожи выражены дистрофические изменения эпидермиса, клеток фибробластическогодифферона и межуточного вещества дермы пересаженного участка кожи.Трансплантат с подлежащим ложем связан рыхлой прослойкой незрелой грануляционной
Таблица 2
Относительная объёмная плотность коллагена I типа в матриксе, %
|
Сутки после операции |
Контрольная группа |
Опытная группа |
Увеличение содержания коллагена в опытной группе по отношению к контрольной, % |
|
7-е сутки |
4,83±1,02 |
7,23±1,02 |
49,7% |
|
14 сутки |
9,24±2,14 |
15,61±2,89 |
68,9% |
|
21 сутки |
11,25±2,12 |
20,7±3,71 |
84,0% |
|
28 сутки |
16,23±2,21 |
29,85±4,01 |
83,9% |
|
44 сутки |
21,23±4,13 |
42,43±2,21 |
99,9% |
Таблица 3
Абсолютная численная плотность остеогенных клеток в области костной мозоли (интермедиарная часть) на различных сроках наблюдения
|
Сутки после операции |
АЧП остеобластов, кл/п.зр. |
АЧП остеоцитов, кл/п.зр. |
||||
|
Контрольная группа |
Опытная группа |
p |
Контрольная группа |
Опытная группа |
p |
|
|
3-и сутки |
10,0±3,0 |
66,0±5,0 |
p≤0,05 |
- |
8,0±3,0 |
p≤0,05 |
|
7-е сутки |
33,0±5,0 |
173,0±17,0 |
p≤0,05 |
5,0±2,0 |
37,0±5,0 |
p≤0,05 |
|
14 сутки |
93,0±8,0 |
108,0±9,0 |
p≤0,05 |
7,0±2,0 |
91,0±6,0 |
p≤0,05 |
|
21 сутки |
120±11,0 |
155,0±12,0 |
p≤0,05 |
20,0±4,0 |
82,0±5,0 |
p≤0,05 |
|
28 сутки |
91±6,0 |
66,0±5,0 |
p≤0,05 |
42,0±3,0 |
108,0±4,0 |
p≤0,05 |
|
44 сутки |
85,0±8,0 |
84,0±7,0 |
p>0,1 |
105,0±11,0 |
76,0±8,0 |
p≤0,05 |
|
61 сутки |
73±4,0 |
25±3,0 |
p≤0,05 |
115,0±9,0 |
80,0±7,0 |
p≤0,05 |
ткани. Полное прикрепление трансплантата у всех животных контрольной группы происходило только на 10 сутки.
На 20 сутки у животных группы контроля, несмотря на успешное приживление трансплантата, не была достигнута органотипичность пересаженного участка кожи. У крыс опытной группы аутодермотрансплантат по строению и гистоархитектонике идентичен интактной коже данной области и плотно фиксирован к подлежащему ложу.
Выводы
-
1. Метаболиты Bacillus subtilis 804, содержащие фактор роста фибробластов, обладают стимулирующим действием на репаративный остеогенез и ускоряют консолидацию переломов в эксперименте на 34-40%по сравнению с контролем.
-
2. Местное однократное применение метаболитов Bacillus subtilis 804 во время аутодермопластики снижало частоту некрозов кожного трансплантата на 25% по сравнению с контролем, а также восстанавливало органотипическое строение кожного покрова.
-
3. Полученные результаты делают целесообразным и необходимым проведение дальнейших испытаний метаболитов Bacillus subtilis 804 с целью создания оригинального отече-
- ственного лекарственного препарата для лечения открытых переломов конечностей.
Список литературы Экспериментальная разработка нового препарата, содержащего фактор роста фибробластов, для лечения открытых переломов
- Мартель И.И. Чрескостный остеосинтез по Илизарову в комплексном лечении больных с открытыми повреждениями конечностей//Гений ортопедии. 2011. №2. С.44-48.
- Прогнозирование гнойно-воспалительных осложнений при открытых переломах длинных трубчатых костей/А.М. Мироманов //Вестн. хирургии им. И. И. Грекова. 2009. Т.168(3). С.57-60.
- Лечение открытых переломов голени/В.В. Ключевский, И.Н.Соловьёв, И.И. Литвинов, А.А.Тимушев//Врач-аспирант. 2015. Т.68, №1.1. С.199-203.
- The hypoxia-inducible factor pathway, prolyl hydroxylase domain protein inhibitors, and their roles in bone repair and regeneration/L. Fan, J.Li, Z. Yu, x. Dang, K. wang//BioMed Research International Volume. Published online 2014 May 11. URL: http://dx.doi.o DOI: rg/10.1155/2014/239356
- Штамм бактерий Bacillus subtilis -продуцент фактора роста фибробластов: пат. 2427644 Рос. Федерация. Заявл. 28.06.2010; опубл. 27.08.11. Бюл.№24.


