Экспериментально-морфологическое исследование влияния кальцийфосфатных соединений и неколлагеновых костных белков на репаративный процесс в костной ткани
Автор: Лунева Светлана Николаевна, Талашова Ирина Александровна, Осипова Елена Владимировна, Накоскин Александр Николаевич, Еманов Андрей Александрович
Журнал: Гений ортопедии @geniy-ortopedii
Рубрика: Оригинальные статьи
Статья в выпуске: 1, 2012 года.
Бесплатный доступ
Композиционный имплантационный материал, имеющий в своем составе кальцийфосфатное соединение и неколлагеновые белки, выделенные из костной ткани и не имеющие сродства к ионообменникам, имплантировали в метафизы большеберцо- вых костей 10 собак. Установлено стимулирующее влияние разработанного композиционного материала на репаративную регенерацию костной ткани в области метафиза. Возмещение дефектов происходило на основе прямого остеогенеза.
Имплантация, композиционный материал, репаративная регенерация, кальцийфосфатное соединение
Короткий адрес: https://sciup.org/142121505
IDR: 142121505
Текст научной статьи Экспериментально-морфологическое исследование влияния кальцийфосфатных соединений и неколлагеновых костных белков на репаративный процесс в костной ткани
Вопрос возмещения костных дефектов, образовавшихся в результате травмы или патологического процесса, остается актуальным для современной медицины. В последние годы разработано огромное количество имплантационных материалов, имеющих различную структуру и состав [1, 2, 6, 7]. Основными требованиями, предъявляемыми к материалам при замещении дефектов, является их способность к остеогенности, остеокондукции, остеоиндукции, остеопротекции и биодеградации, при этом последняя обязательно должна соответствовать скорости регенерации костной ткани [8].
В ФГБУ «РНЦ «ВТО» им. акад. Г. А. Илизарова» были проведены исследования влияния неколлагеновых костных белков на физиологическую и репаративную регенерацию костной ткани [4], показано стимулирующее влияние кальцийфосфатных соединений в композиции с низкомолекулярными фракциями сывороточных белков на костеобразование в дефектах [9, 11].
Цель нашего исследования – изучить влияние композиционного имплантационного материала, в состав которого входят кальцийфосфатное соединение и неколлагеновые белки, выделенные из костной ткани, на репаративную регенерацию кости в дырчатых дефектах метафиза.
МАТЕРИАЛ И МЕТОДЫ ИССЛЕДОВАНИЯ
Эксперимент проведен на 10 взрослых беспородных собаках обоего пола в возрасте от одного года до трех лет с массой тела 8,8 ± 3,2 кг. Животным в стерильных условиях под общим наркозом осуществляли моделирование конусообразных несквозных дефектов диаметром 5 мм и глубиной 7 мм в метафизах большеберцовых костей. Дефекты заполняли композиционным материалом, в состав которого входили кальцийфосфатное соединение, выделенное из костной ткани сельскохозяйственных животных по оригинальной методике [11], и низкомолекулярные неколлагеновые костные белки, не имеющие срод- ства к ионообменникам. Животных выводили из эксперимента через 21 (n = 5) и 42 (n = 4+1 — контроль) суток после операции.
Экспериментальные исследования проводили, руководствуясь требованиями, изложенными в «Европейской конвенции о защите позвоночных животных, используемых для экспериментов или в иных научных целях» (1986 г.), с соблюдением этических норм и гуманного отношения к объектам изучения.
Для гистологического исследования выпиливали фрагменты проксимального метафиза большеберцо- вых костей, включающие области сформированных дырчатых дефектов. Материал фиксировали в 10 % нейтральном растворе формалина, после декальцинации и обезвоживания в спиртах восходящей концентрации заливали в целлоидин. Для исследования остеогенеза в дефекте и морфометрического анализа делали срезы с периостальной и эндостальной поверхностей, в середине корковой пластинки, а также с субэндостальной поверхности, в середине и в глубине дефекта губчатого вещества метафиза. Срезы окрашивали гематоксилином и эозином, пикрофуксином по Ван Гизону, трихромным методом по Массону и изучали в светооптичеком микроскопе «МИКМЕД-5».
Морфометрическое исследование проводили с помощью программного обеспечения «ВидеоТесТ 4,0 - Мастер». На гистологических препаратах определяли долю композиционного имплантационного материала (КИМ) и новообразованной костной ткани в площади дефекта корковой пластинки и губчатого вещества метафиза, а также размеры (площадь и диаметр экв.) гранул имплантируемого материала. Цифровые данные представлены в виде среднего арифметического значения и стандартного отклонения (M ± SD). Для статистической обработки результатов использовали программы «Microsoft Excel-97» и «AtteStat» Версия 1.0 [3].
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
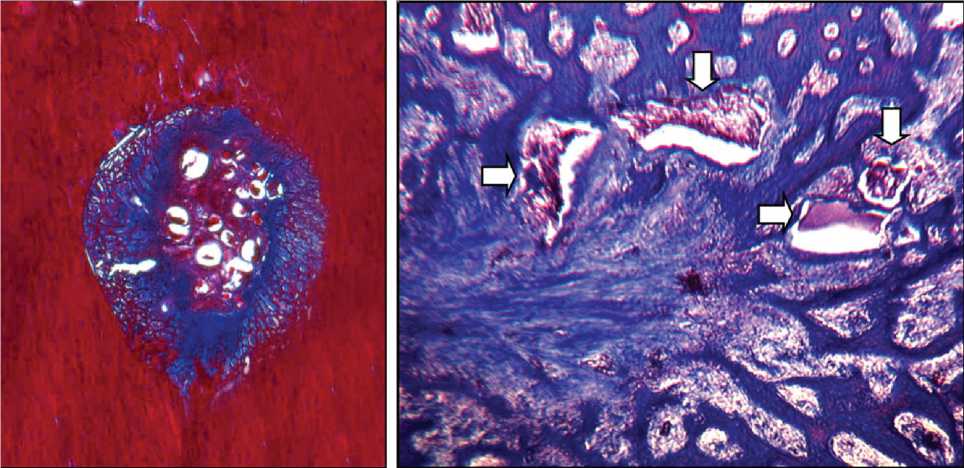
При гистологическом исследовании, проведенном через 21 сутки после операции, в корковой пластинке метафиза определялся дефект округлой формы с четкой ровной границей. Со стороны кости от края дефекта к его центру формировались костные структуры в виде мелкопетлистой трабекулярной сети (рис. 1, а). Поверхность трабекул, расположенных ближе к центру, была покрыта активными остеобластами. Доля новообразованной костной ткани составляла 24,7 ± 6,4 % от площади дефекта. Центральная часть дефекта заполнена волокнистой соединительной тканью с многочисленными полнокровными капиллярами синусоидного типа. Фрагменты КИМ в виде гранул различного размера и формы располагались в основном в центре дефекта (рис. 1, б). Гранулы подвергались деструкции, края их были неровными, на поверхности определялись многоядерные макрофаги. Доля КИМ в площади дефекта составляла 5,6 ± 1,6 %.
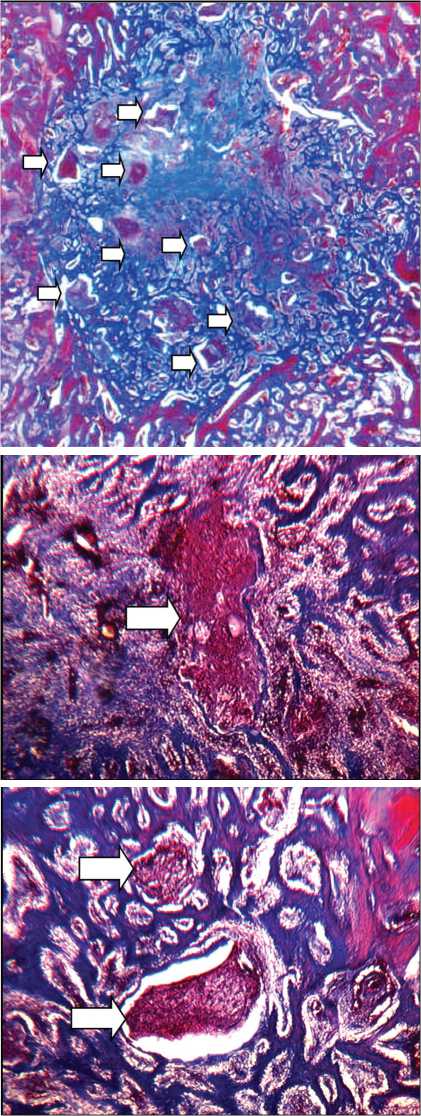
В губчатом веществе метафиза сохранялась четкая граница зоны дефекта (рис. 2, а). Центральная часть дефекта, так же, как и в корковой пластинке, заполнена васкуляризированной рыхлой волокнистой соединительной тканью (рис. 2, б). По периферии полости дефекта располагалась сеть трабекул из грубоволок- нистой костной ткани (рис. 2, в). Новообразованная костная ткань занимала 28,3 ± 10,8 %, доля КИМ составляла 9,7 ± 5,5 % от площади дефекта. Размеры гранул КИМ в дефекте корковой пластинки и в губчатом веществе метафиза не имели значимых различий, их площадь колебалась от 0,16 до 3,55 мм2, диаметр — от 0,45 до 2,13 мм. Гранулы имплантируемого материала, располагающиеся в центральной части дефекта, были окружены васкуляризированной волокнистой соединительной тканью, а по периферии дефекта заключены во вновь сформированную костную ткань.
В прилежащих к дефекту участках в межтрабекулярных пространствах увеличивалась доля красного костного мозга и количество полнокровных капилляров синусоидного типа.
Через 42 дня после операции в губчатом веществе метафиза отсутствовала четкая граница дефекта. Новообразованный участок кости можно было отличить по микроархитектурной организации трабекулярной сети (толщине трабекул, расстоянию между ними, плотности их расположения) и содержимому межтрабекулярных пространств (соотношению красного и желтого костного мозга, количеству кровеносных сосудов) (рис. 3, а, б).
а
б
Рис. 1. Дефект через 21 день после имплантации КИМ: а — гистотопограмма полости дефекта в корковой пластинке. Окраска трихромным методом по Массону. Увеличение лупное; б — центр полости дефекта. Окраска по Массону. Об. — 2,5, ок. — 10
а
б
в
Рис. 2. Полость дефекта в губчатом веществе метафиза через 21 день после имплантации КИМ: а — гистотопограм-ма дефекта. Окраска трихромным методом по Массону. Увеличение лупное; б — центральная часть полости дефекта метафиза; в — периферия полости дефекта метафиза. Окраска по Массону. Об. — 2,5, ок. — 10
Доля новообразованной костной ткани в полости дефекта губчатого вещества метафиза увеличивалась до 55,5 ± 13,3 % (р < 0,05). В корковой пластинке доля новообразованной костной ткани составляла 67,7 ± 17,1 % (р < 0,001).
На данном сроке эксперимента в области дефекта только у двух животных определялись единичные гранулы КИМ, их доля в площади дефекта значимо снижалась как в корковой пластинке, так и в губчатом веществе метафиза (рис. 4).
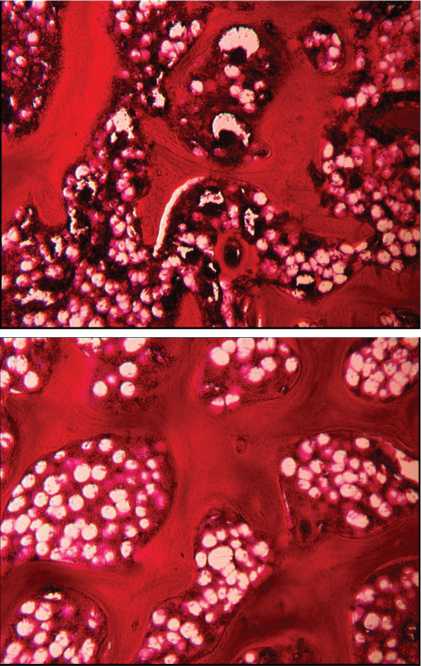
Рис. 3. Полость дефекта в губчатом веществе метафиза через 42 дня после имплантации КИМ: а — полость дефекта; б — участок, прилежащий к зоне дефекта. Окраска гематоксилином и эозином. Об. — 2,5, ок. — 10
□ 21 П42
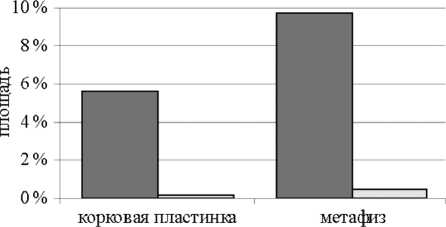
Рис. 4. Доля КИМ в полости дефекта корковой пластинки и губчатом веществе метафиза через 21 и 42 дня после операции
В корковой пластинке метафиза продолжалась перестройка губчатой костной ткани регенерата в компактную. Четко определялась граница между новообразованной костной тканью в дефекте и окружающей костью, что было связано с неупорядоченной ориентацией формирующихся остеонов, не имеющих продольного направления, характерного для окружающей область дефекта кости. У одного животного центральная часть дефекта была заполнена волокнистой соединительной тканью, в которой определялись единичные гранулы композиционного материала (рис. 5). Отсутствие полного восстановления корковой пластинки в данном случае мы связываем с выпадением небольшого количества имплантационного материала из дефекта с периостальной поверхности, что, вероятно, и стало причиной более медленного костеобразования.
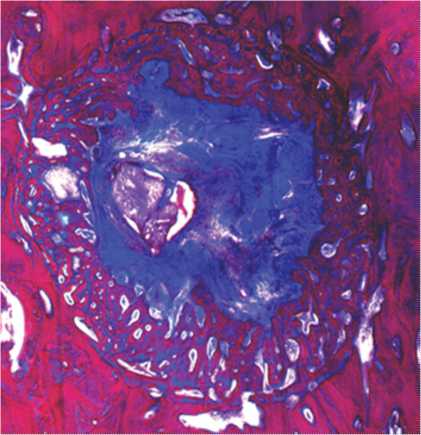
Рис. 5. Полость дефекта в корковой пластинке через 42 дня эксперимента после имплантации КИМ. Окраска по Массону.
Об. — 2,5, ок. — 10
У животного, которому дефект не заполняли композиционным материалом, через 42 дня после операции по краю дефекта определялся узкий прерывистый слой компактной костной ткани. Полость дефекта была заполнена слабо васкуляризированной соединительной тканью (рис. 6). В периферических отделах отмечалось формирование единичных костных трабекул, на поверхности которых располагались активные остеобласты. Внутренняя поверхность полости дефекта подвергалась активной резорбции.
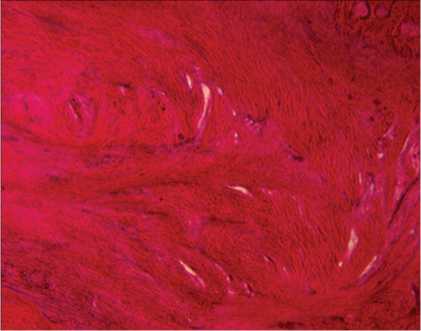
Рис. 6. Полость дефекта через 42 дня (контроль). Окраска гематоксилином и эозином. Об. — 2,5, ок. — 10
Таким образом, проведенное исследование показало стимулирующее влияние разработанного композицион- ного материала на репаративную регенерацию костной ткани в области метафиза. Возмещение дефектов происходило на основе прямого остеогенеза. Заполнение дефекта новообразованной костной тканью начиналось от края к его середине, это свидетельствует о том, что КИМ не является центром остеогенеза, а, проявляя ос-теоиндуктивные свойства, стимулирует костеобразование. К концу эксперимента (42 дня) в корковой пластинке метафиза продолжались процессы ремоделирования костной ткани.
Согласно данным литературы [4, 5, 13, 14, 15], можно предположить, что стимулирующие свойства биокомпозиционного материала определяли низкомолекулярные неколлагеновые костные белки. При активном участии неколлагеновых компонентов протекают важнейшие биологические процессы при репаративной регенерации кости. Одни из них участвуют в формировании микроархитектоники костной ткани, отвечают за связь клеток с коллагеном и гидроксиапатитом, другие — воздействуют на адгезию, миграцию, пролиферацию, дифференцировку и функциональную активность остеогенных клеток. Вместе с коллагеном они участвуют в формировании гуморальной составляющей костного микроокружения.
Минеральная составляющая КИМ, выделенная из костной ткани сельскохозяйственных животных, по содержанию кальция и фосфора и их соотношению приближена к главному неорганическому компоненту кости — гидроксиапатиту и имеет в своем составе небольшое количество карбонатов и белковых соединений, представляющих собой костные неколлагеновые белки, соосадившиеся вместе с фосфатами кальция [10]. Следовательно, кальцийфосфатное соединение, входящее в состав КИМ, может играть роль как остеокондуктора, так и остеоиндуктора.
Необходимо учитывать и тот факт, что, как правило, эксперименты по возмещению дырчатых дефектов выполняют на мелких лабораторных животных с формированием костных дефектов небольшого объема и диаметра (не более 3,0 мм). Возмещение таких дефектов происходит за 60–70 суток [5, 12]. Применение композиции из неорганического материала с неколлагеновыми белками способствовало более быстрому замещению дефектов (42 дня), размер которых был почти в 2 раза больше.
Следовательно, использование разработанного нами композиционного материала на основе кальцийфосфатных соединений в комбинации с низкомолекулярными неколлагеновыми костными белками можно считать одним из перспективных направлений для сокращения сроков возмещения дырчатых костных дефектов.


