Экспериментальное и расчетно-теоретическое исследование теплопроводности неводных растворов электролитов
Автор: Багаева Т.В., Танганов Б.Б., Бубеева И.А.
Журнал: Вестник Восточно-Сибирского государственного университета технологий и управления @vestnik-esstu
Статья в выпуске: 1 (32), 2011 года.
Бесплатный доступ
Приводится описание устройства для определения теплопроводности и теоретическая модель теплопроводности, основанная на подвижности ионов с учетом характеристик отдельных сольватированных ионов и свойств растворителя. Устройство и теоретическая модель позволяют исследовать теплопроводность жидкостей, водных и неводных растворов электролитов в интервале температур 218К-323К при различных концентрациях. Погрешность измерения теплопроводности составляет 1,5-2,5%.
Теплопроводность, электролиты, растворители
Короткий адрес: https://sciup.org/142142285
IDR: 142142285 | УДК: 544.6.018.4:536.2
Текст научной статьи Экспериментальное и расчетно-теоретическое исследование теплопроводности неводных растворов электролитов
Бурное развитие науки и техники требует основательного и всестороннего изучения физикохимических свойств веществ, находящихся в жидких состояниях. Одним из классов этих веществ являются растворы электролитов – неводные растворы неорганических солей. Одной из важных задач при изучении неводных растворов неорганических солей является исследование их теплофизических свойств, в частности теплопроводности. Особого внимания заслуживает экспериментальное исследование теплопроводности неорганических солей в таких растворителях, как этанол и бутанол, которые широко используются в производствах лакокрасочной, нефтехимической и нефтеперерабатывающей промышленности.
Вместе с тем, имеющиеся в литературе данные весьма ограничены и охватывают область температур от 25о до 60оС, почти не изучены в широком интервале изменения концентраций и не могут быть получены расчетными методами с приемлемой для практических целей точностью. Однако исследование теплопроводности неводных растворов может внести определенный вклад и в область фундаментальных исследований теории растворов и жидкого состояния вещества, установления корреляции между теплопроводностью и другими теплофизическими свойствами, в изучении структуры жидкости, в связи с чем экспериментальное исследование теплопроводности неводных растворов неорганических солей в широкой области температур и концентраций является актуальным [6].
Одна из причин того, что неводные растворы электролитов, в частности спиртовые, недостаточно исследованы, заключается в том, что они относятся к числу токсичных продуктов третьего и четвертого класса, требуют строгого соблюдения правил защиты от статического электричества, требуют герметичности, т.е. «неудобные» объекты исследования. Другая причина – в отсутствии надежных установок и теоретических моделей для экспериментального измерения и теоретического расчета коэффициента теплопроводности растворов.
Поэтому перед нами была поставлена задача экспериментального исследования теплопроводности неводных растворов неорганических солей с целью подтверждения расчетно-теоретических данных и выявления влияния температуры и концентрации на поведение теплопроводности.
Выбор метода измерения теплопроводности
Критически подойдя к рассмотрению различных стационарных методов по исследованию теплопроводности жидкостей, в частности неводных растворов электролитов в широкой области изменения параметров, мы остановили свой выбор на стационарном методе с использованием двух датчиков-преобразователей. Применение метода нагретой нити при исследовании теплопроводности растворов электролитов нежелательно, т.к. размещение нити в стеклянные или иные чехлы повышает ошибку в определении температуры и, как следствие, увеличивает погрешность определения коэффициента теплопроводности. Лучше выбрать конструкции прибора в коррозионно-стойком исполнении по отношению к агрессивным растворам при исследовании теплопроводности в широком интервале параметров. Несоблюдение этих условий приводит к изменению концентрации раствора, результатом которого является некорректность определения коэффициента теплопроводности [5].
Устройство для измерения теплопроводности
Для измерения теплопроводности растворов электролитов сотрудниками кафедры «Неорганическая и аналитическая химия» разработано устройство, работающее по стационарному методу с использованием двух датчиков-преобразователей, общая схема которого представлено на рисунке 1.
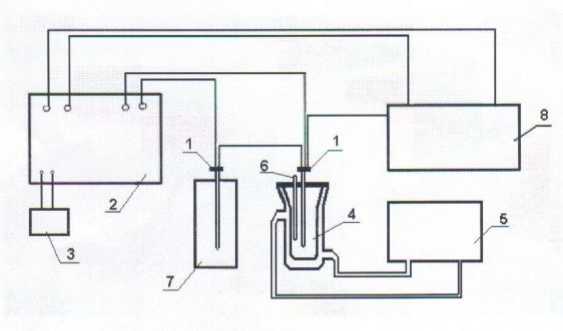
Рис. 1. Схема устройства для измерения теплопроводности: 1 - пара измерительных датчиков-преобразователей, соединенных между собой; 2 - регистрирующий блок, в качестве которого может быть применен потенциометр типа Р 37-1; 3 - нормальный элемент;
4 - термостатированная измерительная ячейка с исследуемым раствором, поддерживающая постоянную температуру; 5 - жидкостный термостат, работающий от сети; 6 - контрольный термометр, в качестве которого может применяться обычный ртутный термометр; 7 - специальный микрохолодильник;
8 - блок питания
Датчики-преобразователи изготовлены из меди-константанта (медно-никелевый сплав МНМЦ 401,5) не них нанесены защитные покрытия в виде стеклянного корпуса с целью приспособления его для измерения теплопроводности жидкостей.
На разработанной установке экспериментально исследованы теплопроводности водных растворов индивидуальных и смешанных электролитов и неводных растворов электролитов. Поэтому полезная модель обладает достаточно высокой точностью получаемых данных по теплопроводности неводных растворов электролитов и может использоваться для определения теплопроводности неисследованных систем [4].
Объекты исследования
Для приготовления растворов использованы: спирт этиловый по ГОСТ 18300-87, спирт бутиловый по ГОСТ 5208-81, калий хлористый марки ХЧ по ГОСТ 4234-77, калий бромистый марки ХЧ по ГОСТ 4160-74, калий йодистый по ГОСТ 4232-74, натрий бромистый по ГОСТ 4169-66, натрий хлористый по ГОСТ 4233-77, аммоний хлористый по ГОСТ 2210-73.
Особое внимание в работе уделялось ректификации этилового спирта. Содержание основного компонента не ниже 96%.
Методика проведения эксперимента
Регулятором температуры жидкостного термостата 5 устанавливается заданный температурный режим. Измерительная ячейка 4 поддерживает постоянную температуру исследуемого раствора по патрубкам термостатирующей жидкостью из термостата 5. Температура испытываемого раствора электролита в измерительной ячейке 4 определяется по контрольному термометру 6. В измерительную ячейку 4 с исследуемым раствором помещается один из датчиков-преобразователей 1, соединенный с источником питания 8. Второй из датчиков-преобразователей 1 находится в специальном холодильнике 7 с кубиками льда. При измерениях стрелка гальванометра регистрирующего прибора 2, контролирующего тепловые потери прибора, отклоняется в ту или иную сторону. После прогрева, убедившись, что длительное время стрелка находится на нулевой отметке шкалы (т.е. отсутствуют потери тепла), проводятся замеры. За показание эксперимента исследуемого раствора принимается среднее арифметическое значение результатов испытания не менее трех образцов. Допускаемое расхождение между значениями, получаемыми для одного и того же раствора, не более 5% [4].
Описание теоретической модели теплопроводности
Значение коэффициента теплопроводности неводных растворов электролитов вычисляли как произведение [1, 3]:
я = Cv • п, где CV - теплоемкость, кал/кг • К;
П - вязкость раствора, Пз = кг/м • с .
Теплоемкость и вязкость неводного раствора электролита определяются как
C V =( 5rT - 2 h a !• N A Ц
П = 1/6 п • r s • b• ( 1 + r s r ) ] .
Тогда окончательное выражение для оценки коэффициента теплопроводности неводных растворов электролитов примет вид:
я
5RT-2 h a I- N.
2 ) A
Ц б тс • r • b - ( 1 + rjrd )
где приведенная масса несольватированных ионов определяется как mKt • mAn
Ц =-- mKt + mAn
Здесь R - универсальная газовая постоянная;
Т - температура, К ;
h to - энергия колебательного процесса «ассоциация-диссоциация»;
ze - элементарный заряд;
h - постоянная Планка;
N A - постоянная Авогадро;
-
rs - радиус сольватированных ионов;
-
b - подвижность иона;
rd - дебаевский радиус или параметр экранирования.
Выражение для определения подвижности:
b = z Kt • zAn ■ e2 4e • U2
Ц
Л
5RT - 2 2
4 n • z Kt • z An • e2 • C • NA • h2
V
V
1000 ц
у
X
x a • exp
4 п • z Kt • zAn • e 2 • C • NA • h2
V
1000 ц • k б • T2
Исследование теплопроводности неводных растворов электролитов
Некоторые результаты экспериментального и расчетно-теоретического исследования теплопроводности показаны в таблицах 1 и 2 и на графической зависимости (рис. 2).
Таблица 1
Значения теплопроводности NaBr, KI, NH 4 Cl в бутаноле ( Вт/м • К )
|
T,К |
C,моль/ л |
NaBr |
KI |
NH4Cl |
|||
|
Часч *103 расч. |
Чеп *10 эксп. |
Часч *103 расч. |
Чеп *10 эксп. |
Часч *103 расч. |
Чеп *10 эксп. |
||
|
288 |
1 |
3699 |
3711 |
1060 |
1099 |
5619 |
5600 |
|
0.5 |
4054 |
4031 |
1188 |
1202 |
6095 |
6058 |
|
|
0.1 |
4699 |
4687 |
1436 |
1449 |
6949 |
6925 |
|
|
0.01 |
5188 |
5149 |
1634 |
1647 |
7580 |
7561 |
|
|
0.001 |
5371 |
5358 |
1711 |
1725 |
7815 |
7796 |
|
|
0.0001 |
5432 |
5408 |
1737 |
1747 |
7894 |
7877 |
|
|
293 |
1 |
3732 |
3721 |
1071 |
1117 |
5666 |
5623 |
|
0.5 |
4085 |
4060 |
1200 |
1213 |
6139 |
6093 |
|
|
0.1 |
4724 |
4701 |
1445 |
1458 |
6981 |
6947 |
|
|
0.01 |
5206 |
5177 |
1641 |
1658 |
7606 |
7590 |
|
|
0.001 |
5386 |
5364 |
1716 |
1733 |
7837 |
7809 |
|
|
0.0001 |
5446 |
5423 |
1742 |
1752 |
7914 |
7898 |
|
|
298 |
1 |
3765 |
3743 |
1082 |
1131 |
5712 |
5687 |
|
0.5 |
4116 |
4086 |
1210 |
1227 |
6183 |
6137 |
|
|
0.1 |
4749 |
4721 |
1454 |
1470 |
7016 |
6993 |
|
|
0.01 |
5225 |
5201 |
1647 |
1665 |
7632 |
7603 |
|
|
0.001 |
5401 |
5389 |
1722 |
1740 |
7859 |
7825 |
|
|
0.0001 |
5460 |
5430 |
1747 |
1765 |
7934 |
7906 |
|
|
303 |
1 |
3816 |
3781 |
1093 |
1140 |
5787 |
5712 |
|
0.5 |
4165 |
4127 |
1221 |
1239 |
6255 |
6189 |
|
|
0.1 |
4794 |
4749 |
1463 |
1485 |
7080 |
7030 |
|
|
0.01 |
5263 |
5229 |
1654 |
1673 |
7687 |
7638 |
|
|
0.001 |
5436 |
5411 |
1727 |
1748 |
7909 |
7874 |
|
|
0.0001 |
5494 |
5452 |
1751 |
1777 |
7984 |
7931 |
|
|
308 |
1 |
3843 |
3800 |
1104 |
1152 |
5823 |
5739 |
|
0.5 |
4192 |
4145 |
1232 |
1245 |
6290 |
6230 |
|
|
0.1 |
4816 |
4780 |
1472 |
1499 |
7110 |
7085 |
|
|
0.01 |
5279 |
5247 |
1660 |
1681 |
7710 |
7683 |
|
|
0.001 |
5451 |
5420 |
1732 |
1752 |
7930 |
7901 |
|
|
0.0001 |
5508 |
5477 |
1756 |
1782 |
8003 |
7972 |
|
|
313 |
1 |
3874 |
3837 |
1115 |
1156 |
5867 |
5794 |
|
0.5 |
4221 |
4189 |
1242 |
1257 |
6331 |
6291 |
|
|
0.1 |
4839 |
4800 |
1481 |
1506 |
7143 |
7115 |
|
|
0.01 |
5297 |
5260 |
1667 |
1690 |
7734 |
7702 |
|
|
0.001 |
5465 |
5433 |
1737 |
1760 |
7950 |
7914 |
|
|
0.0001 |
5521 |
5498 |
1761 |
1788 |
8022 |
8001 |
|
|
318 |
1 |
3904 |
3876 |
1125 |
1161 |
5910 |
5831 |
|
0.5 |
4250 |
4205 |
1252 |
1269 |
6371 |
6322 |
|
|
0.1 |
4862 |
4827 |
1489 |
1519 |
7175 |
7142 |
|
|
0.01 |
5313 |
5294 |
1673 |
1698 |
7758 |
7721 |
|
|
0.001 |
5479 |
5445 |
1742 |
1768 |
7970 |
7932 |
|
|
0.0001 |
5534 |
5507 |
1766 |
1792 |
8041 |
8020 |
|
|
323 |
1 |
3934 |
3901 |
1136 |
1165 |
5953 |
5878 |
|
0.5 |
4278 |
4233 |
1262 |
1282 |
6411 |
6388 |
|
|
0.1 |
4885 |
4851 |
1497 |
1525 |
7206 |
7193 |
|
|
0.01 |
5330 |
5309 |
1679 |
1702 |
7781 |
7744 |
|
|
0.001 |
5493 |
5460 |
1747 |
1773 |
7990 |
7969 |
|
|
0.0001 |
5547 |
5518 |
1770 |
1796 |
8059 |
8031 |
Таблица 2
Температурная зависимость теплопроводности ( Вт/м • К ) NH 4 C1 в среде этанола при C = 0,1 моль / л
|
T,К |
Часч. *103 расч. |
Чсп *10 3 эксп. |
|
288 |
2121 |
2138 |
|
293 |
2131 |
2147 |
|
298 |
2141 |
2155 |
|
303 |
2160 |
2169 |
|
308 |
2169 |
2181 |
|
313 |
2178 |
2193 |
|
318 |
2188 |
2205 |
|
323 |
2197 |
2213 |
Как видно из таблиц и графической зависимости, полученные расчетные данные удовлетворительно подтверждаются экспериментальными данными теплопроводности электролитов в спиртах.
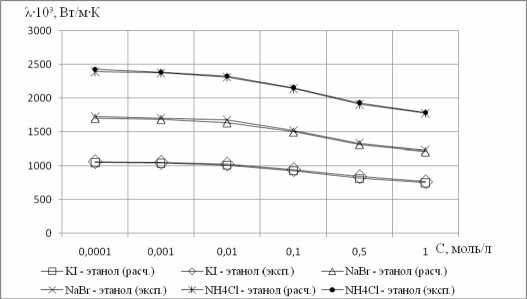
Рис. 2. Графическая зависимость теплопроводности от концентрации
Из представленных в таблицах результатов можно сделать вывод о том, что теплопроводность электролитов в спиртах увеличивается при повышении температуры в исследованном диапазоне концентраций. Действительно, с повышением температуры уменьшается вязкость, нарушается структура раствора, повышается кинетическая энергия ионов и молекул, разрушаются сольватные оболочки ионов, что способствует росту теплопроводности раствора.
Также из графической зависимости видно, что теплопроводность электролитов в спиртах уменьшается с увеличением концентрации раствора во всем исследованном диапазоне температур.


