Экспериментальное исследование биосовместимости противоспаечных мембран при околосердечной имплантации
Автор: Шишкова Дарья Кирилловна, Кудрявцева Юлия Александровна, Насонова Марина Владимировна, Ходыревская Юлия Ивановна, Бурков Николай Николаевич
Журнал: Сибирский журнал клинической и экспериментальной медицины @cardiotomsk
Рубрика: Лабораторные и экспериментальные исследования
Статья в выпуске: 1 т.32, 2017 года.
Бесплатный доступ
Проведен сравнительный анализ мембран на основе (поли(3-гидроксибутират-ко-3-гидроксивалерата) с поли(лактид-ко-гликолидом), изготовленных методом электроспиннинга, и коллагеновых мембран (КолГАРА) при имплантации на переднюю поверхность сердца крыс (Wistar). При исследовании физико-механических свойств было показано, что прочность коллагеновых мембран превышает таковую у мембран из искусственных полимеров, которые, в свою очередь, обладают большей способностью к деформациям. В течение всего периода наблюдения не было выявлено различий в сывороточных концентрациях провоспалительных цитокинов у животных, которым имплантировали полимерные либо коллагеновые мембраны, в сравнении с ложнооперированными животными. Мембраны из природных и искусственных полимеров не вызывали какой-либо системной специфической воспалительной реакции, что свидетельствует об их высокой биосовместимости.
Биодеградируемые полимеры, мембраны, колгара, поли(3-гидроксибутират-ко-3-гидроксивалерат), поли(лактид-ко-гликолид), электроспиннин
Короткий адрес: https://sciup.org/14920163
IDR: 14920163 | УДК: 615.461-77:577.11:621.31
Текст научной статьи Экспериментальное исследование биосовместимости противоспаечных мембран при околосердечной имплантации
В сердечной хирургии, в частности, при коррекции сложных врожденных пороков сердца, проводятся многоэтапные хирургические вмешательства, при этом важную роль играет профилактика образования послеоперационных спаек. Применение биодеградируемых про-тивоспаечных мембран может позволить предотвратить спаечный процесс, являющийся причиной массивного кровотечения, которое удлиняет время повторной операции, а также увеличивает частоту послеоперационных осложнений и летальность. Мы предположили, что биодеградируемые противоспаечные мембраны из поли(3-гидроксибутират-ко-3-гидроксивалерата) (PHBV) с поли(лактид-ко-гликолидом) (PLGA) в соотношении 70:30 с включением дексаметазона (ДМ) при имплантации будут способствовать равномерному выделению данного препарата в окружающие ткани, что позволит снизить воспалительную реакцию и уменьшить риск образования спаек.
Цель работы: оценить реакцию организма на ортотопическую имплантацию противоспаечных мембран.
Материал и методы
Для изготовления мембран использовали PHBV с молекулярной массой 330 кДа (Институт биохимии и физиологии микроорганизмов им. Г.К. Скрябина РАН, Пущино) и PLGA (Лаборатория биополимеров и биотехнологии химического факультета Томского государственного университета) в соотношении лактида к гликолиду 60:40. В качестве группы сравнения была взята рассасывающаяся противоспаечная коллагеновая мембрана Кол-ГАРА (Синтаколл ГмбХ, Германия), в состав которой входит ренатурированный лошадиный коллаген. Были описаны клинические случаи использования КолГАРА при операциях на органах брюшной полости и малого таза [1–3], но не встречались источники литературы, в которых описывались бы случаи использования данного материала в хирургии сердца. Мембраны изготавливали на установке для электроспиннинга Nanon-01А (MECC Inc., Япония) при напряжении 21 Кв и скорости подачи раствора 0,4 мл/ч. Экспериментальные образцы противо-спаечных мембран были представлены следующими группами: PHBV+PLGA, PHBV+PLGA+ДМ (концентрация ДМ составила 0,5 мг/мл), КолГАРА. Для включения ДМ во внутреннюю часть волокна использовали коаксиальную насадку.
Непосредственно перед имплантацией лабораторным животным образцы стерилизовали этиленоксидом при комнатной температуре. Все манипуляции проводили, соблюдая принципы гуманного обращения с животными, регламентированные требованиями Европейской конвенции (Страсбург, 1986).
Образцы мембран (n=28) размером 0,7x0,7 см имплантировали крысам-самцам линии Wistar весом 300– 350 г (одна мембрана на крысу). После введения в ингаляционный наркоз изофлураном (“E-Z Anesthesia”, E-Z Systems Corporation) в условиях чистой операционной проводили доступ к сердцу посредством левосторонней торакотомии с пересечением двух ребер. После выпол- нения перикардиотомии мембраны фиксировали нитью Prolene двумя узловыми швами (у верхушки и у основания сердца) по углам экспериментальных мембран на передней поверхности сердца. После этого грудную полость послойно ушивали нитью Лавсан 3/0. В качестве контрольной группы служили ложнооперированные животные (группа ЛО, n=12), которым в аналогичных условиях выполнялись все манипуляции за исключением подшивания матриксов. В качестве второй контрольной группы выступили здоровые интактные животные (n=5). Вывод животных из эксперимента после оперативного вмешательства проходил на временных точках 2 недели, 1 мес. и 2 мес. (по 3 животных из каждой группы на точку). У всех животных забиралась кровь с целью последующего определения моноцитарного хемоаттрактантного белка (МСР-1) и провоспалительных цитокинов TNF-α, IL-6 и IL-1β посредством иммуноферментного анализа. У всех животных биоптировали сердце с фиксированной на нем мембраной для макроскопического и гистологического изучения. Гистологические срезы готовили по стандартной методике, окрашивали гематоксилин-эозином и по Ван Гизону.
Результаты
Нами были поставлены следующие задачи:
– оценить специфичность воспалительной реакции на имплантацию противоспаечных мембран;
– сравнить противоспаечный эффект мембран из природных и искусственных полимеров;
– выяснить, снижает ли инкорпорирование ДМ в мембраны из искусственных полимеров воспалительную реакцию и препятствует ли образованию спаек.
Для этого было проведено макроскопическое исследование, а в сыворотке крови крыс во всех группах на всех временных точках были измерены концентрации провоспалительных цитокинов (MCP-1, TNF- α , IL-6 и IL-1 β ).
Во всех группах оперированных животных был выявлен спаечный процесс. В группе ложнооперированных животных спаечный процесс отмечался между грудной клеткой и шовным материалом на протяжении всего сро-
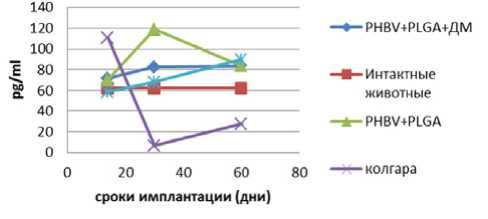
Риc. 1. Динамика MCP-1 противоспаечных мембран и групп сравнения
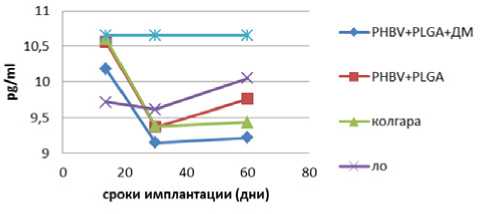
Рис. 2. Динамика TNF- α противоспаечных мембран и групп сравнения
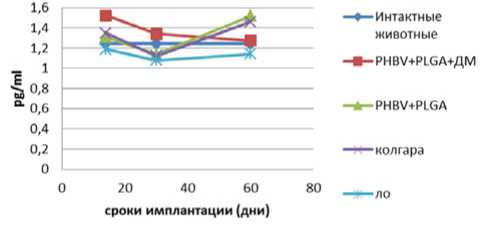
Рис. 3. Динамика IL-6 противоспаечных мембран и групп сравнения
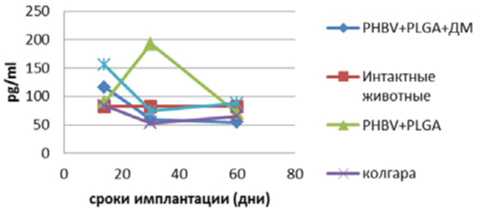
Рис. 4. Динамика IL-1 β противоспаечных мембран и групп сравнения
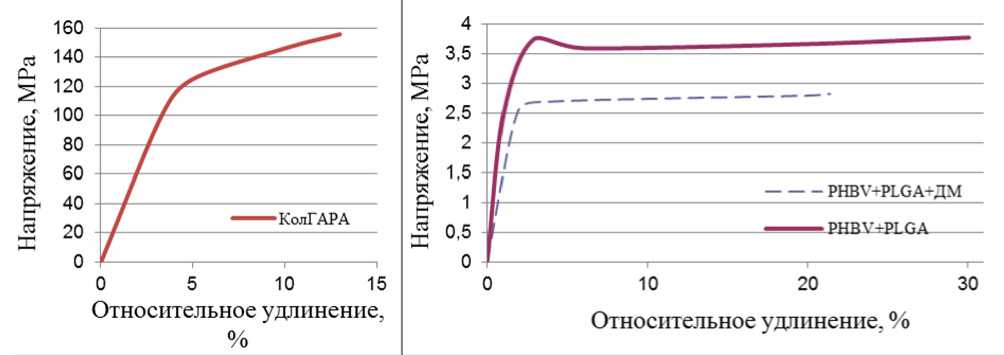
Рис. 5. Диаграмма растяжения противоспаечной коллагеновой мембраны КолГАРА и противоспаечных мембран PHBV+PLGA, PHBV+PLGA+ДМ
ка эксперимента. Наиболее интенсивный спаечный процесс отмечался в группе PHBV+PLGA: спустя 2 недели имплантации спайки визуализировались между внутренней стенкой грудины и нижним краем мембраны, а к 2 мес. имплантации спаечный процесс вокруг мембраны охватывал область перикарда и части легкого.
В группе PHBV+PLGA+ДМ спустя 2 недели после имплантации спаечный процесс был выражен слабее в сравнении с мембраной без добавления лекарственного вещества; к 1 мес. имплантации визуализировались некрупные спайки, мембрана была слегка припаяна к внутренней поверхности ребер, наблюдалась слабая деградация.
В группе КолГАРА к 2 неделям имплантации спаечный процесс наблюдался между внутренней поверхностью грудной клетки, плевры и шовным материалом; а к 2 мес. имплантации мембрана уже не визуализировалась.
Таким образом, мы предположили, что развитие спаечного процесса было обусловлено травматизацией грудной клетки и шовным материалом, а не имплантированными противоспаечными мембранами.
Моноцитарный хемоаттрактантный белок 1 (МСР-1) экспрессируется в основном макрофагами в ответ на широкий спектр таких цитокинов, как IL-6, TNF- α и IL-1 β , но может также секретироваться и другими клет-
Таблица
Физико-механические свойства противоспаечных мембран на основе PHBV+PLGA и мембраны КолГАРА
При сравнении сывороточных концентраций фактора некроза опухоли- α (TNF- α ) и провоспалительных ин-терлейкинов-1 β и -6, которые являются плейотропными молекулами с центральной ролью в реакциях воспаления и апоптоза [4, 5], статистически значимых различий между группами обнаружено не было (рис. 2–4).
При изучении механических свойств противоспаеч-ных мембран было обнаружено, что прочность экспериментальных образцов PHBV+PLGA и PHBV+PLGA+ДМ ниже прочности мембраны КолГАРА в 41,2 (р=0,04) и 55 (р<0,01) раз соответственно (таблица). Добавление дексаметазона как жидкой фазы в состав полимерного матрикса статистически незначимо снижает прочность, и в то же время повышает эластичность материала, увеличивая способность к растяжению. При этом эластичность мембраны PHBV+PLGA+ДМ статистически незначимо превышает эластичность КолГАРА в 1,6 раз.
Одной из характеристик упругих свойств является модуль Юнга, показывающий способность материала сопротивляться растяжению. С модулем Юнга линейно связан коэффициент жесткости, который является показателем конкретного отдельного образца, в то время как модуль Юнга характеризует весь материал в целом. Кол-ГАРА обладает большим модулем упругости, достоверно превышающим аналогичный показатель мембран PHBV+PLGA и PHBV+PLGA+ДМ в 6,37 (р=0,04) и 10,58 (р<0,01) раз соответственно.
Высокий предел прочности барьера КолГАРА при малом растяжении (рис. 5) дает большую жесткость в сравнении с полимерными мембранами и, соответственно, меньшую деформационную способность по сравнению с полимерными мембранами.
При рассмотрении зависимости “напряжение–удлинение” для групп противоспаечных мембран было отмечено, что упругие свойства коллагеновой мембраны Кол-ГАРА сохраняются до нагрузки порядка 100 МРа и относительного удлинения 3%, полимерных мембран, изготовленных методом электроспиннинга – до 2,5 МРа и 1,8% для PHBV+PLGA, 2,2 и 2,5% для PHBV+PLGA+ДМ, после чего идут пластические деформации и дальнейший разрыв образцов.
Выводы
Не было выявлено как специфического воспалительного ответа на имплантацию противоспаечных мембран, так и различий в выраженности иммунной реакции на мембраны из природных и искусственных полимеров, что свидетельствует об их высокой биосовместимости. Кроме того, показано, что инкорпорирование дексаметазона в противоспаечные мембраны из искусственных полимеров не снижает местную воспалительную реакцию. При исследовании физико-механических свойств показано, что прочностные свойства коллагеновых мембран превышают таковые у мембран из искусственных полимеров, которые в свою очередь обладают большей способностью к деформациям.
Список литературы Экспериментальное исследование биосовместимости противоспаечных мембран при околосердечной имплантации
- Силуянов С.В., Алиев С.Р. Первый опыт применения противоспаечной коллагеновой мембраны при операциях на органах брюшной полости и малого таза//Рос. мед. журн. -2015. -№ 13. -С. 789-795.
- Савельева И.В., Полянская И.Б., Красникова Е.Г. и др. К вопросу о профилактике спайкообразования при оперативных вмешательствах на органах малого таза//Рос. мед. журн. -2015. -№ 20. -С. 1233-1237.
- Gorskiy V.A., Sivkov A.S., Agapov M.A. et al. The first experience of using a single-layer intra-abdominal collagen plate//Khirurgiia (Mosk). -2015. -Vol. 5. -P. 59-61.
- Juhasz K., Buzas K., Duda E. Importance of reverse signaling of the TNF superfamily in immune regulation//Expert Rev. Clin. Immunol. -2013. -Vol. 9(4). -P. 335-348.
- Zelova H., Hosek J. TNF- signalling and inflammation: interactions between old acquaintances//Inflammation Res. -2013. -Vol. 62(7). -P. 641-651.


