Экспериментальное исследование радиопротекторных свойств пирувата лития in vitro
Автор: Плотников Е.В., Белоусов М.В., Бразовский К.С., Ларькина М.С., Артамонов А.А., Стучебров С.Г., Чернов В.И.
Журнал: Сибирский онкологический журнал @siboncoj
Рубрика: Лабораторные и экспериментальные исследования
Статья в выпуске: 4 т.23, 2024 года.
Бесплатный доступ
Радиотоксичность является серьезной проблемой для пациентов, проходящих лучевую терапию, поэтому поиск новых препаратов-радиопротекторов для ослабления ее последствий крайне актуален. Радиопротекторы должны обладать рядом свойств, в том числе прямым антиоксидантным действием, снижать окислительный стресс, индуцировать репарацию ДНК или ингибировать апоптоз и при этом не вызывать собственных побочных эффектов. По совокупности свойств перспективными выглядят антиоксиданты на основе солей лития. Целью исследования явилось изучение радиопротекторных свойств пирувата лития in vitro . Материал и методы. В качестве биомоделей для оценки воздействия рентгеновского излучения использовали относительно радиочувствительные мононуклеарные клетки крови и относительно радиоустойчивые фибробласты линии 3T3L1. Клетки инкубировали и облучали в 96-луночных планшетах. Пируват лития применяли в финальной концентрации 1,2 мМ. Облучение проводили с интенсивностью 15 мГр/c в диапазоне поглощенных доз 0-5 Гр на рентгеновской установке (анодное напряжение 160 кВ, средний ток 3,5 мА). Жизнеспособность клеток оценивали с помощью МТТ-теста и резазуринового теста. Оценку вариантов клеточной гибели и уровень окислительного стресса определяли цитофлуориметрическим методом.
Пируват лития, радиопротекция, фибробласты линии 3t3l1, мононуклеарные клетки крови, рентгеновское излучение, окислительный стресс, апоптоз
Короткий адрес: https://sciup.org/140307091
IDR: 140307091 | УДК: 616-006:615.3]-092.4 | DOI: 10.21294/1814-4861-2024-23-4-66-76
Текст научной статьи Экспериментальное исследование радиопротекторных свойств пирувата лития in vitro
Лучевая терапия является одним из наиболее распространенных методов лечения злокачественных новообразований, до 50 % больных на определенном этапе подвергаются лучевой терапии в терапевтических или в паллиативных целях [1]. Для достижения оптимальных результатов необходимо обеспечить разумное равновесие между суммарной лучевой нагрузкой на опухоль и пороговым значением для прилегающих здоровых тканей. Очевидно, что ионизирующее излучение повреждает как нормальные, так и раковые клетки. Отметим, что эффективность лучевой терапии основана на биологическом принципе, согласно которому здоровые клетки обладают большей способностью восстанавливаться и возвращаться к нормальному функциональному состоянию по сравнению с клетками злокачественных опухолей, где репарация и метаболизм в целом проходят неоптимальным путем. Раковые клетки в целом менее эффективно восстанавливают повреждения, вызванные лучевой терапией, что приводит к их преимущественному уничтожению [2]. Для повышения эффективности терапии за счет увеличения дозы необходимо защитить нормальные ткани от радиационного воздействия [3].
С этой целью применяется большое количество физических подходов, включая улучшение оборудования для радиотерапии и проведение рационального фракционирования и зонирования облучения. Перспективным механизмом снижения радиотоксичности нормальных тканей является использование радиопротекторов – специальных соединений, которые защищают неопухолевые клетки от воздействия радиации [4]. Идеальный радиопротектор должен обладать рядом свойств, включая защиту нормальных тканей без значимого воздействия на опухолевую ткань, оптимальной фармакокинетикой и минимальной токсичностью [5]. Как правило, радиопротекторы являются сульфгидрильными соединениями и антиоксидантами, которые действуют путем нейтрализации свободных радикалов, защищая клетки от повреждений, вызванных облучением [6]. Однако для большинства исследованных соединений не удалось показать заметного эффекта в клинической практике. Несмотря на значительную работу в этой области за последние десятилетия, лишь несколько радио-протекторных средств одобрены для клинического применения, причем их широкое применение ограничено существенными побочными эффектами. Например, палифермин и амифостин, одобренные FDA для применения в онкологии [7, 8], имеют широкий список эффектов, осложняющих их применение, включая тошноту и аллергические реакции. Отмечается низкая селективность амифо-стина, а его способность защищать от облучения и опухолевые ткани требует дальнейшей верификации и изучения [9]. Продолжается поиск новых соединений, в том числе природных веществ, которые демонстрируют радиопротекторную активность [10]. С целью радиопротекции применяются различные витамины-антиоксиданты, в первую очередь жирорастворимые [11].
В данном контексте весьма перспективными соединениями выглядят соли лития с антиоксидантной активностью на основе естественных внутриклеточных метаболитов, в частности пирувата. Пируват обладает антиоксидантными свойствами и проявляет цитопротекторную и антиапоптотическую активность [12–14]. Литий, в свою очередь, широко применяется в медицине в качестве психотропного препарата, с хорошо изученным терапевтическим (нормотимическим) действием и в некоторых случаях проявляющий цитопротекторную активность при окислительном стрессе [15–17]. К настоящему времени накоплено много данных, подтверждающих широкий спектр биологических эффектов лития, включая нейро-, кардио- и нефропротекторные свойства, регуляцию воспаления и иммунитета [18–23]. Выявлено стимулирующее действие лития на гемопоэз, что имеет важное значение при восстановлении нормального функционирования организма после лучевого воздействия, в т.ч. лучевой терапии в онкологической практике [22]. В целом, лучевая терапия создает заметную токсическую нагрузку на организм вследствие массированной гибели клеток не только в опухоли, но и в сопредельных здоровых тканях. Совокупность описанных свойств исходных компонентов позволяет сделать предпо- ложение о наличии радиопротекторных свойств у синтезированной соли пирувата лития.
Биологические эффекты ионизирующего излучения связаны с окислительным стрессом, вызванным радиолизом воды и образованием активных форм кислорода, что приводит к повреждению макромолекул, в первую очередь ДНК [24]. Радиационно-индуцированные повреждения ДНК включают однонитевые и двунитевые разрывы, повреждения нуклеотидных оснований, гликозильные повреждения и сшивки ДНК [25]. Наиболее фатальными повреждениями являются двойные разрывы ДНК. В целом повреждение ДНК активирует ряд клеточных регуляторных путей и межклеточных сигналов, которые определяют дальнейшую судьбу клеток, включая активацию репарации ДНК, остановку клеточного цикла или апоптоз. В случае выживания клетки может оставаться серьезное бремя накопленных радиационных повреждений, приводящих к хромосомным аберрациям и нестабильности генома [26]. Интенсивное радиационное и последующее окислительное повреждение нормальных клеток за короткий период приводит к перегрузке систем репарации и индукции апоптоза. Комплексное антиоксидантное и цитопротекторное действие пирувата лития потенциально может обеспечить радиопротекторное действие при ионизирующем излучении.
Целью исследования стало изучение радио-протекторных свойств пирувата лития in vitro .
Материал и методы
Пируват лития (рис. 1) получали ex tempore в реакции стехиометрического количества карбоната лития (Sigma-Aldrich, Германия) и пировиноградной кислоты (Sigma-Aldrich, Германия) 1:2 в биди-стиллированной воде при умеренном нагревании до 40 °C. Для выделения продуктов реакции в кристаллическом состоянии использовали метод выделения из водного раствора протолитическими растворителями (этанолом). После перекристаллизации субстраты промывали, сушили, подтверждали состав соединений (элементный анализ, ИК-спектроскопия) и использовали для экспериментов.
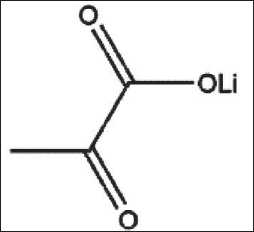
Рис. 1. Структурная формула пирувата лития. Примечание: рисунок выполнен авторами Fig. 1. Structural formula of lithium pyruvate.
Note: created by the authors
Раствор гидропероксида трет-бутила 70 мас. % в H2O (Sigma-Aldrich, Германия) использовали в качестве индуктора окисления для модуляции окислительного стресса. МТТ реагент – Thiazolyl Blue Tetrazolium Bromide (НПП «ПанЭко», РФ) использовался для определения метаболической активности и жизнеспособности адгезивных клеточных культур. Натриевая соль резазурина (Sigma-Aldrich, Германия) использовалась для стандартного реза-зуринового теста в виде водного раствора.
Для экспериментов использовались монону-клеарные клетки периферической крови человека и эмбриональные мышиные фибробласты стандартизированной линии 3T3L1 (ATCC CL-173). Мононуклеарные клетки получены из крови центрифугированием на градиенте фиколла плотностью ρ=1,077 г/см3 (Sigma-Aldrich, USA). Выделенные клетки отмывали, ресуспендировали в среде RPMI 1640 и использовали в экспериментах. Мононуклеарные клетки периферической крови и фибробласты линии 3T3L1 культивировали в питательной среде RPMI-1640 (ПанЭко, РФ). Питательные среды обогащались добавками GlutaMAX (Gibco, США), 10 % эмбриональной телячьей сыворотки (One Shot™, Thermo Fisher Scientific, Бразилия) и антибиотиками (смесь пенициллина и стрептомицина Панэко, Россия). Для проведения экспериментов фибробласты предварительно засевали в лунки 96-луночного планшета в концентрации 3 тыс. клеток/лунка в 100 мкл и инкубировали 24 ч при 37 ºС, 5 % СО2, далее использовали в эксперименте. Моно-нуклеарные клетки засевали непосредственно перед экспериментом в 96-луночный планшет в концентрации 30 тыс. клеток/лунку в 100 мкл. В лунки с клетками вносили пируват лития (из 48 мМ рабочего раствора) для получения диапазона рабочих концентраций 0,6–1,2 мМ в 12 повторах. В контрольные лунки вносили соответствующий объем физраствора. После внесения тестируемого соединения клетки инкубировали в течение 60 мин в обычных условиях (5 % CO2, 37 °C, 100 % влажность), после чего проводили облучение с интенсивностью 15 мГр/с с дистанции 30 см в диапазоне поглощенных доз 0,5–5,0 Гр на рентгеновской установке со следующими параметрами: анодное напряжение – 160 кВ, средний ток – 3,5 мА. Контрольный планшет с клетками подвергался аналогичным манипуляциям, но без облучения.
Для химической индукции окислительного стресса использовали гидроперекись трет-бутила (ГПТБ) в виде 70 % водного раствора (Sigma-Aldrich, Германия). Клетки готовили аналогично вышеописанному способу в 96-луночном планшете. Вносили пируват лития в концентрации 1,2 мМ, инкубировали в течение 60 мин. Далее вносили ГПТБ для достижения финальной концентрации 40 мкМ/л. После этого клетки инкубировали в стандартных условиях 37 °С в 5 % СО2. Оценку уровня ГПТБ-индуцированного окислительного стресса проводили на трех временных точках (24, 48 и 72 ч).
Оценку жизнеспособности суспензионных клеток проводили через 72 ч после рентгеновского облучения с помощью стандартного резазурино-вого теста. Для этого использовали 96-луночные планшеты с клетками. В лунки с клетками добавляли раствор резазурина, получая 0,02 мг/мл. Образцы встряхивали на шейкере в течение 2 мин. Далее планшеты культивировали в течение 4 ч (5 % CO2, 37 °C) и измеряли оптическую плотность образцов при 570 нм на спектрофотометре Multiscan FS (ThermoFisher). Жизнеспособность клеток рассчитывали как процентное отношение значения оптической плотности образца к оптической плотности необлученного контроля без воздействия соединения (с вычетом значений пустых лунок).
Жизнеспособность адгезивных культур изучали с помощью МТТ-теста через 72 ч после облучения. В каждую лунку 96-луночного планшета добавляли раствор МТТ 0,45 мг/мл, инкубировали при температуре 37 οС в атмосфере 5 % СО2 в течение 4 ч до образования кристаллов формазана. После чего среду аспирировали и лунки наполняли 100 мкл диметилсульфоксида (ДМСО) для растворения формазана. В течение 2 мин планшеты перемешивали на шейкере и измеряли оптическую плотность образцов при 570 нм на спектрофотометре Multiscan FS (ThermoFisher). Полученные значения оптической плотности в нескольких повторах усредняли и рассчитывали жизнеспособность в процентах от контроля без воздействия.
Облученные клетки после 72-часовой инкубации в 5 % CO2 при 37 °С собирали из планшета, центрифугировали 5 мин при 200 g, промывали в фосфатном буфере и ресуспендировали в буфере для флуоресцентного окрашивания из набора детекции апоптоза Annexin V-FITC (Abcam, #14085), содержащем смесь Annexin V-FITC и йодистого пропидия. Далее клетки инкубировали 15 мин при комнатной температуре в темном месте и проводили цитофлуориметрическое исследование. Результаты обрабатывали и подсчитывали жизнеспособность и варианты апоптоза с помощью программного обеспечения цитофлуориметра CytoFlex (Beckman Coulter, США). Стратегия гейтирования включала разделение популяции на четыре группы: живые клетки (неокрашенные), ранние апоптотические клетки (окрашенные только Annexin V-FITC), поздние апоптотические клетки (окрашенные обоими красителями) и некротические клетки (окрашенные йодистым пропидием).
Подготовка клеток к оценке уровня окислительного стресса после облучения выполнена аналогично тесту оценки вариантов клеточной гибели. Клетки собирали, отмывали и ресуспендировали в соответствующем буфере из тестового набора детекции окислительного стресса Cellular ROS
Assay Kit (Abcam, #186029). После этого клетки окрашивали, инкубировали 30 мин в инкубаторе при 37 ºС и проводили цитофлуориметрическое измерение параметров. Концентрацию активных форм кислорода в клетках оценивали с помощью программного обеспечения цитофлуориметра CytoFlex (Beckman Coulter, США).
Результаты статистически обрабатывали с помощью программного обеспечения GraphPad Prism 9 (GraphPad Software, CA, USA). Данные показаны в виде «среднее значение ± стандартное отклонение». Различия между группами выявляли с помощью дисперсионного анализ (ANOVA). Различия считали достоверными при р˂0,05.
Результаты
Оценка выживаемости фибробластов через 72 ч после лучевого воздействия и сочетанного применения пирувата лития показана на рис. 2. Выявлен относительно высокий уровень радиорезистентности данных клеток, заметное снижение жизнеспособности показано только в поглощенной дозе 3 Гр и выше.
Относительно большей радиочувствительностью обладают нормальные мононуклеарные клетки периферической крови человека (рис. 3). Через 72 ч после воздействия показано достоверное снижение жизнеспособных клеток, облученных в дозе 1,0 Гр и выше, при этом отмечено защитное действие пирувата лития.
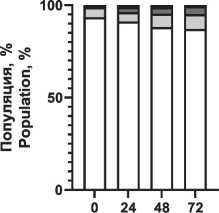
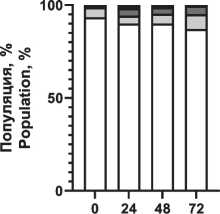
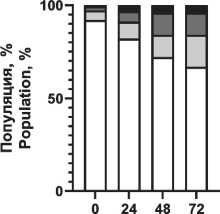
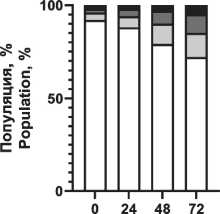
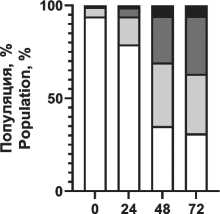
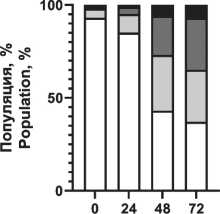
Распределение вариантов клеточной смерти после воздействия ионизирующего излучения и радиопротектора показано на рис. 4. Отмечено увеличение доли апоптотических клеток при повышении поглощенной дозы, при этом наблюдаются снижение фракции апоптоза и увеличение фракции живых клеток при использовании пирувата лития в концентрации 1,2 мМ.
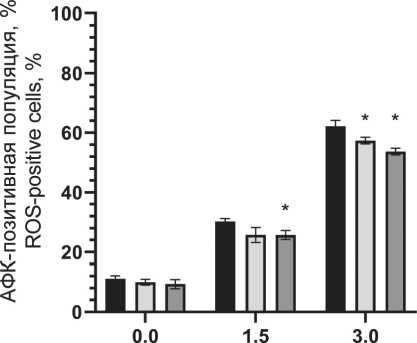
Уровень радиационно-индуцированного окислительного стресса в популяции (фракция АФК-позитивных клеток) через 72 ч после воздействия ионизирующего излучения и защитное действие пирувата лития представлены на рис. 5. Отмечается нарастание уровня окислительного стресса при повышении поглощенной дозы до 3 Гр.
Защитное действие пирувата лития на клетки крови при химически-индуцированном окислительном стрессе (40 мкМ гидроперекиси третбутила) показано на рис. 6. Отмечено выраженное повышение жизнеспособности клеток на всех временных точках при сочетанном использовании пирувата лития с индуктором окислительного стресса.
Обсуждение
Рентгеновское излучение достаточно широко используется в радиотерапии. Воздействие ионизирующего излучения на биологические ткани характеризуется интенсивностью процесса ионизации среды и как следствие повреждением биологических макромолекул, приводящим к летальным нарушениям в клетках-мишенях [27]. Защита нормальных клеток является крайне важной в рамках лучевой терапии и требует создания новых радиопротекторов, поэтому в данной работе изучили потенциальное цитопротекторное действие пирувата лития при действии рентгеновского излучения на клеточные культуры крови (монону-клеары) и соединительной ткани (фибробласты) с различной радиоустойчивостью. В эксперименте клетки соединительной ткани проявили относительно высокую устойчивость к действию облучения (рис. 2). Несмотря на то, что использовалась активно пролиферирующая линия эмбриональных фибробластов, статистически значимое снижение жизнеспособности отмечено только при облучении в поглощенной дозе выше 3 Гр. Воздействие рентгеновского излучения в дозе 0,5–1,5 Гр не приводит к достоверным изменениям в популяции. При этом воздействие пирувата лития приводит к достоверному повышению жизнеспособности по сравнению с облученной контрольной группой только в дозах 3 и 5 Гр (рис. 2). Отмечается дозозависимость этого феномена с более выраженным эффектом при концентрации пирувата 1,2 мМ, тогда как при 0,6 мМ значимых отличий не выявлено. Аналогичное лучевое воздействие на мононуклеарные клетки крови выявило большую радиочувствительность клеток, отмечено снижение жизнеспособности до 76 ± 3 % уже при поглощенной дозе в 1,5 Гр и до 23 ± 4 % при 5,0 Гр. Пируват лития показал
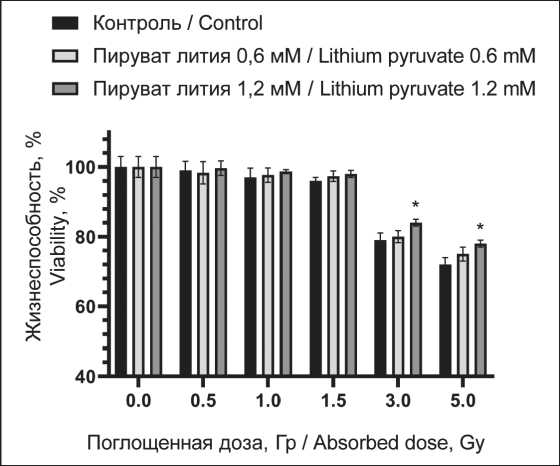
Рис. 2. Жизнеспособность нормальных эмбриональных фибробластов мыши линии 3T3L1 при рентгеновском облучении (0–5 Гр) и воздействии пирувата лития в концентрации 0,6 и 1,2 мМ. Примечания: * – различия значимы по сравнению с группой контроля (p˂0,05); диаграмма выполнена авторами Fig. 2. Viability of normal mice embryonic fibroblasts 3T3L1 line under X-ray irradiation (0–5 Gy) and lithium pyruvate exposure at 0.6 and 1.2 mM.
Notes: * – significant differences vs control (p˂0.05); created by the authors
■ Контроль / Control
□ Пируват лития 0,6 мМ / Lithium pyruvate 0.6 mM
□ Пируват лития 1,2 мМ / Lithium pyruvate 1.2 mM
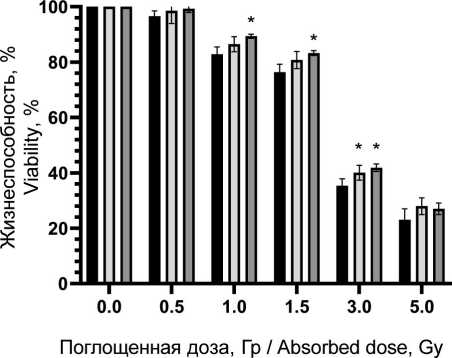
Рис. 3. Жизнеспособность мононуклеарных клеток периферической крови человека при рентгеновском облучении и воздействии пирувата лития в концентрации 0,6 и 1,2 мМ.
Примечания: * – различия значимы по сравнению с группой контроля (p˂0,05); диаграмма выполнена авторами Fig. 3. Viability of human peripheral blood mononuclear cells under X-ray irradiation and lithium pyruvate exposure at 0.6 and 1.2 mM.
Notes: * - significant differences vs control (p<0.05); created by the authors радиопротекторное действие в отношении моно-нуклеаров, что проявилось в повышении жизнеспособной фракции клеток в популяции на 5–7 % при облучении в диапазоне 1–3 Гр по сравнению с облученной контрольной группой без воздействия препарата (рис. 3). При этом в больших дозах облучения не выявлено статистически значимого отличия от контрольной группы. Важно отметить, что терапевтическая эффективность лучевой терапии, помимо физических факторов (поглощенная доза, тип излучения, фракционирование и т.п.), зависит от биологических факторов, в первую очередь радиоустойчивости здоровых тканей и радиочувствительности опухолей [1]. Это требует поиска оптимального баланса между максимизацией дозы облучения для уничтожения раковых клеток и минимизацией дозы облучения здоровых клеток. Обычно нормальные клетки более устойчивы к действию облучения, чем активно делящиеся клетки опухоли. Радиочувствительность клеточной популяции определяется рядом параметров, в первую очередь уровнем репарации (способность восстанавливать повреждения ДНК, вызванные облучением), скоростью репопуляции (степень пролиферации клеток в основных субпопуляциях), перераспределением клеток по фазам клеточного цикла (наименее устойчивые к облучению клетки в митозе, в то время как клетки S-фазы более устойчивы), оксигенацией (чувствительность клеток к облучению повышается в оксигенированной среде) и индивидуальной радиочувствительностью ввиду определенных генетических свойств и мутаций [28, 29]. В этом контексте важно провести оценку основных механизмов клеточной гибели. На примере мононуклеарных клеток крови установлено распределение вариантов гибели клеток при различных поглощенных дозах в сочетании с пируватом лития (рис. 4). Выявлено значительное снижение доли клеток в апоптозе при воздействии пирувата лития, причем наблюдается уменьшение этой фракции во всем диапазоне поглощенных доз по сравнению с контролем. Наблюдается резкое нарастание уровня общей фракции апоптоза на 2–3-и сут после облучения до 29, 63 и 71 % для поглощенных доз 1,5, 3,0 и 5,0 Гр соответственно. При сочетанном применении пирувата лития уровень апоптотических клеток был меньше на 4–8 % для аналогичного диапазона поглощенных доз. Активация апоптоза при облучении напрямую связана с окислительным повреждением ДНК как основной биологической мишенью ввиду критических последствий для клетки, причем одноцепочечные и двухцепочечные разрывы влияют на жизнеспособность клеток по-разному [30]. При значительном накоплении двухцепочечные разрывы не могут быть восстановлены, и это приводит к гибели клеток. Одноцепочечные разрывы могут быть восстановлены клетками при наличии второй нетронутой нити ДНК. Активная репарация ДНК позволяет клетке нивелировать полученные радиационные повреждения, не уходя в апоптоз. Превышение репарационных возможностей клетки, как правило, запускает механизм апоптоза. Выраженный окислительный стресс вследствие интенсивного облучения может приводить к первичной некротической гибели клетки. В данном эксперименте уровень некротической гибели клеток не превышал 9 % даже в максимальных поглощенных дозах, а основным выявленным путем гибели клеток являлся апоптоз. На основании полученных данных предложена концепция радиопротекторного действия пирувата лития, в основе которой лежит цитопротекторное действие пирувата при окислительном стрессе. Снижение уровня продукции АФК при действии пирувата может обеспечивать снижение критических повреждений и дополнительное время для репарации повреждений в клетке без запуска апоптоза, что подтверждается снижением уровня апоптоза и повышением доли жизнеспособных клеток в облученной популяции при действии пирувата лития в концентрации 1,2 мМ (рис. 4). Для подтверждения механизма действия через снижение продукции АФК была выполнена серия тестов по оценке уровня окислительного стресса в клеточной популяции после облучения и применения ГПТБ (химического индуктора окислительного стресса). Экспериментально показано резкое нарастание АФК-позитивных клеток (повышенная продук-
Доза/ Dose
Группа/Group
Контроль/ Control
Пируват лития 1,2 мМ/
Lithium pyruvate 1.2 mM
Ш Мертвые / Dead
СО Поздний апоптоз / Late apoptosis СО Ранний апоптоз / Early apoptosis СО Живые / Live
Время, часы / Time, hours
■ Мертвые / Dead со Поздний апоптоз / Late apoptosis □ Ранний апоптоз / Early apoptosis СО Живые / Live
Время, часы / Time, hours

■ Мертвые / Dead
О Поздний апоптоз / Late apoptosis О Ранний апоптоз / Early apoptosis СО Живые / Live
■ Мертвые / Dead
□ Поздний апоптоз / Late apoptosis СО Ранний апоптоз / Early apoptosis СО Живые / Live
Время, часы / Time, hours
Время, часы / Time, hours
■ Мертвые / Dead со Поздний апоптоз / Late apoptosis со Ранний апоптоз / Early apoptosis СО Живые / Live
■ Мертвые / Dead со Поздний апоптоз / Late apoptosis со Ранний апоптоз / Early apoptosis СО Живые / Live
Время, часы / Time, hours
Время, часы / Time, hours
Рис. 4. Распределение вариантов клеточной гибели мононуклеарных клеток периферической крови через 72 ч после рентгеновского облучения 0–3 Гр и воздействия пирувата лития 1,2 мМ. Примечание: диаграммы выполнены авторами
Fig. 4. Distribution of cell death variants of peripheral blood mononuclear cells 72 hours after exposure 0–3 Gy X-ray irradiation and 1.2 mM lithium pyruvate. Note: created by the authors ция активных форм кислорода), т. е. нарастание окислительного стресса при повышении дозы облучения (рис. 5). Предварительная инкубация клеток с пируватом лития (1,2 мМ) снижает уровень окислительного стресса, но уже при концентрации пирувата лития менее 0,6 мМ можно отметить только некоторый тренд на снижение окисли- тельного стресса в популяции, без достоверных отличий (рис. 5). Наиболее выраженное цитопро-текторное действие пирувата лития установлено при химически-индуцированном окислительном стрессе (рис. 6). Воздействие ГПТБ в концентрации 40 мкМ приводило к гибели до 80 % клеток в 1-е сут. Действие пирувата лития (1,2 мМ) в первые
■ Контроль / Control
□ Пируват лития 0,6 мМ / Lithium pyruvate 0.6 mM
□ Пируват лития 1,2 мМ / Lithium pyruvate 1.2 mM
Поглощенная доза, Гр / Absorbed dose, Gy
Рис. 5. Окислительный стресс (уровень АФК-позитивных клеток) в популяции мононуклеарных клеток периферической крови через 72 ч после рентгеновского облучения и воздействия пирувата лития. Примечания: * – различия значимы по сравнению с группой контроля (p˂0,05); диаграмма выполнена авторами
Fig. 5. Oxidative stress (level of ROS-positive cells) in the population of peripheral blood mononuclear cells 72 hours after X-ray irradiation and lithium pyruvate exposure. Notes: * - significant differences vs control (p˂0.05); created by the authors
Ш Контроль / Control
□ ГПТБ/НРТВ
Пируват лития 1,2 мМ+ГПТБLithium pyruvate 1.2 mM+HPTB
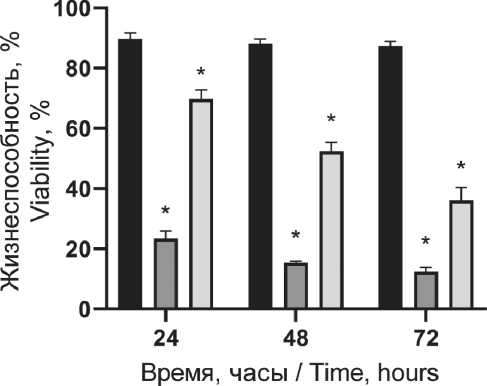
Рис. 6. Цитопротекторное действие пирувата лития в отношении мононуклерных клеток при индуцированном окислительном стрессе (40 мкМ ГПТБ-гидроперекись трет-бутила). Примечания: * – различия значимы по сравнению с группой контроля (p˂0,05); диаграмма выполнена авторами
Fig. 6. Cytoprotective effect of lithium pyruvate for mononuclear cells against induced oxidative stress (40 μM HPTB-tret-butyl hydroperoxide).
Notes: * - significant differences vs control (p<0.05); created by the authors
24 ч повышало выживаемость клеток более чем вдвое. Аналогичное достоверное снижение уровня окислительного стресса в клетках наблюдалась на всех временных точках во всем диапазоне концентраций пирувата лития (рис. 6). Таким образом, максимально эффективная реализация действия цитопротектора может достигаться снижением уровня окислительного стресса (антиоксидантное действие и прямое снижение повреждений), ингибированием апоптоза клеток (и потенциально увеличением времени репарации до критического момента инициации гибели клетки). Эти процессы являются ключевыми в защите клеток при лучевом воздействии. Полученные результаты выявили, что использование пирувата лития приводит к
Список литературы Экспериментальное исследование радиопротекторных свойств пирувата лития in vitro
- Baskar R., Lee K.A., Yeo R., Yeoh K.W. Cancer and radiation therapy: current advances and future directions. Int J Med Sci. 2012; 9(3): 193-9. https://doi.org/10.7150/ijms.3635.
- Begg A.C., Stewart F.A., Vens C. Strategies to improve radiotherapy with targeted drugs. Nat Rev Cancer. 2011; 11(4): 239-53. https://doi.org/10.1038/nrc3007.
- Kamran M.Z., Ranjan A., Kaur N., Sur S., Tandon V. Radioprotective Agents: Strategies and Translational Advances. Med Res Rev. 2016; 36(3): 461-93. https://doi.org/10.1002/med.21386.
- Obrador E., Salvador R., Villaescusa J.I., Soriano J.M., Estrela J.M., Montoro A. Radioprotection and Radiomitigation: From the Bench to Clinical Practice. Biomedicines. 2020; 8(11): 461. https://doi.org/10.3390/biomedicines8110461.
- Mishra K., Alsbeih G. Appraisal of biochemical classes of radioprotectors: evidence, current status and guidelines for future development.
- Biotech. 2017; 7(5): 292. https://doi.org/10.1007/s13205-017-0925-0.
- Szejk M., Kołodziejczyk-Czepas J., Żbikowska H.M. Radioprotectors in radiotherapy - advances in the potential application of phytochemicals. Postepy Hig Med Dosw (Online). 2016; 70(0): 722-34. https://doi.org/10.5604/17322693.1208039.
- Singh V.K., Seed T.M. The efficacy and safety of amifostine for the acute radiation syndrome. Expert Opin Drug Saf. 2019; 18(11): 1077-90. https://doi.org/10.1080/14740338.2019.1666104.
- Zivkovic Radojevic M., Milosavljevic N., Miladinovic T.B., Janković S., Folic M. Review of compounds that exhibit radioprotective and/or mitigatory effects after application of diagnostic or therapeutic ionizing radiation. Int J Radiat Biol. 2023; 99(4): 594-603. https://doi.org/10.1080/09553002.2022.2110308.
- Koukourakis M.I., Giatromanolaki A., Zois C.E., Kalamida D., Pouliliou S., Karagounis I.V., Yeh T.L., Abboud M.I., Claridge T.D., Schofield C.J., Sivridis E., Simopoulos C., Tokmakidis S.P., Harris A.L. Normal tissue radioprotection by amifostine via Warburg-type effects. Sci Rep. 2016; 6: 30986. https://doi.org/10.1038/srep30986.
- Citrin D., Cotrim A.P., Hyodo F., Baum B.J., Krishna M.C., Mitchell J.B. Radioprotectors and mitigators of radiation-induced normal tissue injury. Oncologist. 2010; 15(4): 360-71. https://doi.org/10.1634/theoncologist.2009- S104.
- Lledó I., Ibáñez B., Melero A., Montoro A., Merino-Torres J.F., San Onofre N., Soriano J.M. Vitamins and Radioprotective Effect: A Review. Antioxidants (Basel). 2023; 12(3): 611. https://doi.org/10.3390/antiox12030611.
- Epimakhova E.V., Losenkov I.S., Roshchina O.V., Plotnikov E.V. Otsenka tsitoprotektornogo i antioksidantnogo deistviya piruvata litiya na mononukleary perifericheskoi krovi bol'nykh alkogolizmom. Voprosy narkologii. 2018; 12(171): 36-47.
- Epimakhova E.V., Plotnikov E.V., Boiko A., Losenkov I. Influence of lithium pyruvate on expression of AKT/mTOR-signaling pathway proteins in mononuclear cells of patients with bipolar disorder. Eur Neuropsychopharmacology. 2020; 40(5): 200-201. https://doi.org/10.1016/j.euroneuro.2020.09.262.
- Plotnikov E., Losenkov I., Epimakhova E., Bohan N. Protective Effects of Pyruvic Acid Salt Against Lithium Toxicity and Oxidative Damage in Human Blood Mononuclear Cells. Adv Pharm Bull. 2019; 9(2): 302-6. https://doi.org/10.15171/apb.2019.035.
- Chiu C.T., Wang Z., Hunsberger J.G., Chuang D.M. Therapeutic potential of mood stabilizers lithium and valproic acid: beyond bipolar disorder. Pharmacol Rev. 2013; 65(1): 105-42. https://doi.org/10.1124/pr.111.005512.
- Wang W., Lu D., Shi Y., Wang Y. Exploring the Neuroprotective Effects of Lithium in Ischemic Stroke: A literature review. Int J Med Sci. 2024; 21(2): 284-98. https://doi.org/10.7150/ijms.88195.
- Plotnikov E., Korotkova E., Voronova O. Lithium Salts of Krebs Cycle Substrates as Potential Normothymic Antioxidant Agents. J Pharm Bioallied Sci. 2018; 10(4): 240-5. https://doi.org/10.4103/JPBS.JPBS_140_18.
- Haupt M., Bähr M., Doeppner T.R. Lithium beyond psychiatric indications: the reincarnation of a new old drug. Neural Regen Res. 2021; 16(12): 2383-7. https://doi.org/10.4103/1673-5374.313015.
- Vetlugina T.P., Epimakhova E.V., Savochkina D.N., Plotnikov E.V., Prokop'eva V.D., Losenkov I.S. Deistvie solei litiya na limfotsity patsientov s addiktivnymi i depressivnymi rasstroistvami v opytakh invitro. Sibirskii vestnik psikhiatrii i narkologii. 2019; 4(105): 5-11. https://doi.org/10.26617/1810-3111-2019-4(105)-5-11.
- Plotnikov E.V., Litvak M.M. Primenenie askorbata litiya v kachestve tserebroprotektornogo sredstva na modeli ishemicheskogo insul'ta. Zhurnal nevrologii i psikhiatrii im. S.S. Korsakova. Spetsvypusk «Insul't». 2020; 3(2): 29-32. https://doi.org/10.17116/jnevro202012003229.
- Forlenza O.V., De-Paula V.J., Diniz B.S. Neuroprotective effects of lithium: implications for the treatment of Alzheimer’s disease and related neurodegenerative disorders. ACS Chem Neurosci. 2014; 5(6): 443-50. https://doi.org/10.1021/cn5000309.
- Greenberg D.B., Younger J., Kaufman S.D. Management of lithium in patients with cancer. Psychosomatics. 1993; 34(5): 388-94. https://doi.org/10.1016/s0033-3182(93)71841-1.
- Ferensztajn-Rochowiak E., Rybakowski J.K. The effect of lithium on hematopoietic, mesenchymal and neural stem cells. Pharmacol Rep. 2016; 68(2): 224-30. https://doi.org/10.1016/j.pharep.2015.09.005.
- Liu J., Bi K., Yang R., Li H., Nikitaki Z., Chang L. Role of DNA damage and repair in radiation cancer therapy: a current update and a look to the future. Int J Radiat Biol. 2020; 96(11): 1329-38. https://doi.org/10.1080/09553002.2020.1807641.
- Zhao L., Bao C., Shang Y., He X., Ma C., Lei X., Mi D., Sun Y. The Determinant of DNA Repair Pathway Choices in Ionising Radiation-Induced DNA Double-Strand Breaks. Biomed Res Int. 2020. https://doi.org/10.1155/2020/4834965. 26. Liu L., Liang Z., Ma S., Li L., Liu X. Radioprotective countermeasures for radiation injury (Review). Molecular Medicine Reports. 2023; 27(3): 66. https://doi.org/10.3892/mmr.2023.12953.
- Schaue D., McBride W.H. Opportunities and challenges of radiotherapy for treating cancer. Nat Rev Clin Oncol. 2015; 12(9): 527-40. https://doi.org/10.1038/nrclinonc.2015.120.
- Thoms J., Bristow R.G. DNA repair targeting and radiotherapy: a focus on the therapeutic ratio. Semin Radiat Oncol. 2010; 20(4): 217-22. https://doi.org/10.1016/j.semradonc.2010.06.003.
- Daguenet E., Khalifa J., Tolédano A., Borchiellini D., Pointreau Y., Rodriguez-Lafrasse C., Chargari C., Magné N. To exploit the 5 ‘R’ of radiobiology and unleash the 3 ‘E’ of immunoediting: ‘RE’-inventing the radiotherapy-immunotherapy combination. Ther Adv Med Oncol. 2020; 12. https://doi.org/10.1177/1758835920913445.
- Kargiotis O., Geka A., Rao J.S., Kyritsis A.P. Effects of irradiation on tumor cell survival, invasion and angiogenesis. J Neurooncol. 2010; 100(3): 323-38. https://doi.org/10.1007/s11060-010-0199-4.


