Экспериментальное исследование синтетических полимерных материалов как основы в создании перспективных матриц-носителей для культивирования лимбальных стволовых клеток
Автор: Карпович В.В., Куликов А.Н., Чурашов С.В., Черныш В.Ф., Григорьев С.Г., Блинова М.И., Нащекина Ю.А., Александрова О.И., Хорольская Ю.И., Никонов П.О., Цобкалло Е.С., Москалюк О.А., Мельников А.С., Сердобинцев П.Ю., Машель Т.В., Писугина Г.А., Переплетчикова Д.А., Хороших Д.А.
Журнал: Саратовский научно-медицинский журнал @ssmj
Рубрика: Глазные болезни
Статья в выпуске: 2 т.15, 2019 года.
Бесплатный доступ
Цель: изучить в эксперименте свойства трех различных видов синтетических полиэфирных матриц, провести их сравнительную оценку и определить оптимальную в качестве носителя для культивирования и трансплантации лимбальных стволовых клеток при устранении лимбальной недостаточности. Материал и методы. Проводилась оценка прозрачности, механических свойств (прочность, относительное удлинение при разрыве, модуль жесткости), биосовместимости с клеточными культурами роговицы, а также изучались сроки биодеградации матриц в условиях in vivo. Результаты. В ходе исследования изучены оптические имеханические свойства матриц, изготовленных из полилактид-гликолида (ПЛГ), полилактид-капролактона (ПЛК) и поли-Е-капролактона (ПКЛ). Экспериментально показано, что лимбальные стволовые клетки человека и кролика, а также клетки эпителия роговицы человека адгезировали на поверхности всех типов исследуемых матриц, в процессе культивирования сохраняли типичное строение актинового цитоскелета, способность к пролиферации и миграции. Выявлены различия во взаимодействии разных клеточных культур с различными типами носителей. Сроки биодеградации матриц из ПЛК толщиной 5 мкм составили около 30 суток. Заключение. Полученные результаты указывают на возможность использования матриц из ПЛК толщиной 5 мкм в качестве носителя культивируемых лимбальных стволовых клеток.
Биосовместимость, лимбальные стволовые клетки, механические свойства, прозрачность, синтетические полимеры
Короткий адрес: https://sciup.org/149135332
IDR: 149135332 | УДК: 617.7-001.17-089.844:616-77:576.534
Текст научной статьи Экспериментальное исследование синтетических полимерных материалов как основы в создании перспективных матриц-носителей для культивирования лимбальных стволовых клеток
1 Введение. Заболевания и повреждения роговицы составляют около 25% всей глазной патологии. По данным Всемирной организации здравоохранения, в структуре глазной заболеваемости такие патологические состояния занимают четвертое место (5%), уступая лишь катаракте (47%), глаукоме (12%) и возрастной макулярной дегенерации (9%) [1, 2]. Наиболее распространенными из них являются язвы и помутнения роговицы после перенесенной инфекционной патологии, травм или ожогов, а также ксерофтальмия в детском возрасте [3].
Слепых и слабовидящих в Российской Федерации, зарегистрированных Всероссийским обществом слепых в 2003 г., насчитывалось 224 тыс. человек, а уровень слепоты и слабовидения составил 15,2 случая на 10 тыс. населения [4]. Значительная доля в этой статистике приходится на патологию роговицы, удельный вес которой составляет от 10 до 50% [5, 6].
Основным методом хирургического лечения такой патологии роговицы в настоящее время является сквозная кератопластика [7, 8]. Однако выполнение пересадки роговицы при наличии тотального сосудистого бельма практически всегда обречено на неудачу в связи с неизбежным его рецидивированием [7, 9].
Одной из главных причин сосудистых помутнений роговицы является дисфункция лимбальных стволовых клеток (ЛСК), клинически проявляющаяся состоянием, получившим название лимбальной недостаточности [9, 10]. В настоящее время в качестве одного из способов устранения лимбальной недостаточности исследуется возможность трансплантации на роговицу культивируемых in vitro ЛСК [11]. Наиболее распространенным в мире носителем для культивирования ЛСК является амниотическая мембрана (АМ) [11, 12]. В то же время дефицит этого материала, наличие определенных трудностей при заготовке, консервировании и использовании АМ для указанных целей обусловливают необходимость поиска новых видов матриц-носителей, изготавливаемых из биологических или синтетических материалов.
Цель: изучить в эксперименте свойства трех различных видов синтетических полиэфирных матриц, провести их сравнительную оценку и определить оптимальную в качестве носителя для культивирования и трансплантации ЛСК при устранении лимбаль-ной недостаточности.
Материал и методы. Для приготовления матриц использовали поли-L-лактид-гликолид (85/15) (ПЛГ) (h=3,1 дл/г, Purac), поли-L-лактид-капролактон (85/15) (ПЛК) (h=1,6 дл/г, Purac), поли-Е-капролактон) (ПКЛ) (Mn 80000, Sigma). Материалы ПЛГ и ПЛК имели степень чистоты Medical Grade. Материал ПКЛ степени чистоты не имел. Полимеры растворяли в трихлорметане (Реактив, Россия) до конечной концентрации в 2 мг/мл и наносили их на предметные стекла. После испарения растворителя на воздухе сушили матрицы при температуре 37°С до полного удаления растворителя. Толщина образцов каждой из исследуемых синтетических матриц составляла 5, 10, 15 и 30 мкм.
Для исследования прозрачности синтетических матриц определяли величину диффузного рассеяния света при прохождении через исследуемый материал. Для определения диффузного рассеяния света в матрицах использовали гелий-неоновый лазер DH-HN150 (Beijing, China) с длиной волны 632,8 нм, измеритель профиля пучка BC106N (Thorlabs, США) и линзы с фокусным расстоянием 50 и 75 мм. Величину рассеяния света при прохождении через матрицы рассчитывали из соотношения l= a/b , где a — интенсивность света, прошедшего сквозь объект, внутри телесного угла 2,5° (±1,25°); b — полная интенсивность света, прошедшего сквозь объект.
Исследовали матрицы толщиной 5, 10, 15 и 30 мкм. Для каждой матрицы определение величины диффузного рассеяния света при прохождении через исследуемый материал выполняли в пяти различных точках. В качестве контроля выполнялось исследование кварцевого стекла (стекло КУ-1 кварцевое оптическое). Обработка полученных результатов проводилась с использованием программного обеспечения Origin и Fiji.
Исследование механических свойств синтетических матриц и АМ осуществляли на универсальной установке INSTRON 1122 (Instron, США) в режиме одноосного растяжения. Скорость испытаний составляла 10мм/мин. Исследовали матрицы толщиной 5, 10 и 15 мкм. В процессе испытаний записывали диаграммы растяжения материалов, т. е. зависимости σ (ε), на основе которых определялись следующие величины: прочность (σр, МПа); относительное удлинение при разрыве (εр, %), характеризующее эластичность материала; модуль жесткости (Е, МПа).
Для оценки биосовместимости матриц из ПЛГ, ПЛК, ПКЛ использовали иммортализованную линию клеток эпителия роговицы человека HCE, а также первичные культуры лимбальных стволовых клеток (ЛСК) человека и кролика. ЛСК были выделены в Институте цитологии РАН (Санкт-Петербург) из фраг- ментов лимба кадаверных глаз человека и цельных энуклиированных глаз здоровых кроликов породы шиншилла по методике F. Sefat с соавт. [13].
Все типы клеток культивировали при 37°С в СО 2 -инкубаторе в атмосфере 5% СО 2 . ЛСК человека и кролика культивировали в питательной среде ДМЕМ/F12 (Gibco, США), содержащей 10% FBS (Hy Clone, США) и 1 %-й раствор антибиотиков Pen Strep (Gibco, США). Клетки линии HCE культивировали в питательной среде Keratinocyte-SFM (Gibco, США), содержащей 10% FBS (Hy Clone, США) и 1 %-й раствор антибиотиков Pen Strep (Gibco, США). ЛСК человека и кролика высевали на поверхность матриц в концентрации 2x10 4 клеток/см2, а клетки НСЕ — в концентрации 5x10 4 клеток/см2. Подсчет клеток производился на оборудовании TC-20 фирмы Bio-Rad (США). В качестве контроля использовали клетки, культивируемые в стандартных условиях без полимерных синтетических матриц. Проведено 3 серии независимых экспериментов с последующей оценкой полученных результатов с использованием нижеуказанных методик.
Жизнеспособность и способность клеток к адгезии оценивали по их морфологии с использованием метода фазово-контрастной микроскопии при помощи инвертированного микроскопа Nikon Eclipse TS100. Метод прижизненного наблюдения под инвертированным микроскопом с фотофиксацией позволяет визуально оценить морфологическое состояние клеток в процессе их культивирования в экспериментальных условиях и сравнить с контрольным вариантом.
Пролиферативную активность оценивали методом колориметрического теста с генциановым фиолетовым. Клетки высевали на поверхность матриц и культивировали в стандартных условиях в течение трех суток. По истечении срока культивирования клетки на поверхности матриц или на дне культурального флакона фиксировали 70%-м раствором этанола и проводили окраску 0,2%-м раствором генцианового фиолетового в течение 10 минут с последующей отмывкой дистиллированной водой. Краситель экстрагировали 7%-м раствором уксусной кислоты. Оптическую плотность полученных растворов измеряли с помощью анализатора Fluorofot «Charity» (Россия).
Анализ организации актинового цитоскелета распластанных на матрицах клеток проводили с помощью системы флуоресцентной визуализации клеток ZOE™ фирмы Bio-Rad (США). Для визуализации актиновых микрофиламентов проводили гистохимическое окрашивание родамин-фаллоиди-ном (Invitrogen, США) композиций клеточных культур и матриц, фиксированных в 4%-м растворе параформальдегида. Перед окрашиванием проводили пермеабилизацию клеток с использованием 0,1%-го раствора тритона Х100. Препараты заключали в среду, содержащую флуоресцентный краситель 4',6-diamidino-2-phenylindole (DAPI) фирмы Santa Cruz Biotechnology (США).
Исследование сроков биодеградации (в днях) матриц из ПЛГ, ПЛК и ПКЛ выполняли на 18 кроликах (36 глаз). В I группе (6 кроликов — 12 глаз) выполняли подшивание на поверхность роговицы матриц из ПЛГ, различных по толщине: 5 мкм — 4 глаза, 10
мкм — 4 глаза, 15 мкм — 4 глаза. Во II и III группах (по 6 кроликов — 12 глаз) — аналогичные матрицы из ПЛК и ПКЛ. Консервативное лечение проводили в объеме: инстилляции декса-гентамицина 3 раза в день (до 21 сут.). Сроки наблюдения составили 3, 10, 21, 30 суток. Выполнялась биомикроскопия глаз в каждой группе исследования на щелевой лампе Haag-Streit BD900 (Швейцария) с фотографированием процесса биодеградации матриц в динамике. Работу с животными осуществляли в соответствии с требованиями нормативных и руководящих документов (Хельсинкская декларация 1975, 1983 гг.). На реализацию эксперимента получено разрешение Комитета по вопросам этики при Военно-медицинской академии им. С. М. Кирова (протокол № 215 от 5 ноября 2018 г.).
Оценка статистической значимости различий между изучаемыми показателями в экспериментальных группах, распределение которых соответствовало нормальному или близкому к нему закону распределения, проводилась с помощью дисперсионного анализа (ANOVA) и построения на его основе 95%-х доверительных интервалов. Оценка значимости различия признаков с законом распределения, отличным от нормального, проведена с помощью непараметрической альтернативы одномерному дисперсионному анализу — медианного критерия Кра-скела — Уоллиса.
Результаты. По результатам исследования прозрачность матриц из ПЛГ и ПЛК различной толщины приближалась к 100%, однако с учетом погрешности метода исследования составила не менее 98-99%. Статистически достоверных отличий прозрачности матриц из ПЛГ и ПЛК по сравнению с контролем не выявлено (p>0,05) (рис. 1).
В ходе исследования матриц из ПКЛ обнаружено, что степень их прозрачности заметно снижалась в зависимости от толщины материала (p<0,001), за исключением матриц толщиной 10 и 15 мкм, где не выявлено достоверных отличий (p>0,05) (см. рис. 1). Для этих матриц толщиной 5, 10, 15 и 30 мкм показатели прозрачности составили 80±7, 43±5, 41±5 и 19±3% соответственно.
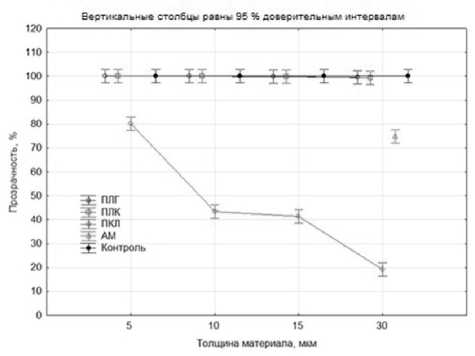
Рис. 1. Результаты дисперсионного анализа полученных показателей прозрачности матриц из поли (лактидгликолида) (ПЛГ), поли (лактидкапролактона) (ПЛК), поли-Е-капролактона (ПКЛ), а также амниотической мемраны.
Контроль — кварцевое стекло КУ-1
Основные механические характеристики исследуемых синтетических матриц и амниотической мембраны
|
Образец |
Прочность σр, МПа |
Относительное удлинение при разрыве εр, % |
Модуль жесткости E, МПа |
|
ПЛК 5 мкм |
27±5 |
3,5±1,0 |
1652±300 |
|
ПЛК 10 мкм |
29±3 |
4,3±2,0 |
2190±220 |
|
ПЛК 15 мкм |
33±5 |
4,7±0,8 |
2186±575 |
|
ПЛГ 5 мкм |
40±9 |
3,2±0,6 |
2275±550 |
|
ПЛГ 10 мкм |
50±6 |
3,2±1,2 |
2730±230 |
|
ПЛГ 15 мкм |
51±4 |
3,6±1,0 |
2578±330 |
|
ПКЛ 5 мкм |
13±3 |
45,0±29,0 |
309±67 |
|
ПКЛ 10 мкм |
9±2 |
30,0±9,0 |
349±54 |
|
ПКЛ 15 мкм |
14±1 |
71,0±38,0 |
349±40 |
|
АМ |
0,8±0,2 |
50,0±11,0 |
0,19±0,07 |
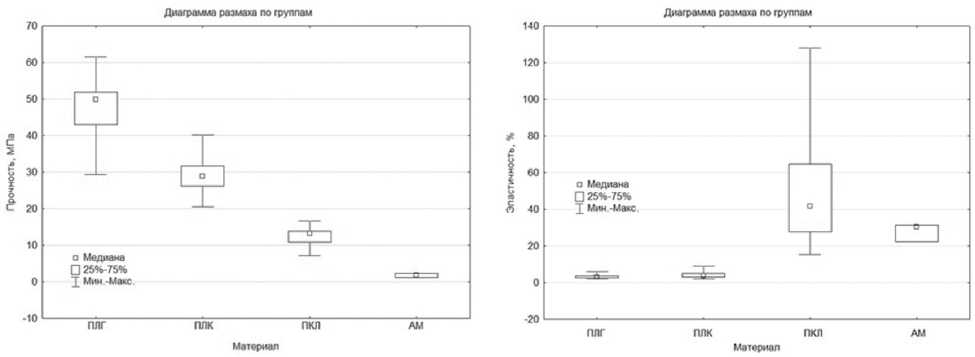
Рис. 2. Результаты непараметрического анализа по Кра-скелу — Уоллису прочности матриц из поли (лактидгликолида) (ПЛГ), поли (лактидкапролактона) (ПЛК), поли-Е-капролактона (ПКЛ), а также амниотической мембраны
Рис. 3. Результаты непараметрического анализа по Кра-скелу — Уоллису эластичности матриц из поли (лактидгликолида) (ПЛГ), поли (лактидкапролактона) (ПЛК), поли-Е-капролактона (ПКЛ), а также амниотической мембраны
Результаты проведенных исследований механических свойств матриц из ПЛГ, ПЛК и ПКЛ различной толщины, а также АМ представлены в таблице.
В ходе анализа полученных данных отмечено, что матрицы из ПЛГ имели достаточно высокую прочность (до 51±4 МПа при толщине 15 мкм), но низкую эластичность (до 3,6±1 % при толщине 15 мкм) и чрезмерно высокую жесткость (2578±330 МПа при толщине 15 мкм).
Матрицы из ПЛК имели меньшую прочность (до 33±5 МПа при толщине 15 мкм), чем матрицы из ПЛГ, однако более высокую эластичность (до 4,7±0,8% при толщине 15 мкм) и низкую жескость (2186±575 МПа при толщине 15 мкм).
Матрицы из ПКЛ имели более низкие показатели прочности (до 14±1 МПа при толщине 15 мкм), однако более высокую эластичность (до 71±38% при толщине 15 мкм) и меньшую жесткость (349±40 МПа при толщине 15 мкм) в сравнении с матрицами из ПЛК и ПЛГ.
АМ имела самые низкие из всех исследуемых материалов показатели прочности (0,8±0,2 МПа) и жесткости (0,19±0,07 МПа), но достаточно высокие показатели эластичности (50±11 %).
Результаты статистического анализа полученных данных представлены на рис. 2–4.
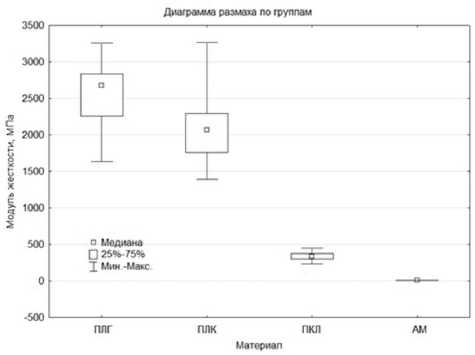
Рис. 4. Результаты непараметрического анализа по Краске-лу — Уоллису модуля жесткости матриц из поли (лактидгликолида) (ПЛГ), поли (лактидкапролактона) (ПЛК), поли-Е-капролактона (ПКЛ), а также амниотической мембраны
В экспериментах in vitro показано, что ЛСК человека и кролика, а также клетки НСЕ адгезируют на поверхности всех типов исследуемых синтетических полимерных матриц и в процессе культивирования сохраняют типичное строение актинового ци-
Контроль плк плг пкл

Рис. 5. Культивирование ЛСК кролика ( A-D ); ЛСК человека ( E-H ); клеток линии HCE ( I–L ) на поверхности матриц на основе ПЛК, ПЛГ и ПКЛ и культуральном пластике (контроль). Морфология ЛСК (кролика и человека) и клеток линии HCE человека на 2-е сутки. Масштабная линейка 200 мкм

|
Контроль |
ПКЛ |
мм. 190 мам |
|
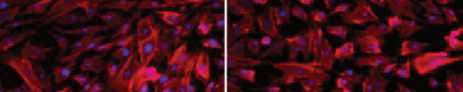
ПЛГ I 1ПЛК
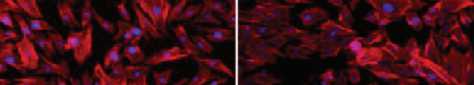
Рис. 6. ЛСК кролика, распластанные на культуральном пластике (контроль) ( A ), синтетических матрицах из ПКЛ ( В ), ПЛГ ( С ) и ПЛК ( D ). Актиновый цитоскелет окрашен родамин-фаллоидином (красный), ядра — DAPI (синий). Масштабная линейка 100 мкм
тоскелета, способность к пролиферации и миграции. Но выявлены различия во взаимодействии разных клеточных культур с различными типами матриц.
Результаты прижизненного наблюдения за морфологическим состоянием ЛСК (человека и кролика) и клеток линии HCE в процессе их культивирования на синтетических полиэфирных матрицах из ПЛГ, ПЛК и ПКЛ приведены на рис. 5.
ЛСК и клетки линии НСЕ в контрольном варианте хорошо распластаны, имеют типичную морфологию и на 2-е сутки культивирования формируют субкон-флюентный монослой (см. рис. 5: A, E, I ). Морфология ЛСК кролика, культивируемых на всех исследуемых типах матриц, не отличалась от контроля, однако плотность клеток была несколько меньше. ЛСК человека и HCE при культивировании на матрицах из ПЛК и ПКЛ не образовывали субконфлюент-ного монослоя на 2-е сутки и группировались на различных участках матриц. По поверхности матриц из ПЛГ лимбальные стволовые клетки и HCE распределялись равномерно, однако их плотность была несколько меньше, чем в контроле.
С помощью колориметрического теста с генци-ановым фиолетовым выявлено, что в контроле независимо от клеточного типа наблюдалась более активная пролиферация всех типов клеток (p<0,001). Однако при культивировании на матрицах клетки сохраняли способность к делению. На 2-е сутки культивирования на матрицах было достаточное количество жизнеспособных клеток для поддержания популяции. Для ЛСК кролика и клеток НСЕ количество клеток на всех типах матриц было примерно одинаковым (p>0,05). Однако для ЛСК человека наиболее предпочтительной оказалась матрица из ПЛГ.
В ходе анализа организации актинового цитоскелета ЛСК кролика, распластанных на матрицах (рис. 6), показано, что клетки на всех экспериментальных образцах были хорошо распластаны, имели характерную для данного типа форму и размер. Актин в основном сосредоточен в пучках филаментов. Межклеточные контакты практически отсутствовали как в контроле, так и в экспериментальных вариантах. Во всех случаях наблюдали митотическую активность.
Для оценки скорости миграции ЛСК с поверхности матрицы использовали коллагеновый гидро- гель. In vitro показано, что ЛСК человека начинают мигрировать с поверхности матриц на прилегающий коллагеновый гидрогель в течение 24 часов. Однако скорость миграции была достаточно низкой, наибольшая миграционная активность наблюдалась в области контакта края матрицы и коллагенового геля. Выявлено, что клетки мигрируют не только на поверхность гидрогеля, но и в его толщу. К концу 4-й недели культивирования наблюдается большое количество клеток на поверхности и в толще гидрогеля, а также на поверхности матрицы. Скорость и активность миграции ЛСК с матриц разных типов была сопоставима с контролем.
В результате наблюдения биодеградации матриц на основе ПЛГ на 3-и сутки ни в одном случае признаков деградации материала не выявлено. На 10-е сутки отмечали истончение краев матриц в области наложения швов только на образцах толщиной 5 мкм. На 21-е сутки на матрицах толщиной 5 мкм появлялись отдельные участки деструкции материала, а на матрицах толщиной 10 мкм — дефекты материала в области швов; на матрицах 15 мкм никаких изменений целостности материала не было. На 30-е сутки отмечался полный дефект материла в оптической зоне матриц толщиной 5 мкм. На матрицах толщиной 10 мкм появлялись отдельные участки деградации. Матрицы в 15 мкм претерпевали лишь начальные изменения целостности в области наложения швов.
На 3-и сутки появлялись первые признаки деградации матриц на основе ПЛК лишь имеющих толщину 5 мкм. На 10-е сутки на матрицах толщиной 5 мкм появлялись участки деструкции; начальные признаки деградации материала в области швов отмечались на образцах в 10 мкм. На 21-е сутки наблюдалась практически полная деструкция матриц толщиной 5 мкм. На матрицах толщиной 10 и 15 мкм отмечалось появление областей деструкции и признаков начальной деградации соответственно. На 30-е сутки образцы толщиной 5 мкм полностью деградировали. Образцы матриц толщиной 10 мкм деградировали более чем на 50%. Образцы толщиной 15 мкм имели изменения в виде островковых областей деструкции.
В результате наблюдения биодеградации матриц на основе ПКЛ на 3-и, 10-е и 21-е сутки ни в одной подгруппе признаков деградации материала не выявлено. На 30-е сутки отмечали появление истончение краев матриц в области наложения швов только на образцах толщиной 5 мкм.
Обсуждение. Одним из важных оптических свойств материала, используемого в качестве носителя для трансплантации на роговицу ЛСК, является его высокая прозрачность. Данное свойство позволяет, во-первых, улучшить визуализацию при наблюдении за процессами культивирования клеток на поверхности носителя в условиях in vitro. Во-вторых, повышенная прозрачность делает возможным проведение более детальной оценки состояния глазной поверхности после трансплантации на нее носителя с ЛСК с целью оценки наличия воспалительных изменений, прозрачности роговицы и степени ее васкуляризации [14].
По результатам проведенных исследований прозрачности наиболее приемлемыми матрицами по этому критерию для использования в качестве носителей являются матрицы из синтетических материалов ПЛГ и ПЛК.
По своим механическим свойствам АМ является вполне пригодным материалом для использования в офтальмохирургической практике. Наиболее приближенными к АМ показателями прочности, эластичности и жесткости по результатам проведенных нами исследований обладали матрицы из ПКЛ и ПЛК толщиной 5–15 мкм.
При сравнении механических свойств матриц из ПЛГ и ПЛК наиболее приближенные к показателям АМ имела матрица из ПЛК.
Оценка биосовместимости синтетических полимерных матриц ЛСК и HCE в условиях in vitro с использованием клеточных тест-систем показала, что на поверхности матриц возможно поддержание клеточных культур в условиях in vitro. Клетки сохраняют типичную морфологию и хорошо распластываются. Однако адгезия и пролиферация как ЛСК, так и HCE на поверхности матриц была ниже, чем в контроле. По результатам исследования in vitro нельзя однозначно установить матрицу, наиболее подходящую по необходимым критериям для культивирования клеток тканей глаза. ЛСК кролика адгезируют, пролиферируют и мигрируют на всех вариантах матриц сопоставимо друг с другом. Для ЛСК и эпителиальных клеток роговицы человека наиболее предпочтительной оказалась все-таки матрица из ПЛГ, так как распределение клеток на ней было более равномерным, хотя результаты колориметрического анализа показывают, что на количестве клеток, культивируемых на разных типах матриц, это практически не отражается.
Кроме того, матрицы, заселенные клетками, способны выступать в качестве «транзитного средства» и могут обеспечить доставку клеток в поврежденную область при трансплантации на раневую поверхность. Модель с использованием коллагеновых гидрогелей позволяет in vitro предположить, что для обеспечения поврежденной области достаточным количеством клеток требуется не менее 3–4 недель. Однако модель in vitro не полностью соответствует условиям, в которых оказываются клетки после трансплантации, и для определения более точных сроков необходимо провести дальнейшие исследования с использованием моделей in vivo.
При сравнении сроков биодеградации выявлено, что матрицы из ПЛК (5 мкм) начинали заметно деградировать уже на 10-е сутки, тогда как на образцах матриц из ПЛГ (5 мкм) достоверные признаки деградации наблюдались значительно позже (21-е сутки). Первые признаки деградации матриц из ПКЛ отмечали на 30-е сутки и только в подгруппе с толщиной материла 5 мкм. Полная биодеградация матриц из ПЛК с толщиной 5 мкм занимала не более 30 суток. Следовательно, скорость биодеградации матриц из ПЛК протекает быстрее, чем из ПЛГ, и по своим срокам сопоставима со сроками лизирования АМ на поверхности роговицы [15].
Заключение. На основе исследования прозрачности, механических свойств, биосовместимости и сроков биодеградации определена как наиболее отвечающая предъявляемым требованиям, а по прочности превосходящая и амниотическую мембрану, матрица-носитель лимбальных стволовых клеток из поли (лактидкапролактона) толщиной 5 мкм. При планировании экспериментальной операции лимбальной трансплантации в качестве носителя культивированных лимбальных стволовых клеток может быть использован данный вариант носителя.
Список литературы Экспериментальное исследование синтетических полимерных материалов как основы в создании перспективных матриц-носителей для культивирования лимбальных стволовых клеток
- Global initiative for the elimination of avoidable blindness. Geneva: World Health Organization, 1997; p. 48
- Pascolini D. Global estimates of visual impairment: 2010 Br J Ophthalmol 2012; 96 (5): 614-8
- Lim AS. Mass blindness has shifted from infection (onchocerciasis, trachoma, corneal ulcers) to cataract. Ophthalmologica 1997; 211 (4): 270 p.
- Либман Е. С., Шахова Е. В. Слепота и инвалидность по зрению в населении России. В сб.: VIII Съезд офтальмологов России: тезисы докладов. М., 2005; с. 78-9
- Каспаров А. А. Лечение важнейших заболеваний роговицы. В сб.: Материалы VIII съезда офтальмологов России. М., 2005; c. 450-1
- Майчук Ю. Ф. Основные тенденции в эпидемиологии и терапии глазных инфекций. Тезисы VIII съезда офтальмологов России. M., 2005; c. 92-3
- Слонимский А. Ю. Возможности сквозной пересадки роговицы при различной патологии переднего отрезка глаза. Клиническая офтальмология 2001; (3): 102-5
- Reinhard Т. Corneal Disease: Recent Developments in Diagnosis and Therapy. Springer-Verlag-Berlin, Heidelberg, 2013; 121 p.
- Черныш В. Ф., Бойко Э. В., Ожоги глаз: состояние проблемы и новые подходы. М.: ГЭОТАР-Медиа, 2017; 184 c.
- Holland EJ, Schwartz GS. The evolution of epithelial transplantation for severe ocular surface disease and a proposed classifcation system. Cornea 1996; 15: 549-56
- Grueterich M, Espana EM, Tseng SC. Ex vivo expansion of limbal epithelial stem cells: amniotic membrane serving as a stem cell niche. Surv Ophthalmol 2003; 4 (6): 631-46
- Pellegrini G, Traverso CE, Franzi AT, et al. Long-term restoration of damaged corneal surfaces with autologous cultivated corneal epithelium. Lancet 1997; 349 (9057): 990-3
- Sefat F, et al. Production, Sterilization and Storage of Biodegradable Electrospun PLGA Membranes for Delivery of Limbal Stem Cells of the Cornea. Procedia Engineering 2013; 59: 101-16
- Куликов А. Н., Чурашов С. В., Черныш В. Ф. и др. Современные подходы к проблеме выбора носителя для культивирования стволовых клеток роговицы в лечении лимбальной недостаточности. Офтальмологические ведомости 2018; 11 (2): 48-56
- Нероев В. В., Гундорова Р. А., Макаров П. В. Ожоги глаз: руководство для врачей. М.:ГЭОТАР-Медиа, 2013; 224 с.


