Экспериментальное изучение распределения температуры в длинных трубчатых костях при периоссальном расположении нагревателей
Автор: Пахмурин Д.О., Пахмурина В.В., Анисеня И.И., Ситников П.К.
Журнал: Сибирский онкологический журнал @siboncoj
Рубрика: Лабораторные и экспериментальные исследования
Статья в выпуске: 2 т.22, 2023 года.
Бесплатный доступ
Цель исследования - изучить динамику изменения температуры снаружи и внутри длинных трубчатых костей животных под воздействием разных температурных режимов в течение заданного времени. материал и методы. Эксперименты проводились с использованием свежезамороженных длинных трубчатых костей свиней. Нагрев осуществлялся с помощью поверхностных нагревателей, температура которых определялась выбранным режимом, в течение 1 ч; фиксация температурных значений проводилась ежеминутно. Экспериментальное исследование было построено на изучении четырех температурных режимов: трех с постоянной температурой (РПН) нагревателя (60, 70, 80 °C) и режима максимального нагрева (РМН), при котором специального ограничения температуры не устанавливалось, поэтому нагрев осуществлялся до 120 °C. Результаты. Происходящие процессы можно описать следующим образом: в первые 10 мин нагрева происходит быстрый подъем температуры, при этом темпы прироста температуры на наружной поверхности опережают темпы прироста температуры внутри костномозгового канала, что приводит к формированию значительной температурной разницы. Далее наблюдается замедление темпов прироста температуры, что приводит к постепенному сближе-нию температурных значений внутри и снаружи кости с последующей стабилизацией температуры на устойчивом уровне (плато), который различен для исследуемых областей. В этот период температурная разница составляет 3,5-6 °C и сохраняется на данном уровне до конца исследования. При РПН 60/70/80 °C стабилизация температуры происходит на уровне 55/61/70 °C в центре костномозгового канала и на уровне 58/67/75 °C под нагревателем соответственно. Период до выхода на температуру стабилизации составляет 30-40 мин. Также необходимо отметить, что устойчивые уровни температуры как внутри, так и снаружи кости были ниже уровня стабилизации температуры нагревателя. Следовательно, чтобы достичь планируемой температуры в центре кости, к ее наружной поверхности необходимо приложить большую температуру, т.е. формируется нисходящий температурный градиент: температура стабилизации нагревателя - температура на наружной поверхности - температура внутри костномозгового канала. Увеличение температуры воздействия позволяет сократить период нагрева, но способствует увеличению температурной разницы в период нагрева (до 25 °C на 5-й мин нагрева при использовании режима максимального нагрева). заключение. Для того, чтобы обеспечить выход на необходимую температуру (60 °С) в течение короткого времени (15-20 мин) при сохранении оптимальных температурных параметров, было предложено разработать режимы с переменной температурой, которые сочетали бы в себе первоначальное использование режима максимального нагрева до момента достижения заданной температуры в костномозговой полости с последующим переключением на режим с постоянной температурой, позволяющий поддерживать достигнутый температурный уровень во время лечебного воздействия.
Термоабляция, опухоли костей, онкоортопедия, остеосаркома, лечение опухоли
Короткий адрес: https://sciup.org/140300167
IDR: 140300167 | УДК: 616.71-006-08 | DOI: 10.21294/1814-4861-2023-22-2-65-75
Текст научной статьи Экспериментальное изучение распределения температуры в длинных трубчатых костях при периоссальном расположении нагревателей
В современной онкоортопедии применяются разные подходы в радикальном лечении костных опухолей. Как правило, пораженный сегмент удаляется полностью, а дефект восполняют имплантами. Применяется и метод реплантации удаленной кости после ее экстракорпоральной высокотемпературной обработки [1]. Дискуссионным аспектом является уровень температуры, необходимый для полной девитализации опухолевых клеток при проведении стерилизации. В литературных источ- никах приводятся исследования, где используются такие методы воздействия, как автоклавирование и пастеризация. К.M.J. Khattak et al. и K.L Pan et al. использовали режим автоклавирования при 120 °C в течение 10 мин [2, 3]; M. Umer et al. также применяли автоклавирование, но в режиме 130 °C в течение 8 мин [4]. Об использовании пастеризации в качестве метода стерилизации сообщают J. Manabe et al. [5]. Пастеризация костного аутотрансплантата осуществлялась в режиме 60 °C в течение 30 мин. Во всех перечисленных работах примененный уровень температуры оценивается как достаточный для стерилизации извлеченных опухолевых фрагментов кости.
Необходимо отметить, что, хотя результаты вышеописанного метода оцениваются как удовлетворительные по таким показателям, как частота локальных рецидивов, послеоперационные осложнения, достигнутые функциональные результаты, существует и недостаток, а именно – развитие такого осложнения, как несращения вследствие нарушения анатомической целостности кости, рассасывание реплантата. В связи с этим в НИИ онкологии Томского НИМЦ разработана принципиально новая методика, при которой гипертермическое воздействие на костную ткань осуществляется без резекции и извлечения костного фрагмента [6]. Проведение интраоперационной термоабляции предполагается в области диафизарных фрагментов длинных трубчатых костей. Сначала выделяется в едином блоке кость с опухолью в пределах радикальных границ, затем этот массив охватывается специальными гибкими нагревателями, после чего осуществляется нагрев в заданном температурном режиме. Тепло распределяется по направлению от периферии к центру со всех сторон, что позволяет прогреть всю толщу кости. Таким образом, достигается решение сразу нескольких проблем – опухоль радикально девитализируется в необходимом объеме, не нужна реконструкция дефекта кости, нет необходимости обязательного выполнения металоостеосинтеза, т. к. предложенная методика позволяет сохранить целостность кости.
Реализация методики осуществляется посредством комплекса локальной гипертермии «Феникс-2», созданного на базе ТУСУР. Также в работе был задействован прибор Termo-MAX (ООО «Фаэтон», г. Томск). Принцип работы данных приборов построен на использовании постоянного тока в нагревательных элементах, за счет которого осуществляется повышение температуры в нагревателях до уровня, заданного оператором. Поддержание данного уровня осуществляется по принципу обратной связи. При этом воздействие на самого пациента осуществляется только тепловыми полями от нагревателя, плотно охватывающего участок кости. Для защиты мягких тканей используется теплоизолирующий материал [7–10]. Приборы способны поддерживать широкий диапазон температуры, за счет чего возможно моделирование разнообразных режимов температурного воздействия. Тем не менее вопрос выбора наиболее оптимального режима термоабляции костей остается открытым.
Цель исследования – изучение динамики изменения температуры снаружи и внутри длинных трубчатых костей животных под воздействием разных температурных режимов в течение заданного времени.
Материал и методы
Эксперименты проводились с использованием свежезамороженных длинных трубчатых костей свиней. Перед проведением эксперимента кость оттаивали при комнатной температуре в течение 10 ч, очищали от остатков мягких тканей, измеряли ее окружность в диафизарной области и взвешивали.
Эксперимент проводился в соответствии с оригинальной методикой, т. е. выделенная кость охватывалась гибким нагревателем, поверх которого накладывали теплоизолирующую прокладку. Для отслеживания динамики температурных изменений использовались два температурных датчика Pt-100 – один снаружи под нагревателем (его размещали так, чтобы он находился по центру нагревателя), другой – внутри костномозговой полости. Чтобы добиться центрального расположения датчика в костномозговой полости, кость с одной стороны отпиливали, в открывшийся костномозговой канал помещали теплоизоляционный материал толщиной 2 мм. В центре проделывали отверстие, через которое вводили датчик температуры. Глубина введения температурного датчика составляла 2,5 см от края нагревателя (при ширине нагревателя 5 см). Таким образом, точка измерения температуры находилась в проекции центра нагревателя.
Предложенная методика проведения высокотемпературного воздействия предполагает, что нагрев проводится интраоперационно, следовательно, температура кости in vivo поддерживается на постоянном температурном уровне, превышающем 30 °C. Чтобы добиться условий, приближающихся к условиям проведения операции, свиную кость с датчиком температуры, установленным в центре костномозгового канала, помещали в термостат с температурой воды 36,6 °С. После того как температура внутри костномозговой полости и температура воды выравнивались, кость извлекали из термостата и накладывали поверхностный нагреватель и теплоизолирующую прокладку. Нагрев осуществлялся с помощью поверхностных нагревателей, температура которых определялась выбранным режимом в течение 1 ч; фиксация температурных значений проводилась ежеминутно.
Экспериментальное исследование было построено на изучении четырех температурных режимов: трех с постоянной температурой нагревателя (РПН) и режима максимального нагрева (РМН), при котором специального ограничения температуры не устанавливалось, поэтому нагрев осуществлялся до 120 °C. Всего в исследовании было использовано 28 плечевых костей свиней. На отработку методики эксперимента было израсходовано 8 костей, при изучении РПН – 15 костей, в экспериментах с использованием РМН – 3 кости. При изучении РПН были сформированы 3 группы по 5 образцов (костей) в каждой. Температура нагревателя была стабилизирована на постоянном уровне:
– первая группа – режим постоянного нагрева 60 °C (Т60);
-
– вторая группа – режим постоянного нагрева 70 °C (Т70);
– третья группа – режим постоянного нагрева 80 °C (Т80).
Статистическая обработка проводилась с помощью программных вычислительных средств Statistica 13.3 software package for Windows (TIBCO Software Inc., Palo Alto, CA, USA). При проведении статистической оценки полученных результатов были выбраны контрольные точки от 0 до 60 мин наблюдения с пятиминутным шагом. Нулевой точке соответствовала исходная температура, регистрируемая непосредственно в момент включения нагревательного прибора; температура, зафиксированная на 60-й мин, соответствовала моменту окончания исследования. В каждой контрольной точке проведен анализ нормальности распределения полученных данных с использованием критерия Шапиро–Уилка [11, 12]. Значение уровня значимости р<0,05 указывало на отклонение закона распределения от нормального. Расчетный критерий показал, что в части контрольных точек распределение полученных данных не соответствует нормальному.
Таким образом, малый объем выборок при отсутствии нормального распределения данных в части контрольных точек обусловил представ- ление полученных данных в виде медианы и интерквартильного размаха, а также интерпретацию полученных данных с использованием непараметрических критериев. Для проверки в случае парных различий применялся критерий Вилкоксона [13], при множественных сравнениях – критерий Краскела–Уоллиса [14]. Статистически значимыми считались различия на уровне 5 %.
Для наглядного представления происходящих тепловых процессов были построены графики зависимости температуры (снаружи/внутри кости) от времени. Распределение температурных значений в контрольных точках представлено в виде ящичных диаграмм, при этом линия внутри ящика соответствует медиане, его верхняя и нижняя границы – 25 и 75-му квартилям, а усы ящиков – максимальному и минимальному значениям.
Результаты
На основании полученных данных построены графики, отражающие зависимость температуры от времени. Все температурные кривые имели однотипный вид вне зависимости от уровня стабилизации температуры. В качестве примера ниже приведен график, соответствующий режиму постоянного нагрева 60 °C (рис. 1).
Происходящие процессы можно описать следующим образом: в первые 10 мин наблюдается максимально быстрый подъем температуры (в
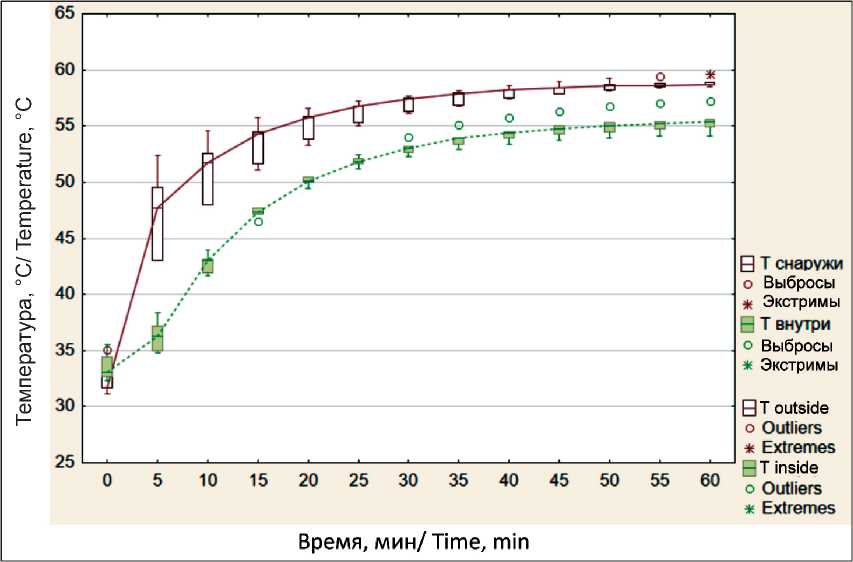
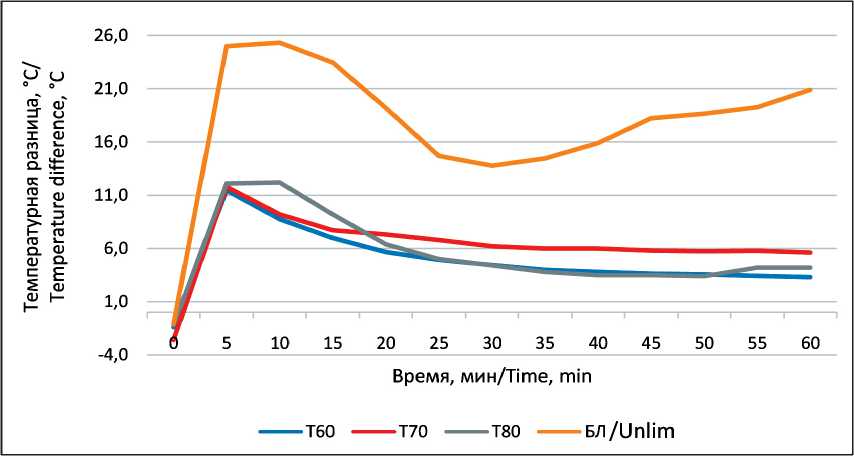
Рис. 1. График распределения температур снаружи и внутри кости в режиме нагрева 60 °C Fig. 1. Graph of temperature distribution outside and inside the bone in heating mode 60 °C
Рис. 2. Температурная разница между внутренней и наружной поверхностью кости при температуре воздействия 60, 70, 80 °C и режиме максимального нагрева Fig. 2. Temperature difference between the inner and outer surface of the bone at the exposure temperature of 60, 70, 80 °C and maximum heating mode
Таблица/Table
Сравнение медианных значений в точке максимальной температурной разницы (5 мин) Comparison of median values at the point of maximum temperature difference (5 min)
Формирующуюся температурную разницу можно наблюдать на графике (рис. 2), при построении которого использованы медианные значения в контрольных точках. Для оценки значимости различий использован критерий Вилкоксона [13]. Различия между температурой на наружной поверхности кости и в центре костномозговой полости в группах с использованием режима постоянного нагрева 60, 70, 80 °C и режима максимального нагрева были оценены как значимые. На графике мы видим, что максимальная температурная разница формируется в первые 5 мин нагрева. В следующие 15–20 мин происходило постепенное сближение температурных значений внутри и снаружи кости, после чего наблюдалась стабилизация температурного разрыва на уровне 3,5–6 °C.
Проведено сравнение медианных значений в точке максимальной температурной разницы (5 мин), которое показывало, что увеличение температуры воздействия способствует увеличению температурной разницы в период нагрева (таблица). Для того чтобы подтвердить наличие данной тенденции, использован режим максимального нагрева, при котором температура нагревателя поднималась до максимального значения и составляла 120 °C. В режиме максимального нагрева было исследовано
3 костных образца. В результате было выявлено увеличение температурной разницы до 25 °C на 5-й мин нагрева, в ходе дальнейшего нагрева температурный разрыв составлял 15–20 °C. Таким образом, можно утверждать, что с ростом температуры воздействия будет формироваться большая температурная разница между температурой на наружной поверхности и температурой в центре костномозговой полости.
Еще одной особенностью нагрева с постоянной температурой является смещение темпов максимального прироста температур относительно друг друга. На рис. 3 показаны выявленные особенности нагрева на примере режима 60 °C. Это свидетельствует о том, что, во-первых, тепловые волны достигают центра кости с задержкой, обусловленной прогревом наружных слоев; во-вторых, за счет последующей концентрации тепловых волн в центре костномозговой полости температура внутри нее продолжает нарастать, хотя на наружной поверхности уже наблюдается ее стабилизация.
Также необходимо было определить, как изменяется температура снаружи и внутри длинной трубчатой кости при увеличении температуры воздействия (режимы нагрева с постоянной температурой 60, 70, 80 °C) в заданный промежуток времени. Ниже представлено графическое изображение полученных данных (рис. 4, 5). На графики нанесены ящичные диаграммы с интервалом в 5 мин, которые соединены линией, проходящей через значения медиан. Хорошо заметны отличия, возникающие между исследуемыми группами. Существенность полученных различий была оценена с использованием непараметрического критерия Краскела–Уоллиса [15]. При рассмотрении трех температурных режимов в совокупности статистически значимая разница появлялась, начиная с 15-й мин на наружной поверхности и с 10-й мин – внутри костномозговой полости.
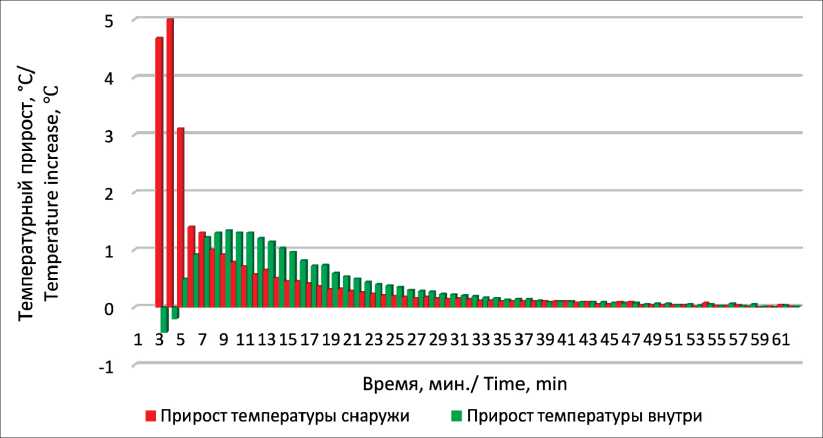
Рис. 3. Смещение темпов прироста температур снаружи и внутри длинной трубчатой кости при постоянной температуре воздействия 60 °C (по медианным значениям)
Fig. 3. Shift in the rate of temperature increase outside and inside the long tubular bone at a constant exposure temperature of 60 °C (according to median values)
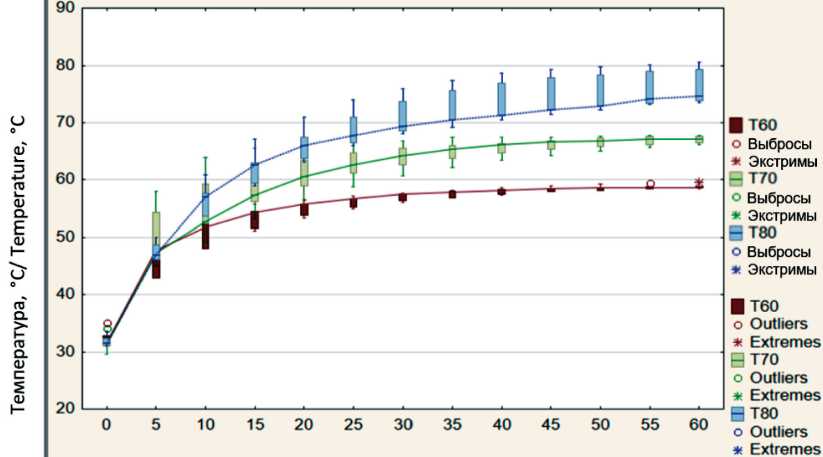
Рис. 4. Температура на наружной поверхности кости при постоянном нагреве с температурой нагревателя 60, 70, 80 °C
Fig. 4. The temperature on the outer surface of the bone under constant heating with a heater temperature of 60, 70, 80 °C
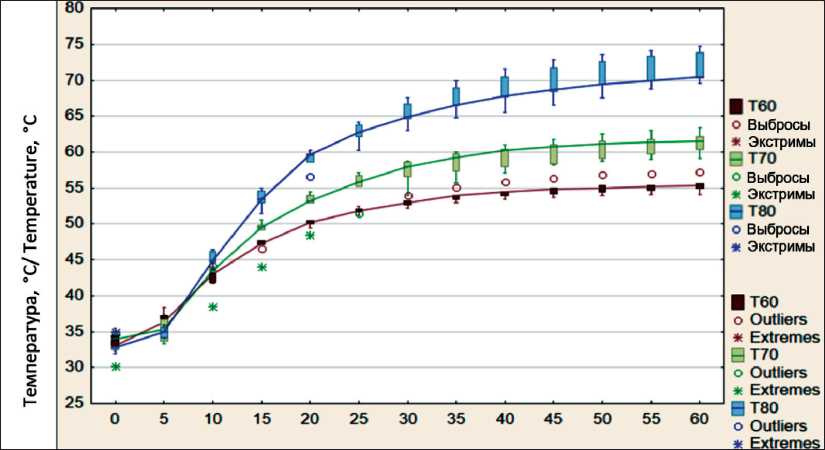
Рис. 5. Температура внутри костномозговой полости при постоянном нагреве с температурой нагревателя 60, 70, 80 °C
Fig. 5. Temperature inside the medullary cavity under constant heating with heater temperature 60, 70, 80 °C
Полученные различия проанализированы попарно: первая пара – режимы с постоянной температурой воздействия 60–70 °C, вторая – 70–80 °C, третья – 60–80 °C. На наружной поверхности кости значимая разница при сравнении режимов появлялась в первой паре начиная с 20-й мин, во второй – с 25-й мин, в третьей паре – на 10-й. На 60-й мин нагрева разница наружной температуры между соседними режимами (между режимами 60–70 °C и 70–80 °C) составляла 8,4–7,6 °C, а в паре 60–80 °C – 16 °C. Увеличение температуры воздействия на 10 °C приводило к росту температуры на наружной поверхности примерно на 8 °C. Таким образом, при использовании этого метода выявлены тепловые потери, вероятнее всего, конвекционного характера. Следовательно, чтобы достичь 60 °С в центре кости к наружной поверхности необходимо приложить большую температуру.
При попарном сравнении температуры, создаваемой при РПН внутри костномозговой полости, также была выявлена статистически значимая разница, которая составляла к моменту окончания нагрева в паре 60–70 °C – 6,1 °C; при 70–80 °C – 9,1 °C и при 60–80 °C – 15,11 °C. То есть, наряду с прямой зависимостью, выражающейся в росте температуры в костномозговой полости при увеличении температуры воздействия, существует и другая тенденция, свидетельствующая об увеличении температурной разницы между температурой воздействия и температурой нагрева внутри кости: так, если при РПН 60 °C она составляла порядка 5 °C, то при РПН 80 °C была получена разница почти в 10 °C.
Обсуждение
В качестве ориентиров для определения пределов температурного воздействия были выбраны: изменение прочности костной ткани, эффективность воздействия на опухолевый процесс, способность к последующей регенерации и рекомендации, данные врачами-онкологами относительно временных рамок, в которые должно проводиться термоабляционное воздействие.
Оценка рассмотренных режимов с позиций изменения механической прочности
По данным литературы, воздействие высокой температуры вызывало снижение механической прочности костной ткани. P. Köhler et al. [16] в исследовании с использованием диафизарной кости кроликов сообщали, что прочность снизилась до 77 % в тесте на кручение после автоклавирования при температуре 121 °С в течение 20 мин. H. Knae-pler et al. в исследовании [17] с использованием губчатой кости свиньи отмечали, что прочность на сжатие снизилась примерно до 60 % после теплового воздействия 100 °С, но механическая прочность не изменилась после тепловой обработки при 60 °С. V.A. Singh et al. [18] провели исследование с использованием длинных трубчатых костей человека (бедренная, большеберцовая) и выявили снижение прочностных характеристик после термообработки в группах как автоклавирования (120 °C), так и кипячения более чем на 50 %. В то же время после термообработки при 60 °С (пастеризация) значительного снижения прочности не наблюдалось.
В силу того, что рассматриваемая нами методика не имеет аналогов и изменения костной ткани при таком подходе не изучались, нами проведены собственные исследования механической прочности кости, направленные на выявление изменения прочностных характеристик после гипертермического воздействия [19]. Было изучено ex vivo влияние термоабляции на прочностные характеристики длинных трубчатых костей здоровых свиней в тестах на сжатие. Значимые результаты, свидетельствующие об ухудшении механической прочности, получены при воздействии температуры 100 °C. При более низких температурах (60–90 °C) значимого снижения прочностных характеристик костей не наблюдалось. Более того, при воздействии 70 °C и 80 °C наблюдалась тенденция к увеличению механической прочности. Наименьшие изменения были отмечены при 60 °C. Следовательно, если определять границы допустимого температурного диапазона с точки зрения механической прочности, то интервал 60–90 °C может служить его границами.
Все рассмотренные РПН находились в допустимом температурном диапазоне, не оказывающем влияния на изменение прочностных характеристик. Исключение составлял лишь режим максимального нагрева, где температурные максимумы превышали 100 °C.
Оценка эффективности воздействияна опухолевый процесс
Оценка противоопухолевого эффекта строилась на основании обзора данных литературы по экстракорпоральной термоабляции пораженных опухолью фрагментов костей. Исследования, изучающие влияние гипертермии на опухолевые клетки, проводились в ФГБУ «РОНЦ им. Н.Н. Блохина». В частности, изучалось воздействие различных режимов гипертермии на жизнеспособность и пролиферативную активность опухолевых клеток [20]. Максимальная используемая температура составляла 50 °С. При этом у всех перевиваемых линий опухолевых клеток наблюдается снижение физиологической активности более 50 %, а снижение пролиферативной активности приближается к 100 %. Изучением влияния температур на опухолевые клетки крыс также занимались Y. Rong et al. [21], которые использовали 5 различных температур (40, 50, 60, 70 и 80 °C) и три временных интервала (10, 20 и 30 мин). Рост опухоли не наблюдался в группах 50 °C (20 и 30 мин) или более 60 °C даже через 35 нед после трансплантации опухоли.
V.A. Singh et al. исследовали влияние температуры на кортикальную кость, содержащую опухолевые клетки [18]. Авторы провели пастеризацию костных фрагментов при температуре 65 °C в течение 30 мин и подтвердили, что использованная ими температура является летальной для опухолевых клеток. Пастеризацию костного аутотрансплантата при температуре 60 °C в течение 30 мин применяли в клинической практике J. Manabe et al. [5], которые расценивали проведенную стерилизацию как достаточную, что при дальнейшем наблюдении за пациентами не выявлено локальных рецидивов.
Таким образом, термобиологические исследования показывают, что температура 60 °C является достаточной для девитализации опухолевых клеток. Поэтому первым из исследованных нами режимов была методика постоянного нагрева 60 °C. Проведенные исследования показали, что нагрев, осуществляемый в соответствии с предложенным режимом, не позволяет достичь требуемой температуры. В фазу стабилизации (с 30 до 60-й мин) температура на наружной поверхности достигала 58 °C, в костномозговой полости – 54 °C. Поскольку нами не найдено данных об использовании в клинической практике температур ниже 60 °C для экстракорпоральной стерилизации опухолевых аутотрансплантатов, данный температурный режим мог быть расценен только как резервный. Целесообразность его применения может быть подтверждена только дополнительными исследованиями, доказывающими противоопухолевый эффект.
С этой точки зрения РПН 70 и 80 °C могут рассматриваться как достаточно эффективные, т.к. температура снаружи кости и внутри костномозговой полости была выше 60 °C. Температурная медиана при РПН 70 °C составила 61,5 °C, при РПН 80 °C – 70,5 °C.
Оценка с точки зрения возможности регенеративных процессов
Согласно современным представлениям, одной из наиболее важных составляющих при запуске регенеративных процессов в костной ткани является костный морфогенетический белок (КМБ). Опытным путем было установлено, что КMБ устойчив к нагреванию до 65 °C [22–24]. Поэтому нами сделано предположение, что если температура внутри костномозговой полости не превысит температуры, вызывающей гибель КМБ, то со стороны эндоста начнутся регенеративные процессы, радиально направленные в сторону более периферийно расположенных костных структур. С учетом вышеизложенного режим постоянного нагрева 80 °C также должен рассматриваться только как резервный вариант, т. к. значения температуры снаружи (≈76 °C) и внутри (≈72 °C) превысили допустимый предел.
Наиболее перспективным нам представляется режим постоянного нагрева 70 °C, при котором температура на наружной поверхности кости достигала порядка 67 °C, а температура внутри кости не превышала 61 °C. Именно этот режим наиболее соответствует предложенной модели восстановительной реконструкции кости.
Оценка с точки зрения временных интервалов, в которые должно проводиться термоабляционное воздействие Врачами-онкологами были даны рекомендации, регламентирующие длительность термоабляционного воздействия: стадия нагрева должна проходить в минимально короткий срок, ограничивающийся 15 мин. Непосредственно время лечебного воздействия должно составлять порядка 30 мин при температуре не менее 60 °C в центре костномозговой полости.
Проведенное исследование показало, что достичь желаемую температуру в 60 °C в центре кости за 15-мин интервал при использовании режимов постоянного нагрева 60, 70, 80 °C невозможно. Единственной методикой, которая демонстрировала такую возможность, был режим максимального нагрева, при котором температура внутри костномозгового канала достигала 67–68 °C на 15-й мин нагрева, а на наружной поверхности – 90 °C, т. е. быстрый нагрев обусловливал появление значительного температурного градиента (22 °C), при котором наружные слои кости перегревались. Следовательно, этот режим не может рассматриваться как перспективный в силу того, что при таком температурном воздействии будет происходить как снижение прочностных характеристик, так и утрата остеоиндуктивной способности костной ткани.
Тем не менее решение поставленной задачи возможно путем разработки режимов с переменной температурой, которые сочетали бы в себе первоначальное использование режима максимального нагрева с последующим переключением на режим с постоянной температурой. В качестве альтернативного варианта можно рассматривать РПН, если будет возможно увеличение времени температурного воздействия, в первую очередь – за счет увеличения стадии нагрева.
Заключение
В представленной работе мы попытались ответить на вопрос о выборе наиболее оптимального режима гипертермического воздействия при использовании оригинальной методики интраоперационной термоабляции. В качестве критериев отбора выступали такие параметры, как эффективность воздействия на опухолевые клетки, сохранение прочностных характеристик и регенеративной способности костной ткани, реализация гипертермического воздействия в отведенных временных рамках (15 мин – нагрев, 30 мин – лечебное время воздействия при температуре не менее 60 °C).
Подводя итог вышеизложенному материалу, можно сделать следующие выводы:
-
1. Наиболее соответствующим предъявленным требованиям является режим постоянного нагрева 70 °C. Медиана температуры стабилизации составляла: 61 °C внутри костномозговой полости и 67 °C на наружной поверхности кости. При такой температуре утрачивается жизнеспособность опухолевых клеток, но сохраняются прочностные характеристики кости. Предполагается, что возможны и регенеративные процессы, т.к. температура нагрева внутри костномозговой полости не достигает пороговой температуры инактивации КМБ. Однако этот режим не удовлетворяет отведенным временным рамкам, т. к. период нагрева до температуры 60 °C составляет 35–40 мин, соответственно, полное время воздействия будет составлять примерно 70 мин.
2. Режим постоянного нагрева 60 °C можно рассматривать лишь как резервный вариант, т.к. достигнутые значения температуры внутри костномозговой полости (55 °C) и на наружной поверхности кости (58 °C) были ниже запланированного уровня. Полученная температура позволяет сохранить прочностные характеристики и регенеративные способности костной ткани. Однако в литературе не описано применения такой температуры при экстракорпоральной стерилизации опухолевых аутотрансплантатов. Поэтому первоначально необходимо оценить достаточность этой температуры для уничтожения опухолевых клеток.
3. Режим постоянного нагрева 80 °C также следует рассматривать как запасной вариант, т.к. высо- кая температура стабилизации (75 °C на наружной поверхности и 70 °C внутри костномозговой полости) подразумевает полную инактивацию КМБ, ответственного за запуск остеоиндуктивных процессов. Сохранение прочностных характеристик также требует уточнения, т. к. при исследовании прочностных характеристик мы использовали заранее заготовленную кость животных, возможно, проведение испытаний на прочность на человеческой кости внесет свои коррективы. Однако необходимо отметить, что данная температура обеспечивает необходимый уровень девитализации опухолевых клеток.
Список литературы Экспериментальное изучение распределения температуры в длинных трубчатых костях при периоссальном расположении нагревателей
- Qu H., Guo W., Yang R., Li D, Tang S., Yang Y, Dong S., Zang J. Reconstruction of segmental bone defect of long bones after tumor resection by devitalized tumor-bearing bone. World J Surg Oncol. 2015; 13: 282. doi: 10.1186/s12957-015-0694-3.
- KhattakM.J., UmerM., Haroon-ur-Rasheed, UmarM. Autoclaved tumor bone for reconstruction: an alternative in developing countries. Clin Orthop Relat Res. 2006; 447: 138-44.
- Pan K.L., Chan W.H., Ong G.B., Premsenthil S., Zulkarnaen M., Norlida D., Abidin Z. Limb salvage in osteosarcoma using autoclaved tumor-bearing bone. World J Surg Oncol. 2012; 10: 105. doi: 10.1186/14777819-10-105.
- Umer M., Umer H.M., Qadir I., Rashid H., Awan R., Askari R, Ashraf S. Autoclaved tumor bone for skeletal reconstruction in paediatric patients: a low cost alternative in developing countries. Biomed Res Int. 2013. doi: 10.1155/2013/698461.
- Manabe J., AhmedA.R., Kawaguchi N., Matsumoto S., KurodaH. Pasteurized autologous bone graft in surgery for bone and soft tissue sarcoma. Clin Orthop Relat Res. 2004; (419): 258-66. doi: 10.1097/00003086200402000-00042.
- Пахмурин Д.О., Федоров А.А., Кобзев А.В., Семенов В.Д., Анисеня И.И., Богоутдинова А.В., Ситников П.К., КажмаганбетоваМ., Матюшков С., Хан К.И., Семенова Г.Д. Способ интраоперационного гипертермического воздействия на костную ткань. Патент РФ № 2695305. Заявл. 13.07.2018; Опубл. 22.07.2019. [Pakhmurin D.O., Fedorov A.A., Kobzev A.V., Anisenya I.I., Bogoutdinova A.V., Sitnikov P.K., KazhmaganbetovaM., Matyushkov S., Khan K.I., Semenova G.D. Method for intraoperative hyperthermic exposure on bone tissue. The patent of the Russian Fedetarion No 2695305. 22.07.2019. (in Russian)].
- Пахмурин Д.О., Кобзев А.В., Семенов В.Д., Литвинов А.В., Учаев В.Н., Хуторной А.Ю. Автоматизированные комплексы высокотемпературного воздействия на биологические ткани. Томск, 2014. 88 с. [Pakhmurin D.O., Kobzev A.V., Semenov V.D., Litvinov A.V., Uchaev V.N., KhutornoyA.Yu. Automated complexes for high-temperature exposure to biological tissues. Tomsk, 2014. 88 p. (in Russian)].
- Pakhmurin D.O., Kobzev A.V., Semenov V.D., Litvinov A.V., Uchaev V.N., Khutornoy A.Yu. A Method of Controlled Local Hyperthermia. World Appl Sci J. 2014; 30(9): 1182-7. doi: 10.5829/idosi. wasj.2014.30.09.14146.
- Pakhmurin D.O., Kobzev A.V., Semenov V.D., Litvinov A.V., Uchaev V.N., Khutornoy A.Yu. A Temperature Stabilization Device for Local Hyperthermia in Cancer Treatment. Middle-East J Sci Res. 2014; 20(12): 1940-5. doi: 10.5829/idosi.mejsr.2014.20.12.21097.
- Кобзев А.В., Пахмурин Д.О., Семенов В.Д., Семенова Г.Д. Комплекс для высокотемпературного воздействия на биологическую ткань (варианты). Патент РФ № 2636877. Заявл. 21.11.2016; Опубл. 28.11.2017. [Kobzev A.V., Pakhmurin D.O., Semenov V.D., Semenova G.D. Complex for high-temperature impact on biological tissue (options). The patent of the Russian Federation No 2636877. 28.11.2017. (in Russian)].
- HartN.H., Nimphius S., Rantalainen T., Ireland A., SiafarikasA., NewtonR.U. Mechanical basis of bone strength: influence of bone material, bone structure and muscle action. J Musculoskelet Neuronal Interact. 2017; 17(3): 114-39.
- Perilli E., BaleaniM., Ohman C., Fognani R., Baruffaldi F., Vice-conti M. Dependence of mechanical compressive strength on local variations in microarchitecture in cancellous bone of proximal human femur. J Biomech. 2008; 41(2): 438-46. doi: 10.1016/j.jbiomech.2007.08.003.
- McDonald J.H. Handbook of Biological Statistics. 3rd ed. [Internet]. Baltimore: Sparky House Publishing, 2014. [cited 2021 Sep 2]. URL: www.biostathandbook.com.
- Mann H.B., WhitneyD.R. On a test of whether one oftwo random variables is stochastically larger than the other. Ann. Math. Stat. 1947; 18: 50-60. doi: 10.1214/aoms/1177730491.
- Castellan S., N. John Castellan Jr. Nonparametric Statistics for the Behavioral Sciences. Second ed. New York: McGraw-Hill, 1988.
- Köhler P., Kreicbergs A., Strömberg L. Physical properties of au-toclaved bone. Torsion test of rabbit diaphyseal bone. Acta Orthop Scand. 1986; 57(2): 141-5. doi: 10.3109/17453678609000888.
- Knaepler H., Haas H., Puschel H.U. Biomechanische Eigenschaften thermisch und radioaktiv behandelter Spongiosa. Unfallchirung. 1991; 17: 194-9.
- Singh V.A., Nagalingam J., SaadM. Pailoor., J. Which is the best method of sterilization of tumour bone for reimplantation? A biomechani-cal and histopathological study. BioMedical Engineering OnLine. 2010, 9: 48. doi: 10.1186/1475-925Х-9-48.
- PakhmurinD., Pakhmurina V., Kashin A., KulkovA., KhlusovI., Kostyuchenko E., Sidorov I., Anisenya I. Compressive Strength Characteristics of Long Tubular Bones after Hyperthermal Ablation. Symmetry. 2022; 14(2). doi:10.3390/sym14020303.
- Анисимова Н.Ю., Киселевский М.В., Абдуллаев А.Г., Малахова Н.В., Ситдикова С.М., Полоцкий Б.Е., Давыдов М.М. Влияние гипертермии на жизнеспособность и пролиферативную активность опухолевых клеток. Российский онкологический журнал. 2016; 21(5): 250-2. [AnisimovaN.Yu., KiselevskyM.V., AbdullaevA.G., MalakhovaN.V., Sitdikova S.M., Polotsky B.E., Davydov M.M. Effect of hyperthermia on the viability and proliferative activity of tumor cells. Russian Journal of Oncology. 2016; 21(5): 250-2. (in Russian)]. doi: 10.18821/1028-99842016-21-5-250-252.
- Rong Y., SatoK., SugiuraH., Ito T., Sakano S., IwataH., KimataK. Effect of elevated temperature on experimental swarm rat chondrosarcoma. Clin Orthop Relat Res. 1995; (311): 227-31.
- Зайцев В.В., Карягина А.С., Лунин В.Г. Костные морфо-генетические белки (BMP): Общая характеристика, перспективы клинического применения в травматологии и ортопедии. Вестник травматологии и ортопедии им. Н.Н.Приорова. 2009; (4): 79-84. [Zaicev V.V., Karyagina A.S., Lunin V.G. Bone morphogenetic proteins (BMP): General characteristics, prospects for clinical use in traumatology and orthopedics. Bulletin of Traumatology and Orthopedics. N.N.Priorova. 2009; (4): 79-84. (in Russian)].
- Reddi A.H. Role of morphogenetic proteins in skeletal tissue engineering and regeneration. Nat Biotechnol. 1998; 16(3): 247-52. doi: 10.1038/nbt0398-247.
- OkamotoM., Murai J., Yoshikawa H., Tsumaki N. Bone morpho-genetic proteins in bone stimulate osteoclasts and osteoblasts during bone development. J Bone Miner Res. 2006; 21(7): 1022-33. doi: 10.1359/ jbmr.060411.


