Экспериментальное изучение условий импрегнации для получения пролонгированной антимикробной активности оригинального остеопластического материала на основе губчатой аллокости
Автор: Антипов А.П., Божкова С.А., Гордина Е.М., Гаджимагомедов М.Ш., Кочиш А.А.
Журнал: Гений ортопедии @geniy-ortopedii
Рубрика: Оригинальные статьи
Статья в выпуске: 3 т.31, 2025 года.
Бесплатный доступ
Введение. Локальная антибиотикотерапия является перспективным методом профилактики и лечения периимплантной инфекции, однако существующие системы доставки антибиотиков имеют ряд ограничений. Цель работы — определить в эксперименте in vitro оптимальные параметры давления, времени экспозиции и типа растворителя для обеспечения пролонгированной элюции ванкомицина из оригинального остеозамещающего материала на основе губчатой аллокости. Материалы и методы. Исследовано семь методик импрегнации с различными комбинациями параметров: давление — от атмосферного до пониженного (7–10 hPa), время — от 5 мин. до 24 ч., растворитель (дистиллированная вода, 50 % раствор этанола, комбинация 50 % этанола с 5 % поливинилпирролидоном (ПВП)). Эффективность оценивали по изменению диаметра зоны подавления S. aureus ATCC 43300 бактериологическим методом и динамике концентрации ванкомицина в элюате методом высокоэффективной жидкостной хроматографии (ВЭЖХ). Статистический анализ выполняли с применением метода ANOVA с post-hoc тестом Тьюки, корреляции — методом Спирмена и путем расчета площади под фармакокинетической кривой. Результаты. Наибольшую эффективность продемонстрировала методика с использованием пониженного давления, 60-минутной экспозиции и спиртового раствора с ПВП, обеспечившая пролонгированное высвобождение ванкомицина до 14 дн. с максимальной площадью под кривой элюции (301364,70) и высокой корреляцией между концентрацией антибиотика и зоной подавления роста (r = 0,908, p < 0,001). Давление оказалось наиболее значимым фактором (F = 19,9916, p < 0,0001), за ним следовали тип растворителя (F = 7,7485, p = 0,0006) и время импрегнации (F = 6,8084, p = 0,0014). Обсуждение. В отличие от традиционных методов локальной антибиотикотерапии, имеющих ограниченную эффективность (3–7 дн.), разработанная методика с использованием пониженного давления и спиртового раствора с ПВП обеспечивает пролонгированное высвобождение ванкомицина до 14 дн. Преимуществом предложенного подхода является более равномерная кинетика элюции по сравнению с полиметилметакрилатом и биодеградируемыми носителями, демонстрирующими резкий начальный выброс антибиотика. Комплементарное использование микробиологического метода и ВЭЖХ подтвердило сохранение антимикробной активности ванкомицина после импрегнации, что принципиально важно для обеспечения терапевтического эффекта. Заключение. Экспериментально установлено, что оптимальными параметрами для обеспечения пролонгированной элюции ванкомицина из остеозамещающего материала на основе губчатой аллокости являются пониженное давление (7–10 hPa), время экспозиции 60 мин. и использование 50 % этанола с 5 % ПВП в качестве растворителя.
Остеозамещающий материал, импрегнация, ванкомицин, локальная антибиотикотерапия, элюция антибиотика, периимплантная инфекция, MRSA
Короткий адрес: https://sciup.org/142244813
IDR: 142244813 | УДК: 616.71-089.843-77:615.33 | DOI: 10.18019/1028-4427-2025-31-3-361-371
Текст научной статьи Экспериментальное изучение условий импрегнации для получения пролонгированной антимикробной активности оригинального остеопластического материала на основе губчатой аллокости
Остеозамещающие материалы (костные трансплантаты, кальцийфосфатные материалы, биоактивные стекла, биополимеры, композитные материалы) широко используют для заполнения дефектов, формирующихся при тотальном эндопротезировании суставов, артродезах позвоночника, после радикального лечения хронического остеомиелита и в онкологической ортопедии [1]. Несмотря на применение современных антисептических и антибактериальных средств во время оперативных вмешательств и в послеоперационном периоде, инфекционные осложнения остаются одной из наиболее серьезных проблем, сопровождающих ортопедическую хирургию [2].
Наиболее частым возбудителем перипротезной инфекции является Staphylococcus aureus [2, 3]. Инфекционный процесс, вызванный этим микроорганизмом, проходит несколько стадий: проникновение в организм, уклонение от факторов иммунной системы, адгезия к поверхности имплантата с последующим образованием биопленки [4, 5]. Компоненты клеточной стенки, ферменты и экзотоксины S. aureus способствуют его вирулентности, обеспечивая инвазию и устойчивую персистенцию патогена в костной ткани [1]. Более того, стафилококковые клетки в составе биопленок демонстрируют сниженную чувствительность к антибиотикам [4, 6], что приводит к хронизации инфекции, необходимости проведения повторных хирургических вмешательств и длительной этиотропной антибактериальной терапии [7].
Для профилактики инфекционных осложнений при имплантации значительного объема аллогенных остеозамещающих материалов необходимо назначение системной антибактериальной терапии в пе-риоперационном периоде, что является стандартом оказания медицинской помощи при подобных вмешательствах [8]. Однако из-за недостаточного кровоснабжения в области замещенного дефекта системная антибиотикотерапия зачастую оказывается неэффективной [9]. В связи с этим физическая адсорбция антибиотиков на поверхности остеопластических материалов является перспективным методом локальной антибиотикотерапии при лечении инфекций.
В процессе разработки остеозамещающих материалов, обладающих антибактериальными свойствами, принципиально важным является определение ключевых факторов, определяющих их терапевтическую эффективность. Основополагающим критерием следует считать их способность обеспечивать стабильное поддержание локальной концентрации антибиотика, существенно превышающей минимальную ингибирующую концентрацию (МИК), на протяжении продолжительного временного интервала. Данное условие является необходимым для достижения антибиопленочного эффекта и предотвращения селекции резистентных штаммов микроорганизмов. [10]. Важным параметром также является равномерность высвобождения антибиотика из остеозамещающего материала. Предыдущие исследования показали, что значительная часть антибиотика элюирует в первые сутки после имплантации, что снижает эффективность антибактериальной терапии [11].
Цель работы — определить в эксперименте in vitro оптимальные параметры давления, времени экспозиции и типа растворителя для обеспечения пролонгированной элюции ванкомицина из оригинального остеозамещающего материала на основе губчатой аллокости.
МАТЕРИАЛЫ И МЕТОДЫ
Материал для исследования получали из головок бедренной кости, резецированных во время операции первичного эндопротезирования тазобедренного сустава и сразу помещенных в трёхслойную стерильную упаковку. До оперативного вмешательства все пациенты обследованы на наличие в крови антител к вирусам иммунодефицита человека ВИЧ-1 и ВИЧ-2, вирусам гепатита В и С, суммарных антител IgM/IgG к Treponema pallidum (ИФА) и подписали информированное добровольное согласие на забор фрагмента кости при проведении хирургического вмешательства. После изъятия материал замораживали при –80 °C, это стандартная температура для длительного хранения биологических тканей, так как при ней значительно замедляются процессы деградации белков и других молекул.
Свежезамороженные головки бедренной кости вручную в стерильных условиях очищали от хрящевой части и кортикальной кости. Оставшуюся губчатую кость распиливали на блоки размером 5×5×5 мм ( n = 21) для стандартизации образцов и удобства помещения в пробирки 10 мл. Для делипидизации и очистки материала использовали комбинацию химических и физических воздействий согласно методике, описанной в патенте RU 2722266 C1 «Лиофилизированный биологический биодеградируемый минерализованный костнопластический материал и способ его изготовления» (рис. 1).
Для оптимизации процесса импрегнации остеозамещающего материала ванкомицином (Ванкобакт, Фармасинтез АО, Россия) исследовано влияние трех ключевых параметров: давления, времени импрегнации и типа растворителя.
Давление при импрегнации варьировали от атмосферного (≈ 1013 hPa) до пониженного (7–10 hPa) при температуре раствора от +2 °C до +8 °C. Такое давление позволяет достигнуть условий, при которых вода будет находиться в состоянии до закипания, что обеспечит наилучшее проникновение антибиотика внутрь пористой структуры материала и его эффективную импрегнацию.

Рис. 1. Стереомикроскопическое изображение очищенного делипидизированного костного материала до распила на блоки (а) и после распила и импрегнации АБ ванкомицин (б). Увеличение 2× (Ломо, Россия)
Исследуемый период времени импрегнации составил от 5 мин. до 24 час. Короткие периоды импрегнации (5 и 60 мин.) выбраны для оценки возможности быстрого насыщения материала антибиотиком, что важно для практического применения методики и потенциального снижения общих сроков изготовления конечного изделия. Длительная экспозиция (24 час.) позволяла оценить максимально возможную степень насыщения материала при различных условиях.
В качестве растворителей использовали:
-
1) дистиллированную воду (H₂O) как базовый растворитель;
-
2) 50 % раствор этанола, обладающий лучшей проникающей способностью за счет меньшего поверхностного натяжения;
-
3) комбинацию 50 % этанола с 5 % поливинилпирролидоном (ПВП), где полимерная добавка должна была обеспечить лучшую стабилизацию и удержание антибиотика в структуре трансплантата.
Объем раствора зависит от расчётной плотности растворителей, исходя из необходимости достижения массового процента антибиотика, — 5 %. Водный раствор имеет плотность примерно 1 г/мл, тогда как 50 % спиртовой раствор обладает меньшей плотностью (~0,93 г/мл), а в случае использования 50 % спиртового раствора с добавлением ПВП плотность раствора слегка увеличивается (~0,94 г/мл). Для каждой методики использовали по три образца губчатой кости.
Сравнительный анализ методик проводили путем последовательного изменения одного параметра при фиксированных значениях остальных (табл. 1).
Таблица 1
Методики импрегнации образцов оригинального остеозамещающего материала ванкомицином
|
№ |
Растворитель |
V р-ра, мл |
Давление, hPa |
Время импрегнации |
|
1 |
H 2 O |
20 |
≈1013 |
60 мин. |
|
2 |
H2O |
20 |
≈1013 |
24 ч. |
|
3 |
H 2 O |
20 |
7–10 |
5 мин. |
|
4 |
H 2 O |
20 |
7–10 |
60 мин. |
|
5 |
H2O |
20 |
7–10 |
24 ч. |
|
6 |
Этанол 50 % |
21,5 |
7–10 |
60 мин. |
|
7 |
Этанол 50 % + ПВП 5 % |
21,2 |
7–10 |
60 мин. |
Для сравнительного изучения продолжительности антибактериальной активности каждый импрегни-рованный образец помещали в отдельную стерильную пробирку, содержащую 3 мл физиологического раствора. В качестве отрицательного контроля использовали образец без ванкомицина. Инкубировали при 37 °С в течение 18–24 час. Через 24 час. образцы переносили в свежий физиологический раствор и продолжали инкубировать в прежних условиях. Готовили взвесь тестируемых изолятов с оптической плотностью 0,5 по McF, наносили ватным тампоном на агар Мюллера – Хинтона и распределяли по поверхности. В качестве тест-штаммов использовали эталонные штаммы S. aureus ATCC 43300 (MRSA) с МИК ванкомицина 1,5 мг/мл. Взвесь суточной культуры бактерий (0,5 McF) распределяли по поверхности агара Мюллера – Хинтона. После каждых суток инкубации 10 мкл инкубационного раствора с образцами наносили на бактериальный газон в трех повторах и инкубировали сутки при 37 °С. Формирование зоны подавления роста в месте нанесения капли надосадка расценивали как наличие достаточной концентрации ванкомицина для подавления роста бактерий. Динамику элюции ванкоми- цина оценивали визуально по наличию и размеру (диаметр, мм) зоны подавления роста MRSA (рис. 2). Ежедневно заменяли физиологический раствор и добавляли свежий в пробирку с образцом. Процедуру повторяли до отсутствия видимой зоны подавления роста в чашках Петри.
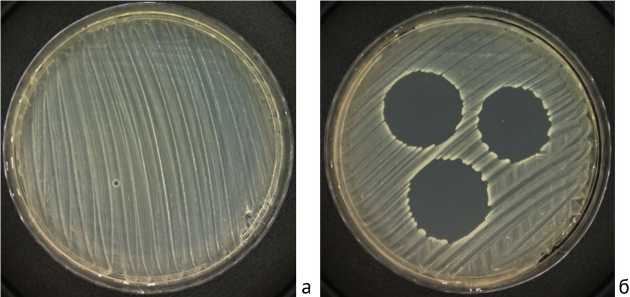
Рис. 2. Чашки Петри с культурой S. aureus ATCC 43300 (MRSA) через 10 сут. от начала эксперимента: а — отсутствие зоны подавления роста, методика 1; б — зоны подавления роста в месте нанесения капель, методика 7
Концентрацию ванкомицина в инкубационном растворе определяли методом высокоэффективной жидкостной хроматографии (ВЭЖХ) на приборе SHIMADZU, колонка Shim-pac HR-ODS (Япония). Из пробирок с образцами 1 мл суточного инкубационного раствора переносили в пробирки эппен-дорф и центрифугировали 5 мин., 13000 об/мин. Затем надосадок переносили в виалу и помещали в хроматограф. Объем вводимой пробы — 100 мкл. Скорость потока — 0,45 мл/мин. Продолжительность анализа — 25 мин. Время удержания ванкомицина на хроматограмме — 8,5 мин. В течение первых 7 сут. инкубационный раствор разбавляли в 1000 раз, и полученные концентрации умножали на коэффициент разведения. Для калибровки ВЭЖХ использовали стандартные растворы ванкомицина в концентрациях от 0,1 до 10 мг/мл. Калибровочную кривую строили по пиковой площади, соответствующей времени удержания ванкомицина (8,5 мин.). Анализ хроматограмм выполняли в программе LabSolutions, обеспечивая точность и воспроизводимость измерений путем проведения триплетных анализов каждой пробы.
Для обработки полученных данных использована статистическая аналитика с целью определения значимых различий между методиками импрегнации ванкомицина. Первичные данные регистрировали в программном обеспечении Microsoft Excel, 2019, Версия 16.72. Проверку нормальности распределения осуществляли с помощью критерия Шапиро – Уилка, как наиболее мощного для выборок малого и среднего размера ( n < 50). Все исследуемые количественные показатели продемонстрировали нормальное распределение ( p > 0.05). Количественные данные представлены в виде «средние значения ± стандартное отклонение» (Mean ± SD). Для сравнения средних значений между группами использовали однофакторный дисперсионный анализ (ANOVA) с последующей пост-хок проверкой Тьюки для выявления парных сравнений, поскольку:
-
— все группы имели равный размер выборки;
-
— требовалось провести попарные сравнения между всеми группами;
-
— тест Тьюки обеспечивает хороший контроль ошибки I рода при сохранении достаточной статистической мощности.
В качестве интегрального фармакокинетического показателя элюции ванкомицина в течение всего периода наблюдения методом трапеций рассчитывали площадь под фармакокинетической кривой (AUC, Area Under Curve). Расчет проводили с использованием программного обеспечения GraphPad Prism 9.0 (GraphPad Software, США) на основании экспериментально полученных концентраций препарата в различные временные точки (с 1 по 14 дн.). Для оценки корреляции между концентрацией ванкомицина и зоной подавления роста использовали коэффициент корреляции Спирмена. Порог значимости установлен на уровне p < 0,05. Для оценки степени соответствия экспериментальных данных экспоненциальной модели использовали коэффициент детерминации ( R² ). Все статистические анализы проводили с использованием программного обеспечения Microsoft Excel, 2019, Версия 16.72, IBM SPSS Statistics, версия 23.0.0.0 (США), MacOS, Monterey 12.2.1.
РЕЗУЛЬТАТЫ
При анализе антибактериальной активности различных методик импрегнации в отношении S. aureus (MRSA) выявлено, что в первые сутки наблюдения они продемонстрировали сопоставимую эффективность с зонами подавления роста в диапазоне 20,7–24,7 мм (табл. 2). Однако уже со вторых суток некоторые группы образцов начали снижать свою активность.
Таблица 2
Динамика диаметра зон подавления роста MRSA в группах образцов, импрегнированных разными методиками
|
Сутки |
Диаметры зон подавления роста MRSA при разных методиках, M ± SD, мм |
||||||
|
Методика 1 |
Методика 2 |
Методика 3 |
Методика 4 |
Методика 5 |
Методика 6 |
Методика 7 |
|
|
1 |
22,0 ± 0,0 |
21,7 ± 0,6 |
24,0 ± 0,0 |
23,3 ± 1,6 |
24,7 ± 0,6 |
20,7 ± 0,6 |
22,3 ± 1,2 |
|
2 |
16,7 ± 2,3 |
18,3 ± 0,6 |
20,0 ± 0,0 |
20,7 ± 0,6 |
20,7 ± 0,6 |
20,7 ± 0,6 |
22,3 ± 1,2 |
|
3 |
15,3 ± 0,6 |
16,0 ± 1,7 |
16,3 ± 1,2 |
16,7 ± 0,6 |
15,3 ± 1,5 |
15,3 ± 0,6 |
22,0 ± 0,6 |
|
4 |
9,0 ± 0,0 |
12,7 ± 1,2 |
14,0 ± 3,5 |
14,0 ± 3,6 |
16,7 ± 1,5 |
15,7 ± 2,5 |
16,7 ± 1,5 |
|
7 |
н/д* |
н/д |
12,0 ± 0,0 |
13,3 ± 1,2 |
15,3 ± 1,2 |
15,3 ± 1,2 |
16,0 ± 0,0 |
|
8 |
н/д |
н/д |
8,0 ± 0,0 |
8,7 ± 0,6 |
13,3 ± 1,2 |
13,7 ± 0,6 |
15,0 ± 1,0 |
|
9 |
н/д |
н/д |
н/д |
8,0 ± 0,0 |
9,3 ± 2,3 |
11,7 ± 2,5 |
13,0 ± 13,0 |
|
10 |
н/д |
н/д |
н/д |
н/д |
9,0 ± 0,0 |
8,7 ± 0,6 |
10,7 ± 2,3 |
|
11 |
н/д |
н/д |
н/д |
н/д |
н/д |
5,3 ± 4,6 |
8,0 ± 0,0 |
|
14 |
н/д |
н/д |
н/д |
н/д |
н/д |
н/д |
8,0 ± 0,0 |
Примечание : н/д — значения ниже предела обнаружения метода (0,0 ± 0,0); данные представлены как среднее значение ± стандартное отклонение (M ± SD), n = 3 для каждой группы.
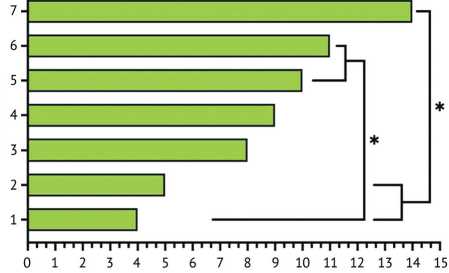
Статистический анализ полученных результатов позволил выявить существенные различия в эффективности исследуемых методов антимикробной обработки. Однофакторный дисперсионный анализ (ANOVA) показал статистически значимые различия в динамике диаметра подавления зон роста MRSA образцов, импрегнированных разными методиками ( F = 4,8192, p = 0,0001). Импрегнация в водном растворе антибиотика при атмосферном давлении была наименее эффективной, и увеличение времени с 60 мин. до 24 час. не оказало влияния на продолжительность антимикробной активности (АМА) образцов, импрегнированных методиками 1 и 2. Насыщение образцов в водном растворе антибиотика в условиях отрицательного давления также не привело к значимому продлению их антистафилококковой активности. В то же время применение спиртового раствора для импрегнации в условиях вакуума было наиболее эффективным в сравнении с методиками 1 и 2 ( p = 0,0283 и 0,05). При этом продолжительность импрегнации 5 мин., 60 мин. и 24 час. не показала значимого влияния времени на продолжительность АМА образцов соответственно групп 5, 6 и 7 ( p от 0,9476 до 1,0 при попарных сравнениях). Статистический анализ динамики диаметров зон подавления роста MRSA с применением post-hoc теста Тьюки показал, что данный показатель для образцов, импрегнированных методиками 5, 6 и 7, статистически значимо превосходил показатель методики 1, кроме того, показатели методики 7 были значимо лучше методики 2 ( p = 0,0023) (рис. 3). Детальное исследование влияния параметров импрегнации на продолжительность антимикробной активности показало, что давление s является наиболее значимым фактором ( F = 19,9916, н
День
Рис. 3. Длительность антимикробной активности in vitro образцов с различными способами импрегнации; * — p < 0,05
p < 0,0001), за ним следуют тип используемого раство- 2
рителя ( F = 7,7485, p = 0,0006) и время импрегнации ( F = 6,8084, p = 0,0014). Все исследованные параметры продемонстрировали статистически значимое влияние на эффективность процесса импрегнации.
При анализе результатов по оценке элюции ванкомицина методом ВЭЖХ также выявлены существенные различия между исследуемыми методиками импрегнации (табл. 3). Длительность эффективной элюции варьировала от 4 до 14 дн., при этом наи меньшее суммарное количество ванкомицина выделялось из образцов, импрегнированных по методике 1 с применением водного раствора и атмосферного давления, а наибольшее — из образцов, насыщенных в спиртовом растворе с полимером в условиях вакуума (методика 7).
Установлено, что увеличение времени импрегнации в водном растворе антибиотика при атмосферном давлении с 60 мин. до 24 час. статистически значимо увеличило концентрацию ванкомицина в инкубационном растворе на протяжении всего периода наблюдения ( p < 0,05). Наиболее выраженные различия отмечали на второй и четвертый дни исследования ( p = 0,0000).
Увеличение времени насыщения образцов в водном растворе в условиях вакуума с 5 до 60 мин. не показало значительных различий в концентрации антибиотика, выделенной в первые сутки (p > 0,05), при этом на 2–3 сут. элюированная из образцов концентрация ванкомицина в методике 4 была в 1,4–1,8 раза выше, чем в методике 3 (p = 0,0001). Аналогичная тенденция выявлена при анализе влияния давления на интенсивность выхода антибиотика. Образцы, насыщенные методиками 1 и 4, не показали значимых различий по выходу ванкомицина в первые сутки (р = 0,2479), однако, начиная со второго дня, различия в концентрации антибиотика в инкубационном растворе были статистически значимыми (р = 0.0000). Вместе с тем, увеличение времени импрегнации образцов в водном растворе в вакууме до 24 час. (методика 5) показала наибольшую для всех изученных методик с применением дистиллированной воды эффективность насыщения, как по продолжительности элюции ванкомицина, так и по его концентрации (р < 0,05).
Таблица 3
Динамика концентрации ванкомицина в инкубационном растворе с образцами, импрегнированными различными способами
|
Сутки |
Концентрация ванкомицина, M ± SD, мкг/мл |
||||||
|
1 |
2 |
3 |
4 |
5 |
6 |
7 |
|
|
1 |
23658 ± 1183 |
18747 ± 938 |
21551 ± 1078 |
25001 ± 1250 |
65258 ± 3263 |
44679 ± 2234 |
82755 ± 2069 |
|
2 |
258 ± 13 |
3234 ± 162 |
4287 ± 215 |
7839 ± 392 |
17894 ± 895 |
17516 ± 876 |
99578 ± 4979 |
|
3 |
574 ± 29 |
1234 ± 62 |
1852 ± 92 |
2816 ± 141 |
4648 ± 233 |
5791 ± 287 |
92877 ± 4644 |
|
4 |
447 ± 3 |
246 ± 13 |
1554 ± 75 |
1755 ± 88 |
3780 ± 189 |
5260 ± 263 |
45621 ± 2281 |
|
5 |
н/д* |
36 ± 2 |
1354 ± 68 |
489 ± 25 |
1957 ± 98 |
3649 ± 183 |
9658 ± 483 |
|
6 |
н/д |
н/д |
823 ± 41 |
546 ± 28 |
933 ± 47 |
2846 ± 143 |
5710 ± 286 |
|
7 |
н/д |
н/д |
450 ± 23 |
480 ± 24 |
784 ± 39 |
1120 ± 56 |
3903 ± 195 |
|
8 |
н/д |
н/д |
129 ± 7 |
238 ± 12 |
417 ± 21 |
490 ± 25 |
1244 ± 62 |
|
9 |
н/д |
н/д |
н/д |
38,1 ± 2,0 |
236,1 ± 12.0 |
166,9 ± 8.0 |
987 ± 50 |
|
10 |
н/д |
н/д |
н/д |
н/д |
45,0 ± 2,3 |
69,0 ± 3,5 |
259 ± 13 |
|
11 |
н/д |
н/д |
н/д |
н/д |
н/д |
43,0 ± 3,4 |
54,1 ± 2,7 |
|
14 |
н/д |
н/д |
н/д |
н/д |
н/д |
н/д |
27,9 ± 1,4 |
|
Суммарное высвобождение |
24937 ± 1183,5 |
23497 ± 954,8 |
32000 ± 1112,6 |
39202,1 ± 1314,8 |
95952,1 ± 3384,9 |
81629,9 ± 2414,8 |
342674 ± 7507,3 |
Примечание : н/д — значения ниже предела обнаружения метода (0,0 ± 0,0); данные представлены как среднее значение ± стандартное отклонение (M ± SD), n = 3 для каждой группы; суммарное высвобождение рассчитано как сумма средних значений за весь период наблюдения, мкг/мл.
В условиях вакуума 60-минутная импрегнация в спиртовом растворе антибиотика (методика 6) была сопоставима с 24-часовым насыщением в водном растворе (методика 5) ( р > 0,05), как в отношении продолжительности элюции ванкомицина, так и суммарной массе вышедшего антибиотика. Добавление полимера в спиртовой раствор антибиотика (методика 7) обеспечило максимальную длительность элюции (14 дн.) и максимальную сумму вышедшего антибиотика среди изученных методик.
Площадь под кривой элюции (AUC) демонстрировала значительную вариабельность между группами. Минимальное значение зафиксировано при применении методики 1 (13108,00), далее наблюдали последовательное увеличение показателя: методика 2 (14123,50), методика 3 (21224,50), методика 4 (26701,60), методика 5 (63323,10), методика 6 (59333,40). Максимальное значение AUC достигнуто при использовании методики 7 (301364,70), что превысило показатель более чем в 23 раза методики 1 и в 5 раз — методики 6.
Полученные результаты свидетельствуют о существенном влиянии, как времени импрегнации, так и давления на характеристики элюции, при этом наибольшая эффективность достигается при использовании комбинированного растворителя с добавлением ПВП.
При оценке корреляционной связи между концентрацией ванкомицина в инкубационной жидкости и зонами подавления роста микроорганизмов (рис. 4) выявлено, что наиболее сильная корреляционная связь обнаружена для образцов группы 7 ( r = 0,908; р < 0,001), что указывает на высокую степень линейной зависимости между исследуемыми параметрами. Методы 4, 5 и 6 также продемонстрировали статистически значимые корреляции ( р < 0,05), с коэффициентами корреляции 0,809, 0,822 и 0,723 соответственно. Методика 3 показала пограничную статистическую значимость ( r = 0,796; р = 0,058), в то время как методы 1 и 2, несмотря на высокие коэффициенты корреляции (0,777 и 0,870 соответственно), не достигли уровня статистической значимости ( р > 0,05).
Анализ экспоненциального убывания выявил высокую степень соответствия экспоненциальной модели для большинства групп, что подтверждается значениями коэффициента детерминации ( R2) . Особенно выделяется группа 2 с практически идеальным соответствием ( R2 = 0,990) и наиболее крутым наклоном экспоненты (–1,509), что свидетельствует о наиболее быстром убывании показателей в этой группе. Группы 3–7 продемонстрировали схожие характеристики экспоненциального убывания с R2 > 0,91 и более пологими наклонами в диапазоне от -0,591 до -0,778. Примечательно, что группа 1 показала наименьшее соответствие экспоненциальной модели ( R2 = 0,484), несмотря на относительно крутой наклон (–1,111).
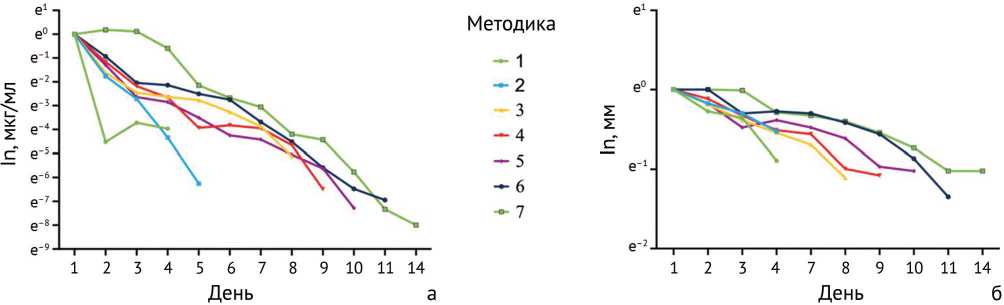
Рис. 4. Динамика: а — элюции ванкомицина из образцов, импрегнированнных различными методиками; б — изменений зон подавления роста S. aureus (MRSA)
Выявленная экспоненциальная зависимость кинетики высвобождения антибиотика демонстрирует важность комплексной оценки нескольких ключевых параметров: продолжительности антимикробной активности, суммарной дозы высвобожденного антибиотика и площади под фармакокинетической кривой (AUC), которые в совокупности определяют терапевтическую эффективность локальной антибиотикотерапии.
ОБСУЖДЕНИЕ
Локальная антибиотикотерапия в современной ортопедической хирургии демонстрирует высокую эффективность при профилактике и лечении инфекционных осложнений после операций (артропластики, вертебрология, челюстно-лицевая хирургия, онкология, гнойная остеология) [12–15]. Анализы литературы свидетельствует о значительном прогрессе в разработке и внедрении различных систем локальной доставки антибактериальных препаратов [16–18].
Полиметилметакрилат (PMMA), являясь традиционным материалом для локальной антибиотикоте-рапии, обеспечивает стабильное, но не продолжительное высвобождение антибиотика при простом замешивании с ванкомицином, — от 1 до 9 сут. и до 14 сут. в исключительных случаях [19–21]. Кроме общеизвестных недостатков использования костного цемента (необходимость выполнения повторного вмешательства [16, 22] и риск бактериальной колонизации с формированием первичных биопленок на поверхности PMMA в первые 18 час. [23, 24]), всего лишь 7 % из общего количества используемого антибиотика элюирует в окружающие ткани [25]. Увеличение локальной концентрации антибиотика за счет увеличения массы добавляемого препарата (более 6 г на 40 грамм PMMA) значительно снижает механическую прочность цемента, что не соответствует стандартам ISO [26].
В качестве альтернативы для создания локального депо активно изучают биодеградируемые носители (сульфат кальция, биодеградируемый полиуретан, полиэтилацетат, полилактид-когликолид и полилактид) [12, 27], существенным преимуществом которых является отсутствие необходимости их удаления и создание высокой в сравнении с PMMA (до 10 раз) концентрации антибиотика, оставаясь при этом ниже токсических уровней [28]. Однако полное рассасывание подобных имплантатов в среднем через 6 нед. (диапазон 30–60 дн.), опережающее скорость формирования новой костной ткани, может приводить к формированию костных полостей, переломам и рецидивам инфекционного процесса [29]. Важно отметить, что кинетика высвобождения антибиотиков из всех носителей характеризуется начальным пиковым выбросом через 48 час.: (9862 ± 1782) нг/мл — для спейсеров из PMMA; (38394 ± 7071) нг/мл — для бус из PMMA, с последующим постепенным снижением локальной концентрации [30]. При этом биодеградируемые материалы демонстрируют более быстрое и полное высвобождение антибиотиков по сравнению с PMMA (CaSO4 — в течение первых трех дней) [22]. В нашем исследовании методика 7 демонстрирует гораздо более плавное экспоненциальное снижение ( R2 > 0,91, наклон от -0,591 до -0,778).
Иные способы локальной антибиотикотерапии заключаются в непосредственном присыпании раны антибиотиком в процессе оперативного лечения или при интраартикулярном введении растворов антибиотика, что позволяет кратковременно создать терапевтические концентрации в области хирургического вмешательства (до 24 час.) без значительного увеличения системных уровней антибиотика [31, 32]. Альтернативным методом создания локальных концентраций антибиотиков, лишенным описанных выше недостатков, является использование импрегнированных антибиотиками аллографтов. Существующие методы можно разделить на несколько основных категорий в зависимости от технологии насыщения материала антибактериальными препаратами. Наиболее простым и распространенным является метод ручного смешивания аллокости в растворе с антибиотиком с последующей сушкой. Время импрегнации может варьировать от короткого периода в 30–60 мин. до пролонгированного в 120–180 мин. Высвобождение антибиотика — неравномерное, с максимальной концентрацией в первые 24–48 час., когда выде- ляется 40–60 % от общего количества импрегнированного антибиотика [33–36]. Согласно исследованиям D.C. Coraça-Huber et al., концентрация антибиотиков, превышающая МИК для стафилококков, при простом погружении аллографта в раствор с антибиотиком сохраняется лишь до 7 сут. in vitro и до 3 сут. in vivo [36].
Более современным подходом является применение ионофореза, позволяющего достичь высоких начальных концентраций антибиотиков с сохранением антимикробной активности до 2 нед. [37]. Тем не менее, метод характеризуется значительной вариабельностью результатов и требует дополнительных исследований влияния на структуру костной ткани.
В развитии существующих подходов к локальной антибиотикотерапии наше исследование предлагает оптимизированный метод импрегнации остеозамещающего материала. В отличие от традиционных, продемонстрировавших ограниченную эффективность (3–7 дн. антимикробного действия), разработанная методика с использованием комбинации пониженного давления (7–10 hPa) и спиртового раствора с добавлением ПВП обеспечила пролонгированное высвобождение ванкомицина до 14 дн. с сохранением терапевтически значимых концентраций. Статистический анализ выявил, что все факторы, изученные в исследовании, влияют на эффективность импрегнации.
В нашем исследовании мы использовали комплементарный подход, сочетая микробиологический метод и ВЭЖХ, что позволило получить более полную картину эффективности разработанной методики импрегнации.
Микробиологический анализ имеет принципиальное значение, поскольку позволяет подтвердить сохранение АМА ванкомицина после воздействия различных физических и химических факторов в процессе импрегнации. Наличие зон ингибирования роста MRSA на протяжении всего периода наблюдения свидетельствует о том, что антибиотик сохраняет свою биологическую активность, несмотря на потенциально возможные структурные изменения под влиянием давления, температуры и химических агентов. Высокая корреляция между размером зон ингибирования и концентрацией антибиотика ( r = 0,908; p < 0,001) подтверждает высвобождение из тестируемых образцов активной формы препарата.
В свою очередь, ВЭЖХ обеспечивает количественную оценку кинетики элюции ванкомицина, позволяя определить точные концентрации препарата в различные временные точки. Это дает возможность построить детальные фармакокинетические профили, оценить равномерность выхода и определить суммарное высвобождение антибиотика. Анализ AUC и характера экспоненциального снижения концентрации ( R2 > 0.91) демонстрирует преимущества оптимизированной методики импрегнации в отношении пролонгированной доставки препарата.
Остеозамещающий материал, используемый в исследовании, характеризуется оптимальной пористой структурой, сопоставимой с другими материалами, применяемыми в костной пластике. Аутографты и аллографты имеют пористость 50–90 % с размером пор 100–500 мкм. Синтетические материалы демонстрируют следующие показатели: гидроксиапатит — пористость 30–90 % с порами 100–400 мкм; трикальцийфосфат — пористость 35–80 % с порами 100–400 мкм; биоактивные стекла — пористость 20–60 % с порами 100–500 мкм. Биополимеры, такие как коллагеновые матрицы (пористость 85–95 %, поры 50–350 мкм) и PLLA скаффолды (пористость 60–90 %, поры 100–500 мкм), также обладают развитой пористой структурой [38, 39]. Такая архитектоника материала обеспечивает большую площадь поверхности для взаимодействия с антибиотиками, что подтверждается на примерах импрегнации синтетических остеозамещающих материалов [40–42]. Губчатая структура такого изделия позволяет достичь высокой степени адсорбции антибиотика, что в сочетании с оптимальными условиями импрегнации (давление, растворитель, время) обеспечивает стабильное и контролируемое высвобождение препарата. При этом важно отметить, что, несмотря на высокие локальные концентрации антибиотика, достигаемые в ходе элюции, применение ванкомицина остается безопасным с точки зрения потенциальной токсичности. В концентрациях до 1000 мкг/мл ванкомицин не оказывает значимого цитотоксического действия на остеобласты, подтверждая свою безопасность для костной ткани при локальном применении [43]. Результаты лабораторных исследований, несмотря на высокие местные концентрации антибиотика (до 1400 мкг/мл), демонстрируют минимальные системные уровни ванкомицина (менее 1,5 мг/мл) и отсутствие нефротоксичности, подтвержденное отсутствием статистически значимых изменений в уровнях креатинина и мочевины после операции ( р > 0,05) [15]. Более того, экспоненциальный характер высвобождения антибиотика ( R2 > 0,91 для методик 3-7) обеспечивает постепенное снижение локальных концентраций, что дополнительно повышает безопасность применения материала.
Важно отметить, что в условиях клинического применения, когда импрегнированный аллографт подвергается импакции в костном ложе, можно ожидать еще более длительного периода высвобождения антибиотика. Это связано с тем, что компрессия материала создает дополнительные диффузионные барьеры, замедляющие элюцию препарата. Данное предположение требует дальнейшего изучения в условиях in vivo , однако уже полученные результаты позволяют прогнозировать достаточную длительность антимикробного эффекта для профилактики и лечения периимплантной инфекции.
Проведенное исследование позволило определить оптимальные параметры импрегнации остеозамещающего материала на основе губчатой аллокости ванкомицином для обеспечения пролонгированной элюции антибиотика. Полученные результаты открывают перспективы для создания новых протоколов локальной антибиотикотерапии в ортопедической хирургии. Предложенная методика является перспективной для получения материала для остеозамещения в условиях инфекционного процесса с целью формирования локального депо антибиотика с контролируемым высвобождением для применения в комплексном лечении пациентов с периимплантной инфекцией.
ЗАКЛЮЧЕНИЕ
Установлено, что наибольшее влияние на эффективность импрегнации оказывает давление, за которым следуют тип растворителя и время экспозиции. Комбинация пониженного давления, спиртового раствора с добавлением поливинилпирролидона и оптимального времени экспозиции обеспечила наилучшие результаты, значительно превосходящие традиционные методики. Разработанная методика позволяет достичь более равномерного высвобождения антибиотика с пологим наклоном экспоненциальной кривой элюции, что обеспечивает поддержание терапевтически значимых концентраций ванкомицина в течение двух недель. Это существенно превышает показатели стандартных методов локальной антибиотикотерапии и создает предпосылки для эффективной профилактики и лечения периимплантной инфекции. Высокая корреляция между концентрацией антибиотика и зонами подавления роста MRSA подтверждает сохранение биологической активности ванкомицина после процесса импрегнации, что имеет принципиальное значение для клинического применения.


