Экспериментальное обоснование и выбор способа радиочастотной аблации при солитарных опухолях
Автор: Кошель А.П., Зуева Е.П., Клоков С.С., Севастьянова Н.В., Мартынюк А.К., Толстых А.С., Списивцев С.А., Разина Т.Г., Крылова С.Г., Амосова Е.Н., Ефимова Л.А., Лопатина К.А., Сафонова Е.А., Гомбоев Т.д
Журнал: Сибирский онкологический журнал @siboncoj
Рубрика: Лабораторные и экспериментальные исследования
Статья в выпуске: 5 (41), 2010 года.
Бесплатный доступ
С целью изучения противоопухолевого и противометастатического действия радиочастотных токов с различным време- нем экспозиции выполнено экспериментальное исследование на 45 мышах с карциномой легких Льюис. На 10-е сут после перевивки животные были распределены на 3 группы: контроль - животные с опухолями без воздействий (n=15); группа № 1 - одномоментное, однократное воздействие 2 электродами (n=15); группа № 2 - одномоментное, однократное воздей- ствие 4 электродами (n=15). Продолжительность эксперимента составила 21 сут. По результатам эксперимента показано, что воздействие на первичную опухоль радиочастотными токами с использованием 4 электродов одновременно приводит к достоверному (p
Радиочастотная аблация, экспериментальная опухоль
Короткий адрес: https://sciup.org/14055678
IDR: 14055678
Текст научной статьи Экспериментальное обоснование и выбор способа радиочастотной аблации при солитарных опухолях
Возможность выполнения оперативных вмешательств у пациентов с первичными и метастатическими опухолями печени до настоящего времени не превышает 10 % [7, 10]. При этом среди причин низкой резектабельности не последнее место занимает необходимость значительного расширения объема операции, особенно при наличии 2 и более очагов, что при сомнительной радикальности вмешательства сопряжено со значительным увеличением степени операционного риска у ослабленных онкологических больных. Использование же малоинвазивных методов деструкции опухоли (радиочастотная термоаблация) в комплексном лечении данных пациентов позволяет рассчитывать на увеличение пятилетней продолжительности жизни до 35,4 % [3]. В настоящее время методы локальной деструкции получили широкую распространённость, несмотря на сравнительно короткую историю их клинического применения. Область их применения в онкологии – лечение пациентов с опухолевым поражением печени, почек, лёгких и костей [14].
Все известные в настоящее время методы локальной деструкции можно разделить на химические и физические. К первым относят алкоголизацию очагов, введение в опухоль гипертонического раствора или цитостатиков, ко вторым – различные методики холодовой и тепловой деструкции [18]. На практике чаще применяется методы теплового разрушения опухолевых тканей, из них радиочастотная термоаблация (РЧА) является одним из наиболее перспективных [2, 12,]. Его можно использовать как в самостоятельном виде, так и в комбинации с другими деструктивными, лекарственными и традиционными хирургическими методами лечения опухолевых поражений печени [6, 8, 9]. В хирургии печени РЧА впервые была применена J. P. McGahan et al. d 1990 г. [16]. Основное ее назначение – чрескожная, лапароскопическая или «открытая» термодеструкция опухолей. В России клиническое использование технологии РЧА только начинается, и пока не существует единого взгляда на возможности данной методики [5].
Цель исследования – изучение противоопухолевого и противометастатического действия радиочастотных токов с различным временем экспозиции в эксперименте на мышах с карциномой легких Льюис.
Материал и методы
Эксперименты выполнены на половозрелых животных: 45 мышах-самках линии С57ВL/6 массой 19–21 г, конвенциональных, 1 категории, полученных из отдела экспериментального биомоделирования НИИ фармакологии СО РАМН (г. Томск). Содержание животных осуществлялось в соответствии с правилами, принятыми Европейской Конвенцией по защите позвоночных животных, используемых для экспериментальных и иных научных целей [11]. Экспериментальные исследования проведены в соответствии с правилами лабораторной практики (GLP), приказом МЗ РФ № 267 от 19.06.03. «Об утверждении правил лабораторной практики», Федеральном законом «О лекарственных средствах» (статья 36), «Руководством по экспериментальному (доклиническому) изучению новых фармакологических веществ» (Москва, 2005).
В качестве экспериментальной модели взята карцинома легких Льюис [15], которая перевивается на 12–14-е сут роста, средняя продолжительность жизни животных – 24 дня. После выдерживания животных в карантине в течение 10 дней с целью адаптации к условиям вивария мыши взвешены и равномерно распределены на группы. Карцинома легких перевита подкожно по 5–6×10 6 клеток в 0,1 мл физиологического раствора [4]. На 10-е сут после перевивки животных равномерно распределили на следующие группы:
Контроль – животные с опухолями без воздействий (n=15).
Группа № 1 – одномоментное, однократное воздействие 2 электродами на 10-е сут развития опухоли (n=15).
Группа № 2 – одномоментное, однократное воздействие 4 электродами на 10-е сут развития опухоли (n=15).
Продолжительность эксперимента составила 21 сут. Для радиочастотной термоаблации использовали опытный образец деструктора онкологического (ДО-01). Аппарат состоит из генератора (мощность 80 Вт, частота колебаний 440 кГц) и дополнительных опций (контроль импеданса и температуры), а также перисталь-тирующего насоса, подающего охлаждающую жидкость (стерильный физиологический раствор) и набора охлаждаемых электродов длиной 15 см с рабочей частью 1 см. Контроль температуры в зоне воздействия осуществляли с помощью термодатчика. Время работы определялось автоматически по достижении заданного импеданса – 350 Ом.
После обработки операционного поля рабочие электроды вводили в опухоль, на всю длину его рабочей части, отступая от края опухоли 3–5 мм. В группе № 1 воздействие радиочастотными токами проводилось однократно с помощью 2 электродов (рис. 1). В группе № 2 однократное воздействие на опухоль осуществляли с помощью 4 электродов одновременно (рис. 2). Воздействие проводилось мощностью 2 Вт при сопротивлении 350 Ом. В ходе манипуляции контролировалась температура тканей, которая составляла 80–100°С. Эффективность
Рис. 1. Схема расположения электродов по отношению к опухоли в группе экспериментальных животных № 1
Рис. 2. Схема расположения электродов по отношению к опухоли в группе экспериментальных животных № 2
лечебных воздействий оценивали на 21-е сут опыта, измеряя массу новообразования и подсчитывая процент торможения роста опухоли (ТРО) по формуле
А- В tpo =--100%,
А где А – средняя масса опухоли в контрольной группе; В – средняя масса опухоли в опытной группе.
Для определения интенсивности процесса метастазирования использовано несколько показателей: количество метастазов в легких (для каждого животного в группе и среднее значение); площадь метастатического поражения, которую рассчитывают по формуле πr 2 , определяя при этом диаметр метастазов.
Частоту метастазирования опухоли вычисляли в процентах по отношению числа животных с метастазами к общему количеству мышей в группе. Индекс ингибирования метастазирова- ния (ИИМ), который позволяет оценить степень метастатического поражения, рассчитывали по формуле [1]
ИИМ = Лк х Вк × 100 %, где А к и А – частота метастазирования в лёгкие у мышей контрольной и опытной групп; В к и В – среднее число метастазов в лёгких в контрольной и опытной группах.
В случае значительного поражения легочной ткани, когда регистрировалось большое количество метастатических узлов, оценивали степень метастатического поражения по шкале, предложенной D. Tarin, J.E. Price (1979) и позволяющей дифференцировать тяжесть поражения в зависимости от количества метастазов и их размеров. Выделяли низкую (LCP – low colonization potential: 1 степень – <10 узлов и 2 степень – от 10 до 30) и высокую (HCP – high colonization potential: 3 степень – >30 узлов, отсутствуют сливные узлы; 4 – <100, есть сливные и 5 – >100 узлов) степень поражения легких. По окончании экспериментов мышей умерщвляли, соблюдая «Правила проведения работ с использованием экспериментальных животных», утвержденные Министерством здравоохранения РФ.
Результаты и обсуждение
У мышей контрольной группы (без воздействий) объём опухоли закономерно повышался на протяжении всего эксперимента. В основной группе № 1 обнаружена тенденция к уменьшению массы опухолевого узла в 1,5 раза по сравнению с контролем. Процент торможения роста опухоли составил 33 %. Частота метастазирования, количество и площадь метастазов в данной группе достоверно не отличались от таковых в контроле, при этом 37,5 % мышей имели более высокую – 3 степень поражения, тогда как в контроле этот показатель составил 8,3 % (табл. 1, 2).
В группе № 2 применение деструктора вызвало достоверное торможение опухолевого роста (65 %), а масса опухоли уменьшилась в 2,9 раза. Кроме того, в данной группе отмечалось снижение количества метастазов в легкие – в 1,6 раза по сравнению с аналогичными значениями в контроле, в 2,6 раза уменьшилась площадь
Влияние режимов РЧА на развитие карциномы легких Льюис (Х ± m)
Таблица 1
|
Группы сравнения |
Масса опухоли, г |
Торможение роста опухоли, % |
Частота метастазирования, % |
Кол-во метастазов на 1 мышь |
Площадь метастазов на 1 мышь, мм2 |
ИИМ, % |
|
Контроль |
2,36 ± 0,35 |
- |
100 |
22,58 ± 3,55 |
17,99 ± 5,46 |
- |
|
РЧА, режим № 1 |
1,57 ± 0,25 |
33 |
100 |
24,38 ± 2,96 |
21,61 ± 7,74 |
-8 |
|
РЧА, режим № 2 |
0,82 ± 0,13* |
65 |
100 |
14,00 ± 2,62** |
7,02 ± 1,99 |
38 |
Примечание: * – различия статистически значимы по сравнению с группой контроля (p<0,01); ** – различия статистически значимы по сравнению с группой контроля (p<0,05).
Влияние режимов РЧА на тяжесть метастатического поражения легких у экспериментальных животных
Таблица 2
|
Группа сравнения |
Степень поражения легких метастазами, % |
|||||
|
Нет метастазов |
LCP |
HCP |
||||
|
1 |
2 |
3 |
4 |
5 |
||
|
Контроль |
- |
16,7 |
75 |
8,3 |
- |
- |
|
РЧА, режим № 1 |
- |
25 |
37,5* |
37,5* |
- |
- |
|
РЧА, режим № 2 |
- |
33,3 |
66,7 |
- |
- |
- |
Примечание: * – различия статистически значимы по сравнению с группой контроля (p<0,05).
метастазов. Все животные имели 1-ю и 2-ю степень метастатического поражения, индекс ингибирования метастазирования составил 38 % (табл. 1, 2).
Объём опухоли у животных в обеих основных группах на 7-е сут имел выраженную
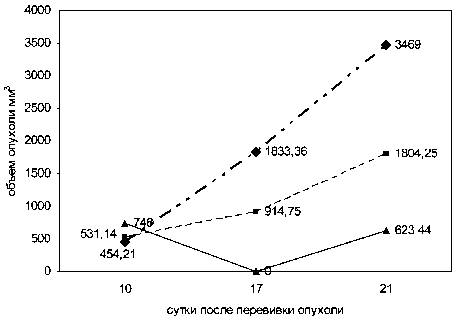
—ф. - группа контроля —■—деструкция, №1 —*—деструкция, №2
Рис. 3. Динамика роста объема перевиваемой опухоли в сравниваемых группах экспериментальных животных тенденцию к уменьшению. При этом наиболее существенно он уменьшился в группе № 2, в которой отмечались лишь некротические участки на месте расположения опухоли. Несмотря на то, что на 21-е сут после трансплантации опухоли её объём в обеих экспериментальных группах вновь стал увеличиваться, он всё ещё статистически значимо отличался от группы контроля (рис. 3).
Заключение. Таким образом, в эксперименте на мышах-самках линии С57Вl/6 с карциномой лёгких Льюис показано, что воздействие на первичную опухоль радиочастотными токами с использованием 4 электродов одновременно приводит к достоверному торможению роста первичного опухолевого узла и снижению количества отдаленных метастазов. Полученные данные позволяют говорить о перспективности применения РЧА у пациентов с первичными и метастатическими опухолями печени как в плане лечения опухоли, так и в плане предупре- ждения отдаленного метастазирования. Вместе с тем небольшое количество наблюдений требует проведения дальнейших экспериментальных и клинических исследований.


