Экспериментальное обоснование применения коллагеновых мембран для реконструкции полнослойных дефектов гиалинового хряща
Автор: Лазишвили Г.Д., Егиазарян К.А., Никишин Д.В., Воронцов А.А., Шпак М.А., Клинов Д.В., Сиротин И.В.
Журнал: Хирургическая практика @spractice
Рубрика: Статьи
Статья в выпуске: 1 (41), 2020 года.
Бесплатный доступ
Статья посвящена изучению в экспериментальных условиях эффективности технологии AMIC при хирургическом лечении полнослойных дефектов гиалинового хряща. Цель исследования - изучить биологический потенциал коллагеновых мембран и их способность к трансформации в хрящевую ткань. Исследование проводилось на 4-х свиньях. На суставах задних конечностей формировались полнослойные дефекты хряща и имплантация 2-х разных по структуре и составу коллагеновых мембран. Животные выводились из эксперимента в сроки 2,3,4,6 месяцев после операции. В статье представлен морфологический анализ характера регенерации хрящевой ткани через 6 месяцев после операции. Исследование показало высокий биологический потенциал коллагеновых мембран и их возможность трансформироваться в гиалиновый хрящ.
Хрящ, локальные дефекты хряща, коленный сустав, технология amic, костно-хрящевой дефект, коллагеновая мембрана, мозаичная пластика
Короткий адрес: https://sciup.org/142226478
IDR: 142226478 | УДК: 617.3 | DOI: 10.38181/2223-2427-2020-1-45-52
Текст научной статьи Экспериментальное обоснование применения коллагеновых мембран для реконструкции полнослойных дефектов гиалинового хряща
Введение: Проблема хирургического лечения локальных полнослойных поражений гиалинового хряща коленного сустава (КС) остается актуальным направлением современной травматологии и ортопедии [1,2,3]. На долю данной патологии приходится до 10-25% клинических случаев, среди всех травм и заболеваний КС [4,5,6,7,8.9,10]. Нередко локальные полнослойные дефекты хряща КС не имеют клинических и МРТ проявлений, а являются операционными находками. Примечателен тот факт, что, в подавляющем большинстве случаев, данному заболеванию подвержены лица молодого, трудоспособного возраста, а последствия данного заболевания имеют больше социальное и экономическое значение [5,9,10,11,12,13].
До сих пор в отечественной литературе нет единых показаний к хирургическому лечению полнослойных поражений хряща; отсутствуют четкие рекомендации в отношении выбора методики хирургической коррекции хрящевых дефектов; не определены показания и не изучены результаты использования биотехнологий для восстановления хрящевой ткани; нет четких рекомендаций по использованию коллагеновых мембран и др. Эти и многие другие факторы определяют актуальность данного направления хирургии и целесообразность изучения биологического потенциала коллагеновых матриц для восстановления полнослойных поражений хрящевой ткани.
За последнее десятилетие для восстановления хрящевых дефектов в клиническую практику стали широко внедряться разнообразные биотехнологии, в том числе и технология индуцированного матрицей аутохондрогенеза - AMIC (autologous matrix indused chondrogenesis) [1,8,13,14]. Она основана на туннелизации субхондральной кости, для обеспечения транспорта на поверхность дефекта костного мозга, и регенеративной способности его стромальных клеток. Образующийся в результате этого «суперсгусток» костного мозга стабилизируется коллагеновой мембраной, имплантируемой в зону поражения хряща.
Несмотря на многочисленные исследования в этой области и широкое использование технологии AMIC в мировой клинической практике, остается много спорных и нерешенных вопросов, таких как: сроки деградации и характер трансформации коллагеновых мембран, степень выдерживаемой ими нагрузки, вид и качество вновь образованной хрящевой ткани и др.
Высокая стоимость коллагеновых мембран, произведенных зарубежными компаниями, ограничивает их широкое применение в отечественном здравоохранении. Однако, высокая потребность в выполнении операций по восстановлению дефектов хряща определила необходимость разработки отечественного аналога, отвечающего всем современным требованиям, предъявляемым клиницистами к коллагеновым мембранам.
Цель исследования: экспериментальным путем изучить биологический потенциал коллагеновых мембран и их способность к трансформации в хрящевую ткань.
В работе использовались два вида коллагеновых мембран. Мембрана Chondro-Gide (контрольная мембрана, производство зарубежной компании) – синтезирована из свиного коллагена 1 и 3-го типа (Рис.1а). Мембрана имеет двухслойную структуру (Рис.1б). Плотный поверхностный слой препятствует проникновению клеток костного мозга в полость сустава, что обеспечивает стабилизацию сгустка костного мозга на поверхности субхондральной кости. Пористый слой мембраны состоит из рыхлых коллагеновых волокон, способствующих проникновению клеток в мембрану и их адсорбции. Мембрана Chondro-Gide является одним из самых востребованных биопродуктов для восстановления хрящевой ткани и широко используется в клинической практике. Именно поэтому она выбрана нами в качестве контрольной мембраны.

Рис.1. Коллагеновая мембрана Chondro-Gide (а) и ее двухслойная структура (б)
Мембрана Ортософт (основная мембрана, разработка отечественных ученых). Мембрана сформирована методом электроспиннинга из нановолокон диаметром 300-500 нм, состоящих из смеси полилактида и бычьего коллагена I-го типа. Мембрана имеет одинаковый микрорельеф и смачиваемость с обеих сторон (Рис.2а). Метод формирования мембраны и ее структура (Рис.2б) радикально отличают ее от мембраны Chondro-Gide, что позволяет произвести объективный сравнительный анализ биологического потенциала обеих мембран и качество их трансформации в хрящевую ткань.

Рис.2. а - мембрана Ортософт. б – сканирующая электронная микроскопия показывает рост клеток на мембране.
Модель эксперимента: исследование проводилось на 4-х свиньях породы «русская белая». Настоящее экспериментальное исследование не противоречило этическим нормам и Международным требованиям по гуманному отношению к лабораторным (экспериментальным) животным, а также ГОСТ Р ИСО 10993-1-2009 «Изделия медицинские».
Исследование выполнено с использованием аналгетиков системного действия, применяемых в ветеринарии и клинической медицине в соответствующих для конкретного животного дозировках. Респираторная поддержка при помощи наркозно-дыхательного аппарата, путем ингаляции кислородно-воздушной смеси по полузакрытому контуру.
На суставах двух задних конечностей каждого животного, с помощью круглого бора формировались полнослойные дефекты хряща прямоугольной формы, размером 1х0,5 см, доходящие до субхондральной кости (Рис.3а). На каждом суставе левых конечностей формировали по два дефекта: контрольный дефект (№1) - без имплантации мембраны, дефект (№2) – для имплантации мембраны Chondro Gide (Рис.3б).
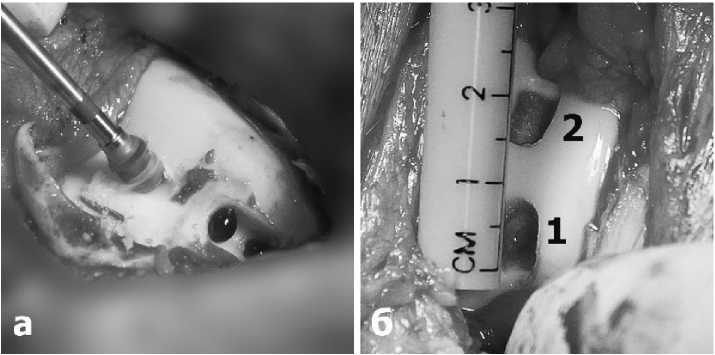
Рис.3. а-формирование хрящевых дефектов бором на левой конечности; б-сформировано 2 полнослойных дефекта хряща (1-контрольный дефект, 2-для имплантации мембраны Chondro-Gide).
На суставах правых конечностей формировался один дефект (№3) – для имплантации мембраны Ортософт. Первым трем животным перед имплантацией мембран выполнялась туннелизация субхондральной кости тонким сверлом (диаметр 1,5 мм); четвертому животному туннелизация не выполнялась. Мембраны моделировались по форме и размеру дефектов, и фиксировались к субхондральной кости с помощью фибринового клея (Рис.4).

Рис.4. а - форма и размеры дефекта хряща № 3 после туннелизации субхондральной кости; б - этап имплантации коллагеновой мембраны Ортософт; в - дефект хряща после иплантации коллагеновой мембраны;
Животные выводились из эксперимента в сроки 2,3,4,6 месяцев после операции. Для последующего морфологического исследования предоставлялось по 2 крупных костных фрагмента с имплантированными мембранами (Рис.5). Из каждой области эксперимента забирались по 3 фрагмента: из самых крайних точек и из центра. Образцы тканей фиксировали в нейтральном 7%-м формалине. В дальнейшем проводилась декальцинация этих фрагментов. Далее проводили через батарею спиртов возрастающей концентрации и заливали в парафин. Парафиновые срезы толщиной 5-7 мкм окрашивали гематоксилином – эозином и по методу Ван-Гизона.
Используя микроскоп с разрешением 12 мегапикселей, с каждого гистологического препарата проводили оценку: воспалительной реакции, клеточного состава, коллагеновых волокон, остеогенеза. Кроме этого изучалась толщина: интактного хряща; хряща у края вмешательства; хряща в центре вмешательства; соединительной ткани в области имплантации; кортикальной пластинки в интактной области; кортикальной пластинки у края вмешательства; кортикальной пластинки в центре вмешательства; площадь кровеносных сосудов; объемы костной ткани; объем хрящевой ткани; объем соединительной ткани; объем кровеносных сосудов.
Ниже представлен макро и микроскопический анализ характера регенерации хрящевой и костной тканей через 6 месяцев после туннелизации субхондральной кости и имплантации коллагеновых мембран.
При макроскопическом анализе дефекта № 1 (без имплантации мембран) отмечалось прогрессирующее увеличение его размеров без признаков регенерации хрящевой ткани на поверхности дефекта (Рис.5а). Микроскопическое исследование показало признаки прогрессирующей деструкции костной ткани и отсутствие признаков хондрогенеза. Исход операции расценен как неудовлетворительный. В связи с этим мы не будем представлять результаты гистологического исследования биологических материалов из зоны дефекта №1. Это экспериментальное наблюдение еще раз подтверждает низкую эффективность одной лишь туннелизации субхондральной кости, что ставит под сомнение целесообразность выполнения подобных операций.
В тоже время поверхность дефектов № 2 и 3 (с имплантацией мембран) была выстлана стабильной, однородной консистенции, жизнеспособной хрящевой тканью (Рис.5а,б). Увеличения размеров дефектов не наблюдалось. Макроскопические результаты операции расценены как хорошие.
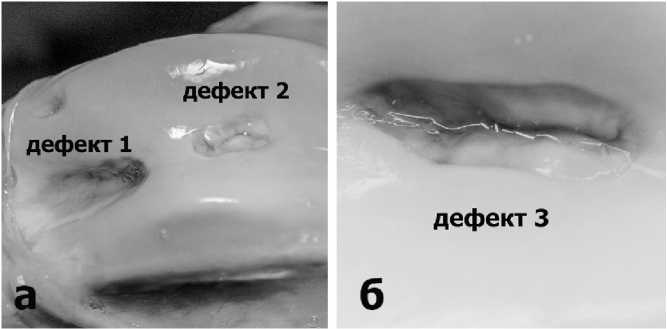
Рис.5. Макроскопическая картина костно-хрящевых дефектов через 6 месяцев после их формирования и имплантации коллагеновых мембран.
Представляем микроскопический анализ характера регенерации костно-хрящевых дефектов. Исследовались биологические материалы из разных участков дефекта. Для данной публикации представлен гистологический анализ тканей только из центральной части дефектов 2 и 3.
Дефект № 2 (имплантация мембраны Chondro-Gide). При исследовании гистологических стекол, окрашенных гематоксилином и эозином, воспалительного процесса, лейкоцитарной инфильтрации, не выявлено. Граница разрушенного хряща, не четкая. По центру сформировалась щелевидная полость, подлежащая костная ткань подверглась резорбции (глубина резорбции несколько уменьшилась по сравнению с 3-х месячным результатом), на месте резорбированной костной ткани сформировалась грубоволокнистая соединительная ткань, с тенденцией к образованию костной ткани по краю дефекта и множественными островками хондроцитов в толще дефекта. Дефект имеет колбообразную форму, и формирование неохондроцитов происходит активнее в направлении от периферии к центру. Имеются отдельные щелевидные полости в толще грубоволокнистой соединительной ткани. На дне дефекта между соединительной тканью и костной тканью формируется довольно выраженная прослойка, состоящая из жировых клеток. Процессы неоангиогенеза выраженные. Также в толще соединительной ткани форми- руются островки хондроцитов (Рис.6). Результаты морфометрии представлены в Таблице 1.
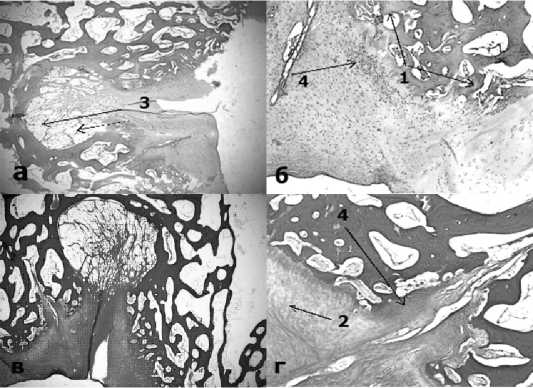
Рис.6. Микроскопический анализ центральной части дефекта № 2 после имплантации мембраны Chondro Gide. А - окраска гематоксилином и эозином, х40; Б-окраска гематоксилином и эозином, х100; В – окраска по методу Ван-Гизона, х40; Г - окраска по методу Ван-Гизона, х100. 1. Формирование остеоида (новобразованной костной ткани); 2. Грубоволокнистая соединительная ткань; 3. Адипоциты (жировые клетки). 4.
Неохондрогенез (новообразованные хондроциты).
Таблица 1
Размерные характеристики гистологического строения центра дефекта № 2
|
Min |
Max |
Mean |
Standard Error |
|
|
Толщина интактного хряща, мкм |
690,23 |
993,28 |
838,67 |
19,12 |
|
Толщина хряща у края вмешательства, мкм |
131,19 |
394,09 |
247,98 |
17,11 |
|
Толщина хряща в центре вмешательства, мкм |
162,53 |
377,61 |
252,68 |
12,19 |
|
Толщина соединительной ткани в области имплантации, мкм |
575,94 |
1587,86 |
900,58 |
72,43 |
|
Толщина кортикальной пластинки в интактной области, мкм |
47,57 |
154,95 |
102,18 |
6,60 |
|
Толщина кортикальной пластинки у края вмешательства, мкм |
42,21 |
154,61 |
94,71 |
6,78 |
|
Толщина кортикальной пластинки в центре вмешательства, мкм |
137,21 |
237,80 |
184,76 |
5,48 |
|
Площадь кровеносных сосудов, мкм2 |
831595,17 |
1865128,00 |
1304367,94 |
78063,84 |
|
Объем костной ткани, % |
14,99 |
19,90 |
17,41 |
0,36 |
|
Объем хрящевой ткани, % |
8,20 |
17,80 |
15,04 |
0,72 |
|
Объем соединительной ткани, % |
11,35 |
20,10 |
17,03 |
0,56 |
|
Объем кровеносных сосудов, % |
9,17 |
15,60 |
11,91 |
0,42 |
Таким образом, при гистологическом исследовании центральной части дефекта 2 были отмечены ускоренные репаративные процессы, формирование островков хрящевой ткани в непосредственной близости к суставной поверхности. Также отмечены незначительные изменения глубины дефекта. Из негативных моментов отмечается образование прослойки жировых клеток между соединительно-тканной мозолью и костной тканью, а также наличие щелевидной полости.
Дефект № 3 (имплантация мембраны Ортософт). При исследовании гистологических стекол, окрашенных гематоксилином и эозином, воспалительного процесса, лейкоцитарной инфильтрации, не выявлено. Выявляется размытая граница разрушенного хряща, подлежащая костная ткань подверглась резорбции, на месте резорбированной костной ткани сформировалась преимущественно грубоволокнистая соединительная ткань и фибрин, с тенденцией к образованию костной ткани. Губчатое вещество – идентично группе с Chondro-Gide. Также произошли изменения в области дефекта. Он разделился на 2 части. Первая часть локализовалась в костной ткани и была представлена округлой полостью, отграниченной сплошным рядом костных трабекул. Полость была заполнена соединительной тканью, фибрином и кровеносными сосудами (имеет минимальные размеры, практически полностью закрылась). Вторая часть располагается на месте поврежденного хряща была представлена грубоволокнистой тканью и хондроцитами примерно в равной степени. Причем, толщина восстановилась до исходных значений толщины не поврежденного хряща. Обе эти части не разграничены кортикальной пластинкой костной ткани. Формирование неохондроцитов происходит как в направлении от периферии к центру, так и отдельными островками по всей толще грубоволокнистой соединительной ткани. Процессы неоангиогенеза выраженные. Также в толще со- единительной ткани формируются островки хондроцитов. На дне происходит формирование адипоцитов (Рис.7). Результаты морфометрии представлены в Таблице 2.
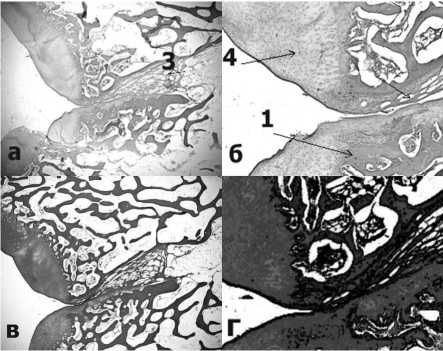
Рис.7. Микроскопический анализ центральной части дефекта № 3 после имплантации мембраны Ортософт. А. окраска гематоксилином и эозином, х40; Б. окраска гематоксилином и эозином, х100; В. окраска по методу Ван-Гизона, х40; Г. окраска по методу Ван-Гизона, х100. 1. Формирование остеоида (новобразованной костной ткани); 2. Грубоволокнистая соединительная ткань; 3. Адипоциты (жировые клетки). 4. Неохондрогенез (новообразованные хондроциты).
Таким образом, при гистологическом исследовании центральной части образца отмечены ускоренные репаративные процессы (не уступающие, а в некоторых моментах превосходящих Chondro-Gide), формирование островков хрящевой ткани в непосредственной близости к суставной поверхности, а также восстановление толщины поврежденного хряща. В отличие от всех групп мембрана Ортософт показала более короткие сроки закрытия дефекта и ускоренные репаративные процессы.
Таблица 2
Размерные характеристики гистологического строения центра дефекта № 3
|
Min |
Max |
Mean |
Standard Error |
|
|
Толщина интактного хряща, мкм |
804,43 |
981,34 |
886,35 |
10,44 |
|
Толщина хряща у края вмешательства, мкм |
286,13 |
551,29 |
377,50 |
17,06 |
|
Толщина хряща в центре вмешательства, мкм |
231,90 |
422,67 |
335,94 |
13,47 |
|
Толщина соединительной ткани в области имплантации, мкм |
1198,61 |
2283,81 |
1688,66 |
71,60 |
|
Толщина кортикальной пластинки в интактной области, мкм |
47,93 |
122,20 |
84,53 |
5,15 |
|
Толщина кортикальной пластинки у края вмешательства, мкм |
31,58 |
131,87 |
91,66 |
5,75 |
Продолжение Таблицы 2.
|
Толщина кортикальной пластинки в центре вмешательства, мкм |
50,11 |
286,96 |
142,66 |
19,93 |
|
Площадь кровеносных сосудов, мкм2 |
990806,30 |
2176230,00 |
1398323,80 |
73734,31 |
|
Объем костной ткани, % |
27,30 |
32,70 |
30,23 |
0,34 |
|
Объем хрящевой ткани, % |
16,90 |
24,70 |
19,99 |
0,43 |
|
Объем соединительной ткани, % |
13,80 |
22,47 |
18,19 |
0,53 |
|
Объем кровеносных сосудов, % |
9,50 |
18,10 |
12,79 |
0,65 |
Выводы. Подводя итог, хотим отметить, что оба исследуемых материала показали отличные результаты в регенерации гиалинового хряща. Однако более детальный анализ данных гистологического исследования выявил следующие особенности:
-
• Мембрана Ортософт в месте дефекта создавала более благоприятные условия для репаративных процессов, что подтверждается самыми короткими сроками закрытия дефекта собственной соединительной тканью. Созревание соединительной ткани протекает в более короткие сроки.
-
• В зоне имплантации мембраны Ортософт, хондрогенез протекал по «рассыпному» типу – в сформированной грубоволокнистой соединительной ткани появлялись «островки» гиалинового хряща. Данные островки первоначально располагались на удалении друг от друга, но имели тенденцию к слиянию между собой. И процессы неохондрогенеза протекали не только на границе со здоровой тканью, но и в толще соединительно-тканной мозоли. В отличие от зоны имплантации мембраны Chondro-Gide, где выявлялся только «краевой» неохондрогенез. Во всех случаях хрящевая ткань, при неохондрогенезе, была представлена гиалиновым хрящом.
-
• Эффективность мембраны Оортософт подтверждается цифровыми значениями объема костной и хрящевой ткани. Эти значения статистически достоверно преобладают над цифрами соответствующих параметров при применении мембраны Chondro-Gide.
Таким образом, проведенное исследование подтвердило эффективность применения коллагеновых мембран для регенерации хрящевой ткани.
В заключении можно подвести промежуточный итог. С одной стороны, выполненная работа, безусловно, позволяет сделать конкретные практические выводы и обозначает ориентиры для будущих исследователей. Работа в очередной раз подтверждает эффективность и перспективность применения технологии AMIC в различных случаях повреждений суставного хряща. С другой стороны, эксперимент отчетливо показывает, что практика туннелизации субхондральной кости без использования мембран не имеет под собой обоснованной базы и не вносит заметный вклад в процесс восстановление хрящевой ткани.
Также работа однозначно демонстрирует перспективы дальнейшего развития технологии AMIC с появлением новых материалов. Эксперимент показал, что композитная мембрана Ортософт не уступает, а в ряде случаев превосходит показатели существующей мембраны. В случае применения мембраны Chondro-Gide образование гиалинового хряща происходит в основном по краям дефекта, в центре превалирует грубоволокнистая соединительная ткань и островки хондроцитов. В случае применения композитной мембраны Ортософт весьма показательны следующие моменты: во-первых, образование хрящевой ткани в процентном соотношение заметно выше; во-вторых, ярко выражены островки хрящевой ткани в центре дефекта по всей его толще, скорость репарации клеток выше, что и является причиной, большего объема хрящевой ткани, и что очень важно, почти не выражена жировая прослойка между вновь образованной тканью и субхондральной костью.
Какие вопросы мы можем адресовать будущим исследователям? Очень важно получить данные с более отдаленными исследованиями, а именно, более 6 месяцев. Также, были бы весьма интересными и ценными для практической области исследования с различными по составу мембранами. Еще больше оптимизма вызывает тот факт, что отечественные разработки и исследования продолжаются.
Список литературы Экспериментальное обоснование применения коллагеновых мембран для реконструкции полнослойных дефектов гиалинового хряща
- Гаркави А.В., Блоков М.Ю. Артроскопическая хондропластика локальных хрящевых дефектов коленного сустава с использованием коллагеновой мембраны Chondro-Gide // Кафедра травматологии и ортопедии. 2015. №3 (15). С.4 - 7.
- Лазишвили Г.Д., Егиазарян К.А., Ратьев А.П., Шпак М.А., Маглаперидзе И.Г. Гибридная костно-хрящевая трансплантация - новый способ хирургического лечения рассекающего остеохондрита коленного сустава // Georgian Medical News. 2019. №10 (295). С.7-13.
- Juneau C., Paine R., Chicas E., Gardner E., Bailey L., McDermott J. Current concepts in treatment of patellofemoral osteochondritis dissecans. Int J Sports Phys Ther. 2016, Vol.11, рр. 903-925.
- Егиазарян К.А., Лазишвили Г.Д., Храменкова И.В., Шпак М.А., Бадриев Д.А. Алгоритм хирургического лечения больных с рассекающим остеохондритом коленного сустава // Вестник РГМУ. 2018. №2. C.77-83.
- Лазишвили Г.Д., Егиазарян К.А., Ратьев А.П., Гордиенко Д.И., Бут-Гусаим А.Б., Чуловская И.Г., Сиротин И.В., Шпак М.А. Гибридная костно-хрящевая трансплантация - инновационная технология для хирургического лечения обширных костно-хрящевых дефектов коленного сустава. // Хирургическая практика. 2019. №4 (40). С.10-18.
- Котельников Г.П., Ларцев Ю.В., Кудашев Д.С., Зуев-Ратников С.Д., Шорин И.С. Мозаичная хондропластика в лечении больных с деструктивно-дистрофическими и посттравматическими поражениями гиалинового хряща в коленном суставе - экспериментальные и клинические аспекты // Фундаментальные исследования. Медицинские науки. 2013. №9. С.252 - 255.
- Маланин Д.А., Писарев В.Б., Новочадов В.В. Восстановление повреждений хряща в коленном суставе. Экспериментальные и клинические аспекты. М.: Волгоградское научное издательство, 2010. 455 с.
- Gao L., Orth P., Cucchiarini M., Madry H. Autologous Matrix-Induced Chondrogenesis: A Systematic Review of the Clinical Evidence. Am J Sports Med. 2019, No. 1 (47), pp. 222-231
- Kim S.H., Ha C.W., Park Y.B. Intra-articular injection of mesenchymal stem cells for clinical outcomes and cartilage repair in osteoarthritis of the knee: a meta-analysis of randomized controlled trials. Archives of Orthopadic and Trauma Surgery. 2019, Vol.139, рр. 971 - 980.
- Kon E., Filardo G., Brittberg M., Busacca M. et al. Multilayer biomaterial for osteochondral regeneration shows superiority vs microfractures for the treatment of osteochondral lesions in a multicentre randomized trial at 2 years. Knee Surgery Sports Traumatology Arthroscopy. 2018, Vol. 26, рр. 2704 - 2715.
- Герасименко М.А. Внутрисуставные хондральные и остеохондральные повреждения коленного сустава у пациентов молодого возраста // Новости хирургии. 2010. Том 18. №2. С.137 - 141.
- Howard J.S., Mattacola C.G., Romine S.E., Lattermann C. Continuous passive motion, early weight bearing, and active motion following knee articular Cartilage repair: evidence for clinical practice. Cartilage. 2010, Vol.1, рр..276-286.
- Benthien J.P., Behrens P. Autologous Matrix-Induced Chondrogenesis (AMIC) combining Microfracturing and a Collagen I/III Matrix for Articular Cartilage Resurfacing. Cartilage. 2010, №1, vol.1, рр. 65-68.
- Girolamo L., Schönhuber H.I., Vigano M. et al. Autologous MatrixInduced Chondrogenesis (AMIC) and AMIC Enhanced by Autologous Concentrated Bone Marrow Aspirate (BMAC) Allow for Stable Clinical and Functional Improvements at up to 9 Years Follow-Up: Results from a Randomized Controlled Study. Journal of Clinical Medicine. 2019, vol.8, No. 3, рр.392-405.


