Экспериментальное определение параметров амплификации полимеразной цепной реакции анализатора нуклеиновых кислот
Автор: Белов Д.А., Петров Д.Г., Белов Юрий Васильевич, Князьков Н.Н., Киселев И.Г.
Журнал: Научное приборостроение @nauchnoe-priborostroenie
Рубрика: Приборостроение физико-химической биологии
Статья в выпуске: 1 т.26, 2016 года.
Бесплатный доступ
Предложен способ определения основных параметров амплификации полимеразной цепной реакции в реальном времени (ПЦР-РВ): эффективности ПЦР и длительности температурного цикла. По результатам проведенных экспериментов и сравнительных расчетов определены режимы амплификации, обеспечивающие сокращение времени анализа и повышение производительности анализаторов нуклеиновых кислот.
Пцр в реальном времени, днк, пороговый цикл, эффективность пцр, длительность температурного цикла
Короткий адрес: https://sciup.org/14265007
IDR: 14265007 | УДК: 543.062;
Текст научной статьи Экспериментальное определение параметров амплификации полимеразной цепной реакции анализатора нуклеиновых кислот
Классический метод полимеразной цепной реакции (ПЦР) основан на периодическом изменении температуры (повторении температурных циклов) анализируемых образцов в заданном диапазоне. Основным функциональным блоком анализатора нуклеиновых кислот, обеспечивающим оптимальные условия ПЦР, является высокоточный циклический термостат (амплификатор ДНК) [1–2], обладающий высокими скоростями нагрева и охлаждения.
В настоящей статье на примере анализатора нуклеиновых кислот АНК-32, который серийно выпускается ИАП РАН [3], выполнен экспериментальный анализ двух основных параметров, определяющих производительность генетического анализатора: эффективности ПЦР и длительности температурного цикла.
Целью настоящей статьи является определение условий, при которых возможно достижение результатов анализа за минимальное время.
ОПРЕДЕЛЕНИЕ ЭФФЕКТИВНОСТИ ПЦР С ПОМОЩЬЮ МЕТОДА РАЗВЕДЕНИЙ
Основным результатом обработки сигналов при относительных количественных измерениях на анализаторах нуклеиновых кислот методом ПЦР в реальном времени (ПЦР-РВ) является определение пороговых циклов (далее — Ct), при которых сигналы флуоресценции образцов достигают постоянного уровня, выбранного оператором. В статьях [4–5] был выполнен анализ особенностей определения Ct.
Рост сигналов на начальной стадии ПЦР [6] происходит по экспоненциальному закону, согласно известной формуле (1):
А = М · (1 + Е ) n , (1)
где А — количество специфических продуктов амплификации; М — начальное количество ДНК-мишеней; n — число циклов амплификации; Е — значение эффективности реакции. Такое определение Е удобно для расчета эффективности в процентах от максимально возможного значения.
В данной статье рассчитывается усредненная эффективность на интервале времени от начала реакции до момента определения порогового цикла, включая небольшой участок линейного роста. При экспериментальном определении эффективности можно использовать методику относительных количественных измерений путем определения пороговых циклов Ct двух образцов с разной концентрацией.
Для приготовления тестовых растворов ДНК использовался раствор ДНК M. tuberculosis и реагенты, входящие в состав коммерческого набора для проведения ПЦР-РВ "Ампли-Туб-РВ" (производства ЗАО "Синтол", Россия) [7].
На рис. 1 в качестве примера приведены графики зависимости сигналов флуоресценции красителя ROX от номера температурного цикла тестовых образцов (образцы 2 мкл и реагенты 23 мкл в каждой пробирке).
Данные были получены при использовании параметров эксперимента, содержащего 40 температурных циклов от Т н = 63 °С до Т в = 95 °С с длительностью поддержания постоянной температуры (полок) соответственно t н = 40 с и t в = 15 с.
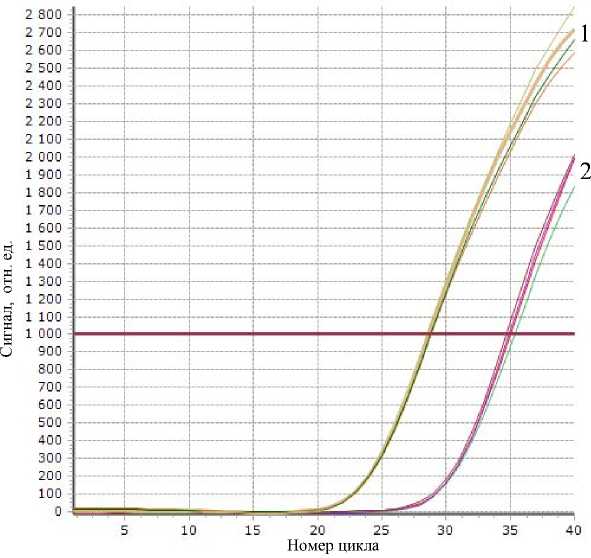
Рис. 1. Графики зависимости сигналов флуоресценции красителя ROX от номера температурного цикла тестовых образцов. Пучок кривых (1) — пробирки А5–А8 с высокой концентрацией тестовых образцов; пучок кривых (2) — пробирки А1–А4 с низкой (в 100 раз меньшей) концентрацией
Табл. 1. Результаты определения средних значений Ctс пороговых циклов Ct
|
№ пробирки |
FAM |
ROX |
||
|
Сt |
Сtc |
Сt |
Сtc |
|
|
A1 |
35.21 |
Ctc2: 35.64 |
34.98 |
Ctc2: 34.96 |
|
A2 |
35.64 |
35.31 |
||
|
A3 |
36.19 |
34.87 |
||
|
A4 |
35.52 |
34.66 |
||
|
A5 |
29.67 |
Ctc1: 29.00 |
28.72 |
Ctc1: 28.72 |
|
A6 |
28.94 |
28.79 |
||
|
A7 |
28.31 |
28.86 |
||
|
A8 |
29.07 |
28.52 |
||
|
ΔCtс |
6.64 |
6.23 |
||
|
Log 10 (1 + E ) |
0.30 |
0.32 |
||
|
E с (среднее E ) |
1.00 |
1.09 |
||
Скорости нагревания/охлаждения — 2 °С/c. Использовался режим предварительного прогревания — 900 с при 95 °С.
Графики получены после предварительной обработки с помощью программного обеспечения анализатора АНК-32: сглаживания (по Савицко-му—Голею), привязки к нулю и привязки к перегибу на уровне 1000 относительных единиц флуо- ресценции (отн. ед.). Привязка к перегибу может быть с успехом использована в случае больших значений пороговых циклов, а также для сокращения длительности анализов (40 температурных циклов вместо 50) без выхода на максимальное значение флуоресценции (выход на "плато").
Пробирки А1–А4 (графики 2) имеют концентрацию тестовых образцов в 100 раз меньше ( N = = 100), чем концентрация в пробирках А5–А8 (графики 1).
Пороговые циклы определены на уровне точек перегиба графиков 1000 отн. ед.
В качестве примера результаты определения пороговых циклов Ct красителей FAM и ROX в пробирках A1–A8 приведены в табл. 1.
Средние значения пороговых циклов Ctc и другие величины здесь и в дальнейшем вычислены с помощью программы Excel. Для расчета эффективности E реакции использованы выражения в среде Excel (2)–(4):
ΔCtс = Ctс2 - Ctс1 ; (2)
LOG10(1 + Е) = LOG10(N) / ΔCtс =
= 2 / ΔCtс ; (3)
E = СТЕПЕНЬ(10; LOG10(1 + Е)) - 1 . (4)
Можно принять Е = 1 для анализируемых образцов с красителями FAM и ROX в диапазоне температур 63–95 °С и сделать вывод о том, что эффективность ПЦР при использовании таких параметров экспериментов близка к максимальной величине, которая теоретически не может быть больше 1.
По результатам сравнения можно отметить почти полное совпадение пороговых циклов Ctс красителей FAM и ROX.
ОПРЕДЕЛЕНИЕ ЭФФЕКТИВНОСТИ ПЦР БЕЗ РАЗВЕДЕНИЯ ОБРАЗЦОВ
Величины эффективности ПЦР без разведения образцов для каждой пробирки можно рассчитать при условии, что для анализируемых образцов с красителями FAM и ROX в диапазоне температур 63–95 °С средние величины эффективности Е с = 1.
Предварительно вычислен коэффициент амплификации К (увеличения исходной пробы в результате выполнения количества циклов, равных величине Ctc) по формуле (5)
К = СТЕПЕНЬ (1 + Ес; Ctc) . (5)
Для красителя FAM, приняв Е с = 1 и взяв из табл. 1 средние значения по пробиркам А1–А4 порогового цикла Ctc2 = 35.64 и по пробиркам А5–А8 — Ctc1 = 29.00, получаем соответственно К 2 = 5.35E+10 и К 1 = 5.36E+08.
Расчет эффективности реакции E выполнен по формулам (6) и (7):
LOG10(1 + Е) = LOG10(К) / ΔCtс ; (6)
E = СТЕПЕНЬ(10; LOG10(1 + Е) - 1) . (7)
Результаты расчетов эффективности Е каждой пробирки с красителем FAM представлены в табл. 2. Здесь Δ Е = E – E c – погрешность измерения величины Е .
Для пробирок А1–А4 и А5–А8 с красителем FAM величины К 2 = 5.35E+10 и К 1 = 5.36E+08, т. е. отличаются на 2 десятичных порядка (согласно величине N = 100). Величина эффективности находится в пределах Е + Δ Е = 1 ± 0.03.
Величины К 2 = 3.33E+10 и К 1 = 4.43E+08, а также пределы Е + Δ Е = 1 ± 0.01 вычислены аналогично для красителя ROX (в табл. 2 не представлены).
В результате расчетов эффективности Е каждой пробирки с красителями FAM и ROX выполнена оценка максимальной погрешности измерения этой величины Δ Е = ± 0.03.
ЗАВИСИМОСТЬ ЭФФЕКТИВНОСТИ ПЦР ОТ ТЕМПЕРАТУРНЫХ ПАРАМЕТРОВ
По результатам проведенных экспериментов выполнено сравнение эффективности при разных значениях температуры полок (другие экспериментальные условия аналогичны условиям предыдущего раздела).
Величины Е = 1 для анализируемых образцов с красителями FAM и ROX в диапазоне температур 63–95 °С использованы для сравнения эффективности экспериментов при использовании других температурных параметров.
Результаты расчетов эффективности реакции E 1 по формулам (5)–(7) при разных значениях температуры полок приведены в табл. 3 и на рис. 2.
Режим 6 отличается от режима 2 длительностью нижней полки t н = 20 с. Пояснения к результатам в этой строке будут приведены в следующем разделе этой статьи.
Табл. 2. Результаты расчетов эффективности Е каждой пробирки с красителем FAM ( Е с = 1)
|
№ пробирки |
Ct |
Log 10 ( К 2) |
Log 10 (1+ Е ) |
Е 2 |
Δ Е 2 |
|
A1 |
35.21 |
10.73 |
0.30 |
1.02 |
0.02 |
|
A2 |
35.64 |
10.73 |
0.30 |
1.00 |
0 |
|
A3 |
36.19 |
10.73 |
0.30 |
0.98 |
– 0.02 |
|
A4 |
35.52 |
10.73 |
0.30 |
1.00 |
0 |
|
№ пробирки |
Ct |
Log 10 ( К 1) |
Log 10 (1+ Е ) |
Е 1 |
Δ Е 1 |
|
A5 |
29.67 |
8.73 |
0.29 |
0.97 |
– 0.03 |
|
A6 |
28.94 |
8.73 |
0.30 |
1.00 |
0 |
|
A7 |
28.31 |
8.73 |
0.31 |
1.03 |
0.03 |
|
A8 |
29.07 |
8.73 |
0.30 |
1.00 |
0 |
Табл. 3. Результаты расчета эффективности ПЦР Е при различных температурных параметрах
|
№ режима |
Т н , °С |
Т в , °С |
Ctc, FAM |
Ctc, ROX |
E , FAM |
Е , ROX |
|
1 |
60 |
95 |
31.16 |
29.91 |
0.91 |
0.95 |
|
2 |
63 |
95 |
29.00 |
28.72 |
1.00 |
1.00 |
|
3 |
66 |
95 |
31.10 |
30.21 |
0.91 |
0.93 |
|
4 |
63 |
92 |
34.38 |
34.89 |
0.79 |
0.77 |
|
5 |
63 |
98 |
30.37 |
29.46 |
0.94 |
0.97 |
|
6 |
63 (20 с) |
95 |
30.86 |
29.34 |
0.92 |
0.97 |
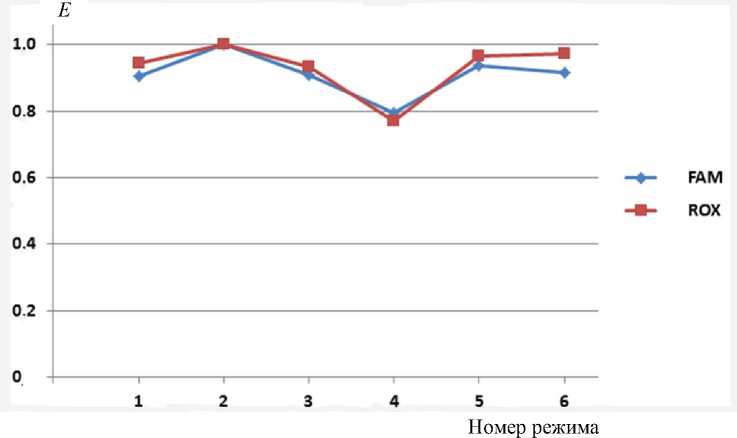
Рис. 2. Графики зависимости эффективности ПЦР E при разных температурных параметрах.
Горизонтальная ось — номер эксперимента (режима), вертикальная ось — эффективность E
Результаты расчетов, приведенные в табл. 3 и на рис. 2, позволяют выполнить сравнение эффективности ПЦР при различных тепловых режимах для красителей FAM и ROX:
– тепловой режим 2 обладает максимальной эффективностью ПЦР, близкой к предельно достижимой величине Е = 1;
– традиционный тепловой режим 1 с диапазоном температур 63–95 °C с красителями FAM и ROX имеет несколько меньшую эффективность Е = 0.91 и 0.95 соответственно;
– тепловой режим 6 обладает эффективностью ПЦР, близкой к величине теплового режима 1, а именно Е = 0.92 и 0.97;
– более низкое значение эффективности ПЦР наблюдается при тепловом режиме 4 ( Т в = 92 °С).
ЗАВИСИМОСТЬ ЭФФЕКТИВНОСТИ ПЦР ОТ ДЛИТЕЛЬНОСТИ ТЕМПЕРАТУРНОГО ЦИКЛА
Можно отметить желание операторов, работающих на генетических анализаторах, выполнять анализы за минимально возможное время. Величину, обратную времени анализа, можно определить как производительность анализатора (количество анализов за 1 ч или за рабочую смену).
В предыдущих разделах показано, что высокая эффективность ПЦР соответствует минимальным пороговым циклам, при этом результат анализа может быть получен за более короткое время.
Однако имеется возможность еще повысить производительность анализатора за счет сокращения времени температурного цикла.
На рис. 3 представлен график изменения температуры в цикле 63–95 °С с заданной длительностью полок t нз = 40 с и t вз = 15 с.
В табл. 4 приведены результаты при следующих заданных параметрах экспериментов: изменение температуры в цикле 63–95 °С; эксперименты 1 и 2 выполнены при длительности полок t нз = = 40 с и t вз = 15 с; эксперимент 6 ( ускоренны й режим амплификации ) выполнен при длительности полок t нз = 20 с и t вз = 15 с.
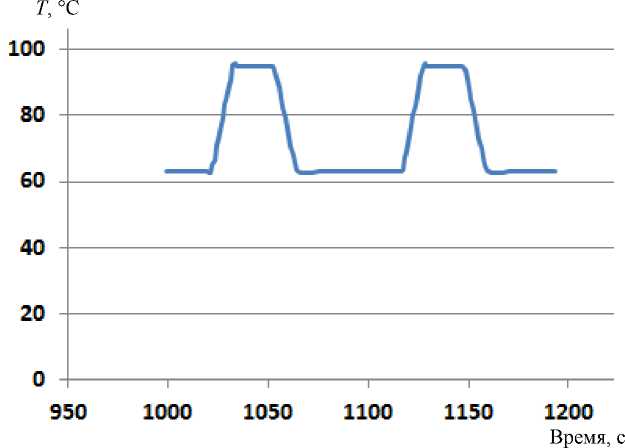
Рис. 3. График фрагмента циклического изменения температуры.
Горизонтальная ось — текущее время в секундах, вертикальная ось — температура °С
Табл. 4. Результаты сравнения измеренных длительностей циклов C и , а также времен выхода пороговых циклов Т и их относительных величин Т / Т 1
|
Краситель |
№ режима |
t нз, с |
t ни, с |
С и , с |
Ctс |
Т , мин |
Т / Т 1 |
|
FAM |
1 |
40 |
46.7 |
95.1 |
31.16 |
49 |
1.00 |
|
2 |
40 |
46.7 |
95.1 |
29.00 |
46 |
0.93 |
|
|
6 |
20 |
25.6 |
78.1 |
30.86 |
40 |
0.81 |
|
|
ROX |
1 |
40 |
46.7 |
95.1 |
29.91 |
47 |
1.00 |
|
2 |
40 |
46.7 |
95.1 |
28.72 |
46 |
0.96 |
|
|
6 |
20 |
25.6 |
78.1 |
29.34 |
38 |
0.81 |
ЗАКЛЮЧЕНИЕ
Измеренные длительности нижних полок t ни отличаются от заданных величин t нз , поскольку в них включена длительность переходного процесса, в течение которого плавно устанавливается температура после активного режима охлаждения. Времена выхода пороговых циклов Т вычислены по формуле (8):
Т = С и · Ctс / 60 мин. (8)
Необходимость расчета величины Т вызвана отсутствием шкалы времени на графике рис. 1.
По результатам сравнения относительных величин Т 6 / Т 1 = 0.81 для красителей FAM и ROX можно сделать вывод: время достижения порогового цикла Т 6 составляет 81 % относительно времени достижения порогового цикла Т 1. Несмотря на небольшое снижение эффективности Е (результаты приведены в табл. 3) при сокращении длительности цикла, экономия времени выполнения анализа (ускоренный режим амплификации) составляет 19 % (40 мин вместо 49 мин для красителя FAM).
Предложен способ определения зависимости эффективности ПЦР от заданных режимов температурных циклов на примере анализов с флуоресцентными красителями FAM и ROX.
Определены погрешности измерения величины эффективности ПЦР.
В результате проведенных экспериментов и расчетов определены температурные режимы, обладающие максимальной эффективностью ПЦР, близкой к предельно достижимой величине, равной 1.
Показано, что за счет выбора наиболее эффективных температурных режимов и сокращения длительности цикла можно заметно уменьшить время выполнения анализа (в приведенном примере на 19 %).
Аналогичные эксперименты и расчеты могут быть пользователями реализованы при выборе температурных и временных режимов при выполнении других анализов на приборах АНК-32
и АНК-48, которые серийно выпускаются в ИАП РАН. Уменьшение времени может быть заметно при выполнении серий однородных анализов.
Список литературы Экспериментальное определение параметров амплификации полимеразной цепной реакции анализатора нуклеиновых кислот
- Чернышев А.В., Бакай Д.А., Курочкин В.Е, Соколов В.Н., Скоблилов Е.Ю. Моделирование теплового состояния микропробирок с образцами в ходе полимеразной цепной реакции//Научное приборостроение. 2005. Т. 15, № 3. С. 54-62. URL: http://213.170.69.26/mag/2005/full3/Art5.pdf.
- Чернышев А.В., Белова О.В. Разработка обобщенной структурной схемы и концептуальной модели расчета амплификаторов ДНК//Научное приборостроение. 2006. Т. 16, № 2. С. 58-65. URL: http://213.170.69.26/mag/2006/full2/Art5.pdf.
- Алексеев Я.И., Белов Ю.В., Варламов Д.А. и др. Приборы для диагностики биологических объектов на основе метода полимеразной цепной реакции в реальном времени (ПЦР-РВ)//Научное приборостроение. 2006. Т. 16, № 3. С. 132-136. URL: http://213.170.69.26/mag/2006/full3/Art14.pdf.
- Белов Ю.В., Петров А.И., Лавров В.В., Курочкин В.Е. Особенности количественных измерений содержания нуклеиновых кислот методом полимеразной цепной реакции в реальном времени//Научное приборостроение. 2011. Т. 21, № 1. С. 44-49. URL: http://213.170.69.26/mag/2011/full/Art4.pdf.
- Белов Ю.В., Петров А.И., Лавров В.В., Курочкин В.Е. Изучение влияния шумов детектора на погрешности количественных анализов нуклеиновых кислот на приборах ПЦР-РВ//Научное приборостроение. 2011. Т. 21, № 2. C. 27-33. URL: http://213.170.69.26/mag/2011/full2/Art4.pdf.
- Теоретические основы полимеразной цепной реакции. Компания "Тульская диагностическая лаборатория". URL: http://tdlab.ru/pcr.php.
- Петров Д.Г., Макарова Е.Д., Корнева Н.А., Альдекеева А.С., Князьков Н.Н. Воздействие полей разной природы на выход ДНК при выделении из модельных растворов на двуокиси кремния. 1. Влияние температуры//Научное приборостроение. 2015. Т. 25, № 2. С. 91-101. URL: http://213.170.69.26/mag/2015/full2/Art9.pdf.


