Экспериментальные аспекты изучения репаративной регенерации суставного хряща в условиях туннелирования субхондральной зоны с введением аутологичного костного мозга
Автор: Шевцов Владимир Иванович, Макушин Вадим Дмитриеви, Ступина Татьяна Анатольевна, Степанов Михаил Александрович
Журнал: Гений ортопедии @geniy-ortopedii
Рубрика: Оригинальные статьи
Статья в выпуске: 2, 2010 года.
Бесплатный доступ
Представлены предварительные результаты изучения репаративной регенерации суставного хряща в условиях экспериментального моделирования остеоартроза с последующим туннелированием субхондральной зоны и трансплантацией аутологичного костного мозга. В данных экспериментальных условиях собственные регенераторные возможности хряща выражались повышением пролиферативной и биосинтетической активности хондроцитов. Обнаруженные в очагах ремоделирования хряща клеточные скопления, окруженные межклеточным веществом, являлись признаком активно идущего репаративного процесса.
Суставной хрящ, моделирование остеоартроза, субхондральная туннелизация, репаративная реге-нерация
Короткий адрес: https://sciup.org/142121310
IDR: 142121310
Текст научной статьи Экспериментальные аспекты изучения репаративной регенерации суставного хряща в условиях туннелирования субхондральной зоны с введением аутологичного костного мозга
Проблема регенерации гиалинового хряща суставов одна из актуальных проблем современной медицины и биологии. Ограниченные способности суставного хряща к регенерации привели к развитию заместительных операций: пересадка надкостницы, надхрящницы, пластика костно-хрящевыми ауто- и аллотрансплантатами [1, 3, 6, 8, 9, 15 и др.]. Каждый из этих методов успешно применяется и может лишь частично восстановить функцию сустава. Ни один из этих способов не приводит к образованию гиалинового хряща, способного выдерживать нагрузку, которая прилагается к суставу в естественных условиях. Проблема заключается в том, что после трансплантации жизнеспособные хондроциты обладают пониженной пролиферативной и синтетической активностью [3]. Это послужило основанием для разработки новых подходов в лечении дефектов хряща на основе культивирования клеток [12, 13, 16, 18]. Однако высокая стоимость технологии культивирования и пересадки клеток ограничивает развитие и широкое внедрение в практику этого метода.
В настоящее время среди способов стимуляции рапаративного остео- и хондрогенеза широкое распространение получили: субхондральная туннелизация, абразия и формирование микропереломов субхондральной кости, объединенные названием – «костномозговая стимуляция». В условиях туннелирования биохимическое окружение биологически активные вещества, образующиеся при некротизации костной стружки, белковые биорегуляторы костного мозга; биофизические факторы уровень содержания кислорода, давление, могут иметь существенное влияние на пролиферацию, остео-и хондрогенную дифференцировку клеток. Благоприятное влияние субхондральной туннели- зации при лечении гонартроза подтверждено многими исследователями [5, 11, 14, 17 и др.].
В связи с этим, с целью обеспечения положительного анатомо-функционального результата в настоящее время актуален поиск более эффективных способов туннелирования и оптимальных условий репаративной регенерации суставного хряща.
Цель – изучение особенностей структурнофункционального реагирования и регенерации суставного хряща в условиях экспериментального моделирования остеоартроза с последующим туннелированием субхондральной зоны и трансплантацией аутологичного костного мозга.
МАТЕРИАЛ И МЕТОДЫ
Эксперимент разделен на 2 серии: 1 серия – моделирование остеоартроза (n=5, 10 суставов), 2 серия – после моделирования остеоартроза на правом коленном суставе проводили туннелирование субхондральной зоны с введением аутологичного костного мозга, левый сустав не туннелировали (n=1). Содержание животных, оперативные вмешательства и эвтаназию осуществляли согласно приказу МЗ СССР № 755, 1977 г.
Экспериментальное моделирование остеоартроза проводили на взрослых беспородных собаках, подобранных по принципу условных аналогов по возрасту и весу. Оперативные вмешательства осуществляли в условиях операционной одновременно на обоих коленных суставах экспериментальных животных. После обработки операционного поля, с медиальной поверхности бедра через прямолинейный разрез мягких тканей выделяли бедренную артерию на уровне средней части бедренной кости. Артерию лигировали в двух местах и пересекали между лигатурами. Операционную рану ушивали послойно. После этого коленный сустав иммобилизировали аппаратом Илизарова, состоящим из двух дугообразных опор, соединенных шарнирными узлами с резьбовыми хвостовиками. Одна из опор располагалась в нижней трети бедра, другая в верхней трети голени. В качестве костных фиксаторов использовали спицы Киршнера, по три на каждой опоре. После иммобилизации сустава осуществляли одномоментную компрессию суставных поверхностей при помощи резьбовых стержней шарнирных узлов.
На момент снятия аппарата (28 суток иммобилизации) клинически у животных наблюдалась разгибательная контрактура коленного сустава и болезненность при пассивных движениях в суставе. Для контроля развития остеоартроза использовался рентгенографический метод. Через 28 суток после рентгенографического подтверждения развития артроза коленных суставов (сужение суставной щели, остеопороз метафиза бедра, очаговый остеосклероз субхондральной зоны) животных выводили из опыта.
Во второй серии, через 7 суток после снятия аппаратов, на правом коленном суставе прово- дили туннелирование с введением в субхондральную зону бедра и голени аутологичного костного мозга при помощи электродрели, инъекционной иглы и шприца типа «рекорд». Туннелирование медиальных мыщелков производили с латеральной стороны сегментов, и наоборот латеральных – с медиальной. Забор костного мозга производили из проксимального метафиза плечевой кости при помощи иглы Кассирского. В каждом мыщелке бедра и голени делали по 4 туннеля, объем вводимого костномозгового субстрата составлял 0,2 мл на 1 введение (в каждый туннель). Через 14 суток после туннелирования животного выводили из опыта.
Суставные поверхности оценивали макроскопически (форма, контур, цвет). Для светооптического исследования применяли парафиновые срезы, окрашенные гематоксилином и эозином и по-лутонкие срезы, окрашенные метиленовым синим (гистохимическая реакция на сульфатированные гликозаминогликаны) и метиленовым синим-основным фуксином. Гистоморфометрические исследования проведены по перпендикулярным суставной поверхности эпоксидным полутонким срезам большой площади (6-8 мкм2). Изображения микропрепаратов оцифровывали на аппаратнопрограммном комплексе «ДиаМорф» (Москва) и анализировали в программе «ВидеоТест-Мастер-Морфология». Определяли толщину хряща ( h хр , мкм), рассчитывали объемную ( V V хц , %) и численную ( N A хц , мкм-2) плотности всех хондроцитов, численную плотность клеток в составе изогенных групп – пролиферировавших хондроцитов ( N A пхц ) и величину их пула ( ВППХц ) – выраженное в процентах отношение N Aпхц /N Aхц , численную плотность пустых клеточных лакун. В качестве контроля изучали суставной хрящ интактных животных (n=5, 5 суставов).
Анализ цифрового материала проводили методами описательной статистики. Достоверность различий оценивали с помощью программы AtteStat, версия 1.0 [2] в электронных таблицах Microsoft Excel 97, в зависимости от характера распределения и объема выборок использовали критерий Стьюдента и критерий Вилкок-сона для независимых выборок.
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
В 1 серии при моделировании остеоартроза наблюдали разволокнение суставной поверхности, выявлены дистрофические изменения, выражающиеся гибелью и деструкцией части хондроцитов, неравномерным окрашиванием межклеточного матрикса и сопровождающиеся снижением толщины хряща. В субхондральной кости наблюдали разрежение костных трабекул. Отмеченные изменения являлись следствием нарушения обменных процессов (ремоделирования) суставного хряща, свидетельствующих о снижении синтеза и преобладании катаболических процессов. Известно, что при иммобилиации сустава происходит нарушение диффузионно-нагрузочного механизма снабжения его трофическими и пластическими веществами, нарушение микроциркуляции всех тканей сустава [7, 10, 19]. Кроме того, в условиях эксперимента было предусмотрено создание гипоксии и ухудшение трофики субхондральной кости (пересечение бедренной артерии). Максимально дистрофические изменения были выражены в хондроцитах промежуточной зоны (рис. 1), которые равноудалены от васкулярного и синовиального факторов питания (более 50 % клеток в состоянии деструкции).
Необходимо отметить, что в данных условиях эксперимента наиболее уязвимым оказался камбий суставного хряща, так как физиологическое самовосстановление его структуры осуществляется механизмами интерстициального роста благодаря постоянно поддерживающейся репродукции хондроцитов в промежуточной зоне [4].
Во 2 серии в гиалиновом хряще левого сус- тава (туннелизацию не проводили, срок эксперимента 21 сутки после снятия аппарата) нарушена гомогенность межклеточного вещества поверхностной зоны, разволокнена верхняя су-перфициальная ее часть. Большая часть хондроцитов в состоянии лизиса (рис. 2, А).
Клетки теряли способность к окрашиванию, хотя и сохраняли свои обычные размеры, границы цитоплазмы становились нерезкими. Основная часть хондроцитов промежуточной зоны в состоянии деструкции. Хрящевые клетки располагались одиночно, изогенные группы отмечены единично (рис. 2, Б). Хондроциты глубокой зоны находились в неактивном состоянии или состоянии деструкции (рис. 2, В). Как и в промежуточной зоне выявлено большое количество пустых клеточных лакун. Были обнаружены лакуны с некротизированными клетками, клеточным детритом. Целостность базофильной линии не нарушена. В части наблюдений отмечено ее расслоение, неравномерное окрашивание.
В гиалиновом хряще правого сустава (14 суток после туннелирования) сохранялось разволокнение суставной поверхности. В поверхностной зоне хондроциты были аномальной формы с пикнотичными ядрами (рис. 3, А). Большая часть хондроцитов промежуточной и глубокой зон была функционально активна (рис. 3, Б, В). Отмечено появление 2, 4-членных изогенных групп.
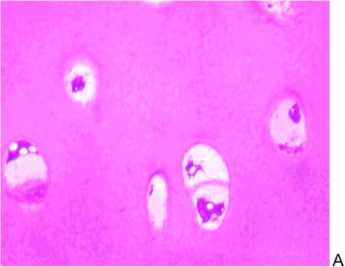
Рис. 1. Собака № 4779. 1 серия эксперимента. Полутонкий срез, окраска метиленовым синим основным фуксином. Суставной хрящ мыщелка бедра, промежуточная зона. А об.40, ок. 12,5. Б об.100МИ, ок. 12,5
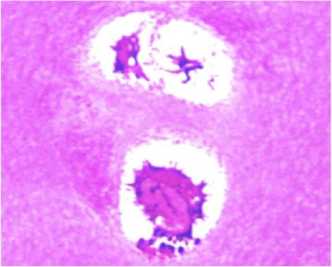
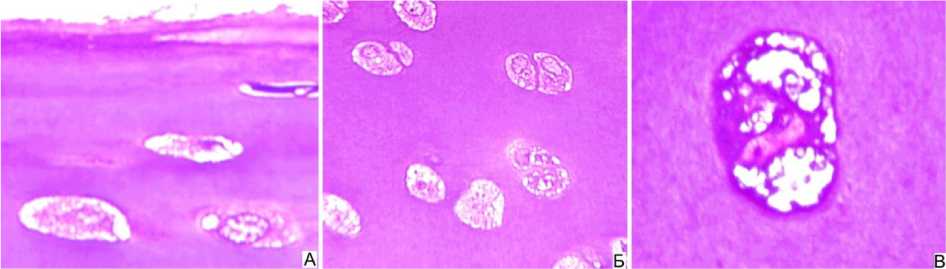
Рис. 2. Собака № 4793, 2 серия, левый сустав. Полутонкий срез, окраска метиленовым синим основным фуксином. Суставной хрящ мыщелка бедра. А поверхностная зона, об.100МИ, ок. 12,5. Б – промежуточная зона, об.40, ок. 12,5. В – хондроцит глубокой зоны, появление в цитоплазме гигантских вакуолей, об.100МИ, ок. 12,5
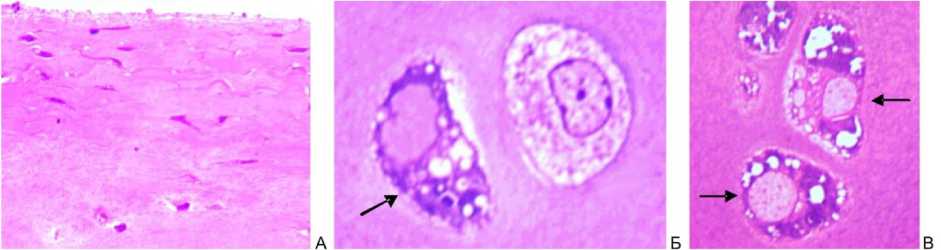
Рис. 3. Собака № 4793, 2 серия, правый сустав. Полутонкий срез, окраска метиленовым синим-основным фуксином. Суставной хрящ мыщелка бедра. А -поверхностная зона, об.40, ок. 12,5. Функционально активные хондроциты (стрелки) промежуточной (Б) и глубокой (В) зон. Об.100МИ, ок. 12,5
Увеличивалось число секреторно-активных клеток, которые имели рыхлые крупные ядра, базофильную цитоплазму, содержащую секреторные гранулы, вакуоли. Гистохимически отмечалась метахромазия перицеллюлярного матрикса (рис. 4). Среди таких клеток наблюдались и клетки, находящиеся в состоянии деструкции.
В отдельных участках хряща отмечено нарушение гомогенности межклеточного вещества вплоть до промежуточной и глубокой зон, демаскировка и деструкция коллагеновых волокон, гибель части хондроцитов. В таких участках, на границе поверхностной и промежуточной зон, выявлены очаги регенерации, представленные островками клеточных скоплений. Клетки располагались группами, в которых содержалось до 10 и более клеток (рис. 5).
По морфологическим признакам эти клетки относятся к хондроцитам. Они были округлой, овальной формы, размер их в группах различен, плотно прилегали друг к другу, цитоплазма их слабо базофильна, у некоторых вакуолизирована. Ядра овальной формы, гомогенны, имели 1 -2 ядрышка и четкую ядерную оболочку. Определялись клетки различной степени зрелости -недифференцированные округлые клетки, типичные функционально активные хондроциты и хондроциты, находящиеся в состоянии вакуольной дистрофии. Клетки продуцировали межклеточное вещество, образуя вокруг себя гомогенные ободки - перицеллюлярный матрикс, формировалась перицеллюлярная капсула, территориальный матрикс. Тесный контакт межклеточного вещества с хрящевыми клетками и отсутствие его вне связи сними (межтерриториальный матрикс не сформирован) указывал, что данные клетки являлись источником новообразованного межклеточного вещества.
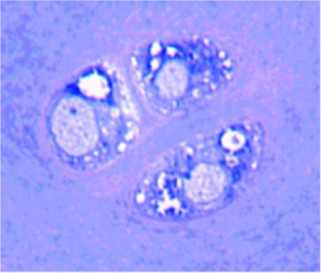
Рис. 4. Собака № 4793, 2 серия, правый сустав. Полутонкий срез, окраска метиленовым синим. Функционально активные хондроциты промежуточной зоны, метахромазия перицеллюлярного матрикса. Об.100МИ, ок. 12,5
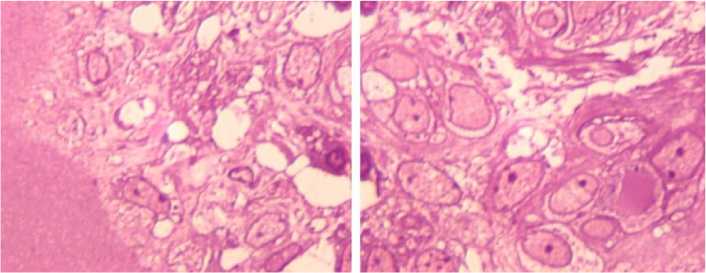
Рис. 5. Собака № 4793, 2 серия, правый сустав. Участки ремоделирования суставного хряща. Полутонкий срез, окраска метиленовым синим - основным фуксином. Об.100МИ, ок. 12,5
В правом эпифизе через 14 суток после туннелирования субхондральной зоны в очагах активного ремоделирования наблюдалось образование густой мелкопетлистой сети молодых трабекул, отличающихся от зрелых трабекул содержанием большого количества клеток. Межбалочные промежутки в участках костеобразования были заполнены красным костным мозгом, в котором отмечены очаги миелопоэза, присутствовали очаги свободно расположенных эритроцитов. В субхондральных отделах туннелированного сустава красный костный мозг занимал большую площадь, чем в левом, в субхондральных отделах которого преобладал желтый костный мозг.
Предварительные морфометрические исследования выявили достоверное (p<0,001) увеличение толщины хряща до 484,95±1,67 мкм, при моделировании остеоартроза этот параметр составлял 318,6±2,7 мкм, у интактных животных 475,5±1,3 мкм. Относительно контроля и 1 серии эксперимента обнаружено достоверное (p<0,05) увеличение численной плотности клеток – 10,55±0,8 (при моделировании остеоартроза 5,4±0,3, в контроле 6,2±0,56). Увеличение данного параметра обусловлено увеличением количества клеток во всех зонах хряща. Величина пула пролиферировавших хондроцитов приближалась к контрольным значениям 14,5 % и составила 14,2 % (при моделировании остеоартроза изогенные группы отмечены единично, входящие в их состав клетки находились в состоянии гибели). Процентное содержание пустых клеточных лакун по сравнению с 1 серией (43,39 %) снижалось до 16,23 % (у интактных животных 13,6 %). Объемная плотность хондроцитов составила 5,98 %, что достоверно
(p<0,05) выше данного показателя в 1 серии (при моделировании остеоартроза – 4,66 %), но достоверно (p<0,05) ниже этого показателя в контроле – 9,03 %.
Таким образом, полученные результаты оценки морфофункционального состояния суставного хряща животных 1 серии показали, что данная экспериментальная модель позволяет получить гонартроз, патогенетически основное место в развитии которого занимает фактор изменений режима функциональных нагрузок и кровоснабжения сустава, определяющие диффузное питание хряща. При данном патологическом процессе собственные регенераторные возможности суставного хряща подавлены, и поэтому его восстановление невозможно без дальнейшего потенцирования внешних по отношению к хрящу механизмов.
Полученные предварительные результаты исследования во 2 серии показали, что в суставном хряще левого сустава через 21 сутки после моделирования остеоартроза основная часть клеток находилась в состоянии лизиса, что свидетельствовало о глубоких метаболических нарушениях хрящевой ткани. Репаративная регенерация проявлялась слабовыраженной пролиферацией хондроцитов. Изогенные группы отмечены единично, клетки, входящие в их состав, находились в состоянии деструкции.
Результаты гистоморфометрического исследования суставного хряща правого сустава при туннелировании субхондральной зоны и трансплантации в туннели аутологичного костного мозга свидетельствовали о том, что массовая гибель хондроцитов и деструкция матрикса компенсировались быстрой репопуляцией клеточного состава и активизацией синтеза компонентов межклеточного матрикса, в результате чего восстанавливалась толщина хряща. Собственные регенераторные возможности хряща выражались повышением пролиферативной и биосинтетической активности хондроцитов. Обнаруженные в очагах ремоделирования хряща клеточные скопления, окруженные межклеточным веществом, являлись признаком активно идущего репаративного процесса.
На основании полученных результатов, способ субхондральной туннелизации с введением аутологичного костного мозга можно рассматривать как перспективный в плане стимуляции репаративной регенерации хряща.


