ЭКСПРЕСС-ДИАГНОСТИКА ЗАБОЛЕВАНИЙ ПО ВЫДЫХАЕМОМУ ВОЗДУХУ НА ОСНОВЕ КВАДРУПОЛЬНОГО МАСС-СПЕКТРОМЕТРА
Автор: Л. В. Новиков, В. В. Манойлов, А. Г. Кузьмин, Ю. А Титов, И. В. Заруцкий, А. О. Нефедов, А. В. Нефедова, А. И. Арсеньев
Журнал: Научное приборостроение @nauchnoe-priborostroenie
Рубрика: Приборостроение для биологии и медицины
Статья в выпуске: 4 т.30, 2020 года.
Бесплатный доступ
Данная работа является развитием исследований, опубликованных в журнале "Научное приборостроение" № 1, 2019. В сравнении с указанной статьей в данной работе расширен литературный обзор, впервые разработан и апробирован алгоритм расчета вероятности заболеваний. Приводятся результаты обработки данных больных, находящихся на лечении в двух онкологических клиниках. Расчет вероятности заболевания по данным масс-спектрометрического анализа выдыхаемого воздуха основан на определении принадлежности масс-спектра тестируемого больного соответствующей контрольной группе. Каждая контрольная группа формируется путем набора массива спектров не менее десяти пациентов с одним и тем же заболеванием. Диагностика выполняется путем преобразования матрицы спектров контрольной группы и спектра тестируемого больного в пространство главных компонент. Вероятность заболевания определяется по евклидову расстоянию координат больного от центроиды контрольной группы в многомерном пространстве главных компонент
Экспресс-диагностика заболевания, метод главных компонент, многомерная плотность вероятности, обработка многомерных данных
Короткий адрес: https://sciup.org/142224619
IDR: 142224619 | УДК: 543.51+ 681.2–5 | DOI: 10.18358/np-30-4-i94105
Текст научной статьи ЭКСПРЕСС-ДИАГНОСТИКА ЗАБОЛЕВАНИЙ ПО ВЫДЫХАЕМОМУ ВОЗДУХУ НА ОСНОВЕ КВАДРУПОЛЬНОГО МАСС-СПЕКТРОМЕТРА
Диагностика заболеваний, основанная на анализе дыхания, в последние годы широко используется в клинической практике [1, 2] с применением самых разнообразных методик и аналитических приборов [3]. Такая диагностика предполагает выявление заболеваний на ранних стадиях, что является перспективным. Установлено, что в выдыхаемом воздухе содержатся важные биомаркеры для ранней диагностики целого ряда заболеваний: сердечно-сосудистых, онкологических, ней-родегенеративных, органов дыхания, диабета и др.
В работах [4, 5] исследуются биомаркеры дыхания при онкологических заболеваниях легких, в том числе у курильщиков. Летучие вещества в образцах предварительно концентрировали путем твердофазной микроэкстракции (SPME) с последующим анализом в тандеме газовый хроматограф – масс-спектрометр (GC-MS). Полученные концентрации анализировались в пространстве главных компонент (PCA) с использованием первых трех координат (PCA1, PCA2, PCA3).
В работе [6] приведен подробный обзор результатов исследований методов диагностики путем анализа количественного и качественного составов выдыхаемого воздуха (ВВ), рассмотрены требования к аналитическим методам и приборам исследования многокомпонентных газовых смесей. Отмечено, что анализ на основе ВВ имеет ряд преимуществ перед диагностикой, основанной на лабораторных методах, — он является относительно дешевым, занимает немного времени и позволяет обнаруживать детектируемые вещества в минимальных концентрациях. Он не предполагает инвазивных вмешательств и может проводиться с любой кратностью, предоставляя возможность тщательного изучения динамики физиологических процессов. Приведен ряд маркеров самых различных заболеваний: органов дыхания, желудочнокишечного тракта, онкологии, центральной нервной системы и др. По исследованиям, проведенным в США, ранняя диагностика заболеваний, в частности органов дыхания, позволила снизить смертность на 20 %. Определены требования к средствам обнаружения молекул-маркеров с учетом разработанных методик и пределов обнаружения: возможность одновременного измерения и идентификации нескольких биомаркеров; высокая чувствительность и высокая точность определения концентраций (на уровне 10 ppb – 10 ppm); селективность (регистрация и идентификация веществ на фоне высоких концентраций азота, кислорода, воды и углекислого газа); быстродействие (время проведения анализа с усредне- нием по нескольким выдохам около 5–10 с); простота использования в клинических условиях; цена "одного замера" и стоимость прибора. В качестве приборов для анализа ВВ рассматривают газовую хроматографию (ГХ), масс-спектрометрию (МС), масс-спектрометрию с газохроматографическим разделением (МСГХ) и ИК-спектроскопию (ИКС).
Авторы работы [7] отмечают необходимость разработки удобного, простого в использовании, неинвазивного метода для скрининга хронического заболевания почек и качества диализа в режиме реального времени. Для этого предложено измерять концентрацию аммиака в выдыхаемом воздухе, однако использование масс-спектрометрии, спектрометрии подвижности ионов, оптических методов лазерного поглощения и др. оборудования дорого, сложно и неудобно для клинического использования. Предложено использовать недавно разработанные газовые сенсоры — полупроводниковый сенсорный чип на основе полимера с нанопорами.
Для сравнения результатов обследования нескольких групп пациентов использовались различные статистические подходы: парный t-тест Стьюдента, критерий Вилкоксона, тест Краскела – Уоллиса, тест Дана, тест Фридмана. Коэффициент корреляции Пирсона и простая линейная регрессия использовались для оценки корреляции между концентрациями выдыхаемого аммиака и др. диагностическими измерениями.
В работе [8] исследуется возможность диагностики эпилепсии путем сравнения состава выдыхаемого воздуха у больных и здоровых пациентов с использованием "электронного носа". Данные прибора обрабатывались нейронной сетью, которая была обучена данными предварительно отобранных пациентов с заболеванием эпилепсией и ее отсутствием. Исследование эффективности диагностики эпилепсии по ВВ показали ее несомненные достоинства по сравнению с традиционными тестами с использованием электроэнцефалограмм.
В работе [9] анализируются различные методы и приборы для сбора пробы в полевых условиях с последующим анализом в хроматографе с масс-спектрометром в качестве детектора, снабженным приставкой для термодесорбции (TD-GC-MS анализ). Статистическая обработка результатов экспериментов по измерению, в частности концентрации изопрена, проводилась с использованием t-теста Стьюдента и смешанного линейного моделирования.
В работе [10] показано, что метод анализа выдыхаемого воздуха с использованием газового хроматографа – спектрометра ионной подвижности (GC-IMS) пригоден для ранней неинвазивной диагностики нейродегенеративных заболеваний, в частности болезни Альцгеймера, характерной для пожилых людей. Комплекс является высокопроизводительным диагностическим инструментом для диагностики в реальном времени в клинических условиях.
Существует острая необходимость в разработке эффективных диагностических инструментов, особенно таких, которые позволяют надежно выявлять заболевания на ранних стадиях (перед проведением сложных лабораторных исследований) с использованием неинвазивных подходов. Ключевой проблемой в анализе ВВ является надлежащий статистический анализ и интерпретация больших и разнородных наборов данных, полученных из исследований ВВ. В настоящей работе использованы квадрупольный масс-спектрометр и метод обработки результатов масс-спектрометрического анализа ВВ, основанный на определении вероятности заболевания путем определения принадлежности масс-спектра тестируемого пациента соответствующей контрольной группе.
КВАДРУПОЛЬНЫЙ МАСС-СПЕКТРОМЕТР
Характеристики
Квадрупольный масс-спектрометр, применяемый в работе для анализа выдыхаемых газов, описан а работе [11]. При малых габаритах и весе он обеспечивает обнаружение компонентов ВВ в диапазоне масс — от 1 до 200 а.е.м., разрешение по массовым числам — 0.5, скорость регистрации — до 1 масс-спектра в 10 с с чувствительностью по концентрациям примесей — от 0.1 ppm. Он прост в использовании, обеспечивает высокую скорость анализа, начиная с забора воздуха до получения результата. Время получения результатов анализа составляет не более минуты.
Краткое описание работы прибора
Анализируемый газ при давлении атмосферы через капиллярный ввод подается в камеру ионизации источника ионов с электронным ударом. Образовавшиеся ионы вводятся в масс-анализатор квадрупольного типа. Получившиеся в процессе регистрации масс-спектрометрические сигналы обрабатываются с помощью специализированного программного обеспечении и сравниваются со спектрами в библиотеке стандартных масс-спектров, затем проводится идентификация отдельных компонент спектра и определение их концентрации. Прогреваемая капиллярная система ввода пробы в масс-спектрометр позволяет проводить анализ на расстоянии до 5 м от прибора. Расход пробы составляет около 5 мкл в 1 с. В вакуумной системе используется турбомолекулярный и мембранный насосы.
Важным преимуществом прибора являются его малые габариты (см. [11]), что позволяет его оперативное перемещение из одного медицинского учреждения в другое для проведения скрининговых обследований больших групп населения.
ОБРАБОТКА ДАННЫХ
При массовом обследовании состояния здоровья населения, как правило, отсутствует предварительная информация о характере заболевания пациента. При проведении диагностики состояния здоровья пациентов методом анализа выдыхаемого воздуха целесообразно регистрировать весь спектр выдыхаемых газов (маркеров заболеваний) и затем сопоставлять его с данными одной из контрольных групп с известным заболеванием. Данные ВВ каждого пациента этой группы можно представить в виде точки в многомерном пространстве. Объединенные данные всех пациентов группы образуют "облако" исходных параметров. Чем ближе точка, определяющая спектр тестируемого больного, находится к центру (центроиде) этого "облака", тем больше вероятность того, что пациент либо страдает заболеванием контрольной группы, либо здоров, если это контрольная группа здоровых пациентов.
Пусть xi,j — j- й параметр (в данном случае — интенсивность спектральной компоненты) i- го пациента контрольной группы, причем i = 1,2,..., I и j = 1,2,..., J , и набор из значений для I пациентов по J регистрируемых компонент ВВ образуют ( I , J ) обучающую матрицу X , столбцы которой обозначим как X j : X = [ X 1 ,..., X j ,..., X J ] [12].
Вектор X j является случайной величиной. Для простоты предположим, что компоненты этого вектора имеют нормальное распределение со средним значением Xj и дисперсией σ2j . Тогда элементы матрицы X образуют в J-мерном пространстве "облако" (обозначим его как G) из I х J точек с центроидой в точке X, координаты которой равны X = ^X1,X2,...,X J ^|. Тестируемый пациент страдает тем же заболеванием (или здоров), что и контрольная группа, если измеренный вектор параметров ВВ Xd =[xd1, xd2,...,xdJ], где xl,j — значение параметра, принадлежит J-мерному пространству G, т.е. Xd е G . Это условие выполняется, если вероятность P отклонения точки Xd от центроиды X не превышает некото- рый порог α . Для определения этой вероятности построим многомерное распределение вероятности принадлежности события пространству G, предполагая, что это распределение подчиняется нормальному закону [13]:
P(Xd ) = W - exp |-1 (Xd - X)‘ KX (Xd - X)},
I 2 J (1)
Xd е G, где K X — ковариационная матрица
'!
K X =E ( X - X ) - ( X - X )
E — символ матема
тического ожидания, (‘) — символ транспонирования матрицы, W — нормирующий множитель. Очевидно, что вероятность P этого события равна единице, если для очередного пациента окажется, что X d = X . Это условие выполняется, если в формуле (1) положить W = 1 . Тогда условие принадлежности пациента контрольной группе имеет вид: P ( X d ) < а , где величина а выбирается методом экспертной оценки.
Однако непосредственное использование формулы (1) для расчета величины P сопряжено со значительными вычислительными трудностями, связанными с наличием большого числа параметров J и корреляционных связей между столбцами матрицы X . Для сжатия данных, сокращения размерности пространства G используют ортогональное преобразование данных в пространство главных компонент — метод главных компонент (МГК) [14].
Для перехода в пространство ГК формируется новая матрица, состоящая из всех строк матрицы X и строки X d . Обозначим эту матрицу как XI . Тогда в новой системе координат:
A
XI = T - P ' + e = £ t j p j + e ,
.i = 1
где p j — собственные функции ковариационной матрицы K X . Матрицу T называют матрицей счетов t = [ T 1 , T 2 ,..., t a ] , ее размерность — ( I × A ); матрицу P называют матрицей нагрузок , ее размерность — ( I x A ) ; e — это матрица остатков (шумов) размерности ( I x J ) ; векторы-столбцы T j ( j = ( 1,2,..., A ) ) называют главными компонентами (ГК), A — число главных компонент. Величина A значительно меньше числа переменных J . Это означает, что основная информация о состоянии пациента сосредоточена в нескольких первых ГК.
Последняя строка этой матрицы, вектор Td — координаты параметров тестируемого пациента в пространстве ГК: Td = [ td 1 td ,2,..., td, A ].
Средние значения столбцов матрицы T равны нулю, а дисперсия — вектор σ 2 с элементами о 2 = X j , т.е. собственными числами ковариационной матрицы. Свойство разложения по ГК таково, что дисперсия быстро уменьшается уже к четвертой ГК, а столбцы матрицы T некоррели-рованы, т.е.
Т Т mn
I x j
при n ^ m , при n = m .
Учитывая это обстоятельство, в новой системе координат формула (1) имеет вид:
P ( T d ) = exp j- 2 T d о - 2 T ,
1 V^ I m = exp Hl -2 r , (2)
-
2 j = 1 ° j ,
и евклидово расстояние от пациента с индексом d до центроиды обучающей группы равно
D ( d ) =
< E t d , j
V j = 1
ОПИСАНИЕ АЛГОРИТМА
Обработка данных состоит из двух этапов: обучение и диагностика .
На этапе обучения формируется K матриц X k , k = 1,2,..., K с данными по интенсивности спектра ВВ для каждого вида заболеваний. При этом число строк Ik каждой матрицы должно быть в несколько раз больше числа столбцов J k .
На этапе диагностики выполняется следующая последовательность операций:
-
1. Измеряются параметры ВВ диагностируемого пациента и формируется вектор-строка X d = { xd ,1 , x d ,2 ,..., x d , j } .
-
2. Строится новая матрица XI k =[ X k ; X d ] размерности ( ( Ik + 1 ) x Jk ) , последней строкой которой является вектор Xd .
-
3. Выполняется нормировка этой матрицы, например, на максимальное значение ее элементов.
-
4. Используя алгоритм метода ГК, вычисляется матрица счетов T k и вектор собственных чисел λ k [15].
-
5. Определяется число первых столбцов A матрицы Т k из условия O k = ^О < £. При этом без потери достоверности можно положить
-
6. Определяется вероятность P ( Т k ) по формуле (2).
-
7. Переход к п. 2 ( k = k + 1) для определения
-
8. Анализ результатов вычисления вероятности P (T1 k ) , k = 1,2, ^ , K для всех K заболеваний с целью определения наиболее вероятного.
ε = 0.001–0.01. Последняя строка матрицы t^^} — главные компоненты пара-
Тк = f tk , t k k 2 d d ,1 d ,2
метров ВВ диагностируемого пациента.
вероятности принадлежности тестируемого пациента другой группе заболеваний.
ПРОВЕРКА АЛГОРИТМА
Проиллюстрируем изложенную выше теорию на одной группе из 43 больных, с диагностированной онкологией одного типа1). Эта группа разделена на две: обучающую (36 пациентов) и контрольную (7 пациентов). При этом концентрация компонентов ВВ первого пациента из контрольной группы для примера совпадает с центроидой обучающей. Привлечена к проверке эффективности алгоритма еще одна контрольная группа2) с другими онкологическими заболеваниями из 10 больных. Пациентам обоих контрольных групп присвоены порядковые номера соответственно d = ( 1,2,3,...,7 ) и d = ( 1,2,3,...,10 ) .
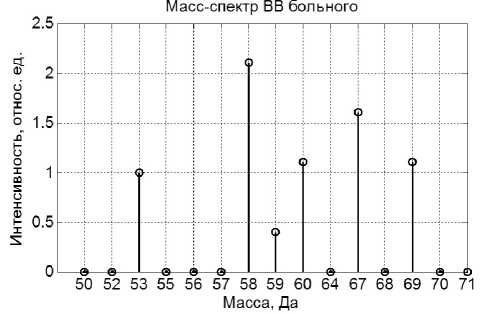
Рис. 1. Масс-спектр ВВ обследуемого пациента.
Масса 53 — изопрен, 58 — ацетон, 60 — уксус, 67 — изопрен (?), 69 — пентин; 59 — некий нераспознанный пока биомаркер, выявленный у некоторых пациентов с онкологией
На рис. 1 показан пример масс-спектра ВВ одного из пациентов первой (обучающей) группы. Из каждой контрольной группы поочередно выбираем данные по ВВ и выполняем п. 1–6 алгоритма. При этом оказывается, что достаточно положить A = 6, т.к. ^ k = 0. По формулам (3) и (2) вычисляются евклидово расстояние от центроиды обучающей выборки и вероятность диагностики заболевания онкологией контрольного пациента. Для каждой контрольной группы эти результаты заносятся в табл. 1 и 2. На рис. 2 в пространстве первых двух ГК (T1 и T2) изображены координаты пациентов обучающей ( о ) и первой контрольной ( + ) группы. Из данных табл. 1 видно, что по мере удаления координат ВВ от центроиды для этой контрольной группы вероятность заболевания онкологией уменьшается, но остается большой. Следует обратить внимание, что эта вероятность зависит также от места расположения координат пациента в шестимерном (в данном случае) про-
Табл. 1. Измеренная вероятность болезни для пациентов первой контрольной группы
|
Пациент |
Евклидово расстояние |
Вероятность заболевания |
|
1 |
0.0116 |
0.9854 |
|
2 |
0.1076 |
0.1888 |
|
3 |
0.1499 |
0.2055 |
|
4 |
0.2044 |
0.1164 |
|
5 |
0.2554 |
0.2864 |
|
6 |
0.2892 |
0.3458 |
|
7 |
0.3247 |
0.1197 |
Табл. 2. Измеренная вероятность болезни для пациентов второй контрольной группы
На рис. 3 в пространстве первых двух ГК (T1 и T2) изображены координаты пациентов обучающей ( о ) и второй контрольной группы (+).
Оказалось, что все пациенты этой группы (кроме первого) находятся вне "облака" обучающей выборки. Из данных табл. 2 видно, что вероятность наличия заболевания онкологией пациентов этой группы ничтожно мала.
ЗАКЛЮЧЕНИЕ
Система диагностики заболеваний по ВВ, состоящая из квадрупольного масс-спектрометра
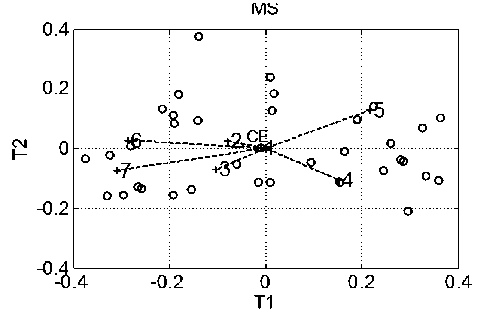
Рис. 2. Пациенты обучающей ( о ) и первой контрольной ( + ) групп пациентов в пространстве первых двух ГК.
CE — положение центроиды, 1–7 — номера пациентов
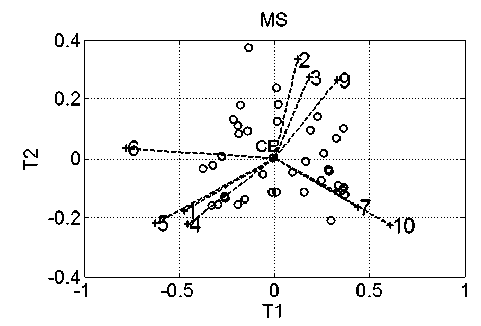
Рис. 3. Пациенты обучающей ( о ) и второй контрольной ( + ) групп пациентов в пространстве первых двух ГК.
CE — положение центроиды, 1–10 — номера пациентов и комплекта обработки данных с возможностью обучения и определения вероятности заболевания, обеспечивает неинвазивный экспресс-анализ состояния больного. Диагностика с определением вероятности принадлежности больного одной из обучающих групп позволяет за несколько десятков секунд составить общую картину вероятных заболеваний пациента и квалифицированно назначить дальнейшее обследование.
Список литературы ЭКСПРЕСС-ДИАГНОСТИКА ЗАБОЛЕВАНИЙ ПО ВЫДЫХАЕМОМУ ВОЗДУХУ НА ОСНОВЕ КВАДРУПОЛЬНОГО МАСС-СПЕКТРОМЕТРА
- 1. Cao W., Duan Y. Breath analysis: potential for clinical diagnosis and exposure assessment // Clinical Chemistry. 2006. Vol. 52, no. 5. P. 800–811. DOI: 10.1373/clinchem.2005.063545
- 2. Pereira J., Porto-Figueira P., Cavaco C., Taunk K., Rapole S., Dhakne R., Nagarajaram H., Câmara J.S. Breath analysis as a potential and non-invasive frontier in disease diagnosis: an overview // Metabolites. No. 5. 2014. P. 3–55. DOI: 10.3390/metabo5010003
- 3. Kononov A., Korotetsky B., Jahatspanian I., Gubal A. et al. Online breath analysis using metal oxide semiconductor sensors (electronic nose) for diagnosis of lung cancer // Journal of Breath Research. 2020. Vol. 14, no. 1. DOI: 10.1088/1752-7163/ab433d
- 4. Kischkel S., Miekisch W., Sawacki A., Straker E.M., et al. Breath biomarkers for lung cancer detection and assessment of smoking related effects — confounding variables, influence of normalization and statistical algorithms // Clinica Chimica Acta. 2010. Vol. 411, is. 21–22. P. 1637–1644.
- 5. Fuchs P., Loeseken Ch., Schubert J.K., Miekisch W. Breath gas aldehydes as biomarkers of lung cancer. International Journal of Cancer, 2010, vol. 126, no. 11, pp. 2663–2670.
- 6. Вакс В.Л., Домрачева Е.Г., Собакинская Е.А., Черняева М.Б. Анализ выдыхаемого воздуха: физические методы, приборы и медицинская диагностика // УФН.
- 2014. Т. 184, № 7. С. 739–758. DOI:
- 10.3367/UFNr.0184.201407d.0739
- 7. Chen1 Ch.-Ch., Hsieh Ju-Ch., Chao Ch.-H., Yang W.-Sh.,
- et al. Correlation between breath ammonia and blood urea
- nitrogen levels in chronic kidney disease and dialysis patients // Journal of Breath Research. 2020. Vol. 14, no. 3.
- DOI: 10.1088/1752-7163/ab728b
- 8. van Dartel D., Schelhaas H.J., Colon A.J., Kho K.H., de Vos C.C. Breath analysis in detecting epilepsy // Journal of Breath Research. 2020. Vol. 14, no. 3. DOI: 10.1088/1752-7163/ab6f14
- 9. Harshman S.W., Pitsch R.L., Davidson Ch.N., Scott A.M., et al. Characterization of standardized breath sampling for off-line field use // Journal of Breath Research. 2019. Vol. 14, no. 1. DOI: 10.1088/1752-7163/ab55c5
- 10. Tiele1 A., Wicaksono A., Daulton E., Ifeachor E., Eyre V., et al. Breath-based non-invasive diagnosis of Alzheimer’s disease: A pilot study // Journal of Breath Research. 2020. Vol. 14, no. 2. DOI: 10.1088/1752-7163/ab6016
- 11. Манойлов В. В., Кузьмин А. Г.,Заруцкий И.В., Титов Ю.А.,Самсонова Н.С. Методы обработки и исследование возможностей классификации масс-спектров выдыхаемых газов // Научное приборостроение. 2019. Т. 29, № 1. С. 106–110. URL: http://iairas.ru/mag/2019/abst1.php#abst16
- 12. Большаков А.А. Методы обработки многомерных данных и временных рядов / А.А. Большаков, Р.Н. Каримов. М.: Горячая линия-Телеком, 2007. 522 с.
- 13. Ширяев А.Н. Вероятность. Том 1. M.: Изд-во МЦНМО, 2007. 552 c.
- 14. Айвазян С.А., Бухштабер В.М., Енюков И.С., Мешалкин Л.Д. Прикладная статистика. Классификация
- и снижение размерности. М.: Финансы и статистика, 1989. 607 с.
- 15. Эсбенсен К. Анализ многомерных данных / пер. с англ. под ред. О.Е. Родионовой. Черноголовка: Издво ИПХФ РАН, 2005. 161 с.


