Экспрессия активной формы каспазы-3 не является достоверным показателем индукции апоптоза в стимулированных CD4+ Т-лимфоцитах
Автор: Сайдакова Евгения Владимировна, Власова Виолетта Викторовна
Журнал: Вестник Пермского университета. Серия: Биология @vestnik-psu-bio
Рубрика: Иммунология
Статья в выпуске: 3, 2019 года.
Бесплатный доступ
Цель настоящей работы - анализ экспрессии активной формы каспазы-3 в стимулированных CD4+ Т-лимфоцитах и сопоставление ее с другими широко используемыми маркерами апоптоза и активности CD4+ Т-клеток. В процессе исследований мононуклеарные клетки периферической крови человека стимулировали анти-CD3/анти-CD28 антителами в течение 48 ч. и определяли экспрессию активной формы каспазы-3, маркеров активации (CD25), пролиферации (Ki-67) и апоптоза (PO-PRO/PI и AnnexinV/PI) методом проточной цитометрии. Было установлено, что под влиянием стимулятора доля каспаза-3-позитивных лимфоцитов среди CD4+CD45RA- Т-клеток увеличилась в 5.7 раз (P 0.05). Относительное количество клеток, экспрессирующих активную форму каспазы-3, было связано с параметрами активации (R = 0.878; P 0.05). Исходя из полученных данных можно заключить, что использование активной формы каспазы-3 в качестве единственного маркера при исследовании апоптоза стимулированных CD4+ Т-лимфоцитов приводит к ложноположительным результатам, во многом отражающим активацию клеток. Для получения достоверных данных требуется введение дополнительных параметров, учитывающих как индукцию программируемой клеточной гибели, так и активность лимфоцитов.
Cd4+ т-лимфоциты, апоптоз, каспаза-3, проницаемость цитоплазматической мембраны, асимметрия цитоплазматической мембраны, активация, проточная цитометрия
Короткий адрес: https://sciup.org/147227098
IDR: 147227098 | УДК: 612.086 | DOI: 10.17072/1994-9952-2019-3-353-358
Текст научной статьи Экспрессия активной формы каспазы-3 не является достоверным показателем индукции апоптоза в стимулированных CD4+ Т-лимфоцитах
кологических заболеваний [Carson, Ribeiro, 1993; O'Reilly, Strasser, 1999; Lowe, Lin, 2000]. Важная роль в регуляции апоптоза принадлежит ферменту «каспаза-3», который расщепляет ядерную ламину, зоны фокальных и межклеточных контактов, участвует во фрагментации ДНК [Brancolini et al., 1997; Janicke et al., 1998; Kook et al., 2003]. Появление в клетке активной формы каспазы-3 принято считать «точкой невозврата» в индукции апоптоза [Fan et al . , 2017]. Эта молекула используется как маркер для определения умирающих клеток в работах, направленных на изучение лейкемии, радиочувствительности, безопасности медицинских процедур и т.д. [Belloc et al., 2000; Carracedo et al., 2002; Santos et al., 2017]. Однако вопрос о том, является ли экспрессия активной формы каспазы-3 предвестником верной гибели стимулированных CD4+ Т-лимфоцитов, остается открытым.
Цель настоящей работы – проанализировать экспрессию активной формы касазы-3 в стимулированных CD4+ Т-лимфоцитах и сопоставить ее с другими широко используемыми маркерами апоптоза и активности CD4+ Т-клеток.
Материалы и методы исследований
Получение биологического материала
План работы был утвержден локальным этическим комитетом Пермского краевого центра по профилактике и борьбе со СПИД и инфекционными заболеваниями. Каждый участник исследования подписал информированное согласие.
Забор крови осуществляли натощак из локтевой вены в пробирки, содержащие этилендиаминтет-рауксусную кислоту. Мононуклеарные клетки периферической крови изолировали путем центрифугирования (400 g, 40 мин.) в градиенте плотности Диаколла ρ=1.077 (Диа-М, Россия). Полученные образцы подвергали контролируемому замораживанию до -80 ° С в течение суток в среде, содержащей 90% инактивированной теплом эмбриональной телячьей сыворотки (Gibco, США) и 10% диметилсульфоксида (MP Biochemicals, США), после чего клетки переносили в жидкий азот для длительного хранения.
Постановка культур
Мононуклеарные клетки периферической крови размораживали и использовали для постановки культур. В образец клеток в соотношении 2:1 вносили ан-ти-CD3 и анти-CD28 антитела, конъюгированные с магнитными бусами (Gibco, США). В качестве контроля были использованы мононуклеарные клетки без добавления митогена. Образцы культивировали в иммунологических 96-луночных круглодонных планшетах (МиниМед, Россия) в полной питательной среде при +37 ° С в течение 48 ч.
Цитометрический анализ
Разделение мононуклеарных клеток периферической крови на субпопуляции выполняли с помощью коммерческих антител к поверхностным антигенам CD4 и CD45RA (BioLegend, США). Т-лимфоциты с фенотипом CD4+CD45RA– оценивали в качестве клеток памяти [Akbar et al . , 1988].
При исследовании апоптоза Т-лимфоцитов выявляли ряд параметров:
-
1) активацию сигнальных путей апоптоза устанавливали по связыванию моноклональных антител, специфичных к активной форме каспазы-3 (BD Bioscience, США);
-
2) проницаемость клеточной мембраны детектировали, окрашивая клетки PO-PRO (Thermo Fisher Scientific, США) и йодистым пропидием (Thermo Fisher Scientific, США);
-
3) нарушение асимметрии клеточной мембраны исследовали, добавляя к лимфоцитам AnnexinV, конъюгированный с флуоресцентным красителем (Beckman Coulter, США).
В качестве умирающих путем апоптоза рассматривали клетки с фенотипами: Caspase-3+, PO-PRO+PI+ или AnnexinV+PI+. Делящиеся клетки оценивали при помощи анти-Ki-67 антител (BD Pharmingen, США). Активированные Т-лимфоциты определяли по связыванию анти-CD25 антител (BioLegend, США). Также к активированным причисляли клетки с фенотипами PO-PRO+PI– или AnnexinV+PI–.
Цитометрический анализ проводили на приборе CytoFLEX S (Beckman Coulter, США). Для визуализации и обработки результатов использовали программу CytExpert (Beckman Coulter, США).
Статистическая обработка данных
Статистическая обработка результатов выполнялась методами непараметрического анализа. Рассчитывали медиану и интерквартильный размах (25–75%). Сравнение величин проводили с использованием U-критерия Манна-Уитни. Корреляционный анализ выполняли по методу Спирмена. Вычисления и построение графиков проводили с использованием пакета компьютерных программ Stata 11.1.
Результаты и их обсуждение
В исследование были включены 10 относительно здоровых добровольных доноров крови; в основном женщины (70%). Средний возраст обследованных составил 33.6 года.
Двое суток инкубации мононуклеарных клеток со стимулирующим агентом привели к увеличению доли CD4+CD45RA– Т-лимфоцитов, экспрессирующих активную форму каспазы-3 (рис. 1).
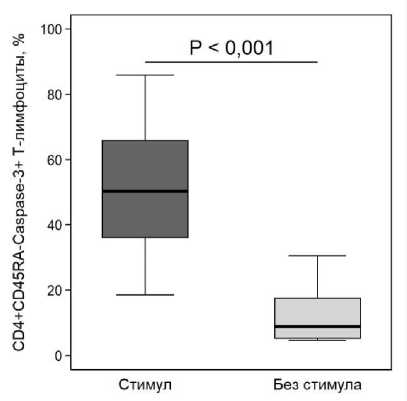
Рис. 1 . Процентное содержание каспаза-3+ клеток.
Мононуклеарные клетки выделяли из периферии-ческой крови здоровых людей (n = 10) и инкубировали 48 ч. с добавлением анти-CD3/анти-CD28 антител (стимул) или без них (без стимула). Различия между группами устанавливали с использованием U-критерия Манна-Уитни ражающих увеличенную проницаемость и нарушенную асимметрию клеточной мембраны, были статистически значимо связаны между собой (рис. 2).
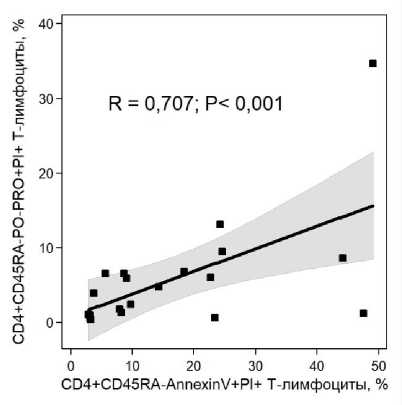
Рис. 2 . Различные подходы к определению апоптоза дают схожие результаты.
R – коэффициент ранговой корреляции Спирмена
Параллельно с анализом экспрессии активной формы каспазы-3 нами были определены другие маркеры апоптоза CD4+ Т-лимфоцитов: увеличение проницаемости и нарушение асимметрии клеточной мембраны. При их использовании было установлено, что 48 ч. инкубации со стимулирующим агентом не приводят к увеличению количества CD4+ Т-клеток памяти, умирающих путем апоптоза (таблица).
Относительное количествоCD4+ Т-клеток памяти, умирающих путем апоптоза
|
Показатели |
Стимул |
Без стимула |
|
PO-PRO+PI+, % |
9.0 (1.3–24.8) P > 0.05 |
6.4 (2.1–11.7) |
|
AnnexinV+PI+, % |
20.6 (6.7–24.4) P > 0.05 |
8.7 (3.6–21.8) |
Примечание. Указаны медианы и интерквартильные размахи. Мононуклеарные клетки выделяли из периферической крови здоровых людей и инкубировали 48 ч. с добавлением анти-CD3/анти-CD28 антител (стимул) или без них (без стимула). Лимфоциты с фенотипом CD4 + CD45RA – окрашивали наборами красителей, отражающих индукцию апоптоза. Статистический анализ – U-критерий Манна-Уитни.
Корреляционный анализ продемонстрировал отсутствие статистически значимых связей между процентным содержанием CD4+CD45RA–Caspase-3+ и CD4+CD45RA–PO-PRO+PI+ Т-клеток ( P> 0.05). Корреляции между относительными количествами CD4+CD45RA–Caspase-3+ и CD4+CD45RA– AnnexinV+PI+ Т-лимфоцитов также выявлено не было (P > 0.05). Вместе с тем, доли умирающих клеток, определенные при помощи красителей, от-
В отсутствие связей с показателями апоптоза, экспрессия каспазы-3 оказалась ассоциирована с индексами активности стимулированных CD4+ Т-клеток. Так, процентное содержание Т-клеток памяти, несущих активную форму каспазы-3, коррелировало с долей активированных (CD25+) Т-лимфоцитов (рис. 3). Важно отметить, что другие показатели апоптоза не имели статистически значимых корреляционных зависимостей с содержанием CD4+CD25+ Т-клеток памяти.
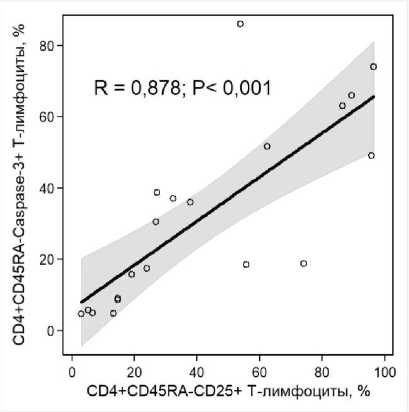
Рис. 3 . Связь процентного содержания каспаза-3+ и активированных CD4+ Т-клеток памяти.
R – коэффициент ранговой корреляции Спирмена
Также относительное количество каспаза-3-поззитивных CD4+ Т-клеток памяти было статистически значимо связано с долей делящихся (Ki-67+) CD4+ Т-лимфоцитов (рис. 4). При использова- нии других маркеров программируемой гибели клеток схожих корреляционных зависимостей обнаружено не было (P > 0.05).
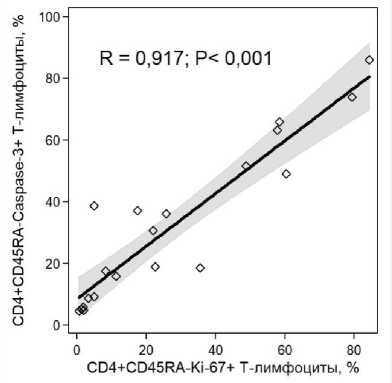
Рис. 4 . Связь экспрессии активной формы каспазы-3 и пролиферации CD4+ Т-клеток памяти.
R – коэффициент ранговой корреляции Спирмена
В свою очередь, число каспаза-3-содержащих Т-клеток памяти было ассоциировано с долей CD4+CD45RA–AnnexinV+PI– Т-клеток (рис. 5) и процентным содержанием CD4+CD45RA–PO-PRO+PI– Т-лимфоцитов (рис. 6). Важно отметить, что относительное количество активированных (CD25+) Т-клеток памяти также было статистически значимо связано как с долей PO-PRO+PI– Т-лимфоцитов (R = 0.684; P < 0.001), так и с процентным содержанием AnnexinV+PI– Т-клеток (R = 0.893; P < 0.001).
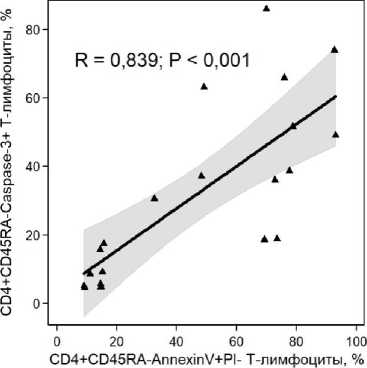
Рис. 5 . Связь экспрессии активной формы каспазы-3 и нарушения асимметрии мембраны жизнеспособных CD4+ Т-клеток памяти.
R – коэффициент ранговой корреляции Спирмена
Таким образом, в результате проведенных исследований нами было установлено, что при стимуляции клеток через Т-клеточный рецептор в жизнеспособных CD4+ Т-лимфоцитах памяти пе- риферической крови человека индуцируется экспрессия активной формы каспазы-3. Число каспа-за-3-позитивных CD4+CD45RA– Т-клеток ассоциировано с показателями активации (CD25+, PO-PRO+PI–, AnnexinV+PI–) и пролиферации (Ki-67+) Т-лимфоцитов, но не коррелирует с показателями апоптоза (PO-PRO+PI+, AnnexinV+PI+) этих клеток.
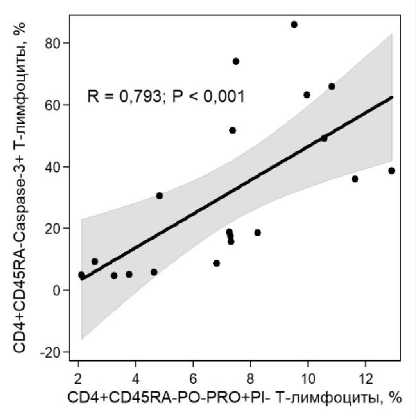
Рис. 6 . Связь экспрессии активной формы каспазы-3 и проницаемости мембраны жизнеспособных CD4+ Т-клеток памяти.
R – коэффициент ранговой корреляции Спирмена
Каспаза-3 относится к числу эффекторных цистеиновых протеаз. Её функции напрямую связаны с развитием характерной для апоптоза морфологии клетки [Alnemri, 1997], но не ограничиваются индукцией программируемой гибели. Так, она вовлечена в дифференцировку скелетной мускулатуры [Fernando et al., 2002], деление В-лимфоцитов [Woo et al., 2003] и созревание эритроцитов [Lamkanfi et al . , 2007]. В Т-лимфоцитах каспаза-3 необходима для запуска активных фаз клеточного цикла [Alam et al., 1999; Kennedy et al . , 1999], а ее ингибирование приводит к дефекту пролиферации стимулированных наивных Т-клеток [Alam et al . , 1999]. Также известно, что в жизнеспособных активированных Т-клетках каспаза-3 сохраняет способность расщеплять свои физиологические субстраты (PARP, ядерная ламина), хотя в присутствие интерлейкина-2 наличие активной формы каспазы-3 не приводит к расщеплению ДНК [Wilhelm, Wagner, Hacker, 1998]. Вероятно, в сигнальном пути апоптоза существуют контрольные точки, предотвращающие гибель клетки вопреки действию каспазы-3. Механизмы регуляции активности каспазы-3 в жизнеспособных клетках на сегодняшний день остаются неизвестными.
Заключение
Согласно полученным нами данным, экспрессия активной формы каспазы-3 плотно связана с активацией и пролиферацией CD4+CD45RA– Т-клеток. Поэтому ее использование в качестве единственного маркера при исследовании апоптоза стимулированных CD4+ Т-лимфоцитов может приводить к получению ложноположительных результатов. Комбинирование с другими параметрами, отражающими индукцию программируемой клеточной гибели и активность лимфоцитов, может облегчить интерпретацию получаемых данных и увеличить достоверность выводов.
Список литературы Экспрессия активной формы каспазы-3 не является достоверным показателем индукции апоптоза в стимулированных CD4+ Т-лимфоцитах
- Akbar A.N. et al. Loss of CD45R and gain of UCHL1 reactivity is a feature of primed T cells // J. Immunol. 1988. Vol. 140. P. 2171-2178.
- Alam A. et al. Early activation of caspases during T lymphocyte stimulation results in selective substrate cleavage in nonapoptotic cells // J. Exp. Med. 1999. Vol. 190. P. 1879-1890.
- Alnemri E.S. Mammalian cell death proteases: a family of highly conserved aspartate specific cysteine proteases // J. Cell Biochem. 1997. Vol. 64. P. 33-42.
- Belloc F. et al. Flow Cytometry detection of caspase 3 activation in preapoptotic leukemic cells // Cytometry. 2000. Vol. 40. P. 151-160.
- Brancolini C. et al. Dismantling cell-cell contacts during apoptosis is coupled to a caspase-dependent proteolytic cleavage of beta-catenin // J. Cell Biol. 1997. Vol. 139. P. 759-771.
- Carracedo J. et al. Caspase-3-dependent pathway mediates apoptosis of human mononuclear cells induced by cellulosic haemodialysis membranes // Nephrol. Dial. Transplant. 2002. Vol. 17. P. 1971-1977.
- Carson D.A., Ribeiro J.M. Apoptosis and disease // The Lancet. 1993. Vol. 341. P. 1251-1254.
- Fan J. et al. Circulating Peptidome and Tumor-Resident Proteolysis // Enzymes. 2017. Vol. 42. P. 1-25.
- Fernando P. et al. Caspase 3 activity is required for skeletal muscle differentiation // Proc. Natl. Acad. Sci. USA. 2002. Vol. 99. P. 11025-11030.
- Janicke R.U. et al. Caspase-3 is required for DNA fragmentation and morphological changes associated with apoptosis // J. Biol. Chem. 1998. Vol. 273. P. 9357-9360.
- Kennedy N.J. et al. Caspase activation is required for T cell proliferation // J. Exp. Med. 1999. Vol. 190. P. 1891-1896.
- Kook S. et al. Caspase-dependent cleavage of tensin induces disruption of actin cytoskeleton during apoptosis // Biochemical and Biophysical Research Communications. 2003. Vol. 303. P. 37-45.
- Lamkanfi M. et al. Caspases in cell survival, proliferation and differentiation // Cell Death. Differ. 2007. Vol. 14. P. 44-55.
- Lowe S.W., Lin A.W. Apoptosis in cancer // Carcinogenesis. 2000. Vol. 21. P. 485-495.
- O'Reilly L.A., Strasser A. Apoptosis and autoimmune disease // Inflamm. Res. 1999. Vol. 48. P. 5-21.
- Santos N.F.G.D. et al. Active caspase-3 expression levels as bioindicator of individual radiosensitivity // An. Acad. Bras. Cienc. 2017. Vol. 89. P. 649-659.
- Vaux D.L., Strasser A. The molecular biology of apoptosis // Proc. Natl. Acad. Sci. USA. 1996. Vol. 93. P. 2239-2244.
- Wilhelm S., Wagner H., Hacker G. Activation of caspase-3-like enzymes in non-apoptotic T cells // Eur. J. Immunol. 1998. Vol. 28. P. 891-900.
- Woo M. et al. Caspase-3 regulates cell cycle in B cells: a consequence of substrate specificity // Nat. Immunol. 2003. Vol. 4. P. 1016-1022.


