Экспрессия фактора роста эндотелия сосудов и его рецепторов первого и второго типов в клетках первичной опухоли у больных раком почки
Автор: Хоченков Д.А., Волкова М.И., Тимофеев И.В., Ольшанская А.С., Хоченкова Ю.А., Соломко Э.Ш., Ашуба С.А., Матвеев В.Б.
Журнал: Сибирский онкологический журнал @siboncoj
Рубрика: Лабораторные и экспериментальные исследования
Статья в выпуске: 4 т.20, 2021 года.
Бесплатный доступ
Цель исследования – изучить экспрессию фактора роста эндотелия сосудов (VegF-a) и его рецепторов VegFR-1 и VegFR-2 в клетках почечно-клеточного рака и оценить влияние уровней экспрессии данных маркеров на характеристики опухолевого процесса и прогноз больных. Материал и методы. В исследование было включено 65 больных раком почки pt1a–t4N0/+m0/+. Пациенты, подвергнутые радикальному хирургическому вмешательству, находились под динамическим наблюдением. Для исследования использовали гистологические образцы опухолевой ткани, полученные при оперативном удалении новообразования. Во всех случаях выполнялось рутинное морфологическое исследование. Экспрессию VegFa, VegFR-1, -2 изучали методом иммуногистохимического окрашивания с использованием соответствующих антител к рецепторам и ростовым факторам. Результаты. В цитоплазме и на мембране клеток первичной опухоли больных раком почки обнаружена экспрессия VegF и его рецепторов VegFR-1, -2. Отмечена значимая прямая корреляция гиперэкспрессии изучаемых маркеров со степенью анаплазии g 3-4 (VegFR-1, -2) и признаками значительной распространенности опухолевого процесса, включая высокую категорию рТ (VegFR-1, -2), больший размер первичной опухоли (VegFR-1, -2), опухолевую инвазию паранефрия (VegF, VegFR-1), опухолевый венозный тромбоз (VegFR-1, -2), множественные метастазы (VegF-2), метастазы в надпочечнике (VegF, VegFR-2) и печени (VegFR-1) (р-0,05). Отмечена тенденция к значимому влиянию на риск прогрессирования рака почки после циторедуктивной нефрэктомии уровня экспрессии VegF (р=0,0821). Выявлена тенденция к значимому влиянию на риск смерти от рака почки у оперированных больных уровня экспрессии VegFR-2 (р=0,089). Других взаимосвязей экспрессии VegF-a/VegFR-1, -2 с прогнозом течения рака почки не обнаружено (р-0,05 для всех). Заключение. На поверхности и в цитоплазме клеток первичной опухоли больных раком почки pt1a-t4N0/+m0/+ обнаружена экспрессия VegFa, а также его рецепторов VegFR-1 и VegFR-2. Отмечена достоверная корреляция гиперэкспрессии VegF/VegFR с высокой степенью анаплазии опухоли g3-4 и значительной распространенностью опухолевого процесса. В однофакторном анализе отмечено значимое неблагоприятное влияние на специфическую выживаемость гиперэкспрессии VegFR-2. В регрессионном анализе гиперэкспрессия VegFR-2 имела тенденцию к независимому влиянию на специфическую выживаемость. Полученные результаты показывают значение экспрессии VegF/VegFR в качестве биомаркеров при почечно-клеточном раке.
Почечно-клеточная карцинома, рак почки, фактор роста эндотелия сосудов, экспрессия рецепторов, общая выживаемость
Короткий адрес: https://sciup.org/140254535
IDR: 140254535 | УДК: 616.61-006.6:577.112 | DOI: 10.21294/1814-4861-2021-20-4-64-72
Текст научной статьи Экспрессия фактора роста эндотелия сосудов и его рецепторов первого и второго типов в клетках первичной опухоли у больных раком почки
Характерной особенностью рака почки является гиперваскуляризация. Гиперэкспрессия фактора роста эндотелия сосудов (Vascular endothelial growth factor – VEGF) считается одним из центральных событий, приводящих к возникновению и прогрессированию почечно-клеточного рака (ПКР). Для увеличения размеров опухоли необходима интенсификация кровоснабжения, которая достигается путем экспрессии и секреции VEGF, способствующего образованию новых кровеносных сосудов вокруг опухоли. Кроме того, под действием этого подсемейства факторов роста происходит диссеминация раковых клеток. Передача сигналов инициируется за счет связывания VEGF с его рецепторами (VEGFR), VEGFR-1 (Flt-1), VEGFR-2 (KDR/Flk-1) и VEGFR-3 (Flt-4) [1]. Основным регулятором ангиогенеза является
VEGF и родственный ему рецептор VEGFR-2. Именно эти свойства сделали VEGF и VEGF-индуцированный ангиогенез привлекательными терапевтическими мишенями для лечения ПКР [2]. Для воздействия на VEGF-зависимые сигнальные пути онкогенеза были разработаны два подхода. Первый – это использование низкомолекулярных ингибиторов рецепторных тирозинкиназ различного спектра действия, таких как сунитиниб, сорафениб, для блокирования внутриклеточной протеинкиназной активности рецепторов VEGF. Вторая стратегия связана с применением моноклональных антител (бевацизумаб и его биоаналоги), которые связывают циркулирующий VEGF и предотвращают его связывание и активацию рецептора.
В то же время остается дискуссионным вопрос о выборе прогностических и предиктивных мар- керов при раке почки и его лечении при помощи таргетных антиангиогенных препаратов. При определении VEGF в плазме не было обнаружено значимой корреляции между содержанием VEGF до лечения бевацизумабом и клиническим ответом или временем до прогрессирования [3]. Была установлена незначительная корреляция растворимого VEGFR-2 с ответом на терапию сунитинибом у пациентов с метастатическим ПКР [4].
Целью исследования являлись изучение экспрессии VEGF-A/VEGFR-1, -2 в клетках опухоли почки и оценка влияния уровней экспрессии данных молекул на характеристики опухолевого процесса и прогноз больных ПКР.
Материал и методы
В исследование было включено 65 больных раком почки pT1a–T4N0/+M0/+, проходивших лечение в ФГБУ «НМИЦ онкологии им. Н.Н. Блохина» Минздрава России. Медиана возраста – 59,0 (33–79) лет, соотношение мужчин и женщин – 1,9:1. Пациенты, подвергнутые радикальному хирургическому вмешательству, находились под динамическим наблюдением. Из 25 больных, подвергнутых циторедуктивным операциям, противоопухолевая терапия была назначена 22 (88,0 %), из них цитокины – 3 больным с метастазами в легкие, антиангиогенная таргетная терапия – 19 пациентам.
Для исследования использовали гистологические образцы опухолевой ткани, полученные при оперативном удалении новообразования. Во всех случаях выполнялось рутинное морфологическое исследование. Экспрессию VEGFA, VEGFR-1, -2 изучали методом иммуногистохимического окрашивания с использованием антител к рецепторам и ростовым факторам: anti-VEGFR1 (ab2350 Abcam, разведение 1:50), anti-VEGFR2 (A-3, Santa Cruz, разведение 1:100), anti-VEGF (VG-1, Dako, 1:100) и набора REAL™ EnVision™ Detection System, Peroxidase/DAB+ Rabbit/Mouse (Dako). Срезы докрашивали гематоксилином Майера (Sigma), депарафинизировали при последовательной обработке в ксилоле и спирте и заключали под покровное стекло при помощи Shandon Mount solution (Thermo). Оценку результатов окрашивания проводили с применением светового микроскопа «Nikon» Eclipse 50i при увеличении ×10–40. Уровни экспрессии оценивались полуколичествен-ным методом определения интенсивности окрашивания (0, 1+, 2+ и 3+) и подсчетом относительного количества окрашенных клеток, выраженного в процентах (0–100 %). Значение уровня экспрессии по иммуногистохимической шкале (H-score (HS)) рассчитывалось путем умножения процента окрашенных клеток на показатель интенсивности окрашивания [3].
Все данные пациентов внесены в базу на основе электронных таблиц Microsoft Excel с помощью специально разработанного кодификатора. Ана- лиз данных осуществлялся с применением блока статистических программ SPSS Statistics 19. Для оценки взаимосвязи признаков рассчитывали коэффициент корреляции Пирсона (r) и проводили оценку его значимости. Для оценки точности прогнозирования события в зависимости от значений анализируемых факторов строили ROC-кривые. По координатам ROC-кривых выделяли пороговое значение анализируемых факторов, наиболее значимое для составления прогноза. Продолжительность жизни рассчитывали от даты хирургического вмешательства до последнего дня наблюдения или смерти, продолжительность жизни без рецидива – от даты радикального хирургического вмешательства до даты регистрации рецидива, продолжительность жизни без прогрессирования – от даты циторедуктивного хирургического вмешательства до даты регистрации прогрессирования рака почки. Выживаемость оценивали по методу Kaplan–Meier, различия выживаемости определяли с помощью log-rank теста. Для выявления прогностически значимых для выживаемости факторов использовали одно- и многофакторный регрессионный анализ Сох.
Результаты
При клиническом исследовании установлено, что у 59 (90,8 %) больных имели место односторонние опухоли почек, у 6 (9,2 %) – двухсторонние. Медиана диаметра наибольшей опухоли почечной паренхимы составила 10 (2,5–26) см. В 50 (76,9 %) случаях отмечена опухолевая венозная инвазия. У 45 (69,2 %) больных на момент операции имелись отдаленные метастазы. Солитарные метастатические очаги диагностированы в 22 (33,8 %), множественные – в 23 (35,4 %) наблюдениях. Более одной локализации метастазов было у 11 (16,9 %) больных. Метастазы рака почки локализовались в надпочечнике – у 28 (43,1 %), легких – у 22 (33,8 %), костях – у 5 (7,7 %), печени – у 2 (3,1 %) пациентов.
Всем больным выполнена нефрэктомия с расширенной забрюшинной лимфодиссекцией. В 50 (76,9 %) случаях объем операции также включал тромбэктомию. В 28 (43,1 %) наблюдениях помимо первичной опухоли удалялись опухолевые очаги других локализаций: адреналэктомия выполнена 24 (36,9 %), резекция контралатеральной почки – 1 (1,5 %), резекция легкого – 1 (1,5 %), удаление костного метастаза – 1 (1,5 %) пациенту. Хирургическое лечение было радикальным в 40 (61,5 %) наблюдениях и имело циторедуктивный характер в 25 (39,5 %) случаях.
Гистологически во всех удаленных образцах первичной опухоли верифицирован ПКР, при этом в большинстве случаев выявлен светлоклеточный вариант опухоли – 59 (90,8 %). Несветлоклеточный ПКР обнаружен в 6 (9,2 %) наблюдениях, в том числе 2 (3,1 %) случая па-
Таблица 1/table 1
Экспрессия сосудистого эндотелиального фактора роста и его рецепторов первого и второго типов в клетках первичной опухоли у больных раком почки expression of vascular endothelial growth factor and VegFR-1 and VegFR-2 receptors in primary tumor cells of patients with Rcc
В цитоплазме и на мембране клеток первичной опухоли больных раком почки обнаружена экспрессия VEGF и его рецепторов VEGFR-1, -2 (табл. 1, рис. 1). Корреляции уровней экспрессии ростового фактора и его тирозинкиназ не выявлено (p>0,05 для всех).
Проведен анализ возможной взаимосвязи характеристик опухолевого процесса (количество пораженных почек, гистологический вариант рака почки, степень анаплазии опухоли, категория рТ, размер опухоли почки, врастание опухоли в паранефрий, формирование и протяженность опухолевого венозного тромба, инвазия опухоли в венозную стенку, категории pN и М, количество метастазов, наличие метастазов в лимфоузлы, легкие, кости, надпочечник, печень) с уровнями экспрессии VEGF, а также рецепторов тирозин-киназ VEGFR-1, -2. Отмечена значимая прямая корреляция гиперэкспрессии этих маркеров со степенью анаплазии G 3–4 (VEGFR-1, -2) и признаками значительной распространенности опухолевого процесса, включая высокую категорию рТ (VEGFR-1, -2), больший размер первичной опухоли (VEGFR-1, -2), опухолевую инвазию пара-нефрия (VEGF, VEGFR-1), опухолевый венозный тромбоз (VEGFR-1, -2), множественные метастазы (VEGF-2), метастазы в надпочечнике (VEGF, VEGFR-2) и печени (VEGFR-1) (р<0,05 для всех). Других значимых корреляций не обнаружено. В табл. 2 отражены только статистически значимые взаимосвязи.
Медиана наблюдения за всеми больными составила 19,9 ± 2,9 (1–133) мес. Рецидивы рака почки развились у 17 (42,5 %) из 40 радикально оперированных больных. Во всех случаях зарегистрировано появление отдаленных метастазов. Двум пациентам с солитарными метастазами в печени выполнено их удаление с последующим динамическим наблюдением. Пятнадцати больным назначена антиангиогенная таргетная терапия. Максимальный ответ на лечение – стабилизация. При этом 42 (64,6 %) из 65 пациентов живы: 24 (36,9 %) – без признаков болезни, 18 (27,7 %) – с метастазами; 23 (35,4 %) пациента умерли, их них 22 (33,8 %) – от прогрессирования рака почки, 1 (1,5 %) – от осложнений хирургического лечения. Медиана общей (ОВ) и специфической (СВ) выживаемости у 65 пациентов составила 43,8 ± 7,7 и 52,1 ± 8,0 мес соответственно. Медиана безреци-дивной выживаемости (БРВ) у 40 радикально опе-
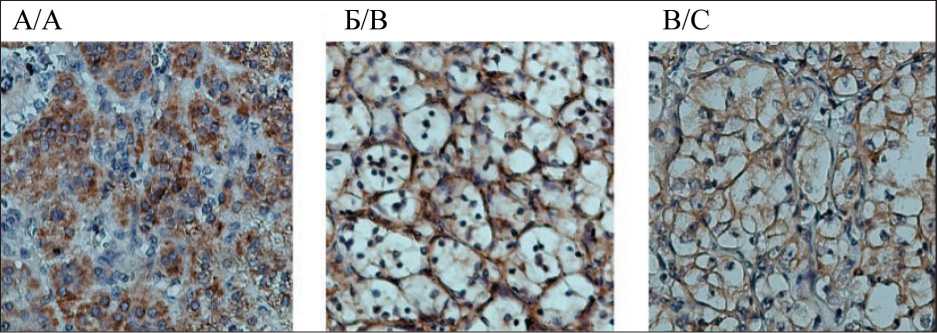
Рис. 1. Экспрессия VEGF (А) и его рецепторов VEGFR-1 (Б) и VEGFR-2 (В) на образцах опухоли у пациентов с почечноклеточным раком
Fig. 1. Expression of VEGF (A) and its receptors VEGFR-1 (B) and VEGFR-2 (C) on tumor samples from patients with renal cell carcinoma
Таблица 2/table 2
Корреляция уровней экспрессии VegF/VegFR-1, -2 на клетках первичной опухоли с характеристиками опухолевого процесса у больных раком почки correlation of VegF/VegFR-1, -2 expression levels on primary tumor cells with tumor characteristics in patients with Rcc
|
Характеристики опухолевого процесса/ Tumor characteristics |
Корреляция Пирсона r, 2-сторонняя значимость/ Pearson's correlation r, 2-sided significance |
VEGFA |
VEGFR-1 |
VEGFR-2 |
|
Степень анаплазии G/ |
r |
0,045 |
0,493** |
0,339** |
|
Anaplasia grade |
Знч.(2-сторон.)/2-sided significance |
0,719 |
0,000 |
0,006 |
|
Категория рТ/ |
r |
0,135 |
0,493** |
0,314* |
|
pT category |
Знч.(2-сторон.)/2-sided significance |
0,284 |
0,000 |
0,011 |
|
Размер опухоли почки/ |
r |
-0,012 |
0,270* |
0,254* |
|
Size of kidney tumor |
Знч.(2-сторон.)/2-sided significance |
0,922 |
0,030 |
0,042 |
|
Инвазия паранефрия/ |
r |
0,281* |
0,250* |
0,157 |
|
Invasion of paranephria |
Знч.(2-сторон.)/2-sided significance |
0,024 |
0,044 |
0,213 |
|
Опухолевый тромбоз/ |
r |
-0,012 |
0,281* |
0,365** |
|
Tumor thrombosis |
Знч.(2-сторон.)/2-sided significance |
0,925 |
0,023 |
0,003 |
|
Количество метастазов/ |
r |
-0,006 |
0,110 |
0,384** |
|
Number of metastases |
Знч.(2-сторон.)/2-sided significance |
0,967 |
0,472 |
0,009 |
|
Метастазы в надпочечник/ |
r |
0,389** |
-0,127 |
0,400** |
|
Adrenal metastases |
Знч.(2-сторон.)/2-sided significance |
0,008 |
0,404 |
0,007 |
|
Метастазы в печень/ |
r |
-0,151 |
0,300* |
0,146 |
|
Liver metastases |
Знч.(2-сторон.)/2-sided significance |
0,322 |
0,045 |
0,340 |
Примечание: * – корреляция значима на уровне 0.05 (2-сторон.); ** – корреляция значима на уровне 0,01 (2-сторон.).
Note: * – Correlation is significant at 0.05 (2-sided); ** – Correlation is significant at the 0.01 level (2-sided).
рированных пациентов достигла 79,2 ± 43,1 мес, медиана беспрогрессивной выживаемости (БПВ) у 25 больных после циторедуктивной операции – 7,4 ± 2,4 мес.
Проведен анализ влияния на выживаемость варианта и степени анаплазии почечно-клеточного рака, стороны поражения почки, категории рТ, опухолевой инвазии в паранефрий, наличия опухолевого венозного тромба, категорий pN и М, количества метастазов, радикальности хирургического лечения. Учитывая тот факт, что за исключением одной смерти все летальные исходы в группе исследования были обусловлены прогрессированием рака почки, анализ факторов риска ОВ не проводился, и акцент был сделан на поиске признаков, влиявших на СВ. В однофакторном анализе значимыми клинико-морфологическими факторами риска СВ являлись: степень анаплазии G3–4, одностороннее поражение почек, категория рТ3-Т4, опухолевый венозный тромбоз, множественные метастазы и нерадикальная операция (р<0,05 для всех). В однофакторном анализе отмечена тенденция к снижению БРВ у больных раком почки с опухолевым венозным тромбозом (р=0,087). Значимых факторов риска БРВ не выделено. В однофакторном анализе отмечена тенденция к снижению БПВ после циторедуктивной операции у больных раком почки G3-4 (р=0,073). Значимых факторов риска БПВ не выделено.
Проведен анализ предсказательной ценности уровней экспрессии VEGF/VEGFR-1, -2 на опухолевых клетках для прогнозирования рецидива рака почки после радикального хирургического лечения, прогрессирования заболевания после циторедуктивной нефрэктомии, а также смерти от рака почки. Отмечена тенденция к значимому влиянию на риск прогрессирования рака почки после циторедуктивной нефрэктомии уровня экспрессии VEGF (р=0,0821). Выявлена тенденция к значимому влиянию на риск смерти от рака почки у оперированных больных уровня экспрессии VEGFR-2 (р=0,089). Других взаимосвязей экспрессии VEGF-A/VEGFR-1, -2 с прогнозом течения рака почки не обнаружено (р>0,05 для всех).
Выделено пограничное значение VEGF, составившее 80 HS. Отмечена тенденция к достоверному снижению БПВ пациентов с гипоэкспрессией VEGF< <80 HS по сравнению с VEGF≥80 HS (медиана – 6,7 ± 1,2 vs 48,8 ± 0,0 мес соответственно, р=0,054).
Выделено пограничное значение VEGFR-2, равное 100 HS. В однофакторном анализе выявлено достоверное снижение медианы СВ с 59,3 ± 12,1 до 6,2 ± 0,3 мес у больных с гиперэкспрессией VEGFR-2≥ 100 HS по сравнению с пациентами, имевшими более низкую экспрессию данного маркера (р<0,0001) (рис. 2).
Проведен регрессионный анализ СВ, в который включены выделенные в однофакторном анализе
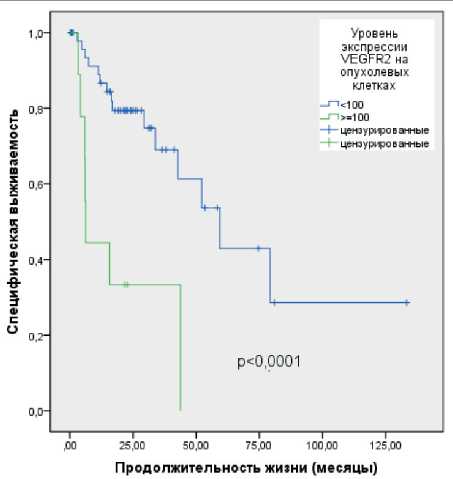
Рис. 2. Специфическая выживаемость больных раком почки pT1a-T4N0/+M0/+ после нефрэктомии в зависимости от уровня экспрессии VEGFR-2 в клетках первичной опухоли
Fig. 2. Specific survival of patients with kidney cancer (pT1a-T4N0/+M0/+) after nephrectomy with respect to the level of VEGFR-2 expression in primary tumor cells факторы риска. При этом из анализа исключены взаимосвязанные факторы (категория рТ в качестве фактора, определяющегося наличием опухолевого тромба, а также множественные метастазы в качестве фактора, определяющего нерадикальность хирургического лечения). Отмечена тенденция к независимому влиянию на СВ степени анаплазии G3–4 (отношение рисков (HR) 1,7 (95 % доверительные интервалы (CI): 1,0–3,1); р=0,072), опухолевого тромбоза (HR 6,2 (95 % CI: 0,8–49,1); p=0,082) и гиперэкспрессии VEGFR-2 (HR 2,4 (95 % CI: 0,9–6,5); p=0,081).
Обсуждение
Несмотря на доказанную эффективность ингибиторов VEGF/VEGFR в лечении распространенного ПКР, количество исследований, направленных на изучение экспрессии и прогностического значения молекул данного сигнального пути, ограничено, а полученные результаты разноречивы. Это послужило причиной для инициации нашей работы. Исследование было проведено на проспективно набиравшемся операционном материале больных ПКР с оценкой экспрессии маркеров при помощи иммуногистохимического исследования, которое неплохо зарекомендовало себя в ранних работах [5] и в настоящее время широко используется другими исследователями [6, 7].
Ожидаемо на поверхности и в цитоплазме клеток первичной опухоли больных раком почки pT1a-T4N0/+M0/+ мы обнаружили экспрессию VEGF, а также рецепторов тирозинкиназ VEGFR-1, VEGFR-2. Клетки ПКР наиболее ак- тивно продуцировали VEGFR-1. При этом частота экспрессии VEGF составила 55,4 % при среднем уровне экспрессии 32,4 HS, его рецептор первого типа продуцировался в 75,4 % опухолей (97,2 HS), второго типа – несколько реже, в 55,4 % препаратов (39,2 HS). S. Lkhagvadorj et al. выполнили иммуногистохимическое исследование экспрессии VEGFR-1 в 126 образцах ткани светлоклеточного ПКР. Экспрессия VEGFR-1 была обнаружена в 59 (46,8 %) препаратах [8]. Следует отметить, что окрашивание VEGF в цитоплазме клеток ПКР не изменяется при хранении образцов опухоли в парафине в течение 2–20 лет, а мембранная экспрессия снижается, возможно, за счет различного распределения, связывающей способности и дегенерации изоформ VEGF [9]. Подготовка ткани опухоли к исследованию также может изменить структуру белка [10].
Некоторыми авторами также отмечена взаимосвязь продукции VEGF опухолевыми клетками с рядом характеристик, ассоциированных с агрессивным течением ПКР. Так, D. Minardi et al. выявили корреляцию VEGF cо стадией ПКР, степенью анаплазии опухоли G3–4 и группой прогноза ПКР [6, 7]. N. Tsuchiya et al., напротив, не удалось обнаружить взаимосвязи экспрессии VEGF и клинико-морфологических характеристик 23 образцов ПКР [11].
Нам не удалось показать влияние уровня экспрессии VEGFA на выживаемость больных ПКР, как и некоторым другим исследовательским группам [6, 11]. Однако мы отметили тенденцию к достоверному снижению БПВ пациентов с гипоэкспрессией VEGFA<80 HS по сравнению с VEGFA≥80 HS (медиана 6,7 ± 1,2 vs 48,8 ± 0,0 мес соответственно, р=0,054). Сходные результаты были получены в исследовании J. Jacobsen et al., продемонстрировавшие снижение медианы ОВ у пациентов с уровнем VEGF ниже медианы [9]. В крупной серии наблюдений D. Minardi et al. (2015), напротив, медиана ОВ оказалась значимо выше при низкой экспрессии VEGF по сравнению с гиперэкспрессией данного маркера (р<0,001) [6].
Помимо недостаточного количества наблюдений, возможным объяснением обратной корреляции уровня VEGF и БПВ в нашей серии наблюдений может являться эффект «обкрадывания», когда опухоли с высокой экспрессией VEGFR связывают VEGF до того, как он может секретироваться для стимуляции неоваскуляризации. Косвенным подтверждением этому факту мы считаем отсутствие значимой корреляции уровня VEGF и VEGFR-1, -2. Надо отметить, что к сходным выводам пришли H.M. Kluger et al. [12].
Необходимо отметить, что данные о прогностической значимости рецепторов VEGF, полученные разными авторами, существенно различаются. S. Lkhagvadorj et al. отметили, что более высокая экспрессия VEGFR-1 прямо коррелировала с низкой степенью анаплазии опухоли по Фурману и отсутствием инвазии тканей почечного синуса в 126 образцах ткани светлоклеточного ПКР [8]. В исследовании J. Jacobsen et al. отмечена более высокая экспрессия VEGFR-2 при ранних стадиях ПКР [9]. O. Eronat et al. не обнаружили корреляции VEGFR-2 с размером, гистологическим вариантом и степенью анаплазии опухоли по Фурману, категорией рТ, наличием регионарных и отдаленных метастазов у 48 больных ПКР [13]. Напротив, H.M. Kluger et al., изучив 334 образца ПКР, отметили, что экспрессия VEGFR прямо коррелирует со степенью анаплазии опухоли [12].
Заключение
В нашем исследовании было показано, что на поверхности и в цитоплазме клеток первичной опухоли больных раком почки pT1a-T4N0/+M0/+ обнаружена экспрессия VEGFA, а также его рецепторов VEGFR-1 и VEGFR-2. Отмечена достоверная корреляция гиперэкспрессии VEGF/VEGFR с высокой степенью анаплазии опухоли G3–4 и значительной распространенностью опухолевого процесса. В однофакторном анализе отмечено значимое неблагоприятное влияние на специфическую выживаемость гиперэкспрессии VEGFR-2≥ 100 HS. В регрессионном анализе гиперэкспрессия VEGFR-2 имела тенденцию к независимому влиянию на специфическую выживаемость (HR 2,4 (95 % CI: 0,9–6,5); p=0,081) наряду с такими общепризнанными факторами риска, как степень анаплазии G3–4 (HR 1,7 (95 % CI: 1,0–3,1); р=0,072) и опухолевый венозный тромбоз (HR 6,2 (95 % CI: 0,8–49,1); p=0,082).
Список литературы Экспрессия фактора роста эндотелия сосудов и его рецепторов первого и второго типов в клетках первичной опухоли у больных раком почки
- Hanahan D., Weinberg R.A. Hallmarks of cancer: the next generation. Cell. 2011 Mar 4; 144(5): 646-74. https://doi.org/10.1016/j.cell.2011.02.013.
- Heath V.L., Bicknell R. Anticancer strategies involving the vasculature. Nat Rev Clin Oncol. 2009 Jul; 6(7): 395-404. https://doi.org/10.1038/nrclinonc.2009.52.
- Yang J.C. Bevacizumab for patients with metastatic renal cancer: an update. Clin Cancer Res. 2004 Sep 15; 10(18 Pt 2): 6367S-70S. https://doi.org/10.1158/1078-0432.CCR-050006.
- Deprimo S.E., Bello C.L., Smeraglia J., Shalinsky D.R., Freddo J., Baum C.M., Spinella D.G. Soluble protein biomarkers of pharmacodynamic activity of the multi-targeted kinase inhibitor SU11248 in patients with metastatic renal cell cancer. Cancer Res. 2005; 65: 108-108.
- Detre S., Saclani Jotti G., Dowsett M. A “quickscore” method for immunohistochemical semiquantitation: validation for oestrogen receptor in breast carcinomas. J Clin Pathol. 1995 Sep; 48(9): 876-8. https://doi.org/10.1136/jcp.48.9.876.
- Minardi D., Santoni M., Lucarini G., Mazzucchelli R., Burattini L., Conti A., Bianconi M., Scartozzi M., Milanese G., Primio R.D., Montironi R., Cascinu S., Muzzonigro G. Tumor VEGF expression correlates with tumor stage and identifies prognostically different groups in patients with clear cell renal cell carcinoma. Urol Oncol. 2015 Mar; 33(3): 113.e1-7. https://doi.org/10.1016/j.urolonc.2014.06.014.
- Minardi D., Lucarini G., Santoni M., Mazzucchelli R., Burattini L., Pistelli M., Bianconi M., Di Primio R., Scartozzi M., Montironi R., Cascinu S., Muzzonigro G. VEGF expression and response to sunitinib in patients with metastatic clear cell renal cell carcinoma. Anticancer Res. 2013 Nov; 33(11): 5017-22.
- Lkhagvadorj S., Oh S.S., Lee M.R., Jung J.H., Chung H.C., Cha S.K., Eom M. VEGFR-1 Expression Relates to Fuhrman Nuclear Grade of Clear Cell Renal Cell Carcinoma. J Lifestyle Med. 2014 Mar; 4(1): 64-70. https://doi.org/10.15280/jlm.2014.4.1.64.
- Jacobsen J., Grankvist K., Rasmuson T., Bergh A., Landberg G., Ljungberg B. Expression of vascular endothelial growth factor protein in human renal cell carcinoma. BJU Int. 2004 Feb; 93(3): 297-302. https://doi.org/10.1111/j.1464-410x.2004.04605.x.
- Ortega N., Hutchings H., Plouët J. Signal relays in the VEGF system. Front Biosci. 1999 Feb 1; 4: D141-52.
- Tsuchiya N., Sato K., Akao T., Kakinuma H., Sasaki R., Shimoda N., Satoh S., Habuchi T., Ogawa O., Kato T. Quantitative analysis of gene expressions of vascular endothelial growth factor-related factors and their receptors in renal cell carcinoma. Tohoku J Exp Med. 2001 Oct; 195(2): 101-13. https://doi.org/10.1620/tjem.195.101.
- Kluger H.M., Siddiqui S.F., Angeletti C., Sznol M., Kelly W.K., Molinaro A.M., Camp R.L. Classification of renal cell carcinoma based on expression of VEGF and VEGF receptors in both tumor cells and endothelial cells. Lab Invest. 2008 Sep; 88(9): 962-72. https://doi.org/10.1038/labinvest.2008.65.
- Eronat O., Kandemir O., Onursever A. The expression level of vascular endothelial growth factor receptor-2, vascular endothelial growth factor receptor-3, and insulin-like growth factor II mRNA binding protein 3 in renal cell carcinoma: Can these markers indicate poor prognosis in immunohistochemical examination? Clin Cancer Investig J. 2018; 7: 14. https://doi.org/10.4103/ccij.ccij_84_17.


