Экспрессия гена белка эксцизионной репарации нуклеотидов ERCC1 в опухолевой ткани как прогностический фактор при колоректальном раке
Автор: Богомолова И.А., Долгова Д.Р., Антонеева И.И., Парменова Е.Г., Мягдиева И.Р., Уревский М.А.
Журнал: Ульяновский медико-биологический журнал @medbio-ulsu
Рубрика: Биологические науки
Статья в выпуске: 3, 2023 года.
Бесплатный доступ
В настоящее время является актуальным изучение биомаркеров резистентности опухоли к препаратам платины при колоректальном раке. У 35 % пациентов с колоректальным раком I-III стадий после адъювантной полихимиотерапии с использованием платиносодержащих противоопухолевых агентов рецидивы и метастазы возникают в течение первых 5 лет. Резистентность к препаратам платины определяется рядом факторов, в т.ч. повышенной способностью к репарации ДНК. Цель исследования оценка прогностической роли экспрессии гена ERCC1 в опухолевой ткани при колоректальном раке. Материалы и методы. Изучалась экспрессия гена белка эксцизионной репарации нуклеотидов ERCC1 в опухолевой ткани в качестве прогностического маркера эффективности адъювантной химиотерапии FOLFOX/XELOX у пациентов с колоректальным раком II-IVстадий. Оценивалась взаимосвязь уровня экспрессии ERCC1 в опухолевой ткани с эффективностью химиотерапии, клинической стадией, возрастом, выживаемостью, степенью дифференцировки и наличием мутаций EGFR сигнального пути (NRAS, KRAS, BRAF). Результаты. Экспрессия ERCC1 выявлена в 46,9 % образцов опухолевой ткани и 88,9 % образцов ткани линии резекции. В группе пациентов с гиперэкспрессией ERCC1 в опухоли медиана дожития оказалась достоверно ниже, чем в группе с низкой экспрессией. В опухолях с мутациями NRAS и BRAF экспрессия гена ERCC1 отсутствовала. Не показано различий в группах пациентов в зависимости от стадии, дифференцировки опухоли и наличия мутаций. Выводы. Экспрессия ERCC1 (выше порогового значения 2) в опухоли при колоректальном раке может служить независимым прогностическим фактором резистентности к химиотерапии по схеме FOLFOX/XELOX.
Ercc1, колоректальный рак, химиорезистентность
Короткий адрес: https://sciup.org/14128738
IDR: 14128738 | УДК: 616.34-006.6:616-08-059 | DOI: 10.34014/2227-1848-2023-3-167-176
Текст научной статьи Экспрессия гена белка эксцизионной репарации нуклеотидов ERCC1 в опухолевой ткани как прогностический фактор при колоректальном раке
Введение. Колоректальный рак (КРР) – злокачественное заболевание, возникающее в слизистой толстой и прямой кишки. КРР занимает лидирующие позиции в структуре онкологической заболеваемости в мире. При этом последние годы отмечается выраженная тенденция к росту. Так, в России заболеваемость КРР с 2008 г. по 2018 г. выросла с 87,6 до 111,6 на 100 тыс. населения [1].
У 35 % пациентов с КРР I–III стадий после адъювантной полихимиотерапии (АХТ) с использованием платиносодержащих противоопухолевых агентов рецидивы и метастазы возникают в течение первых 5 лет. У значительной части пациентов на III стадии заболевания отдаленные метастазы развиваются в течение года после окончания лечения. Более того, согласно данным ряда исследований эффективность АХТ не установлена и не меняет показателей безрецидивной выживаемости при КРР [2].
Резистентность к препаратам платины определяется рядом факторов, в т.ч. повышенной способностью к репарации ДНК. Поврежденные молекулы ДНК восстанавливаются системой репарации несоответствий. Главная роль в этой системе принадлежит эксцизионной репарации нуклеотидов, в результате которой устраняются дефекты структуры ДНК. Удаление поврежденного участка ДНК производится гетеродимером, включающим ERCC1 [3, 4].
Показано, что препараты платины имеют более высокую активность при дефиците функции эксцизионной репарации [5].
В настоящее время ERCC1 на основании результатов многочисленных экспериментальных исследований признан маркером резистентности к платиновым препаратам. В то же время, по данным клинических наблюдений, может иметь место обратная зависимость между экспрессией ERCC1 и эффективностью платиносодержащих препаратов [6] либо отсутствие такой зависимости [7].
Цель исследования. Оценить прогностическую роль экспрессии гена ERCC1 в опухолевой ткани при колоректальном раке.
Материалы и методы. Ретроспективное исследование выполнено на базе ГУЗ Областной клинический онкологический диспансер г. Ульяновска (ГУЗ УОКОД). Исследуемая группа пациентов имела верифицированный рак толстого кишечника, подтвержденный гистологическим исследованием опухоли до проведения специального лечения. За период 2014–2018 гг. отобрана группа пациентов (n=46), проходивших лечение в ГУЗ УОКОД и подписавших добровольное информированное согласие на участие в исследовании.
Описание клинико-морфологических параметров опухоли в исследуемой группе пациентов с КРР представлено в табл. 1. В большинстве случаев опухоль локализовалась в левой половине ободочной кишки и прямой кишке – 80,5 % (n=37), локализация опухоли в правом отделе встречалась в 19,5 % случаев (n=9) (табл. 1). Общее состояние пациентов оценивалось по 4-балльной шкале ECOG и на момент прохождения специального лечения не превышало 2 баллов. Ожидаемая продолжительность жизни у всех пациентов была не менее 12 мес. АХТ по схеме: 5-фторпирими-дины + оксалиплатин (FOLFOX/XELOX) – назначалась всем пациентам через 4–6 нед. после операции. Оценка клинической эффективности лечения проводилась каждые 2 мес.
(4 курса FOLFOX / 2 курса XELOX), а также после завершения всех курсов АХТ. План обследования включал общеклинический и биохимический анализы крови, общий анализ мочи, кровь на РЭА, СА 19/9, лучевые методы (рентгенография органов грудной клетки в двух проекциях, УЗИ органов брюшной полости, малого таза, забрюшинного пространства). При сомнительных результатах стандартных методов обследования выполнялась мультиспиральная компьютерная томография или магнитно-резонансная томография органов грудной клетки, брюшной полости, малого таза с внутривенным контрастированием. По окончании лечения пациенты находились под динамическим наблюдением врача-онколога с периодическим контрольным обследованием в соответствии со стандартными критериями ВОЗ.
В зависимости от промежутка времени от момента окончания АХТ до прогрессирования заболевания все пациенты были разделены на группы:
-
- платиночувствительные: длительность бесплатинового интервала более 6 мес.;
-
- платинорезистентные: длительность бесплатинового интервала менее 6 мес.;
-
- платинорефрактерные: прогрессирование процесса во время АХТ или в течение одного месяца после лечения.
Время до прогрессирования заболевания определялось как промежуток времени от момента начала наблюдения до даты фиксирования рецидива или метастазирования опухоли.
Критериями исключения из исследования стали отдаленные метастазы, предоперационная лучевая или химиолучевая терапия, АХТ только фторпиримидинами, соматические заболевания в стадии декомпенсации, противопоказания к проведению АХТ, положительный край резекции при гистологическом исследовании опухоли.
Проводилось молекулярно-генетическое исследование FFPE-образцов опухоли методом ПЦР. В качестве биоматериала использовались гистологические срезы опухолей, содержащие не менее 80 % опухолевых клеток. За условную норму принимались срезы с блоков линий резекций этих же опухолей. Выделе- ние РНК проводилось из срезов опухоли толщиной 10–15 мкм (общей площадью не менее 2 см2) с использованием магнитных частиц SileksMagNA (KitKIRFFPE100, ООО «Силекс», г. Москва, Россия). Сразу же после выделения проводилась постановка реакции обратной транскрипции. Для количественной ПЦР использовался набор qPCRmix-HS («Евроген», Россия); для оценки уровня мРНК гена ERCC1 – набор праймеров и зонда TaqMan Gene Expression Assay ERCC1 Hs00157415 (Applied Biosystem, USA). Для нормализации данных применялся ген-рефери 18S (набор TaqMan Gene Expression Assay 18S, Hs99999901). Расчет нормализованной экспрессии исследуемого гена проводился на ПО BioRad CFX Manager 3.1.
Статистическая обработка результатов исследования выполнялась с использованием программ Microsoft Excel 2010 и BioStat (AnalystSoft Inc., USA). Количественные показатели оценивались на предмет соответствия нормальному распределению с помощью критерия Шапиро – Уилка (при n<50). Сравнение двух групп по количественному показателю, распределение которого отличалось от нормального, выполнялось с помощью U-критерия Манна – Уитни. Анализ выживаемости проводился по критерию Каплан – Майера. Различия считались достоверными при уровне значимости p<0,05.
Все исследования проводились после одобрения локальным этическим комитетом ИМЭиФК УлГУ (протокол № 9 от 15.09.2017).
Таблица 1
Table 1
Characteristics of trial patients with colorectal cancer, n=46
|
Показатель Parameter |
Количество пациентов, n (%) Number of patients, n (%) |
|
Пол / sex: – мужской / male – женский / female |
22 (47) 24 (53) |
|
Возраст, лет / age, years: – младше 55 / <55 – старше 55 / >55 |
21 (46) 25 (54) |
|
Стадия заболевания / Disease stage: – II – III – IV |
11 (24) 25 (54) 10 (22) |
|
Показатель T / T-value: – Т 2 – Т 3 – Т 4 |
2 (4,3) 31 (67,4) 13 (28,3) |
|
Оценка метастатического поражения регионарных лимфоузлов / Metastatic lesions of regional lymph nodes: – N0 – N1 – N2 |
13 (28,3) 22 (47,8) 11 (23,9) |
|
Локализация опухоли / Tumor localization: – С18 – С19 – С20 |
29 (63) 3 (6,5) 14 (30,5) |
|
Показатель Parameter |
Количество пациентов, n (%) Number of patients, n (%) |
|
Степень дифференцировки / Differentiation: – низкодифференцированная G3 / G3, poorly differentiated – умеренно дифференцированная G2 / G2, moderately differentiated – высокодифференцированная G1 / G1, well differentiated |
5 (10,9) 26 (56,5) 14 (32,6) |
|
Наличие мутаций EGFR-сигнального пути / Mutations in the EGFR pathway: – NRAS – KRAS – BRAF – дикий тип / wild-type |
3 (6,5) 3 (6,5) 16 (34,8) 24 (52,2) |
Характеристика пациентов (n=46) с КРР, включенных в исследование
Результаты. В результате проведенных исследований экспрессия ERCC1 выявлена только в 46,9 % исследованных образцов опухолевой ткани и 88,9 % образцов ткани линии резекции. Последнее представляется логичным, поскольку важной функцией гена ERCC1 является поддержание стабильности клеточного генома. Белок ERCC1 выступает как облигатный компонент живой клетки.
Таблица 2
Table 2
Показатели экспрессии ERCC1 в опухолевой ткани при КРР в зависимости от клинических характеристик пациентов (Med (Q1–Q3))
ERCC1 expression rates in tumor tissue in colorectal cancer according to clinical characteristics of patients (Med (Q1–Q3))
|
Наличие мутаций EGFR-сигнального пути Mutations in the EGFR pathway |
Стадия КРР Colorectal cancer stage |
Степень дифференцировки опухоли Tumor differentiation |
|||||
|
мутации mutations NRAS KRAS BRAF |
дикий тип wild-type |
II |
III |
IV |
низкодиф-ференци-рованная poorly differentiated |
умеренно дифференцирован-ная moderately differentiated |
высоко-дифференцирован-ная well differentiated |
|
0,381 |
0,290 |
0,56 |
0,04 |
0,192 |
3,796 |
0,04 |
0,381 |
|
(0,031– |
(0,026– |
(0,38– |
(0,015– |
(0,077– |
(1,960– |
(0,015– |
(0,03– |
|
1,044) |
2,567) |
2,524) |
0,609) |
2,132) |
5,633) |
0,609) |
1,213) |
При этом уровень экспрессии гена ERCC1 в 46,9 % образцов опухоли КРР в целом по всей выборке пациентов составил 0,290 (0,027–1,132), что не отличается от соответствующего уровня в образцах зоны резекции толстой кишки – 0,413 (0,128–1,341) (p=0,437).
При оценке уровня транскрипта ERCC1 в опухоли пациентов с мутациями генов EGFR-сигнального пути было установлено, что экспрессия изучаемого гена при диком типе опухоли и при наличии мутаций NRAS, KRAS, BRAF статистически значимо не различается (p=0,398). Сравнение уровней экс- прессии у пациентов на разных стадиях канцерогенеза и с различной степенью дифференцировки опухоли также не выявило достоверных отличий (табл. 2). В группе с низкой дифференцировкой выявлены два случая гиперэкспрессии. В целом при умеренной дифференцировке опухоли экспрессия изучаемого маркера ниже, чем при низкой. Показатели экспрессии ERCC1 в опухолевой ткани при КРР на различных стадиях заболевания имеют широкий диапазон разброса данных. Минимальные значения отмечены при III стадии заболевания, однако различия между группами не являются достоверными (II и III стадии – р=0,092; III и IV стадии – р=0,210).
Анализ выживаемости пациентов с КРР по критерию Каплан – Майера показал, что в группе с экспрессией ERCC1 в опухоли выше 2 медиана дожития по времени без прогрес- сирования составила 551 день, что достоверно ниже, чем в группе с низкой экспрессией (медиана – 1887 дней) (log-rank критерий, р=0,008).
Уровень экспрессии ERCC1 в опухоли выше 2 был взят как в 5 раз превышающий уровень нормализованной экспрессии в опухоли по отношению к экспрессии гена-рефери. У 10 (22 %) из 46 пациентов наблюдалась гиперэкспрессия ERCC1 (экспрессии гена в опухоли более 2) (рис. 1).
При оценке коэффициента риска наступления рецидива после стандартного лечения FOLFOX/XELOX у пациентов с КРР II–IV стадий можно использовать уровень первоначальной экспрессии ERCC1 в опухолевой ткани, имеющий прогностическое значение в отношении эффективности платиносодержащей ХТ (HR 2,99 (0,958–9,343).
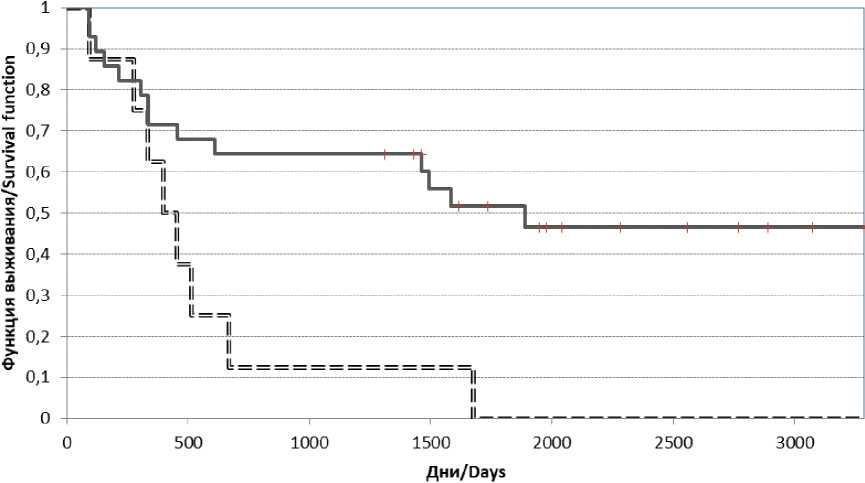
===экспрессия ERCC1 выше 2
----экспрессия ERCC1 ниже 2
ERCC1 expression below2
ERCC1 expression above 2
+ экспрессия ERCC1 ниже 2-cens
ERCC1 expression below2-cens
Рис. 1. Кривая выживания по Каплан – Майеру по времени без прогрессирования при колоректальном раке II–IV стадий в зависимости от экспрессии ERCC1 в опухоли
Fig. 1. Kaplan-Meier curve without progression in patients with colorectal cancer (stages II–IV), according to ERCC1 expression in the tumor
Обсуждение. Объяснение различного клинического течения опухолевого процесса при одном и том же морфологическом типе опухоли становится возможным, если предположить, что имеет место несколько вариантов заболевания, отличающихся по молекулярному патогенезу [8]. Молекулярно-генетическая характеристика опухоли изменяется при прогрессировании заболевания и должна учитываться при выборе схемы лечения так же, как результаты обследования и морфологической верификации.
На сегодня молекулярно-генетические маркеры делят на стандартные (обязательные при выборе противоопухолевой терапии при ряде локализаций) и экспериментальные. ERCC1 (фермент репарации ДНК) является одним из наиболее изученных экспериментальных маркеров.
Известно, что мишенью действия препаратов платины является опухолевая ДНК. На сегодня описано более 17 механизмов платиноре-зистентности в опухолевых клетках [9, 10].
Предиктивная значимость ERCC1 как маркера резистентности к препаратам платины показана для рака яичников [5, 11, 12].
Данные литературы о прогностической значимости ERCC1 при КРР достаточно противоречивы. При этом следует различать данные об экспрессии белка, получаемые иммуногистохимическим методом [13, 14], и результаты оценки уровня экспрессии гена ERCC1 в опухолевой ткани [15, 16]. Согласно данным, полученным как при изучении опухолевых тканей, так и в культуре клеточных линий, сверхэкспрессия ERCC1 может не коррелировать с клинико-патологическими особенностями колоректального рака, увеличивает радиорезистентность в клетках КРР и может коррелировать / не коррелировать с показателями безрецидивной выживаемости.
Заключение. Данный биомаркер чувствительности опухоли к препаратам платины неоднозначно экспрессируется в опухоли при КРР. Не показано различий в группах пациентов в зависимости от стадии, дифференцировки опухоли и наличия мутаций. Экспрессия ERCC1 выше порогового значения 2 в опухоли при КРР может служить независимым прогностическим фактором химиорезистентности к АХТ по схеме FOLFOX/XELOX.
Список литературы Экспрессия гена белка эксцизионной репарации нуклеотидов ERCC1 в опухолевой ткани как прогностический фактор при колоректальном раке
- Каприн А.Д., Старинский В.В., Петрова Г.В. Злокачественные новообразования в России в 2018 году (заболеваемость и смертность). Москва: МНИОИ им. П.А. Герцена - филиал ФГБУ «НМИЦ радиологии» Минздрава России; 2019. 236.
- Laurent-Puig P., Marisa L., Taieb J. Colon cancer molecular subtype intratumoral heterogeneity and its prognostic impact: An extensive molecular analysis of the PETACC-8. Annals of oncology. 2018; 29: 60.
- Bepler G., Kusmartseva I., Sharma S., Gautam A., Cantor A., Sharma A., Simon G. RRM1 modulated in vitro and in vivo efficacy of gemcitabine and platinum in non-small-cell lung cancer. J Clin Oncol. 2006; 24 (29): 4731-4737.
- Fujii T., Toyooka S., Ichimura K., Fujiwara Y., Hotta K., Soh J. ERCC1 protein expression predicts the response of cisplatin-based neoadjuvant chemotherapy in non-small-cell lung cancer. Lung Cancer. 2008; 59 (3): 377-384.
- Stevens E.V., Nishizuka S., Antony S., Reimers M., Varma S., Young L., Munson P.J., Weinstein J.N., Kohn E. C., Pommier Y. Predicting cisplatin and trabectedin drug sensitivity in ovarian and colon cancers. Mol Cancer Ther. 2008; 7 (1): 10-18.
- Olaussen K.A., DunantA., Fouret P. DNA repair by ERCC1 in non-small-cell lung cancer and cisplatin-based adjuvant chemotherapy. N Engl J Med. 2006; 355 (10): 983-991.
- Okumura H., Uchikado Y., Setoyama T. Biomarkers for predicting the response of esophageal squamous cell carcinoma to neoadjuvant chemoradiation therapy. Surg Today. 2014; 44 (3): 421-428.
- Houlston R.S. What we could do now: molecular pathology of colorectal cancer. Mol Pathol. 2001; 54 (4): 206-214.
- Galluzzi L., Vitale I., Senovilla L. Independent transcriptional reprogramming and apoptosis induction by cisplatin. Cell Cycle. 2012; 11 (18): 3472-3480.
- Borst P., Rottenberg S., Jonkers J. How do real tumors become resistant to cisplatin? Cell Cycle. 2008; 7 (10): 1353-1359.
- AvilaM.A. Exploratory analysis of hibrin in advanced ovarion cancer (AOC) patients treated in the phase III 0VA-301 trial. ASCO. 2013; 5566.
- Хохлова С.В., Черкасова М.В., Орел Н.Ф., Лимарева С.В. Каким больным раком яичника показана комбинация трабектедина с пегилированным липосомальным доксорубицином. Вестник РАМН. 2013; 68 (11): 115-121.
- Li P., Fang Y.J., Li F. ERCC1, defective mismatch repair status as predictive biomarkers of survival for stage III colon cancer patients receiving oxaliplatin-based adjuvant chemotherapy. Br J Cancer. 2013; 108 (6): 1238-1244.
- Kim C. Y., Seo S.H., An M.S. ERCC1 as a Predictive Marker for FOLFOX Chemotherapy in an Adjuvant Setting. Ann Coloproctol. 2015; 31 (3): 92-97.
- Huang Y.J., Huang M.Y., Cheng T.L. ERCC1 Overexpression Increases Radioresistance in Colorectal Cancer Cells. Cancers (Basel). 2022; 14 (19): 4798.
- JiangH., Li B., Wang F. Expression of ERCC1 and TYMS in colorectal cancer patients and the predictive value of chemotherapy efficacy. Oncol Lett. 2019; 18 (2): 1157-1162.


