Экспрессия гена BRCA1 при нейроэндокринных опухолях желудочно-кишечного тракта
Автор: Гафтон И.Г., Имянитов Е.Н., Семиглазов В.В., Мацко Д.Е., Гафтон Г.И., Семилетова Ю.В., Иевлева А.Г., Михнин А.Е., Лемехов В.Г.
Журнал: Сибирский онкологический журнал @siboncoj
Рубрика: Клинические исследования
Статья в выпуске: 4 (64), 2014 года.
Бесплатный доступ
Представлены результаты молекулярно-генетического исследования экспрессии гена BRCA1 у больных нейроэндокринными опухолями желудочно-кишечного тракта. Исходя из анализа результатов выживаемости больных НЭО в зависимости от уровня экспрессии BRCA1, можно предположить о возможности использования данного показателя как в качестве прогностического критерия, так и в качестве фактора, определяющего целесообразность назначения препаратов платины. Чем агрессивнее нейроэндокринные опухоли, тем ниже экспрессия гена BRCA1, тем менее целесообразно назначение платиносодержащих схем химиотерапии.
Нейроэндокринные опухоли, экспрессия brca1, лечение
Короткий адрес: https://sciup.org/14056441
IDR: 14056441 | УДК: 616.33/34-006-08:575.113:577.21
Текст научной статьи Экспрессия гена BRCA1 при нейроэндокринных опухолях желудочно-кишечного тракта
Нейроэндокринные опухоли (НЭО) представляют собой гетерогенную группу новообразований, исходящих из нейроэндокринных клеток, которые локализуются в различных органах и тканях человека. Развитие новых лабораторных технологий значительно упростило идентификацию нейроэндокринных клеток. Решающее значение в диагностике НЭО имеет иммуногистохимическое исследование. Одним из наиболее характерных маркеров нейроэндокринных компонентов является маркер специфических эндокринных гранул – хромогранин А [2, 3, 6, 9]. Другим универсальным антигеном опухолей данной группы является маркер молекул нейроадгезии – рецептор CD56
-
[4] . Патогенез нейроэндокринных опухолей, как и других карцином, сопряжён с накоплением соматических мутаций в онкогенах и антионкогенах. Многие характерные для карцином нарушения, в частности делеции участков хромосом («потери гетерозиготности»), метилирование регуляторных областей генома, аномалии экспрессии генов, обнаруживаются и в новообразованиях нейроэндокринного происхождения, однако в последнем случае подавляющая часть известных на сегодняшний день геномных дефектов не проявляет какой-либо специфичности [7].
Определение мутации и уровня экспрессии гена BRCA1 активно используется при лечении рака молочной железы (РМЖ) и рака яичников (РЯ), определяя прогноз заболевания и эффективность терапии. При наличии генетического дефекта в одном из генов наследственного рака BRCA1, BRCA2 или PALB2 опухоли обычно демонстрируют высокую чувствительность к BRCA-специфическим препаратам производным платины, ингибиторам PARP, митомицину и т.д. [8]. Высокая прогностическая значимость наличия мутации BRCA1 при РМЖ и РЯ заставляет многих ученых искать новые мишени в широком спектре онкологических нозологий.
В лечении НЭО хирургический подход продолжает занимать ведущие позиции даже при генерализованных формах заболевания. Отдаленные показатели общей выживаемости при системной терапии этой группы больных остаются неудовлетворительными. Современные подходы к молекулярной диагностике и таргетной терапии позволяют обнаружить потенциально уязвимые мутации и подобрать эффективное лечение хотя бы для небольшой части онкологических пациентов с НЭО. Кроме того, открывшиеся возможности таргетной терапии дали новую ветвь в клинических исследованиях. Её превалирующее значение состоит в селективном воздействии на опухоль без повреждения здоровых клеток.
Возможно, что новые препараты окажутся эффективными для терапии нейроэндокринных опухолей за счет использования их биологических особенностей (выраженная васкуляризация, наличие рецепторов соматостатина и других пептидов, рецепторы тирозинкиназы). Целесообразно проведение клинических исследований для оценки как новых, так и уже известных мутаций и показателей экспрессии генов с целью определения прогноза заболевания и улучшения показателей эффективности лекарственной терапии.
Целью исследования являются выявление прогностически значимых мутаций у больных нейроэндокринными опухолями желудочно-кишечного тракта и оптимизация лечения данной группы пациентов.
Материал и методы
В исследование включено 58 больных с гистологически верифицированным нейроэндокринным раком желудочно-кишечного тракта рТ 1–4 N 0–3 M 0 стадии, радикально оперированных с января 1994 г. по декабрь 2013 г. в клинике ФГБУ «НИИ онкологии им. Н.Н. Петрова». Сведения о пациентах были получены из историй болезни, амбулаторных карт, гистологических заключений, стандартных протоколов исследования операционного материала. Минимальный период наблюдения составил 5 мес, максимальный – 18 лет. Отдаленные результаты наблюдения собраны по всем пациентам. При их анализе удалось установить, что 18 (31,0 %) больных умерли от основного заболевания. У 34 (58,6 %) пациентов выявлен рецидив заболевания в различные сроки наблюдения. При скрининге гистологического материала, полученного от 33 пациентов, на предмет наличия в опухоли уязвимых мутаций были выявлены следующие особенности: транслокаций EML4-ALK и делеций в 19 экзоне гена EGFR выявлено не было. Однако при последующем анализе была выявлена низкая экспрессия BRCA1 у 2 (6,1 %) из 33 (100,0 %) пациентов (таблица).
Делеции в 19 экзоне гена EGFR детектировали путем ПЦР-амплификации всей последовательности экзона при помощи прямого 5’-CTGTCATAGGGACTCTGGAT-3’ и обратного 5’-CAGCAAAGCAGAAACTCACAT-3’праймеров. Детекция транслокаций EML4-ALK осуществлялась путем ПЦР-амплификации 5 наиболее частых типов транслокаций ((EML4ex13/ALKex20, V.1; EML4ex20/ALKex20, V.2; EML4ex6/ALKex20, V.3; EML4ex18/ALKex20; EML4ex2/ALKex20) с помощью специфических праймеров. Последовательности кДНК гена-мишени BRCA1 и гена-рефери (SDHA) амплифицировали при помощи специфических праймеров в присутствии TaqMan-зондов.
Таблица
|
Экспрессия гена BRCA |
Женщины (n=20) |
Мужчины (n=13) |
|
До 0 |
3 (15,0 %) |
5 (38,5 %) |
|
0–2 |
8 (40,0 %) |
4 (30,8 %) |
|
2–4 |
8 (40,0 %) |
3 (23,1 %) |
|
4–7,4 |
1 (5,0 %) |
1 (7,7 %) |
Показатели экспрессии гена BRCA1 в зависимости от пола больных
Статистическая обработка полученных результатов проводилась с использованием принятых методов параметрической и непараметрической статистики. Вычисляли средние показатели и стандартные ошибки относительных величин. Статистическая значимость различий сравниваемых групп оценивалась с помощью критериев Пирсона и точных методов Фишера [1].
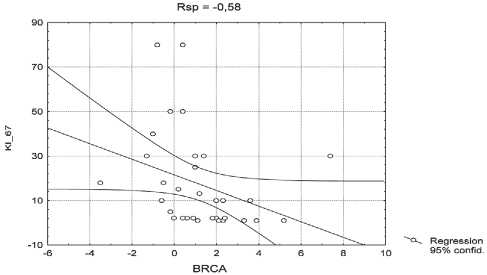
Рис. 1. Взаимосвязь показателей экспрессии BRCA1 с Ki67
Результаты и обсуждение
Для выявления взаимосвязей уровня экспрессии гена BRCA1 с исследуемыми показателями мы использовали коэффициент корреляции Спирмена (Rsp), который может принимать значения от –1 до +1. При этом отрицательный коэффициент корреляции позволяет принять гипотезу о наличии монотонной отрицательной связи, т.е. увеличение значения одной переменной ведет к уменьшению значения коррелирующей с ней переменной. Как следует из рис. 1, при исследовании взаимосвязи критерия Кi67 и уровня экспрессии BRCA 1 выявлена отрицательная монотонная связь, т.е. чем меньше показатель Ki67, тем выше экспрессия BRCA1 (Rsp –0,58), что также является статистически значимым показателем р=0,000362.
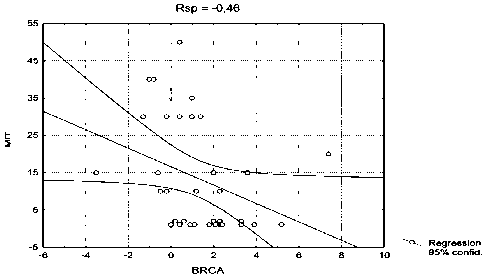
Рис. 2. Взаимосвязь показателей экспрессии BRCA1 с митотической активностью нейроэндокринных опухолей
Аналогичная картина наблюдается при исследовании митотической активности в нейроэндокринных опухолях в зависимости от показателей экспрессии BRCA1 (рис. 2), чем меньше показатель митотической активности, тем выше экспрессия BRCA1 (Rsp – 0,46), что также является статистически значимым показателем (р=0,006764). Диапазон показателей экспрессии BRCA1 статистически значимо (p=0,039) коррелирует со степенью дифференцировки НЭО, в среднем составляя при G1 – 2,1, тогда как при G2 и G3 – 0,4 (рис. 3). Таким образом, обобщая вышеописанные данные, можно утверждать, что чем агрессивнее нейроэндокринные опухоли, тем ниже экспрессия гена BRCA1 .
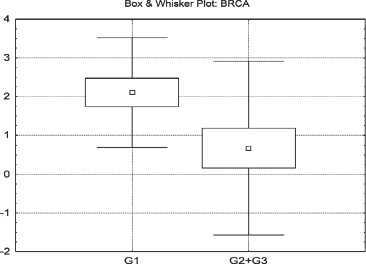
Степень дифференцировки
Рис. 3. Взаимосвязь показателей экспрессии BRCA1 со степенью дифференцировки нейроэндокринных опухолей
Так как BRCA-ассоциированные опухоли развиваются за счет дефекта системы репарации двухцепочечных разрывов и межнитевых сшивок ДНК, то терапия агентами, вызывающими подобные повреждения генома (препараты платины, митомицин С), может оказаться высокоэффективной. Положительный эффект такого лечения был показан в основном для наследственного РМЖ и РЯ [5]. В нашем случае у 6,1 % пациентов можно предположить эффективность назначения данной группы препаратов. При дополнительном анализе показателей экспрессии в зависимости от пола пациента статистически значимых изменений не выявлено, р=0,12 (рис. 4).
Для выявления взаимосвязей показателей экс-
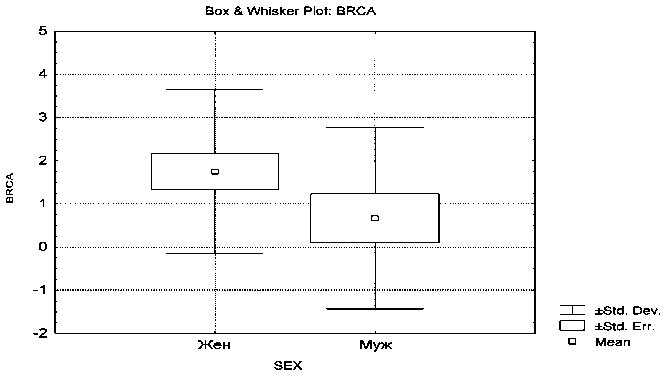
Рис. 4. Зависимость показателей экспрессии BRCA1 от пола пациентов с нейроэндокринными опухолями желудочно-кишечного тракта
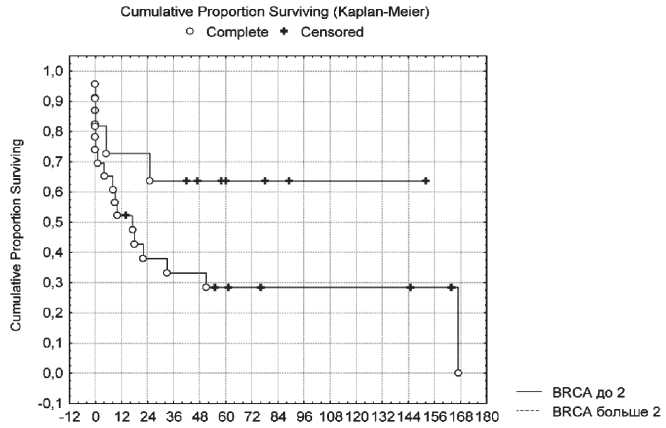
Безрецидивный период (мес.)
Рис. 5. Показатели безрецидивной выживаемости больных с нейроэндокринными опухолями желудочно-кишечного тракта в зависимости от уровня экспрессии BRCA1 (p<0,05)
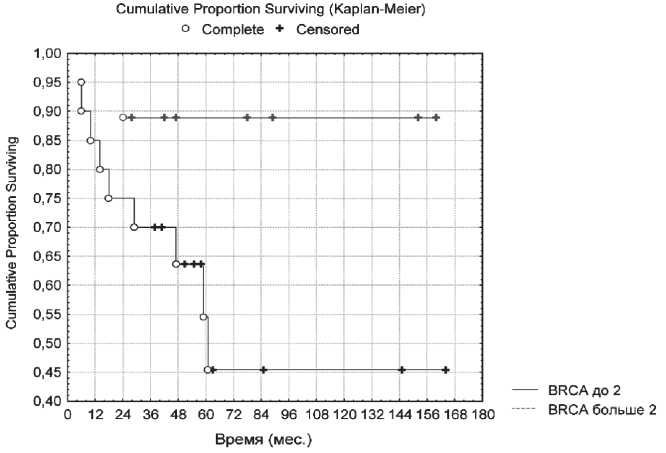
Рис. 6. Показатели общей выживаемости больных с нейроэндокринными опухолями желудочно-кишечного тракта в зависимости от уровня экспрессии BRCA1 (р=0,12)
прессии BRCA1 с исследуемыми критериями мы не могли применить традиционное значение BRCA1=4, так как с такими значениями наблюдали всего 2 пациентов. По этой причине мы воспользовались статистическими характеристиками нашей выборки по уровню экспрессии BRCA1 и реализовали 2 варианта анализа:
-
1) делением показателей BRCA1 по медиане;
-
2) делением показателей BRCA1 по тертилям.
Взаимосвязи уровня экспрессии BRCA1 удалось выявить при выделении подгруппы по верхней тер-тили, равной 2. Наблюдается статистически значимое (р<0,05) увеличение показателей безрецидивной выживаемости при уровне экспрессии BRCA1 выше значения 2,0 по сравнению со значением BRCA1 менее 2,0 (рис. 5). Медиана одногодичной безре-цидивной выживаемости при уровне экспрессии BRCA1 выше 2,0 составляет 52 %, пятилетней – 28 %, тогда как при экспрессии BRCA1 менее 2,0 медиана одногодичной безрецидивной выживаемости пациентов с НЭО составила 72 %, пятилетней – 62 %. При анализе показателей общей выживаемости (ОВ) установлено, что у больных с экспрессией BRCA1 выше 2,0 наблюдается тенденция (р=0,12) к увеличению уровня ОВ по сравнению с пациентами с экспрессией BRCA1 менее 2,0 (рис. 6). Исходя из результатов анализа выживаемости больных НЭО в зависимости от уровня экспрессии BRCA1 , можно предположить возможность использования данного показателя как в качестве прогностического критерия, так и в качестве фактора, определяющего целесообразность назначения препаратов платины.
Заключение
На основании полученных данных можно утверждать, что чем агрессивнее нейроэндокринные опухоли, тем ниже экспрессия гена BRCA1 . Целесообразно дальнейшее изучение эффективности препаратов платины у больных с низкой экспрессией BRCA1 .
Данная работа поддержана грантом РНФ № 14–15–00528


