Экспрессия гена глутаматдегидрогеназы gdh2 арабидопсиса индуцируется под влиянием ингибитора синтеза тетрапирролов норфлуразона
Автор: Гарник Е.Ю., Бельков В.И., Тарасенко В.И., Потапова Т.В., Корзун М.А., Константинов Ю.М.
Журнал: Журнал стресс-физиологии и биохимии @jspb
Статья в выпуске: 4 т.9, 2013 года.
Бесплатный доступ
Ген gdh2, кодирующий бета-субъединицу глутаматдегидрогеназы арабидопсиса, относится к генам с циркадианной регуляцией. Его экспрессия значительно возрастает в темное время суток и снижается до минимума на свету. Известно, что в репрессии гена gdh2 на свету участвуют сахарозависимые регуляторные пути, однако конкретные механизмы регуляции неизвестны. Нами показано, что в проростках арабидопсиса, выращенных в присутствии ингибитора синтеза тетрапирролов норфлуразона, экспрессия гена gdh2 возрастала в 6-11 раз относительно контрольных условий, причем степень повышения уровня транскриптов gdh2 зависела от уровня освещенности и не коррелировала с индукцией генов-маркеров повышения уровня активных форм кислорода. Данное повышение экспрессии можно объяснить как низким уровнем глюкозы в клетках обработанных норфлуразоном проростков, так и отсутствием репрессии со стороны хлоропластно-ядерных регуляторных путей вследствие дисфункции хлоропластов. Мы предполагаем, что в циркадианной регуляции экспрессии гена gdh2 участвуют не только сахарозависимые, но и хлоропластно-ядерные регуляторные пути.
Короткий адрес: https://sciup.org/14323810
IDR: 14323810
Текст научной статьи Экспрессия гена глутаматдегидрогеназы gdh2 арабидопсиса индуцируется под влиянием ингибитора синтеза тетрапирролов норфлуразона
Глутаматдегидрогеназа (GDH, EC 1.4.1.2) – фермент митохондриальной локализации, катализирующий реакцию дезаминирования глутамата до 2-оксоглутарата и обеспечивающий таким образом связь углеводного и азотного обмена в клетке. Холофермент GDH представляет собой гексамер, составленный из двух типов субъединиц, альфа и бета, которые у Arabidopsis thaliana кодируются ядерными генами, соответственно, gdh1 и gdh2. Ген gdh2
относится к генам с циркадианной регуляцией. Его экспрессия значительно возрастает в темное время суток и снижается до минимума на свету (Miyashita, Good, 2008). В 1992 г. было доказано, что продукт реакции, катализируемой ферментом GDH – 2-оксоглутарат – может быть введен в цикл Кребса и использован для получения энергии (Robinson et al., 1992). Также было установлено, что мутанты арабидопсиса по генам GDH имеют более низкую выживаемость при длительном выдерживании в темноте (Miyashita, Good, 2008). В связи с этим была высказана гипотеза, что GDH в растительной клетке играет роль «страховки» на случай углеводного голодания. При снижении уровня глюкозы в клетке гены GDH дерепрессируются (gdh2 в большей степени, gdh1 в меньшей), и повышение количества активного фермента GDH позволяет клетке использовать глутамат в катаболических реакциях. Действительно, в 2006 г. с использованием ДНК-микрочипов (microarray) было показано, что уровень транскриптов генов gdh1 и gdh2 снижается после обработки 7-суточных проростков арабидопсиса 3% раствором глюкозы в течение 2-6 часов в 2 -2,5 раза (Li et al., 2006). Однако при изменении условий освещенности уровень транскриптов гена gdh2 может изменяться в десятки раз (Turano et al., 1997). До сих пор не удавалось добиться такого масштаба изменений экспрессии генов GDH посредством изменения углеводного статуса растений арабидопсиса. Это позволяет предполагать, что уровень экспрессии генов GDH определяется не только углеводным статусом клеток, но и хлоропластно-ядерными сигналами, обусловленными функциональным состоянием хлоропластов при изменении освещенности. Кроме того, имеются сообщения об индукции экспрессии гена gdh2 в условиях окислительного стресса как биотического (Pageau et al., 2006), так и абиотического происхождения (Scopelitis et al., 2007). Таким образом, вопрос о регуляции экспрессии gdh2 оказывается чрезвычайно запутанным. Неизвестно, какие конкретно молекулярные механизмы опосредуют эту регуляцию, поскольку для сахарозависимой регуляции существует, по-видимому, ряд относительно независимых регуляторных путей, большая часть которых пока не изучена (Rook et al., 2006; Smeekens et al., 2013), а количество известных и предполагаемых на сегодня хлоропластноядерных регуляторных путей таково, что для удобства описания их объединяют по крайней мере в пять групп, в состав которых входят и пути, опосредуемые активными формами кислорода (АФК) хлоропластного происхождения (Phannschmidt, 2010).
Ставя задачу идентифицировать конкретные механизмы, опосредующие регуляцию гена gdh2 , необходимо в первую очередь сузить круг возможных кандидатов на эту роль. В данной работе мы исследовали влияние на экспрессию gdh2 функционального состояния хлоропластов и окислительного стресса, вызванного их дисфункцией.
МАТЕРИАЛЫ И МЕТОДЫ
Растительный материал и условия выращивания. Семена Arabidopsis thaliana (L.) Heynh. экотип Columbia (далее Col-0) были получены из Arabidopsis Biological Resource Center (The Ohio State University, USA). Растения выращивали до стадии 10-12 розеточных листьев на грунте, как описано ранее (Tarasenko et al., 2012), либо стерильно в чашках Петри на средах, содержавших: минеральные соли по Murasige, Skoog (Murasige, Skoog, 1962) – половинный состав, фитогель («Sigma-Aldrich», США) – 0,8%, а также сахарозу - 1%, норфлуразон («Sigma-Aldrich», США) – 50 нМ либо 5 мкМ. После стратификации при +4 0С в течение трех суток чашки помещали в ростовую камеру, где проростки выращивали в течение семи суток при температуре 25 0С, освещенности 150 мкЕ либо 10 мкЕ и длине светового дня 16 ч. В экспериментах по изучению влияния ингибиторов дыхательной цепи часть выращенных проростков убирали перед выделением РНК в темноту на 18 часов. Время экспозиции оставшихся проростков на свету перед выделением РНК составляло не менее 6 ч. За 6 ч до начала экстракции РНК проростки обрабатывали растворами 20 мкМ ротенона («Sigma-Aldrich», США), 10 мкМ антимицина А («Sigma-Aldrich», США) либо 10 мМ Н2О2.
Экстракция РНК. РНК экстрагировали из растительного материала при помощи TRIReagent («Sigma-Aldrich», США) согласно протоколу производителя. Гомогенизацию материала с TRI-Reagent проводили в гомогенизаторе TissueLyser («QIAGEN», США) в течение 2 мин при частоте 30 колебаний в секунду. Для денатурации белков использовали бромхлорпропанол («Sigma-Aldrich», США). Осаждение нуклеиновых кислот, растворение осадка РНК и анализ в агарозном геле проводили, как описано ранее (Тарасенко и др., 2010).
Нозерн-блоттинг. Мечение фрагментов ДНК проводили с помощью ПЦР в присутствии [a-32P]dATP («ФГУП ИРМ», Россия) в количестве 100 мкКи на одну пробу как описано ранее (Гарник и др., 2006). Общую клеточную РНК разделяли в
1,2%-ном агарозном геле в денатурирующих условиях и переносили на нейлоновую мембрану Hybond N («Amersham», США). Предгибридизацию (42оС, 60 мин) проводили в буфере, содержавшем 5Х SSC, 5Х раствор Денхардта, 0,5%-ный ДДС-Na, 50%-ный формамид. Гибридизацию проводили при 42оС в том же буфере, содержавшем радиоактивно меченный ДНК-зонд, предварительно денатурированный путем инкубации в течение 5 мин при 95оС. Продолжительность гибридизации составляла 18 ч. Мембрану отмывали, как описано ранее (Гарник и др., 2006). Перед повторной гибридизацией мембрану отмывали от связавшегося зонда путем инкубации в растворе 0,5%-ного ДДС-Na при 95оС в течение 40 мин.
Синтез первой цепи кДНК. Для удаления возможных примесей ДНК к 8 мкл препарата РНК добавляли 1 мкл 10х буфера ДНКазы («Fermentas», Литва) и 0.5 мкл (0.5 единиц) ДНКазы. Инкубировали 30 мин при 37 0С. Для инактивации ДНКазы добавляли в реакционную смесь 1 мкл ЭДТА (25 мкМ) и прогревали 10 мин при 65 0С. Добавляли 1 мкл праймера oligo-dT (80 рМ) и прогревали 5 мин при 70 0С, инкубировали 5 минут на льду. К смеси добавляли 4 мкл 5х буфера обратной транскриптазы («Fermentas», Литва), 0.5 мкл (20 единиц) ингибитора РНКаз («Fermentas», Литва), 2 мкл 10мМ смеси dNTP. Инкубировали 5 мин при 37 0С. Добавляли 0.7 мкл (140 единиц) обратной транскриптазы ReverAidHMinusM-MulV («Fermentas», Литва). Инкубировали 60 мин при 42 0С. Инактивировали фермент инкубацией 10 мин при 70 0С.
Обратно-транскриптазная ПЦР в реальном времени (ОТ-ПЦР-РВ). ОТ-ПЦР-РВ проводили с использованием готовой смеси реагентов SYBRSelectMasterMix («Aplied Biosystems», США) и оборудования C1000 Thermal Cycler CFX96 RealTime System («Bio-Rad», США). Объем реакционной смеси составлял 10 мкл. ПЦР проводили по следующему протоколу: прогревание до 50 0С, 2 мин (согласно рекомендации производителя), один цикл денатурации (95 0С, 3 мин), 36 циклов амплификации (95 0С, 20 с - 60 0С, 30 с - 72 0С, 30 с), после чего образцы подвергались нагреву до 95 0С для последующего анализа кривых плавления. Ген yls8 (AT5g08290) был использован как референсный. Список всех использованных праймеров приведен в таблице 1 (табл. 1). Все праймеры были предварительно проверены путем анализа продуктов ПЦР-реакции в агарозном геле, каждая пара давала единственный продукт требуемого размера. Анализ результатов и построение графиков проводили при помощи программного обеспечения CFX ManagerTM Software Version 1.6 («Bio-Rad», США).
РЕЗУЛЬТАТЫ
Первую серию экспериментов проводили на проростках арабидопсиса, выращенных на грунте при освещенности 150 мкЕ и находившихся на стадии 10-12 розеточных листьев. Выделяли РНК параллельно из проростков, выдержанных до начала экстракции РНК на свету не менее 4 ч или в темноте в течение 18 ч. Нозерн-гибридизация показала, что на свету уровень транскриптов гена gdh2 был наименьшим и не изменялся при обработке проростков перекисью водорода (10 мМ), ингибитором комплекса I ротеноном (20 мкМ) либо ингибитором комплекса III антимицином А (10 мкМ). После выдерживания проростков в темноте в течение 18 ч уровень транскриптов исследуемого гена был выше, чем на свету, и значительно повышался после обработки проростков антимицином А (рис. 1). Таким образом, индукция экспрессии гена gdh2 под действием антимицина А происходила только в темноте.
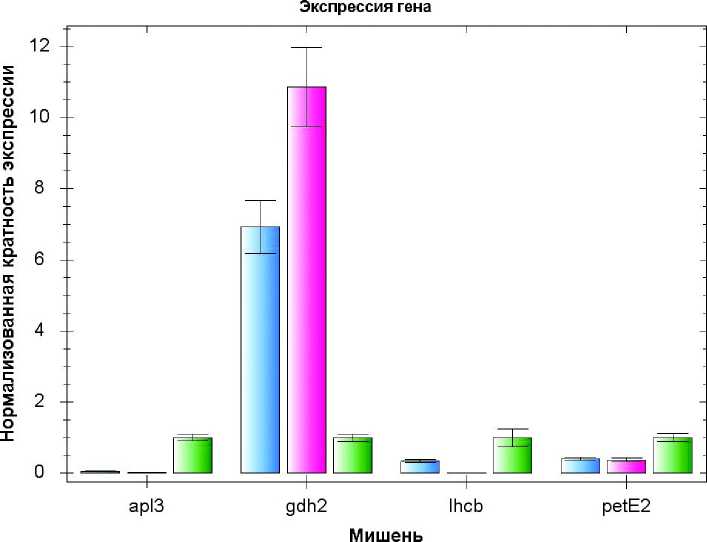
Для количественной оценки изменений экспрессии гена gdh2 при различном функциональном состоянии хлоропластов использовали метод обратнотранскриптазной ПЦР в реальном времени (ОТ-ПЦР-РВ). Проростки арабидопсиса выращивали стерильно на чашках Петри на плотных средах, содержавших норфлуразон в концентрации 5 мкМ, при освещенности 150 мкЕ (умеренная освещенность, обозначение на рисунке «NF ML») либо 10 мкЕ (низкая освещенность, обозначение «NF LL») в течение семи суток. Методом ОТ-ПЦР-РВ оценивали изменения экспрессии генов apl3 , lhcb2 , petE2 , gdh2, dnaJ, fer1 , nod . Для каждого гена экспрессию в проростках, выращенных на среде без норфлуразона при освещенности 150 мкЕ (обозначение «контроль ML»), принимали за единицу.
Ген apl3 кодирует большую субъединицу АДФ-глюкозофосфорилазы, первого фермента пути биосинтеза крахмала. Экспрессия apl3 индуцируется при повышении в клетке уровня глюкозы (Rolland et al ., 2006). Мы использовали данный ген как маркер уровня глюкозы в клетках проростков после разных видов обработки. Гены lhcb2 и petE2 , кодирующие соответственно субъединицу светособирающего комплекса фотосистемы II и пластоцианин 2, значительно индуцируются в зеленых тканях на свету, причем изменения уровня глюкозы не имеют для их экспрессии большого значения
(Nott et al ., 2006). Данные гены использовали для контроля светозависимых реакций, не связанных с изменениями уровня глюкозы. Кроме того, оценивали уровень транскриптов генов, индукция которых используется в качестве маркера дисфункции хлоропластов (dnaJ ) (Van Aken, Whelan, 2012) и повышения уровня различных видов активных форм кислорода (АФК): перекиси водорода ( fer1 ) и синглетного кислорода ( nod ) (Saini et al ., 2011).
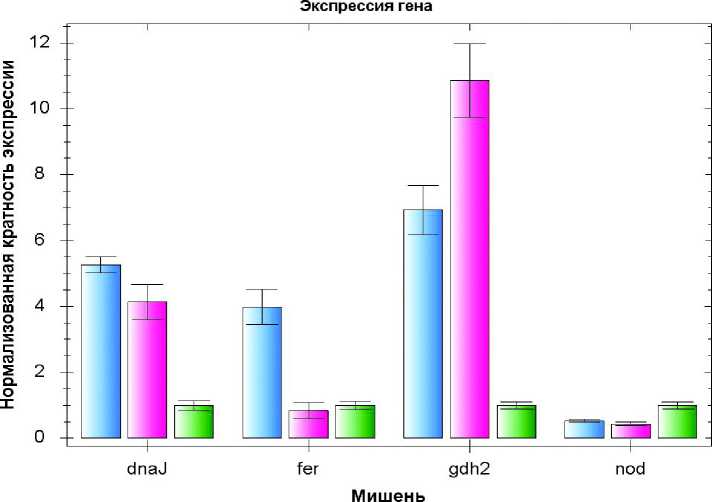
На рис. 2 видно, что уровень транскриптов apl3 значительно снижался при выращивании проростков в присутствии норфлуразона. Уровень генов lhcb2 и petE2, связанных с фотосинтезом, также снижался при выращивании проростков в присутствии норфлуразона, хотя в меньшей степени. При этом снижение экспрессии гена lhcb2 зависело от уровня освещенности и было наибольшим в проростках, выращенных в присутствии норфлуразона при освещенности 150 мкЕ (рис. 2). Экспрессия гена dnaJ (маркера дисфункции хлоропластов), была повышена в проростках, выращенных в присутствии норфлуразона, в 4-5
раз. Экспрессия маркера перекиси водорода fer1 была повышена только в присутствии норфлуразона при низкой освещенности. Экспрессия гена nod в присутствии норфлуразона не изменялась. Уровень транскриптов исследуемого гена gdh2 в присутствии норфлуразона возрастал в 6-8 раз при низкой освещенности и в 9-11 раз при умеренной освещенности (рис. 3).
Свет Темнота

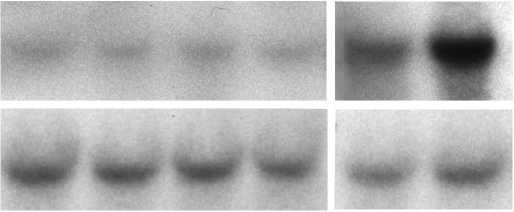
Рисунок 1. Экспрессия гена gdh2 в проростках арабидопсиса, выдержанных на свету и в темноте, в присутствии ингибиторов электрон-транспортной цепи митохондрий.
Свет – освещенность 150 мкЕ; Темнота – проростки выдержаны в темноте в течение 18 часов; Ротенон – обработка проростков 20 мкМ ротеноном; Антимицин А – обработка 10 мкМ антимицином А; Н 2 О 2 – обработка 10 мМ перекисью водорода; Контроль – отсутствие обработки.
gdh2 tub
1=^1 NF LL СД NF ML i^^i контроль ML
Рисунок 2. Экспрессия генов apl3 , gdh2 , lhcb , petE2 в проростках арабидопсиса, выращенных в присутствии норфлуразона, в различных условиях освещенности.
NF LL – норфлуразон 5 мкМ, освещенность 10 мкЕ; NF ML – норфлуразон 5 мкМ, освещенность 150 мкЕ; Контроль ML – среда без норфлуразона, освещенность 150 мкЕ.
1 1—■ NFLL i—■ NF ML I ■ контрольМПГ|
Рисунок 3. Экспрессия гена gdh2 и генов-маркеров дисфункции хлоропластов и повышения уровня АФК в проростках арабидопсиса, выращенных в присутствии норфлуразона, в различных условиях освещенности.
NF LL – норфлуразон 5 мкМ, освещенность 10 мкЕ; NF ML – норфлуразон 5 мкМ, освещенность 150 мкЕ; Контроль ML – среда без норфлуразона, освещенность 150 мкЕ.
Таблица 1: Последовательности праймеров, использованных в работе.
|
Обозна -чение |
Локус |
Продукт |
Последовательность праймеров |
|
apl3 |
At4g39210 |
Большая субъединица АДФ-глюкозофосфорилазы |
Л: CGTGCGTCGGAGTATGGACTG П: AGATTTTGCTGCTTCTTGATGAGAC |
|
gdh2 |
At5g07440 |
бета-субъединица NAD- зависимой глутаматдегидрогеназы |
Л: CGCTCTTGGTGGTGTCCTGAA П: CTCCTCCTGCGTTTGCGTAGA |
|
lhcb2 |
At2g05070 |
хлорофилл b - связывающий белок светособирающего комплекса фотосистемы II |
Л: AGGCGGTTTGGTTCAAGGC П: GCCCATTTCCTGCGACTCTGT |
|
yls8 |
At5g08290 |
yellow-leaf-specific gene 8 (референсный ген) |
Л: GAGGTGCTTGCGTCTGTTGCT П: TGTCCTTGAGAGCCCAGTTGAT |
|
dnaJ |
AT3g14200 |
DnaJ heat shock protein маркер дисфункции хлоропластов |
Л: AGGGAAAAACAATGGCGGAAGA П: TGGTGTGAAGTGGCTATGAGGTG |
|
nod |
At5g64870 |
маркер повышения уровня синглетного кислорода |
Л: ACGAGAAGCAGAAGCAAGCG П: GGTAAGTCCCCTGAGCATCGG |
|
fer1 |
At5g59820 |
ферритин 1 маркер повышения уровня перекиси |
Л: ACTCCCTCACGGCTCTGCTT П: CGAAAGGCTGGAACACGACTC |
|
petE2 |
At1g20340 |
пластоцианин 2 |
Л: ATCCGCCACCGTCAGAATCCA П: ACCCATCCCCTCCTCCCAAGA |
ОБСУЖДЕНИЕ
Нозерн-гибридизация подтвердила данные литературы о том, что при выдерживании проростков арабидопсиса в темноте уровень транскриптов gdh2 повышается (Miyashita, Good, 2008). Интересно, что при этом индукция экспрессии gdh2 под действием ингибитора дыхательной цепи антимицина А, ранее подробно исследованная нами в клетках гетеротрофной суспензионной культуры арабидопсиса (Тарасенко и др., 2009), происходила только в проростках, выдержанных в темноте в течение 18 ч. В проростках, находившихся перед экстракцией РНК в условиях освещенности 150 мкЕ, мы не обнаружили такой индукции (рис. 1). Вероятно, ретроградная индукция гена gdh2, опосредуемая дисфункцией электрон-транспортной цепи митохондрий, возможна только при условии отключения механизмов репрессии данного гена, работающих на свету. Таким образом, ретроградный митохондриально-ядерный путь регуляции экспрессии гена gdh2 оказывается подчинен светозависимым регуляторным механизмам.
Для исследований влияния функционального состояния хлоропластов на экспрессию генов растений широко применяется норфлуразон – ингибитор фитоендесатуразы в хлоропластах. Выращивание проростков растений в присутствии норфлуразона приводит к блокированию синтеза тетрапирролов (и, следовательно, хлорофиллов а и в) (Nott et al., 2006). При высокой и умеренной освещенности это приводит к разрушению тилакоидов, что сопровождается сильным окислительным стрессом (Kim, Apel, 2013). Однако снижение освещенности до очень низкого уровня (10 мкЕ) приводит к тому, что действие света, по-видимому, оказывает не настолько сильное повреждающее действие (Saini et al., 2011). Известно, что выращивание проростков в присутствии норфлуразона приводит к значительному снижению экспрессии ядерных генов, связанных с фотосинтезом (Susek et al., 1993; Nott et al., 2006). В настоящей работе мы применяли как умеренный (150 мкЕ), так и очень низкий (10 мкЕ) уровень освещенности. Это дало нам возможность посредством определения уровня транскриптов генов, маркирующих повышение различных видов АФК, оценить возможное влияние возникающего вследствие дисфункции хлоропластов окислительного стресса на экспрессию гена gdh2.
Характер экспрессии маркеров окислительного стресса ( fer1 и nod ) позволяет сделать вывод, что выращивание проростков в присутствии норфлуразона не сопровождалось повышением уровня синглетного кислорода. Уровень перекиси водорода, по-видимому, повышался только при освещенности 10 мкЕ в присутствии норфлуразона (рис. 3). Это может свидетельствовать о хлоропластном происхождении этой перекиси: при освещенности 150 мкЕ, когда хлоропласты повреждены в большей степени, перекись уже не продуцируется. Уровень транскриптов маркера дисфункции хлоропластов dnaJ был повышен в 4-5 раз в присутствии норфлуразона в обоих вариантах освещенности.
Сопоставление изменений экспрессии генов fer1 и nod с экспрессией гена gdh2 позволяет сделать вывод, что индукция гена gdh2 в присутствии норфлуразона не зависит от уровня АФК (как перекиси водорода, так и синглетного кислорода) (рис. 3). Это хорошо согласуется с полученными нами ранее данными о том, что индукция гена gdh2 в суспензионной культуре клеток арабидопсиса, вызванная ингибированием дыхательной цепи митохондрий, не зависит от изменений уровня АФК в клетках (Тарасенко и др., 2009). При этом, как и следовало ожидать, обработка норфлуразоном при всех вариантах освещенности сопровождалась индукцией гена dnaJ, являющегося маркером дисфункции хлоропластов.
Экспрессия гена gdh2 была значительно (в 611 раз) индуцирована в проростках с нарушенным функциональным состоянием хлоропластов, причем степень этой индукции была выше при освещенности 150 мкЕ. Известно, что при нормальном функционировании хлоропластов экспрессия gdh2 демонстрирует обратную зависимость от уровня освещенности: при более высокой освещенности уровень транскриптов gdh2 оказывается ниже (Turano et al., 1997; Miyashita, Good, 2008). В нашем случае, однако, освещенность на уровне 150 мкЕ на фоне отсутствия фотосинтетических пигментов приводила к разрушению тилакоидов хлоропластов и прекращению фотосинтеза, что должно было приводить, с одной стороны, к резкому снижению уровня глюкозы в клетках, что подтверждается в наших экспериментах резким снижением уровня транскриптов гена apl3 (рис. 2). C другой стороны, это должно было приводить к исчезновению хлоропластноядерных сигналов, в норме обеспечивающих ретроградную регуляцию экспрессии ядерных генов, что также подтверждается снижением экспрессии генов petE2 и lhcb2, для которых установлена зависимость экспрессии от хлоропластно-ядерных сигналов (рис. 2). Таким образом, более выраженная индукция gdh2 в присутствии норфлуразона при освещенности 150 мкЕ объяснима как с позиций гипотезы о сахарозависимой регуляции данного гена, так и с точки зрения того предположения, что экспрессия данного гена регулируется хлоропластно-ядерными ретроградными сигналами.
Таким образом, нами впервые показана индукция ядерного гена арабидопсиса gdh2 , кодирующего бета-субъединицу митохондриальной глутаматдегидрогеназы, в ответ на дисфункцию хлоропластов, вызванную обработкой норфлуразоном. На основании полученных данных можно сделать вывод, что наиболее вероятными кандидатами на роль регуляторных путей, обеспечивающих изменения экспрессии gdh2 , являются сахарозависимый путь, влияние которого отражено в изменениях экспрессии гена apl3 , и пути, опосредуемые хлоропластно-ядерными ретроградными сигналами, не связанными, однако, с продуцируемыми в хлоропластах АФК. Исследованный нами ранее ретроградный митохондриально-ядерный путь регуляции гена gdh2 может функционировать не только в клетках гетеротрофной суспензионной культуры, но и в зеленых проростках арабидопсиса, однако только при условии дерепрессии гена gdh2 в темноте.
ACKNOWLEDGEMENT
Работа выполнена при финансовой поддержке гранта РФФИ 12-04-01148-а и Минобрнауки Российской Федерации (соглашение № 8266). В работе использовано оборудование Байкальского аналитического центра (ЦКП) СО РАН при президиуме ИНЦ СО РАН.
Список литературы Экспрессия гена глутаматдегидрогеназы gdh2 арабидопсиса индуцируется под влиянием ингибитора синтеза тетрапирролов норфлуразона
- Гарник Е.Ю., Тарасенко В.И., Кобзев В.Ф., Константинов Ю.М. (2006) Дифференциальная экспрессия митохондриальных генов кукурузы при изменении редокс-состояния митохондрий. Физиология растений, 53(4), 518-524
- Тарасенко В.И., Гарник Е.Ю., Константинов Ю.М. (2010) Характеристика растений арабидопсиса с инактивированным геном Fe-S субъединицы комплекса I дыхательной цепи митохондрий. Физиология растений, 57(3), 415-424
- Тарасенко В.И., Гарник Е.Ю., Шмаков В.Н., Константинов Ю.М. (2009) Индукция экспрессии гена gdh2 арабидопсиса при изменении редокс-состояния митохондриальной дыхательной цепи. Биохимия, 74(1), 62-69
- Lee C.P., Eubel H., Millar A.H. (2010) Diurnal changes in mitochondrial function reveal daily optimization of light and dark respiratory metabolism in Arabidopsis. Mol. Cell. Proteomics, 9(10), 2125-2139
- Miyashita Y. Goog A.G. (2008) NAD(H)-dependent glutamate dehydrogenase is essential for the survival of Arabidopsis thaliana during dark-induced carbon starvation. J. Exp. Botany, 59, 667-680
- Murashige T., Skoog F. (1962) Revised Medium for Rapid Growth and Bioassays with Tobacco Tissue Cultures. Physiol. Plant., 15, 473-497
- Pageau K., Reisdorf-Cren M., Morot-Gaudry J.-F., Maxclaux-Daubresse C. (2006) The two senescence-related markers, GS1 glutamine synthetase) and GDH dehydrogenase), involved in nitrogen mobilization, differentially regulated during pathogen attack and stress hormones and reactive oxygen species Nicotiana tabacum L. J. Exp. Bot., 57(3), 547-557
- Phannschmidt Th. (2010) Plastidial retrograde signalling -a true ‘‘plastid factor’’ or just metabolite signatures? Trends in Plant Sci., 15, 427-435
- Robinson S.A., Stewart G.R., Phillips R. (1992) Regulation of glutamate dehydrogenase activity in relation to carbon imitation and protein catabolism in carrot cell suspension cultures. Plant Physiol., 98, 1190-1195
- Rolland F., Baena-Gonzalez E., Sheen J. (2006) Sugar sensing and signaling in plants: conserved and novel mechanisms. Annu. Rev. Plant Biol., 57, 675-709
- Saini G., Meskauskiene R., Pijacka W., Roszak P., Sjogren L.L.E., Clarke A.K., Straus M., Apel K. (2011) "Happy on norflurazon" (hon) mutations implicate perturbance of plastid homeostasis with activating stress acclimatization and changing nuclear gene expression in norflurazon-treated seedlings. Plant Journal., 65, 690-702
- Skopelitis S.D., Paranychiakis N.V., Kouvarakis A., Spyros A., Stephanou E.G., Roubelakis-Angelakis K.A. (2007) The isoenzyme 7 of tobacco NAD(H)-dependent glutamate dehydrogenase exhibits high deaminating and low aminating activities in vivo. Plant Physiol., 145, 1726-1734
- Smeekens S., Ma J., Hanson J., Rolland F. (2010) Sugar signals and molecular networks controlling plant growth. Curr. Opin. Plant Biol., 13, 274-279
- Susek R.E., Ausubel F.M., Chory J. (1993) Signal transduction mutants of Arabidopsis uncouple nuclear CAB and RBCS gene expression from chloroplast development. Cell, 74, 787-799
- Tarasenko V.I., Garnik E.Y., Shmakov V.N., Konstantinov Y.M. (2012) Modified alternative oxidase expression results in different reactive oxygen species contents in Arabidopsis cell culture but not in whole plants. Biologia Plantarum, 56, 635-640
- Turano F.J., Thakkar S.S., Fang T., Weisemann J.M. (1997) Characterization and expression of NAD(H)-dependent in Arabidopsis glutamate dehydrogenase genes. Plant Physiol., 113, 1329-1341
- Van Aken O., Whelan J. (2012) Comparison of transcriptional changes to chloroplast and mitochondrial perturbations reveals common and specific responses in Arabidopsis. Front Plant Sci., 3, 281


