Экспрессия генов множественной лекарственной устойчивости и монорезистентности при немелкоклеточном раке легкого
Автор: Юмов Е.Л., Цыганов М.М., Литвяков Николай Васильевич, Полищук Татьяна Владимировна, Миллер Сергей Викторович, Родионов Е.О., Тузиков Сергей Александрович
Журнал: Сибирский онкологический журнал @siboncoj
Рубрика: Лабораторные и экспериментальные исследования
Статья в выпуске: 1 (61), 2014 года.
Бесплатный доступ
Была изучена экспрессия генов множественной лекарственной устойчивости (МЛУ) и монорезистентности в нормальной ткани бронхов и опухолевой ткани немелкоклеточного рака легкого (НМРЛ) после неоадъювантной химиотерапии (НАХТ) по схеме винорельбин/карбоплатин. В исследование включено 27 больных НМРЛ ТNM. Материалом для исследования служила 2-40-30нормальная ткань бронхов, нормальная ткань легких и опухолевая ткань, которые забирались во время оперативного вмешательства после курсов НАХТ. Уровень экспрессии 9 генов МЛУ: ABCB1, ABCB2, ABCC1, ABCC2, ABCС5, ABCG1, ABCG2, GSTP1, MVP, и 7 генов монорезистентности: BRCA1, ERCC1, RRM1, TOP1, TOP2A, TUBB3, TYMS оценивали при помощи обратнотранскриптазной количественной ПЦР в режиме реального времени (RT-qPCR). Показан высокий уровень экспрессии некоторых генов МЛУ и монорезистентности в бронхах ( АВСВ1, АВСВ2, ABCG1, ERCC1, GSTP1 и MVP), по сравнению с опухолевой тканью, у больных T 1-2 ( ABCG1, ABCG2 и ERCC1 ) и при аденокарциноме ( BRCA1, MVP и ABCB1 ), по сравнению с плоскоклеточным раком. Установлена тенденция к снижению уровня экспрессии генов МЛУ и монорезистентности в опухоли больных с частичной регрессией, по сравнению с опухолью больных со стабилизацией процесса, что соответствует ранее полученным данным на опухоли молочной железы о снижении экспрессии генов МЛУ после химиотерапии у пациентов с хорошим непосредственным эффектом.
Рак легкого, рнк, экспрессия, гены множественной лекарственной устойчивости, гены монорезистентности
Короткий адрес: https://sciup.org/14056394
IDR: 14056394 | УДК: 616.24-006.6:615.017:575.113
Текст научной статьи Экспрессия генов множественной лекарственной устойчивости и монорезистентности при немелкоклеточном раке легкого
СИБИРСКИЙ ОНКОЛОГИЧЕСКИЙ ЖУРНАЛ. 2014. № 1 (61)
В большинстве развитых стран рак легкого является наиболее распространенной формой злокачественного новообразования. В России ежегодно диагностируется более 52 тыс. новых случаев (86,7 на 100 тыс. населения), при этом выявляемость больных с I–II стадиями составляет 26,4 %, с III и IV стадиями – 31,8 % и 38,3 % соответственно [2, 8, 17].
Несмотря на постоянное совершенствование хирургического метода, заметной тенденции к улучшению показателей выживаемости за последние годы не наблюдается. Обобщенные данные ряда клиник показывают, что после радикальных хирургических вмешательств 5-летняя выживаемость больных немелкоклеточным раком легкого (НМРЛ) II стадии составляет в среднем 46 %, с IIIА–В стадиями не превышает 11–15 % [6, 11]. Таким образом, подтверждается необходимость использования системной терапии у данной категории пациентов. Химиотерапия в случаях резек-табельного рака легкого может применяться как до операции, так и после нее. При этом преимущества того или иного режима химиотерапии находятся в процессе изучения, и нет пока однозначной точки зрения в плане рекомендаций по ее применению в комбинированном лечении НМРЛ [1, 5, 7, 17].
Важнейшим ограничением конвенциональной химиотерапии рака является химиорезистентность, которая может быть как предсуществующей, так и формироваться в процессе лечения и обусловливаться повышением экспрессии энергозависимых транспортеров лекарств ( ABCB1 , ABCC1 , ABCC2 , ABCG1 , ABCG2 , MVP ), осуществляющих выброс цитостатических препаратов из опухолевых клеток против градиента концентрации [13].
Кроме этого, чувствительность опухоли к отдельным препаратам коррелирует с экспресси-онными характеристиками некоторых молекул, которые называют маркерами монорезистентности. Например, повышенная экспрессия ферментов репарации ДНК, в частности ERCC1 и ХRCC1, позволяет опухоли нейтрализовать воздействие препаратов платины и алкилирующих агентов [10]. Для таксанов и винорельбина важна экспрессия в опухоли β3-тубулина (TUBB3) – основного строительного материала микротрубочек, которые разрушают таксаны и винорельбин. При НМРЛ высокая экспрессия TUBB3 связана с хорошим ответом на адъювантную химиотерапию по схеме цисплатина и винорельбина [14]. Настоящее исследование посвящено изучению механизмов, участвующих в реализации эффекта неоадъювантной химиотерапии (НАХТ) немелкоклеточного рака легкого, которые связаны с экспрессией генов множественной лекарственной устойчивости (МЛУ) и монорезистентности.
Цель исследования – изучить экспрессию генов МЛУ и монорезистентности в нормальной ткани бронхов и опухолевой ткани немелкоклеточного рака легкого после проведения неоадъювантной химиотерапии по схеме винорельбин/карбоплатин.
Материал и методы
В исследование включены 27 больных немелкоклеточным раком легкого Т2–4N0–3M0, получавших лечение в клиниках ФГБУ «НИИ онкологии» СО РАМН. Исследование проведено в соответствии с Хельсинкской декларацией 1964 г. (исправленной в 1975 и 1983 гг.), получено разрешение локального этического комитета НИИ онкологии СО РАМН и информированное согласие пациентов. Пациенты получали комбинированное лечение: 2 курса НАХТ по схеме винорельбин (35 мг/м2) / карбоплатин (AUC 6), радикальное хирургическое вмешательство и 3 курса химиотерапии в адъювантном режиме по той же схеме.
Распределение больных по полу: мужчин – 23 (85,2 %), женщин – 4 (14,8 %). Медиана возраста – 57,8 года (диапазон 46–67 лет). Центральный рак выявлен у 15 (55,5 %) больных, периферический рак – у 12 (44,5 %). По морфологии плоскоклеточный рак выявлен у 18 (66,7 %) больных, реже встречалась аденокарцинома – у 7 (25,9 %), на долю карциносаркомы и крупноклеточного рака пришлось по 1 случаю (3,7 %). Стадии заболевания: IIА стадия была диагностирована у 3 (11,1 %) больных, IIB стадия – у 6 (22,2 %), IIIA стадия – у 15 (55,5 %) и IIIB стадия зафиксирована у 3 (11,1 %) пациентов. Объем выполненных операций: реконструктивнопластические – 4 (14,8 %) вмешательства, комбинированные операции – 6 (22,2 %), лобэктомии – 10 (37 %) и пневмонэктомии – 7 (25,9 %) случаев. Всем пациентам выполнялась медиастинальная лимфодиссекция.
Материалом для исследования служила нормальная ткань бронхов, нормальная ткань легких и опухолевая ткань, которые забирались во время оперативного вмешательства после курсов НАХТ. Образцы ткани (~60–70 мм3) помещали в раствор
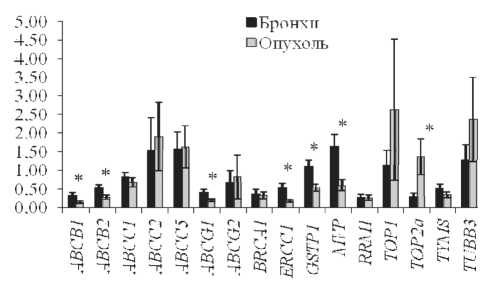
Рис. 1. Экспрессия генов МЛУ и монорезистентности в опухолевой ткани легкого и нормальных бронхах после проведения НАХТ.
Примечание: * – различия между выборками статистически значимы
RNAlater (Ambion, USA) и сохраняли при температуре –80ºС (после 24-часовой инкубации при +4ºС) для дальнейшего выделения РНК. Тотальную РНК выделяли с помощью набора RNeasy mini kit Plus, содержащего ДНК-азу I (Qiagen, Germany) с добавлением в раствор РНК ингибитора РНК-аз Ribo-LockTM (Fermentas, Lithuania). RIN составил 6,6–8,0, определялся при помощи системы капиллярного электрофореза TapeStation (Agilent Technologies, USA). Концентрацию и чистоту выделения РНК оценивали на спектрофотометре NanoDrop-2000 (Thermo Scientific, USA) (концентрация РНК составила 75–210 нг/мкл, А260/А280=1,85–2,15; А260/ А230=1,80–2,22). Для получения кДНК на матрице РНК проводили реакцию обратной транскрипции с помощью набора RevertAid™ (Fermentas, Lithuania) со случайными гексануклеотидами. Уровень экспрессии генов 9 МЛУ: ABCB1, ABCB2, ABCC1, ABCC2, ABCС5, ABCG1, ABCG2, GSTP1, MVP, и 7 генов монорезистентности: BRCA1, ERCC1, RRM1, TOP1, TOP2A, TUBB3, TYMS оценивали при помощи обратнотранскриптазной количественной ПЦР в режиме реального времени (RT-qPCR) по технологии TaqMan на амплификаторе Rotor-Gene-6000 (Corbett Research, Australia). ПЦР ставили в объеме 15 мкл с 2,5 ед HotStart Taq polymerase (Sibenzyme, Россия) с соответствующим буфером и 50 нг кДНК. Последовательность праймеров представлена в табл. 1, методика оценки относительной экспрессии генов МЛУ описана ранее [9]. Для калибратора использовали РНК здоровой легочной ткани 10 больных НМРЛ. В качестве результата использовался уровень экспрессии указанных генов относительно GAPDH и нормальной ткани бронхов, вычисляемый по методу Pfaffl [12].
Статистическая обработка данных проводилась с использованием пакета прикладных программ «STATISTICA 8.0» (StatSoft Inc., USA). Для проверки гипотезы о значимости различий признака использовали критерий Вилкоксона – Манна – Уитни.
Результаты и обсуждение
После проведенного лечения эффективность НАХТ была оценена с помощью шкалы RECIST у 27 пациентов. Полная регрессия была достигнута в 1 (3,7 %), частичная регрессия – в 4 (14,8 %) случаях, а наиболее часто встречался эффект стабилизации процесса – в 22 (81,5 %) наблюдениях.
Было установлено, что в нормальных бронхах экспрессия генов: АВСВ1 , АВСВ2 , ABCG1 , ERCC1 , GSTP1 и MVP после проведения НАХТ значительно выше, чем в опухолевой ткани, за исключением гена TOP2a , экспрессия которого в опухоли выше, чем в бронхах (рис. 1), т. е. противоопухолевые химиопрепараты накапливаются больше в опухолевой ткани легких, а не в бронхах.
На следующем этапе оценили связь экспрессии генов МЛУ и монорезистентности с основными клинико-морфологическими параметрами. Не было установлено связи экспрессии изучаемых генов в опухоли с возрастом пациентов (данные не представлены) и лимфогенным метастазированием (табл. 2).
У больных с опухолью, соответствующей Т3–4, отмечалась сниженная по сравнению с Т1–2 экспрессия генов ABCG1 , ABCG2 и ERCC1 после НХТ, что может обусловливать более высокую чувствительность опухоли больных с Т3–4 к химиотерапии и карбоплатину, в частности, поскольку известно, что высокая экспрессия генов репарации и ERCC1 определяет устойчивость опухоли легкого к препаратам платины (табл. 2) [16].
При периферической локализации опухоли экспрессия генов MVP и ТОР1 выше, чем при центральной локализации, в 2–3 раза (табл. 3). Аденокарцинома, по сравнению с плоскоклеточным раком, отличалась высокой экспрессией BRCA1 , определяющего резистентность к карбоплатину, и генов MVP и ABCB1 , которые отвечают за устойчивость к винорельбину [18]. Это может явиться одной из важных причин известной в литературе низкой чувствительности аденокарциномы (по
Таблица 1
|
Гены |
Ампликон |
Последовательность |
Дизайн |
|
ABCB1 NM_000927.4 |
93 bp |
F 5'-gattgacagctacagcacgg-3' |
ОД |
|
R 5’-ggtcgggtgggatagttga-3’ |
|||
|
Probe 5’-tgccgaacacattggaaggaaa-3’ |
|||
|
ABCB2 NM_018833.2 NM_000544.3 |
153 bp |
F 5’-ctggtcgtgtgattgacatcct-3’ |
[10] |
|
R 5’-gcaagttgattcgagacatggt-3’ |
|||
|
Probe 5’-aggtgattttgacccccatgccttt-3’ |
|||
|
ABCC1 NM_004996.3 |
87 bp |
F 5’-aggtgggctgcggaaag-3’ |
ОД |
|
R 5’-cggagcccttgatagcca-3’ |
|||
|
Probe 5’-tggctgagatggacaaagtggag-3’ |
|||
|
ABCC2 NM_000392.3 |
85 bp |
F 5’-cctgtcggctctgggaa-3’ |
|
|
R 5’-tgcccttgatggtgatgtg-3’ |
|||
|
Probe 5’-ggactgctgtgggacatagg-3’ |
|||
|
ABCC5 NM_005688.2 |
76 bp |
F 5’-caagagggtaaactggttgga-3’ |
|
|
R 5’-ctaaaatggctgaaatgagagag-3’ |
|||
|
Probe 5’-ggcagtgtgggaagtggaaaa-3’ |
|||
|
ABCG1 NM_004915.3 |
78 bp |
F 5’-cctactacctggccaagaccat-3' |
[10] |
|
R 5’-agtacacgatgctgcagtaggc-3' |
|||
|
Probe 5’-acgtgccctttcagatcatgttcccagt-3’ |
|||
|
ABCG2 NM_004827.2 |
97 bp |
F 5’-aaaggatgtctaagcaggga-3’ |
ОД |
|
R 5’-tgaggccaataaggtgagg-3’ |
|||
|
Probe 5’-tcgaggctgatgaatggagaag-3’ |
|||
|
BRCA1 NM_007294.3 NM_007298.3 NM_007297.3 NM_007300.3 |
107 bp |
F 5’- acagctgtgtggtgcttctgtg -3’ |
|
|
R 5’- cattgtcctctgtccaggcatc -3’ |
|||
|
Probe 5’- catcattcacccttggcacaggtgt -3’ |
|||
|
ERCC1 XM_005258638.1 Все транскрипты |
121 bp |
F 5’- ggcgacgtaattcccgacta -3’ |
|
|
R 5’- agttcttccccaggctctgc -3’ |
|||
|
Probe 5’- accacaacctgcacccagactacatcca -3’ |
|||
|
GAPDH NM_002046.3 |
124 bp |
F 5’-gccagccgagccacatc-3’ |
|
|
R 5’-ggcaacaatatccactttaccaga-3’ |
|||
|
Probe 5’-cgcccaatacgaccaaatccg-3’ |
|||
|
GSTP1 NM_000852.3 |
84 bp |
F 5’- ctggtggacatggtgaatgac -3' |
|
|
R 5’- cttgcccgcctcatagttg -3' |
|||
|
Probe 5’- aggacctccgctgcaaatacatctc -3' |
|||
|
MVP NM_017458.3 |
87 bp |
F 5’-ggaggtgctggaaaaggac-3’ |
|
|
R 5’-tcctcaaaatcaagcagcg-3’ |
|||
|
Probe 5’-ctgcccaacactgccctccat-3’ |
|||
|
RRM1 NM_001033.3 |
94 bp |
F 5’- actaagcaccctgactatgctatcc -3’ |
|
|
R 5’- cttccatcacatcactgaacacttt -3’ |
|||
|
Probe 5’- cagccaggatcgctgtctctaacttgca -3’ |
Последовательность праймеров и проб исследованных генов
Продолжение таблицы 1
|
TOP1 NM_003286.2 |
97 bp |
F 5’-ggcgagtgaatctaaggataatgaa -3’ |
ОД |
|
R 5’- tggatatcttaaagggtacagcgaa -3’ |
|||
|
Probe 5’-accattttcccatcatcctttgttctgagc -3’ |
|||
|
TOP2A NM_001067.3 |
75 bp |
F 5’-agtcgctttcagggttcttgag-3’ |
ОД |
|
R 5’-tttcatttacaggctgcaatgg-3’ |
|||
|
Probe 5’-cccttcacgaccgtcaccatgga-3’ |
|||
|
TUBB3 NM_006086.3 |
71 bp |
F 5’-gggccaagttctgggaagtc-3’ |
|
|
R 5’-cgagtcgcccacgtagttg-3’ |
|||
|
Probe 5’-atgagcatggcatcgaccccagc-3’ |
|||
|
TYMS NM_001071.2 |
91 bp |
F 5’-tctggaagggtgttttgga-3' |
|
|
R 5’-tcccagattttcactccctt-3' |
|||
|
Probe 5’-tctttagcatttgtggatcccttga-3' |
Примечание: все пробы – FAM →BHQ1; NM – номер последовательности РНК в NCBI Nucleotide Database ; bp – пары оснований; F – прямой праймер; R – обратный праймер; ОД – оригинальный дизайн.
Таблица 2
|
Гены |
Размер опухоли |
Лимфогенное метастазирование |
||
|
Т |
Т |
N 0 |
N1–3 |
|
|
ABCB1 |
0,40 ± 0,22 |
0,13 ± 0,05 |
0,25 ± 0,16 |
0,16 ± 0,06 |
|
ABCB2 |
0,33 ± 0,15 |
0,28 ± 0,07 |
0,30 ± 0,10 |
0,28 ± 0,08 |
|
ABCC1 |
0,98 ± 0,78 |
0,56 ± 0,15 |
0,80 ± 0,50 |
0,58 ± 0,17 |
|
ABCC2 |
0,07 ± 0,05 |
0,21 ± 0,06 |
0,26 ± 0,11 |
0,14 ± 0,06 |
|
ABCC5 |
0,65 ± 0,24 |
0,52 ± 0,11 |
0,59 ± 0,18 |
0,53 ± 0,12 |
|
ABCG1 |
0,42 ± 0,17* |
0,17 ± 0,05 |
0,23 ± 0,13 |
0,23 ± 0,06 |
|
ABCG2 |
0,58 ± 0,36* |
0,16 ± 0,06 |
0,24 ± 0,12 |
0,27 ± 0,13 |
|
BRCA1 |
0,10 ± 0,07 |
0,37 ± 0,13 |
0,46 ± 0,23 |
0,23 ± 0,11 |
|
ERCC1 |
0,37 ± 0,09* |
0,13 ± 0,03 |
0,19 ± 0,08 |
0,18 ± 0,05 |
|
GSTP1 |
0,40 ± 0,20 |
0,40 ± 0,16 |
0,24 ± 0,16 |
0,49 ± 0,17 |
|
MVP |
0,63 ± 0,21 |
0,42 ± 0,11 |
0,50 ± 0,17 |
0,45 ± 0,12 |
|
RRM1 |
0,17 ± 0,01 |
0,32 ± 0,11 |
0,14 ± 0,02 |
0,36 ± 0,12 |
|
TOP1 |
0,33 ± 0,19 |
0,21 ± 0,07 |
0,25 ± 0,13 |
0,23 ± 0,08 |
|
TOP2a |
0,76 ± 0,25 |
2,46 ± 1,12 |
1,02 ± 0,63 |
2,61 ± 1,28 |
|
TYMS |
0,25 ± 0,12 |
0,31 ± 0,08 |
0,38 ± 0,10 |
0,26 ± 0,08 |
|
TUBB3 |
0,51 ± 0,07 |
1,21 ± 0,43 |
1,27 ± 0,59 |
0,95 ± 0,43 |
Примечание: * – различия между выборками статистически значимы. СИБИРСКИЙ ОНКОЛОГИЧЕСКИЙ ЖУРНАЛ. 2014. № 1 (61)
Связь экспрессии генов МЛУ и монорезистентности в опухолевой ткани легкого с размером опухоли и лимфогенным метастазированием
Таблица 3
|
Гены |
Гистотип |
Локализация |
||
|
Аденокарцинома |
Плоскоклеточный |
Периферическая |
Центральная |
|
|
ABCB1 |
0,24 ± 0,09* |
0,10 ± 0,03 |
0,26 ± 0,11 |
0,13 ± 0,05 |
|
ABCB2 |
0,33 ± 0,18 |
0,22 ± 0,06 |
0,36 ± 0,10 |
0,21 ± 0,07 |
|
ABCC1 |
0,12 ± 0,06 |
0,76 ± 0,31 |
0,54 ± 0,22 |
0,76 ± 0,33 |
|
ABCC2 |
0,25 ± 0,07 |
0,15 ± 0,07 |
0,12 ± 0,04 |
0,23 ± 0,09 |
|
ABCC5 |
0,25 ± 0,05 |
0,66 ± 0,15 |
0,39 ± 0,09 |
0,71 ± 0,16 |
|
ABCG1 |
0,17 ± 0,05 |
0,22 ± 0,07 |
0,25 ± 0,09 |
0,21 ± 0,07 |
|
ABCG2 |
0,13 ± 0,04 |
0,34 ± 0,17 |
0,31 ± 0,17 |
0,20 ± 0,08 |
|
BRCA1 |
0,64 ± 0,33* |
0,17 ± 0,05 |
0,51 ± 0,23 |
0,16 ± 0,04 |
|
RRM1 |
0,28 ± 0,15 |
0,29 ± 0,13 |
0,28 ± 0,12 |
0,28 ± 0,13 |
|
GSTP1 |
0,13 ± 0,11 |
0,42 ± 0,19 |
0,29 ± 0,11 |
0,52 ± 0,23 |
|
MVP |
1,09 ± 0,62* |
0,30 ± 0,08 |
0,64 ± 0,12* |
0,30 ± 0,13 |
|
ERCC1 |
0,13 ± 0,05 |
0,15 ± 0,05 |
0,25 ± 0,07 |
0,13 ± 0,04 |
|
TOP1 |
0,25 ± 0,22 |
0,14 ± 0,05 |
0,38 ± 0,12* |
0,10 ± 0,04 |
|
TOP2a |
0,38 ± 0,28* |
3,28 ± 1,50 |
0,83 ± 0,21 |
3,34 ± 1,69 |
|
TYMS |
0,37 ± 0,17 |
0,27 ± 0,09 |
0,34 ± 0,10 |
0,25 ± 0,09 |
|
TUBB3 |
2,21 ± 1,08* |
0,87 ± 0,39 |
1,52 ± 0,58 |
0,59 ± 0,31 |
Примечание: * – различия между выборками статистически значимы.
сравнению с плоскоклеточным раком) к химиотерапии [5].
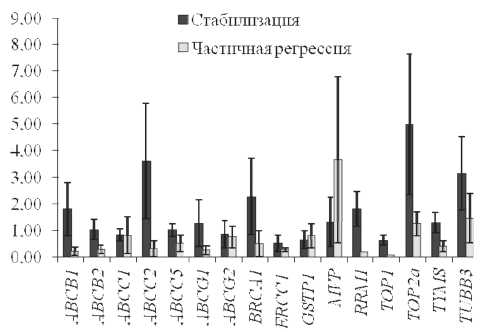
После проведения НАХТ была оценена экспрессия генов МЛУ и монорезистентности в опухолевой ткани у больных с частичной регрессией и стабилизацией. Статистически значимых различий не установлено, что связано с небольшой частотой больных с частичной регрессией (n=4). Однако на рис. 2 хорошо виден низкий уровень экспрессии большинства генов МЛУ и монорезистентности в опухоли легкого больных с частичной регрессией (для генов
АВСВ1
,
АВСВ2
,
ABCC2
,
ABCG1
,
TYMS
снижение на уровне тенденции, 0,05 Рис. 2. Экспрессия генов МЛУ и монорезистентности в опухолевой ткани легкого у больных с различным ответом на НАХТ НАХТ сочеталось с хорошим ответом на лечение. Повышение экспрессии этих генов было связано с отсутствием непосредственного эффекта НАХТ [3, 4, 9]. Динамический процесс формирования Связь экспрессии генов МЛУ и монорезистентности в опухолевой ткани легкого с гистотипом и локализацией опухоли МЛУ, о котором свидетельствует повышенный или сниженный уровень экспрессии генов МЛУ после химиотерапии, может являться универсальным механизмом лекарственной устойчивости опухолей многих локализаций в клинических условиях. Заключение Была изучена экспрессия генов МЛУ и монорезистентности в нормальной ткани бронхов и опухолевой ткани НМРЛ после проведения неоадъювантной химиотерапии по схеме винорельбин/ карбоплатин. Показан высокий уровень экспрессии некоторых генов МЛУ и монорезистентности в бронхах, по сравнению с опухолевой тканью, у больных T1-2 при аденокарциноме по сравнению с плоскоклеточным раком. Установлена тенденция к снижению уровня экспрессии генов МЛУ в опухоли больных с частичной регрессией по сравнению с опухолью больных со стабилизацией процесса, что соответствует нашим данным, полученным на опухоли молочной железы [3, 4, 9]. Работа поддержана грантом ФЦП «Научные и научно-педагогические кадры инновационной России на 2009–2013 гг.» соглашение № 8291 от 27 августа 2012 г.