Экспрессия генов NK-lysin, blvr, ifn-a и клеточные популяции периферической крови при инфицировании коров вирусом бычьего лейкоза
Автор: Косовский Г.Ю., Глазко В.И., Ковальчук С.Н., Архипова А.Л., Глазко Т.Т.
Журнал: Сельскохозяйственная биология @agrobiology
Рубрика: Факторы клеточного иммунитета
Статья в выпуске: 4 т.52, 2017 года.
Бесплатный доступ
Распространение ретровирусных инфекций, в частности вируса бычьего лейкоза (BLV), до сих пор не удается ни предупредить, ни контролировать. Недостаточно эффективными остаются методы вакцинации (G. Gutiérrez c соавт., 2014) и выявления инфицированных животных (M. Nishiike c соавт., 2016), что приводит к необходимости углубленного исследования взаимодействий патогена с организмом хозяина. Ранее нами были получены данные о том, что общей характеристикой для инфицированных BLV животных с умеренным и высоким лейкоцитозом является повышение количества тромбоцитов, тогда как у коров с выраженным лейкоцитозом наблюдается снижение числа нейтрофилов (Г.Ю. Косовский c соавт., 2017). Для того чтобы оценить взаимосвязи между инфицированностью животных BLV, соотношением клеточных популяций периферической крови и экспрессией генов, кодирующих рецептор BLV (ген blvr ), белок антивирусной защиты интерферон альфа ( ifn- a) и эффекторный белок врожденного иммунитета NK-лизин (NK-lysin), в настоящей работе выполнен сравнительный анализ перечисленных показателей у двух групп коров неодинакового происхождения - черно-пестрых голштинизированных (n = 57) и помеси симменталы × голштины (n = 60) (группы были сформированы в хозяйствах в Московской и Пензенской областях). В результате получены данные о том, что коровы из разных хозяйств, не инфицированные BLV, различались в основном по содержанию в периферической крови нейтрофилов и тромбоцитов. Тем не менее, в обоих хозяйствах у инфицированных BLV животных наблюдалась сниженная экспрессия гена NK-lysin и увеличенное количество тромбоцитов по сравнению с коровами, свободными от инфекции. У инфицированных BLV коров отмечалась относительно повышенная экспрессия blvr, отражающая, по-видимому, увеличение доли юных форм В-лимфоцитов (M. Lavanya c соавт., 2008). На основании полученных нами результатов и данных литературы предложена следующая схема влияния BLV на экспрессию NK-lysin и подавление апоптоза: вирусный белок Tax (активатор транскрипции провирусной ДНК BLV) также индуцирует у хозяина экспрессию гена tnf- a, кодирующего фактор некроза опухолей альфа (M. Arainga c соавт., 2012), тот, в свою очередь, индуцирует активацию регуляторов иммунного гомеостаза - клеток Treg (L.Y. Chang c соавт., 2015), маркерный признак которых - продукция TGF-β (трансформирующий фактор роста бета), а TGF-β ингибирует пролиферацию и активность Т-киллеров и NK-клеток - продуцентов NK-лизинов и увеличивает количество и активность тромбоцитов, в частности тромбоцитарную антиапоптозную активность (K. Ohira c соавт., 2016; S.C. Tao c соавт., 2016). Предложенная схема свидетельствует о том, что влияние на системы врожденного иммунитета представляет собой ключевое событие индуцируемого BLV патогенеза.
Вирус бычьего лейкоза, гранулоциты, агранулоциты, nk-лизин, рецептор вируса бычьего лейкоза, интерферон альфа, экспрессия генов, врожденный иммунитет
Короткий адрес: https://sciup.org/142214071
IDR: 142214071 | УДК: 636.2:575.174.015.3:578.2:577.2.08:51-76 | DOI: 10.15389/agrobiology.2017.4.785rus
Текст научной статьи Экспрессия генов NK-lysin, blvr, ifn-a и клеточные популяции периферической крови при инфицировании коров вирусом бычьего лейкоза
Инфекционные заболевания — основная причина экономических потерь в молочном и мясном скотоводстве. Существенный вклад в них вносит энзоотический лейкоз крупного рогатого скота, вызываемый вирусом бычьего лейкоза (Bovine Leukemia Virus — BLV) (1, 2). Среди животных, инфицированных BLV, 60-70 % остаются асимптотическими носителями патогена; примерно у 30 % таких носителей с течением времени развивается лимфоцитоз, и только у 5-10 % инфицированных особей — лейкемии и лимфомы. Оздоровление стад затруднено из-за того, что антитела к белкам вируса могут обнаруживаться у животных и в отсутствие клонов вирус-продуцирующих В-лимфоцитов, а выявление (или не выявление) интегрированной в геном особи провирусной ДНК BLV не всегда дает надежный прогноз развития заболевания, следовательно, существует необходимость поиска дополнительных характеристик инфекционного процесса, индуцируемого BLV (3).
Чаще всего провирусную ДНК BLV несут около 1 % клеток пери- ферической крови (3). Выделены две субпопуляции инфицированных BLV В-лимфоцитов: одна — это активные продуценты зрелых вирусных частиц и иммуноглобулина IgM, другая — «молчащие» В-лимфоциты с низкой экспрессией провирусной ДНК BLV и IgM, которые отличаются от клеток первой субпопуляции более высокой экспрессией ряда онкогенов и повышенной частотой клеточной гибели. Обе клеточные субпопуляции имеют одинаково повышенную экспрессию рецептора BLV на B-лимфоцитах по сравнению с таковой у неинфицированных животных, то есть у этих двух субпопуляций чувствительность к инфицированию BLV не различается (4). Обнаружено, что количество вирус-продуцирующих B-лимфоцитов существенно выше в системе ex vivo по сравнению с in vivo, что свидетельствует о наличии интенсивного «очищающего» отбора против продуцирующих BLV B-лимфоцитов с вовлечением факторов иммунной системы (5).
Выполненное нами ранее изучение профилей клеточных популяций периферической крови в группах черно-пестрого голштинизированного скота, инфицированных BLV и свободных от инфекции, свидетельствовало о связях между выраженным лейкоцитозом, увеличением количества тромбоцитов, уменьшением — нейтрофилов, а также относительно повышенной представленностью нейтрофилов у животных с присутствием антител к BLV (РИД+), но без наличия в геномах провирусной ДНК BLV (6).
В настоящем исследовании впервые выполнен анализ экспрессии генов таких эффекторных белков иммунной системы, как NK-лизин (один из основных белков цитотоксических гранул Т-киллеров и NK-клеток) (7), рецептор для вируса бычьего лейкоза (BLVR, дельта субъединица транспортной системы AP3 плазматической мембраны лимфоцитов) (8) и моноцитарный интерферон альфа (IFN Α ) (9), и предложена схема влияния BLV на экспрессию NK-lysin и подавление апоптоза.
Цель работы заключалась в выявлении факторов, которые могли бы быть связаны с изменениями функциональной активности иммунной системы у животных, инфицированных вирусом бычьего лейкоза.
Методика . В исследование были включены животные в возрасте 25 лет: 57 гол. — черно-пестрые голштинизированные коровы, содержавшиеся в хозяйстве ЗАО «Можайское» (Московская обл.), 60 гол. — помеси симменталы ½ голштины (в ряде поколений проводилось поглощающее скрещивание на голштинов) из хозяйства «Заря» (Пензенская обл.). Кровь для анализа брали из хвостовой вены.
Эритроцитарные и лейкоцитарные профили и характеристики эритроцитов определяли на автоматическом гематологическом анализаторе Abacus junior Vet5 («Diatron», Австрия; принцип работы основан на методе Культера). Использовали индивидуальные образцы свежей цельной периферической крови каждого животного (4 мл), стабилизированной EDTA. Носителей провирусной ДНК BLV выявляли с использованием радиальной иммунодиффузии по Манчини (РИД) и методом PCR, разработанным нами ранее (10). ДНК выделяли из 100 мкл цельной крови коров с помощью набора реагентов М-Сорб для выделения ДНК из клинических образцов («Синтол», Россия) согласно рекомендациям производителя. На этом основании особей разделяли на свободных от инфекции и несущих в геноме интегрированную провирусную ДНК BLV. Тотальную РНК выделяли из 1 мл цельной крови коров с помощью реактива ExtractRNA («Евроген», Россия) в соответствии с рекомендациями производителя. Обработку РНК ДНКазой I («Thermo Fisher Scientific», США) и синтез первой цепи кДНК с помощью набора MMLV RT kit («Евроген», Россия) проводили согласно рекомендациям производителей.
Сравнительный анализ экспрессии NK-lysin, blvr и ifn-α выполняли методом количественной полимеразной цепной реакции в реальном времени (RT-PCR) с использованием интеркалирующего красителя SYBR Green с помощью готовой смеси для PCR qPCRmix-HS SYBR («Евроген», Россия) на приборе LightCycler 96 («Roche», Швейцария). В качестве референсного использовали ген рибосомального белка RPLPO. Реакцию амплификации проводили в 20 мкл реакционной смеси, содержащей по 0,2 мкмоль прямого и обратного праймеров и 2 мкл кДНК. В работе использовали праймеры со следующими последовательностями: для NK-lysin — 5'-CCTCGGTGCTCCTGGTYGC-3', 5'-GGTCACCCTGGGGATCCTC-3'; для blvr — 5'-CTATCGGACCAGTATGTGAAG-3', 5'-CTCCTCGGTGACG-ATGTCC-3’; для ifn-a — 5'-GATGAGAGCCTCCTGGACAA-3', 5'-GAAGT-ATTTCCTCACAGCCAG-3’ и для RPLPO — 5'-CAACCCTGAAGTGCTTG-ACAT-3′, 5′-CAGATGGATCAGCCAAGAAG-3′. PCR выполняли на приборе LightCycler 96 («Roche», Швейцария) при следующих условиях: денатурация при 95 °С в течение 15 с, отжиг праймеров при 60 °С в течение 15 с, элонгация при 72 °С в течение 15 с (40 циклов). Сигнал флуоресценции снимали по каналу SYBR. Специфичность реакции проверяли на кривых температурной диссоциации полученных ампликонов.
Количественный анализ экспрессии генов проводили с помощью программного обеспечения LightCycler 96 SW1.1 («Roche», Швейцария).
Статистическую обработку данных выполняли в программе Statisti-ca 6.0 («StatSoft, Inc.», США). Значимыми считали различия при P < 0,05. В таблицах приведены средние арифметические ( X ) и ошибки средних (± х ).
Результаты . В наших предыдущих исследованиях получены данные, свидетельствующие о том, что инфицированные вирусом бычьего лейкоза (BLV) коровы отличаются от свободных от инфекции не только лейкоцитозом, но и пониженным содержанием нейтрофилов, в также повышенным — тромбоцитов и моноцитов (6). По количеству лейкоцитов инфицированные животные подразделялись на две группы — с близким к типичному для неинфицированных животных и с высоким лейкоцитозом (более 17½109 кл/л). Для того чтобы выяснить воспроизводимость таких различий, в настоящей работе мы проанализировали профили клеток периферической крови у коров помесного происхождения (получены от поглотительных скрещиваний симментальских коров на голштинов) (табл. 1).
1. Сравнительный анализ эритроцитарных и лейкоцитарных профилей периферической крови у коров, свободных от инфекции (контроль) и инфицированных вирусом бычьего лейкоза, в двух хозяйствах в Московской и Пензенской областях ( Х ± х )
|
Клеточная |
Коровы без встройки |
Коровы, инфицированные BLV (РИД+, BLV+) |
|
|
популяция, |
провирусной ДНК BLV |
без высокого |
с максимальным |
|
характеристика |
(РИД - , BLV - , контроль) |
лейкоцитоза |
лейкоцитозом |
|
Эритроциты: |
|||
|
¹ 1 |
6,86±0,22* ( n = 7) |
6,15±0,17 ( n = 16) |
6,34±0,36* ( n = 6) |
|
¹ 2 Лейкоциты: |
5,79±0,29* ( n = 10) |
5,60±0,29 ( n = 7) |
5,66±0,27* ( n = 8) |
|
¹ 1 |
10,21±0,70 ( n = 7) |
11,73±0,88 ( n = 16) |
25,49±1,01** ( n = 6) |
|
¹ 2 Лимфоциты: |
7,75±1,08 ( n = 10) |
9,00±1,44 ( n = 7) |
34,21±6,18** ( n = 8) |
|
¹ 1 |
4,85±0,48 ( n = 7) |
6,12±0,73 ( n = 16) |
21,70±1,08 ( n = 6) |
|
¹ 2 Моноциты: |
4,36±0,94 ( n = 10) |
5,40±1,27 ( n = 7) |
29,68±5,71 ( n = 8) |
|
¹ 1 |
0,52±0,15 ( n = 7) |
0,28±0,09 ( n = 16) |
1,61±0,24* ( n = 6) |
|
¹ 2 Нейтрофилы: |
0,36±0,11 ( n = 10) |
0,27±0,10 ( n = 7) |
0,61±0,21* ( n = 8) |
|
¹ 1 |
4,54±0,50* ( n = 7) |
4,63±0,83* ( n = 16) |
1,66±0,35* ( n = 6) |
|
¹ 2 Эозинофилы: |
2,39±0,65* ( n = 10) |
2,76±0,38* ( n = 7) |
3,31±0,59* ( n = 8) |
|
¹ 1 |
0,45±0,16 ( n = 7) |
0,59±0,09 ( n = 16) |
0,51±0,18* ( n = 6) |
|
¹ 2 |
0,63±0,12 ( n = 10) |
0,55±0,12 ( n = 7) |
0,93±0,20* ( n = 8) |
Продолжение таблицы 1
|
Базофилы: |
|||
|
¹ 1 |
0,0114±0,0014* ( n = 7) |
0,0088±0,0027 ( n = 16) |
0,0067±0,00211* ( n = 6) |
|
¹ 2 |
0,0050±0,0022* ( n = 10) |
0,0143±0,0043 ( n = 7) |
0,0175±0,0059* ( n = 8) |
|
Тромбоциты: |
|||
|
¹ 1 |
12,90±9,91* ( n = 7) |
160,81±47,55 ( n = 16) |
122,33±78,28 ( n = 6) |
|
¹ 2 |
126,50±35,15* ( n = 10) |
318,14±107,92 ( n = 7) |
252,62±43,35 ( n = 8) |
|
Средний объем эритроцитов, мкм3: |
|||
|
¹ 1 |
44,86±2,11** ( n = 7) |
46,12±0,86** ( n = 16) |
46,50±1,09 ( n = 6) |
|
¹ 2 |
55,30±1,58** ( n = 10) |
52,86±1,12** ( n = 7) |
49,75±1,42 ( n = 8) |
|
Изменчивость эритроцитов по диаметру, %: |
|||
|
¹ 1 |
20,83±0,52 ( n = 7) |
18,55±0,34 ( n = 16) |
18,83±0,31 ( n = 6) |
|
¹ 2 |
27,43±9,17 ( n = 10) |
17,69±0,48 ( n = 7) |
17,09±0,36 ( n = 8) |
П р и м еч а ни е. BLV - и BLV+ — наличие и отсутствие вируса бычьего лейкоза, РИД - и РИД+ — отрицательная и положительная реакция иммунодиффузии. Эритроциты — ½1012/л, лейкоциты — ½109/л; ¹ 1 и ¹ 2 — хозяйства, n — число животных.
* P < 0,05, ** P < 0,01 (достоверность различий с контролем).
Животные двух хозяйств заметно отличались друг от друга по средним значениям количества эритроцитов и их среднему объему, а также по размеру популяций нейтрофилов, базофилов и тромбоцитов. Интересно, что относительно большее количество эритроцитов у коров из хозяйства ЗАО «Можайское» (далее ¹ 1) совпадало с меньшим объемом индивидуальных эритроцитов по сравнению с показателями у животных из хозяйства «Заря» (далее ¹ 2) (см. табл. 1). При этом у коров из обоих хозяйств наблюдалась статистически достоверная (P < 0,05) отрицательная корреляция между числом эритроцитов и их средним объемом (¹ 1 — r = -0,90; ¹ 2 — r = -0,86), то есть, по-видимому, суммарный функциональный потенциал клеток эритроидного ряда может существенно не различаться.
Содержание лейкоцитов, лимфоцитов, моноцитов и эозинофилов в крови животных в подгруппах, свободных от инфекции и с умеренным лейкоцитозом, не различались в обоих хозяйствах, но в хозяйстве ¹ 2 в подгруппе с высоким лейкоцитозом количество лейкоцитов и лимфоцитов было статистически достоверно (P < 0,05) выше, а моноцитов — ниже (P < 0,05), чем в хозяйстве ¹ 1 (см. табл. 1). У коров из хозяйства ¹ 1 обнаружилась некоторая тромбопения по сравнению с животными из хозяйства ¹ 2 при одинаковых различиях между подгруппами по тромбоцитам: наименьшее число — у свободных от инфекции животных, наибольшее — у инфицированных BLV с умеренным лейкоцитозом (см. табл. 1).
У коров из хозяйства ¹ 1, свободных от инфекции (условно контрольная подгруппа), содержание базофилов статистически достоверно (P < 0,05) превышало этот показатель в хозяйстве ¹ 2, причем если в хозяйстве ¹ 1 у инфицированных BLV животных количество базофилов уменьшалось относительно условного контроля, то в хозяйстве ¹ 2 — наоборот, увеличивалось (см. табл. 1).
По нейтрофилам разные подгруппы коров из хозяйства ¹ 2 статистически достоверно не различались, тогда как в хозяйстве ¹ 1 в подгруппе с выраженным лейкоцитозом количество нейтрофилов оказалось самым низким. При этом по нейтрофилам в подгруппах коров, свободных от инфекции и с умеренным лейкоцитозом, показатель в хозяйстве ¹ 1 почти в 2 раза превышал аналогичный в хозяйстве ¹ 2 (см. табл. 1). В литературе имеются противоречивые данные о влиянии носительства BLV на количество нейтрофилов: в одних работах не выявлены различия между инфицированными и не инфицированными BLV коровами (11), в других — у некоторых животных наблюдается нейтрофилия (12); также описан выраженный нейтрофилез в молоке коров, инфицированных BLV (13).
Таким образом, у животных, которые имеют неодинаковое происхождение и содержатся в разных хозяйствах, лейкоцитарная компонента ока-788
залась сходной по размеру популяции агранулоцитов и эозинофилов в периферической крови особей, свободных от инфекции и с умеренным лейкоцитозом, но существенно различалась по численности нейтрофилов и базофилов (была выше в хозяйстве ¹ 1), а также тромбоцитов (была ниже в хозяйстве ¹ 1). Различия проявились и в том, что в подгруппах с выраженным лейкоцитозом в хозяйстве ¹ 1 наблюдалось статистически достоверное падение количества нейтрофилов и базофилов по сравнению с показателями у коров в хозяйстве ¹ 2 на фоне более низкого уровня лейкоцитов и лимфоцитов (см. табл. 1). Полученные данные свидетельствуют о том, что у коров из хозяйства ¹ 2 по сравнению с животными из хозяйства ¹ 1 наблюдается определенное подавление клеточных популяций, связанных с функцией врожденного иммунитета (нейтрофилы, базофилы).
2. Экспрессия (усл. ед.) генов NK-lysin, blvr, ifn- α в периферической крови коров, свободных от инфекции (контроль) и инфицированных вирусом бычьего лейкоза (со встройкой провирусной ДНК) ( Х ± х , два хозяйства в Московской и Пензенской областях)
|
Хозяйство, ген |
Коровы ( n ) РИД - без встройки провирусной ДНК BLV (контроль) |
Коровы ( n ) РИД+ со встройкой ДНК BLV |
|
|
без высокого лейкоцитоза |
с максимальным лейкоцитозом |
||
|
¹ 1, NK-lysin |
64,30±18,74 ( n = 7) |
54,49±8,98 ( n = 16) |
36,15±11,04 ( n = 6) |
|
¹ 2, NK-lysin |
27,43±9,17 ( n = 10) |
9,17±4,09 ( n = 7) |
3,76±1,22 ( n = 8) |
|
¹ 1, blvr |
7,10±1,50 ( n = 7) |
11,26±2,17 ( n = 15) |
12,18±2,37 ( n = 6) |
|
¹ 1, ifn- α |
40,90±21,67 ( n = 10) |
68,42±48,26 ( n = 11) |
1,90±0,84 ( n = 6) |
|
¹ 2, ifn- α |
21,80±12,00 ( n = 7) |
||
П р и м е ч а н и е. BLV — вирус бычьего лейкоза, РИД - и РИД+ — отрицательная и положительная реакция иммунодиффузии, n — число животных. Экспрессию генов выражали относительно экспрессии референтного гена рибосомального белка RPLPO. Прочерки означают отсутствие данных.
Для того чтобы оценить активность ключевых генов, вовлеченных в процессы патогенеза, индуцируемого BLV, мы выполнили анализ экспрессии у NK-lysin, blvr, ifn- α (табл. 2). У животных из хозяйства ¹ 2, свободных от инфекции, по сравнению с такой же подгруппой коров из хозяйства ¹ 1 экспрессия NK-lysin оказалась существенно (более чем в 2 раза) снижена, что согласуется с данными об определенном подавлении клеточных популяций, связанных с врожденным иммунитетом, у животных из хозяйства ¹ 2 (см. табл. 1). Тем не менее, как и у коров из хозяйства ¹ 1, у животных из хозяйства ¹ 2 наблюдалось выраженное уменьшение экспрессии NK-lysin у животных, инфицированных BLV (см. табл. 2). Иными словами, у инфицированных BLV особей обнаруживалось дальнейшее подавление эффекторных факторов естественного иммунитета (NK-lysin), несмотря на различия между хозяйствами по представленности связанных с ним клеточных популяций в периферической крови животных. Следует отметить, что в обоих хозяйствах были выявлены подгруппы коров, у которых присутствовали антитела к BLV (РИД+), но отсутствовали клоны клеток, несущих провирусную ДНК в геноме. В хозяйстве ¹ 1 таких было 7 из 34 РИД+ особей (20,6 %), в хозяйстве ¹ 2 — 11 из 38 (28,9 %). Это несколько больше, чем описано в литературе (12, 14), но, тем не менее, воспроизводится в разных хозяйствах и свидетельствует о регулярности ложноположительных результатов при выявлении инфицированных BLV животных с использованием только РИД.
Интересно, что в обеих подгруппах РИД+ коров без встройки про-вирусной ДНК BLV (BLV - ) из двух хозяйств наблюдалось повышение характеристик, связанных с врожденным иммунитетом, по сравнению с показателями, которые регистрировали у особей, несущих провирусную ДНК BLV. Так, в хозяйстве ¹ 1 у коров РИД+BLV - содержание нейтрофилов в 789
крови составило (3,59±0,61)½109/л, тогда как у особей с высоким лейкоцитозом — (1,66±0,35)½109/л, а в хозяйстве ¹ 2 у коров РИД+BLV - относительная экспрессия NK-lysin достигала значений 13,62±4,03 по сравнению с 9,17±4,09 в подгруппе с умеренным лейкоцитозом и 3,76±1,22 — в подгруппе с максимальным лейкоцитозом (см. табл. 2). По-видимому, коровы РИД+BLV - в двух хозяйствах могут обладать относительно повышенной активностью врожденного иммунитета и, соответственно, способны более успешно элиминировать клеточные клоны, инфицированные BLV.
Экспрессия гена blvr в хозяйстве из Московской области была выше в подгруппах инфицированных коров (см. табл. 2), но при этом не коррелировала с увеличением популяции лимфоцитов. В литературе имеются данные, свидетельствующие о том, что экспрессия blvr обнаруживается у юных форм В-лимфоцитов и падает по мере их старения (8). Наши результаты позволяют предполагать относительно повышенный вклад юных В-лимфоцитов в лимфоцитарную популяцию клеток у инфицированных BLV животных.
Экспрессия ifn -α характеризовалась высокой индивидуальной изменчивостью (см. табл. 2). По-видимому, это обусловлено вовлечением продуктов генов ifn -α в широкий спектр сигнальных путей и сетевых взаимодействий (15). Тем не менее, у коров из обоих хозяйств в подгруппах с высоким лейкоцитозом наблюдалась тенденция пониженной экспрессии ifn -α по сравнению с животными, свободными от инфекции BLV и с умеренным лейкоцитозом (см. табл. 2). У особей РИД+BLV - в хозяйстве из Пензенской области проявилась тенденция к относительно увеличенной экспрессии ifn -α (155,26±106,17), что тоже может свидетельствовать в пользу предположения об относительно повышенной активности естественных систем противовирусной защиты у таких животных.
В целом, полученные данные свидетельствуют о том, что вне зависимости от выраженности лейкоцитоза у инфицированных BLV животных обнаруживается уменьшение экспрессии NK-lysin , увеличение популяции юных форм В-лимфоцитов (судя по росту экспрессии гена blvr ), а также определенная тенденция к снижению экспрессии генов интерферона альфа ( ifn -α) при выраженном лейкоцитозе. По-видимому, наиболее надежным показателем ослабления защиты от BLV (безотносительно индивидуальных особенностей соотношения грануло- и агранулоцитов в периферической крови) может служить значительное ограничение экспрессии NK-lysin у инфицированных BLV животных, выявленное нами в обоих хозяйствах (см. табл. 2). Интересно отметить, что в выполненных нами ранее исследованиях по секвенированию фрагментов ДНК, фланкированных инвертированным повтором микростателлита (GAG) 6 С, было обнаружено, что инфицированные BLV животные отличались от свободных от инфекции интеграцией этой последовательности в структурный ген, кодирующий NK-lysin (16). Тем не менее, в настоящее время отсутствует возможность дифференцировать наличие мутаций, способствующих снижению экспрессии гена NK-lysin у инфицированных BLV коров, от ограничения экспрессии или уменьшения пролиферации компетентных клеток в связи с функциональными изменениями статуса иммунной системы.
Известно, что начальные этапы любого инфекционного процесса связаны с активацией систем врожденного иммунитета и тесных сетевых взаимодействий между агранулоцитами и гранулоцитами, причем конечный результат таких взаимодействий критически зависит от исходного состояния клеточных популяций лейкоцитов (17). По-видимому, именно недостаточная изученность этих взаимоотношений и обусловливает отсутствие успехов в разработках методов вакцинации против таких дельта-790
ретровирусов, как BLV и T-лимфотропный вирус типа 1 (HTLV-1) (18).
Ведущий фактор иммунологического гомеостаза — популяции регуляторных Т-клеток (Treg) (19). Treg клетки препятствуют активации эффекторных T-лимфоцитов, вовлеченных в аутоиммунные и аллергические процессы, и в то же время снижают противоопухолевый иммунитет. Обнаружено, что у крупного рогатого скота, инфицированного BLV, наблюдается активация Treg клеток, что сопровождается, в частности, снижением цитотоксической активности естественных киллеров (NK-клетки) (20, 21). Доля Treg клеток положительно коррелирует с количеством лимфоцитов, титром вируса и вирусной нагрузкой у крупного рогатого скота, инфицированного BLV. Есть экспериментальные данные, свидетельствующие о том, что подавление антивирусной активности и цитотоксичности NK-клеток обусловлено активацией секреции рост-трансформирующего фактора бета (TGF- β ) Treg клетками (22). Следует подчеркнуть, что один из эффектов действия провирусного гена tax BLV на гены хозяина — это увеличение экспрессии фактора некроза опухолей TNF-α (23, 24), который, в свою очередь, активирует Treg клетки (25, 26). Иными словами, экспрессия про-вирусной ДНК BLV сопровождается активацией экспрессии TNF-α у хозяина. Это индуцирует Treg клетки, маркером активации которых служит экспрессия TGF- β , подавляющего пролиферацию и экспрессию цитотоксинов у NK-клеток, что соответствует полученным нами данным об ограничении экспрессии NK-lysin у инфицированных BLV коров в обоих хозяйствах.
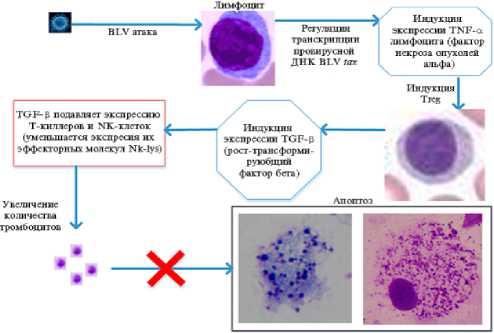
Влияние транскрипции прови-русной ДНК вируса бычьего лейкоза (BLV) на снижение активности Т-киллеров и NK-клеток и индукцию увеличения количества тромбоцитов (блокаторы апоптоза) у инфицированных животных: BLV tax — активатор транскрипции провирусной ДНК BLV (влияет на экспрессию ряда генов хозяина, в частности гена TNF- α ); TNF- α — фактор некроза опухолей α , продуцируемый лимфоцитами; TGF- β — фактор трансформации роста β ; Treg — тимус-зависимая популяция регуляторных клеток.
Функциональная активность NK-клеток непосредственно зависит от нейтрофилов, образуя ось взаимодействия между нейтрофилами и NK-клетками (27-29). В последние годы накапливаются экспериментальные данные о том, что в адаптивном и врожденном иммунитете нейтрофилы как важный источник цитокинов и хемокинов, активирующих другие клетки иммунной системы, выполняют особую роль при регуляции взаимодействий в популяциях лейкоцитов (18). В то же время сообщается о зависимости выживаемости самих нейтрофилов от взаимодействия с тромбоцитами (30). Тромбоциты, кроме всего прочего, оказывают блокирующее влияние на апоптоз (31).
Накопленные данные позволяют предложить схему эффектов транскрипции провирусной ДНК BLV после ее встройки в геном хозяина: активатор транскрипции провирусной ДНК BLV Tax индуцирует увеличение количества TNF-α у хозяина, что активирует Treg клетки, подавляющие, в частности, цитотоксическую функцию NK-клеток (рис.). Такая схема соответствует полученным нами экспериментальным результатам и дает основания предполагать, что ключевым фактором прогноза устойчивости к ретровирусу BLV, а также возможными мишенями при разработке приемов ее по- вышения служат метаболические пути, связанные с активацией механизмов врожденного иммунитета и, в частности, экспрессии NK-lysin.
Итак, выполненные исследования дают основания для следующего заключения. Численность эритроцитов периферической крови у коров разного происхождения и из разных хозяйств может быть неодинаковой, но эти различия статистически достоверно отрицательно коррелируют со средним объемом эритроцита. У животных из разных хозяйств могут существенно различаться размеры популяции нейтрофилов, что сопровождается соответствующими различиями по экспрессии эффекторного фактора врожденного иммунитета — NK-lysin (чем меньше нейтрофилов, тем ниже экспрессия генов NK-lysin) . Несмотря на выраженные различия, в обоих обследованных хозяйствах инфицирование коров BLV реализуется на фоне уменьшения экспрессии NK-lysin по сравнению с таковой у особей, свободных от инфекции. Одним из биомаркеров воспалительных процессов служит увеличение числа тромбоцитов, и по этому показателю группы коров из разных хозяйств тоже могут существенно различаться. Однако у животных, инфицированных BLV, при сравнении со свободными от инфекции обнаруживается существенное увеличение популяции тромбоцитов, проявляющих антиапоптозную функцию, что, по-видимому, способно провоцировать неопластическую трансформацию клеток.
Авторы выражают глубокую благодарность к.б.н. Л.М. Федоровой за детальное обсуждение нашей работы и плодотворную дискуссию, оказавшую существенное влияние на анализ полученных нами результатов.
Список литературы Экспрессия генов NK-lysin, blvr, ifn-a и клеточные популяции периферической крови при инфицировании коров вирусом бычьего лейкоза
- Liu J., Cao X. Cellular and molecular regulation of innate inflammatory responses. Cellular and Molecular Immunology, 2016, 13: 711-721 ( ) DOI: 10.1038/cmi.2016.58
- Ott S.L., Johnson R., Wells S.J. Association between bovine-leukosis virus seroprevalence and herd-level productivity on US dairy farms. Prev. Vet. Med., 2003, 61: 249-262.
- Nishiike M., Haoka M., T., Kohda T., Mukamoto M. Development of a preliminary diagnostic measure for bovine leukosis in dairy cows using peripheral white blood cell and lymphocyte counts. J. Vet. Med. Sci., 2016, 78(7): 1145-1151 ( ) DOI: 10.1292/jvms.16-0022
- Ikebuchi R., Konnai S., Okagawa T., Nishimori A., Nakahara A., Murata S., Ohashi K. Differences in cellular function and viral protein expression between IgMhigh and IgMlow B-cells in bovine leukemia virus-infected cattle. J. Gen. Virol., 2014, 95(Pt 8): 1832-1842 ( ) DOI: 10.1099/vir.0.065011-0
- Florins A., de Brogniez A., Elemans M., Bouzar A.B., François C., Reichert M., Asquith B., Willems L. Viral expression directs the fate of B cells in bovine leukemia virus-infected sheep. J. Virol., 2012, 86(1): 621-624 ( ) DOI: 10.1128/JVI.05718-11
- Косовский Г.Ю., Глазко В.И., Ковальчук С.Н., Глазко Т.Т. Эритроцитарные и лейкоцитарный клеточные характеристики у коров, инфицированных Anaplasma marginale и вирусом бычьего лейкоза. Сельскохозяйственная биология, 2017, 52(2): 391-400 ( ) DOI: 10.15389/agrobiology.2017.2.391rus
- Chen J., Yang C., Tizioto P.C., Huang H., Lee M.O.K., Payne H.R., Lawhon S.D., Schroeder F., Taylor J.F., Womack J.E. Expression of the bovine NK-lysin gene family and activity against respiratory pathogens. PLoS ONE, 2016, 11(7): e0158882 ( ) DOI: 10.1371/journal.pone.0158882
- Lavanya M., Kinet S., Montel-Hagen A., Mongellaz C., Battini J.L., Sitbon M., Taylor N. Cell surface expression of the bovine leukemia virus-binding receptor on B and T lymphocytes is induced by receptor engagement. J. Immunol., 2008, 181(2): 891-898 ( ) DOI: 10.4049/jimmunol.181.2.891
- Boyette L.B., Macedo C., Hadi K., Elinoff B.D., Walters J.T., Ramaswami B., Chalasani G., Taboas J.M., Lakkis F.G., Metes D.M. Phenotype, function, and differentiation potential of human monocyte subsets. PLoS ONE, 2017, 12(4): e0176460 ( ) DOI: 10.1371/journal.pone.0176460
- Косовский Г.Ю., Сотникова Е.А., Мудрик Н.Н., Cuong V.C., Toan T.X., Hoan T.X., Глазко В.И. Диагностика лейкоза КРС с помощью праймеров к генам gag и pol. Ветеринария, 2013, 8: 58-61.
- Swenson C.L., Erskine R.J., Bartlett P.C. Impact of bovine leukemia virus infection on neutrophil and lymphocyte concentrations in dairy cattle. J. Am. Vet. Med. Assoc., 2013, 243(1): 131-135 ( ) DOI: 10.2460/javma.243.1.131
- Khudhair Y.I., Hasso S.A., Yaseen N.Y., Al-Shammari A.M. Serological and molecular detection of bovine leukemia virus in cattle in Iraq. Emerg. Microbes Infect., 2016, 5: e56 ( ) DOI: 10.1038/emi.2016.60
- Della Libera A.M.M.P., de Souza F.N., Batista C.F., Santos B.P., de Azevedo L.F.F, Sanchez E.M.R., Diniz S.A., Silva M.X., Haddad J.P., Blagitz M.G. Effects of bovine leukemia virus infection on milk neutrophil function and the milk lymphocyte profile. Vet. Res., 2015, 46: 2 ( ) DOI: 10.1186/s13567-014-0125-4
- Nishiike M., Haoka M., T., Kohda T., Mukamoto M. Development of a preliminary diagnostic measure for bovine leukosis in dairy cows using peripheral white blood cell and lymphocyte counts. J. Vet. Med. Sci., 2016, 78(7): 1145-1151 ( ) DOI: 10.1292/jvms.16-0022
- Moon J.H., Lim S., Jo K., Lee S., Seo S., Kim S. PINTnet: construction of condition-specific pathway interaction network by computing shortest paths on weighted PPI. BMC Syst. Biol., 2017, 11(Suppl 2): 15 ( ) DOI: 10.1186/s12918-017-0387-3
- Глазко В.И., Косовский Г.Ю., Ковальчук С.Н., Глазко Т.Т. Ассоциации инвертированного повтора (GAG)6С (ISSR-PCR маркеры) со структурными генами в геноме крупного рогатого скота. Вестник РАЕН, 2015, 1: 75-81.
- Rivera A., Siracusa M.C., Yap G.S., Gause W.C. Innate cell communication kick-starts pathogen-specific immunity. Nat. Immunol., 2016, 17(4): 356-363 ( ) DOI: 10.1038/ni.3375
- Gutiérrez G., Rodríguez S.M., de Brogniez A., Gillet N., Golime R., Bur-ny A., Jaworski J.P., Alvarez I., Vagnoni L., Trono K,. Willems L. Vaccination against d-retroviruses: the bovine leukemia virus paradigm. Viruses, 2014, 6(6): 2416-2427 ( ) DOI: 10.3390/v6062416
- Tuettenberg A., Hahn S.A., Mazur J., Gerhold-Ay A., Scholma J., Marg I., Ulges A., Satoh K., Bopp T., Joore J., Jonuleit H. Kinome profiling of regulatory T cells: a closer look into a complex intracellular network. PLoS ONE, 2016, 11(2): e0149193 ( ) DOI: 10.1371/journal.pone.0149193
- Suzuki S., Konnai S., Okagawa T., Ikebuchi R., Shirai T., Sunden Y., Mingala C.N., Murata S., Ohashi K. Expression analysis of Foxp3 in T cells from bovine leukemia virus infected cattle. Microbiol. Immunol., 2013, 57(8): 600-604 ( ) DOI: 10.1111/1348-0421.12073
- Suzuki S., Konnai S., Okagawa T., Ikebuchi R., Nishimori A., Kohara J., Mingala C.N., Murata S., Ohashi K. Increased expression of the regulatory T cell-associated marker CTLA-4 in bovine leukemia virus infection. Vet. Immunol. Immunopathol., 2015, 163(3-4): 115-124 ( ) DOI: 10.1016/j.vetimm.2014.10.006
- Ohira K., Nakahara A., Konnai S., Okagawa T., Nishimori A., Maekawa N., Ikebuchi R., Kohara J., Murata S., Ohashi K. Bovine leukemia virus reduces anti-viral cytokine activities and NK cytotoxicity by inducing TGF-β secretion from regulatory T cells. Immun. Inflamm. Dis., 2016, 4(1): 52-63 ( ) DOI: 10.1002/iid3.93
- Arainga M., Takeda E., Aida Y. Identification of bovine leukemia virus tax function associated with host cell transcription, signaling, stress response and immune response pathway by microarray-based gene expression analysis. BMC Genomics, 2012, 13: 121 ( ) DOI: 10.1186/1471-2164-13-121
- Aida Y., Murakami H., Takahashi M., Takeshima S.-N. Mechanisms of pathogenesis induced by bovine leukemia virus as a model for human T-cell leukemia virus. Front. Microbiol., 2013, 4: 328 ( ) DOI: 10.3389/fmicb.2013.00328
- Chang L.Y., Lin Y.C., Chiang J.M., Mahalingam J., Su S.H., Huang C.T., Chen W.T., Huang C.H., Jeng W.J., Chen Y.C., Lin S.M., Sheen I.S., Lin C.Y. Blockade of TNF-a signaling benefits cancer therapy by suppressing effector regulatory T cell expansion. Oncoimmunology, 2015, 4(10): e1040215.
- Pierini A, Strober W, Moffett C, Baker J, Nishikii H, Alvarez M, Pan Y, Schneidawind D, Meyer E, Negrin RS. TNF-a priming enhances CD4+FoxP3+ regulatory T-cell suppressive function in murine GVHD prevention and treatment. Blood, 2016, 128(6): 866-871 ( ) DOI: 10.1182/blood-2016-04-711275
- Riise R.E., Bernson E., Aurelius J., Martner A., Pesce S., Chiesa M.D., Marcenaro E., Bylund J., Hellstrand K., Moretta L., Moretta A., Thoren F.B. TLR-stimulated neutrophils instruct NK cells to trigger dendritic cell maturation and promote adaptive T cell responses. J. Immunol., 2015, 195: 1121-1128 ( ) DOI: 10.4049/jimmunol.1500709
- Amano K., Hirayama M., Azuma E., Iwamoto S., Keida Y., Komada Y. Neutrophils induced licensing of natural killer cells. Mediators of Inflammation, 2015, 2015: Article ID 747680 ( ) DOI: 10.1155/2015/747680
- Ueda R., Narumi K., Hashimoto H., Miyakawa R., Okusaka T., Aoki K. Interaction of natural killer cells with neutrophils exerts a significant antitumor immunity in hematopoietic stem cell transplantation recipients. Cancer Medicine, 2016, 5(1): 49-60 ( ) DOI: 10.1002/cam4.550
- Pieterse E., Rother N., Yanginlar C., Hilbrands L.B., van der Vlag J. Neutrophils discriminate between lipopolysaccharides of different bacterial sources and selectively release neutrophil extracellular traps. Front. Immunol., 2016, 7: 484 ( ) DOI: 10.3389/fimmu.2016.00484
- Tao S.C., Yuan T., Rui B.Y., Zhu Z.Z., Guo S.C., Zhang C.Q. Exosomes derived from human platelet-rich plasma prevent apoptosis induced by glucocorticoid-associated endoplasmic reticulum stress in rat osteonecrosis of the femoral head via the Akt/Bad/Bcl-2 signal pathway. Theranostics, 2017, 7(3): 733-750 ( ) DOI: 10.7150/thno.17450


