Экспрессия генов синтеза кадаверина в условиях супероксидного окислительного стресса
Автор: Ахова Анна Викторовна, Секацкая Полина Андреевна, Ткаченко Александр Георгиевич
Журнал: Вестник Пермского университета. Серия: Биология @vestnik-psu-bio
Рубрика: Микробиология
Статья в выпуске: 1, 2023 года.
Бесплатный доступ
Исследовано влияние редокс-циклирующего соединения метилвиологена, вызывающего продукцию супероксидных радикалов и развитие окислительного стресса в бактериальных клетках? на уровень экспрессии генов cadA и ldcC. Оценка генной экспрессии проведена с применением штаммов Escherichia coli, несущих репортерные генные слияния промоторов исследуемых генов со структурной частью гена lacZ, значения экспрессии выражены в единицах Миллера. Бактерии выращивали в условиях периодического культивирования в бульоне LB без перемешивания и с перемешиванием со скоростью 100 об/мин. Установлено, что воздействие метилвиологена, вызывающее индукцию гена nfo, входящего в состав soxRS-регулона защиты от супероксидного окислительного стресса (долговременное повышение экспрессии гена в 10 раз), приводило к незначительному и кратковременному повышению уровня экспрессии генов ldcC и cadA (максимально в 1.4 раза, не дольше 1 ч.). Усиление окислительного стресса за счет повышения аэрации/интенсивности перемешивания не влияло на уровень экспрессии генов ldcC и cadA. Метилвиологен в использованных дозах (1-100 мкг/мл) не оказывал влияния на количество колониеобразующих единиц в культуре. Таким образом, в условиях нелетального супероксидного стресса, вызванного воздействием метилвиологена, изменение уровня экспрессии генов ldcC и cadA незначительно, что существенным образом отличается от экспрессии генов, входящих в soxRS-регулон антиоксидантной защиты.
Паракват, супероксид, кадаверин, лизиндекарбоксилаза, метилвиологен
Короткий адрес: https://sciup.org/147239993
IDR: 147239993 | УДК: 579.222 | DOI: 10.17072/1994-9952-2023-1-51-57
Текст научной статьи Экспрессия генов синтеза кадаверина в условиях супероксидного окислительного стресса
1–3 Институт экологии и генетики микроорганизмов УрО РАН – филиал ПФИЦ УрО РАН, Пермь, Россия '■ ■ ,
Биогенные полиамины, представленные у бактерий, в основном, путресцином, кадаверином и спермидином, играют важную роль в их жизнедеятельности и, в том числе, при адаптации к воздействию неблагоприятных факторов среды. В частности, полиамины защищают макромолекулы бактериальной клетки от окислительного повреждения, связываясь с ними, и тем самым ограничивая доступ свободных радикалов, а также нейтрализуя активные формы кислорода при непосредственном взаимодействии [Rhee, Kim, Lee, 2007; Michael, 2016].
Показано, что повышение продукции полиаминов происходит в бактериальных клетках, подвергнутых окислительному стрессу, вызванному воздействием метилвиологена [Tkachenko, 2004]. Метилвиоло-ген (паракват) относится к группе виологенов, редокс-активных соединений, осуществляющих одноэлектронный перенос. Метилвиологен может функционировать как компонент окислительно-восстановительного цикла, получая электрон от восстановителя, часто НАД(Ф)Н, и отдавая его окислителю, кислороду, за счет чего формируется супероксидный анион. Таким образом, метилвиологен выступает в качестве генератора супероксида, одной из активных форм кислорода, в клетке.
Воздействие метилвиологена вызывает в бактериальной клетке активацию экспрессии группы генов, защищающих микроорганизм от окислительного повреждения и объединенных в soxRS -регулон [Seixas et al., 2022]. Регуляция экспрессии soxRS -регулона происходит в два этапа. Белок SoxR, окисляясь, переходит в активную форму и запускает экспрессию гена soxS , затем вновь синтезированный белок SoxS активирует экспрессию других генов, входящих в данный регулон [Nunoshiba et al., 1992; Wu, Weiss, 1992; Hidalgo et al., 1995; Ding, Demple, 2000]. Хотя механизм регуляции индукции данного регулона хорошо изучен, природа окисляющего фактора до сих пор является предметом для обсуждения. Поскольку индукция данного регулона происходит в ответ на воздействие редокс-циклирующих соединений, генерирующих супероксид, предполагалось, что супероксидный анион может выступать в качестве непосредственного окислителя SoxR [Liochev et al., 1999]. В дальнейшем было установлено, что воздействие редокс-циклирующих соединений может вызывать окисление SoxR и активировать экспрессию гена soxS в анаэробных условиях. Это позволило сделать вывод о том, что редокс-циклирующие соединения могут выступать в качестве прямых окислителей SoxR [Gu, Imlay, 2011]. Кроме того, переход окисленной формы SoxR в восстановленную происходит при участии редуктаз, использующих НАДФН в качестве источника электронов, поэтому сигналом для активации SoxR может являться исчерпание НАДФН в клетке, например, вследствие окисления его в процессе генерации супероксидных радикалов [Kobayashi, Tagawa, 1999; Krapp, Humbert, Carrillo, 2011].
В любом случае, каков бы ни был механизм, воздействие метилвиологена вызывает у бактерий окислительный стресс и активацию специфического защитного ответа – индукцию soxRS -регулона. Наряду с этим воздействие метилвиологена вызывает повышение активности лизиндекарбоксилаз и накопление продукта катализируемой ими реакции – кадаверина, который защищает бактерии от супероксидного стресса [Tkachenko, 2004; Felix et al., 2021]. Повышение активности лизиндекарбоксилаз может происходить как на уровне регуляции активности белка, так и за счет увеличения его количества в результате повышения генной экспрессии. В геноме Escherichia coli обнаружены два гена, кодирующие лизиндекарбоксилазы, ldcC и cadA [Yamamoto et al., 1997]. Интересно изучить, происходит ли активация генов синтеза кадаверина в ответ на супероксидный окислительный стресс, и могут ли эти гены быть членами soxRS -регулона.
Цель настоящей работы – исследовать уровень экспрессии генов ldcC и cadA в клетках E. coli , подвергнутых окислительному стрессу, вызванному воздействием метилвиологена.
Материалы и методы исследования
Объекты исследования и условия культивирования . Исследования проведены с использованием штаммов E. coli , несущих транскрипционные генные слияния. Штамм E. coli N9213 (GC4468, но nfo::lacZ Δmar rob::kan ) любезно предоставлен Р.Г. Мартином [Martin, Gillette, Rosner, 2000], штаммы E. coli SHT40 (GC4468, но ldcC::lacZ ) и E. coli SHT45 (GC4468, но cadA::lacZ ) из лабораторной коллекции [Akhova et al., 2021].
Бактерии, сохраняемые на скошенном агаре LB, переносили в 5 мл бульона LB в пробирках с ватномарлевыми пробками и культивировали без перемешивания при температуре 37ºС в течение 5-6 ч. Выращенные клетки переносили в колбы Эрленмейера объемом 250 мл с ватно-марлевыми пробками, содержащие 50 мл бульона LB, и культивировали при 37ºС в течение 14-16 ч. Затем бактериальную культуру разводили в свежей питательной среде до ОП 600 =0.1 и культивировали в описанных выше условиях. По достижении бактериальной культурой ОП 600 =0.3 вносили метилвиологен дихлорид гидрат (Aldrich, Германия).
Определение уровня генной экспрессии проводили с применением репортерных генных слияний промотора исследуемого гена и структурной части гена lacZ , кодирующего β-галактозидазу, по методу, описанному Дж. Миллером [Miller, 1972]. Для выделения фермента клетки обрабатывали додецилсульфатом натрия и хлороформом. В качестве субстрата реакции использовали о -нитрофенил-β-D-галактопиранозид.
Оценку плотности бактериальной культуры проводили, измеряя ее оптическую плотность на длине волны 600 нм (ОП 600 ) с использованием спектрофотометра UV1280 (Shimadzu, Япония).
Определение количества колониеобразующих единиц (КОЕ) проводили путем высева последовательных десятикратных разведений культуры в физрастворе на поверхность агара LB в чашках Петри. Количество образовавшихся колоний подсчитывали после инкубации при температуре 37ºС в течение 16-18 ч.
Статистическую обработку данных осуществляли с использованием пакета программ Statistica 6.0 (StatSoft Inc., США). На рисунках представлены средние значения и стандартное отклонение, рассчитанные на основе результатов не менее трех отдельных экспериментов.
Результаты и их обсуждение
С применением метода генных слияний изучено влияние метилвиологена на уровень экспрессии генов, кодирующих ферменты, катализирующие синтез кадаверина в результате декарбоксилирования лизина, ldcC и cadA .
Окислительный стресс в клетках бактерий моделировали добавкой метилвиологена в концентрации 1-100 мкг/мл при культивировании их, в основном, в условиях микроаэрации (без перемешивания). Ме-тилвиологен в указанных концентрациях не оказывал значительного влияния на скорость роста бактериальной культуры (рис. 1а) и количество колониеобразующих единиц (данные не показаны).
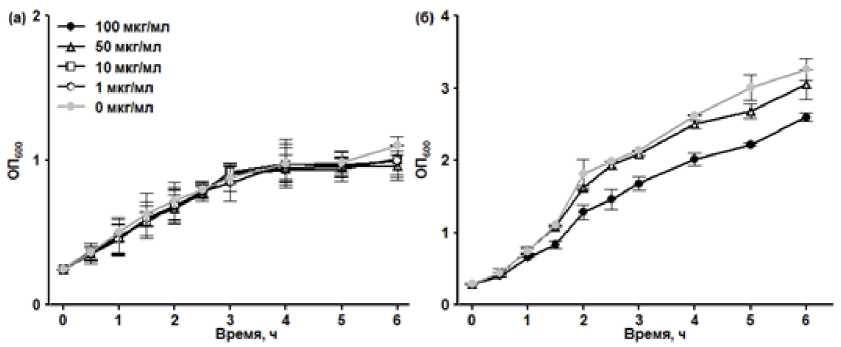
Рис. 1. Влияние метилвиологена (мкг/мл) на рост культуры E. coli , выращиваемой без перемешивания (а) и при перемешивании со скоростью 100 об/мин (б). Метилвиологен добавлен в 0 ч.
[Effect of methyl viologen (µg/mL) on the growth (OD 600 ) of Escherichia coli cultivated without agitation (а) and with agitation at 100 r.p.m. (б). Methyl viologen was added at 0 h. Here and below, the data are presented as mean and standard deviation]
Для подтверждения способности метилвиологена в условиях проводимых экспериментов вызывать окислительный стресс и индукцию soxRS -регулона была дана оценка его влияния на уровень экспрессии гена nfo . Данный ген кодирует эндонуклеазу IV, участвующую в репарации ДНК. Метилвиологен вызывал увеличение экспрессии гена nfo в 2 раза уже через 15 мин. после добавки. Максимального значения уровень экспрессии гена достигал через 1.5 ч. после внесения метилвиологена и в 10 раз превышал уровень экспрессии в клетках контрольной культуры, не подвергнутой воздействию оксиданта (рис. 2).
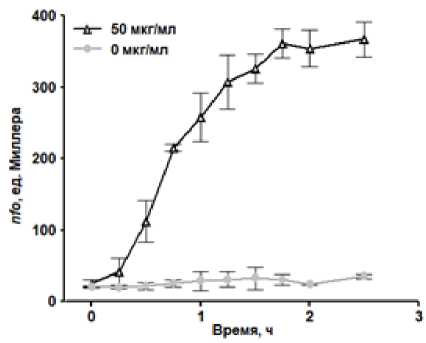
Рис. 2. Влияние 50 мкг/мл метилвиологена на уровень экспрессии гена nfo в клетках E. coli , выращиваемых без перемешивания. Метилвиологен добавлен в 0 ч.
[Effect of 50 µg/mL methyl viologen on the expression of the nfo gene in E. coli cells grown without agitation.
-
Methyl viologen was added at 0 h.]
Воздействие метилвиологена практически не оказывало влияния на профиль экспрессии генов ldcC и cadA (рис. 3). Наблюдалось незначительное кратковременное увеличение уровня экспрессии гена ldcC на второй час после добавки метилвиологена и гена cadA на первый час стрессового воздействия. Максимальный уровень увеличения экспрессии составил 40% (увеличение в 1.4 раза). Более того, на последующих этапах культивирования уровень экспрессии гена cadA в клетках, подвергнутых воздействию ме-тилвиологена, был ниже по сравнению с контролем (вне зависимости от концентрации оксиданта).
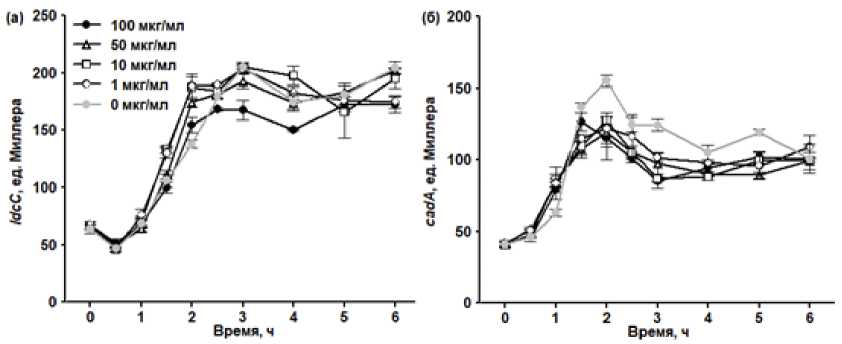
Рис. 3. Влияние метилвиологена (мкг/мл) на уровень экспрессии гена ldcC (а) и гена cadA (б) в клетках E. coli , выращиваемых без перемешивания. Метилвиологен добавлен в 0 ч.
[Effect of methyl viologen (µg/mL) on the expression of the ldcC (а) and cadA (б) genes in E. coli cells grown without agitation. Methyl viologen was added at 0 h.]
Усиление аэрации за счет повышения интенсивности перемешивания усиливало действие метилвио-логена, в частности, добавка 100 мкг/мл данного вещества вызывала снижение скорости роста культуры (см. рис 1б). Тем не менее, усиление окислительного стресса при повышении интенсивности перемешивания не сопровождалось увеличением уровня экспрессии гена cadA и приводило к снижению уровня экспрессии гена ldcC (рис. 4).
Ранее было показано, что в клетках Vibrio vulnificus, подвергнутых действию метилвиологена в концентрации 1-6 мМ (≈ 257-1 543 мкг/мл), повышается лизиндекарбоксилазная активность и транскрипция гена cadA, а в качестве основного транскрипционного регулятора в этих условиях выступает SoxR (гомолога SoxS у данного микроорганизма не обнаружено) [Kim, Choi, Lee, 2006].
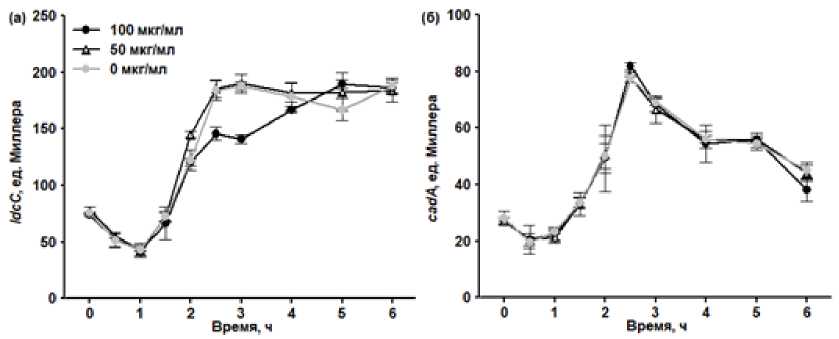
Рис. 4. Влияние метилвиологена (мкг/мл) на уровень экспрессии гена ldcC (а) и гена cadA (б) в клетках E. coli , выращиваемых c перемешиванием со скоростью 100 об/мин. Метилвиологен добавлен в 0 ч.
[Effect of methyl viologen (µg/mL) on the expression of the ldcC (а) and cadA (б) genes in E. coli cells grown with agitation at 100 r.p.m. Methyl viologen was added at 0 h.]
Полученные нами данные свидетельствуют в пользу того, что в условиях окислительного стресса, вызванного редокс-циклирующим агентом метилвиологеном, вклад повышения уровня транскрипции генов, кодирующих лизиндекарбоксилазы, в общее увеличение лизиндекарбоксилазной активности клеток E. coli и накопление кадаверина незначителен. Сравнение изменения профилей экспрессии генов cadA / ldcC и гена nfo , входящего в soxRS -регулон, в ответ на воздействие метилвиологена демонстрирует малую вероятность того, что механизмы регуляции экспрессии данных генов одинаковы.
Следует отметить, что полученные выводы распространяются лишь на случаи воздействия, вызывающие окислительный стресс, но не сопровождающиеся гибелью бактериальных клеток. Возможно, в других экспериментальных условиях воздействие метилвиологена будет оказывать более значительное влияние на экспрессию генов синтеза кадаверина.
Заключение
Таким образом, воздействие генератора супероксидных радикалов метилвиологена вызывает в клетках E. coli незначительное кратковременное увеличение транскрипции генов ldcC и cadA . Изменение профиля экспрессии генов синтеза кадаверина в ответ на супероксидный окислительный стресс значительно отличается от изменения экспрессии гена nfo , входящего в регулон под контролем регуляторов SoxR и SoxS.


