Экспрессия и очистка четвертого меланокортинового рецептора
Автор: Южакова А.И., Горделий В.И.
Журнал: Труды Московского физико-технического института @trudy-mipt
Рубрика: Биология и медицина
Статья в выпуске: 2 (38) т.10, 2018 года.
Бесплатный доступ
Основной функцией четвёртого меланокортинового рецептора человека (MC4R) является регуляция пищевого поведения. Здесь мы описываем способ получения MC4R в необходимых для кристаллизации количествах. Показана экспрессия белка в клетках кишечной палочки и его очистка с помощью аффинной и гель-фильтрационной хроматографии. Очищенный белок был ренатурирован при помощи неопентил-гликоля (NG310). Также приводится анализ функциональности полученного белка при помощи экспериментов по связыванию лиганда.
Семиспиральные рецепторы, меланокортиновый рецептор, гетерологичная экспрессия
Короткий адрес: https://sciup.org/142215036
IDR: 142215036 | УДК: 577.112.083
Текст научной статьи Экспрессия и очистка четвертого меланокортинового рецептора
Четвертый меланокортиновый рецептор человека (MC4R) входит в семейство семи-спиральных трансмембранных рецепторов, сопряженных с G-белком, и является частью меланокортиновой системы, регулирующей широкий ряд функций в организме. В организме человека, меланокортиновая система, представлена, пятью родственными рецепторами, а-, 3- и у-меланоцитстимулирующими гормонами и адренокортикотропным гормоном, двумя эндогенными антагонистами (Agouty и agouty related protein), а. также двумя вспомогательными белками (махагони и синдекан-3) [1]. Меланокортиновые рецепторы вовлечены в регуляцию широкого ряда, физиологических функций организма, и экспрессируются в различных тканях: они участвуют в регуляции пигментации, выработке гормонов надпочечников, модулировании иммунного ответа, метаболизма, липидов, пищевого поведения и в других процессах. Из-за. их заметной регуляторной роли в перечисленных процессах они рассматриваются в качестве лекарственных мишеней.
Преимущественно MC4R экспрессируется в клетках мозга, где основной его функцией является регуляция потребления и расхода, энергии. Помимо поддержания энергетического
гомеостаза, он также влияет на половое поведение и воспалительные процессы [2]. К настоящему моменту описано более 150 различных мутаций шс4г, расположенных в различных участках гена, часть из которых является причиной моногенного ожирения [3].
Для коррекции функционирования мутантного белка широко применяют различные синтетические лиганды, взаимодействующие с белком и влияющие на его работу. Однако в случае с MC4R подобных лекарственных препаратов, которые бы успешно дошли до клинического применения, до сих пор не найдено. Причиной могут быть многочисленные побочные эффекты, наблюдаемые при испытаниях потенциально эффективных препаратов [4].
Для более эффективного дизайна лекарственных препаратов необходимо понимание точного механизма взаимодействия рецептора с лигандами. В настоящее время известны только частичные структуры MC4R, а именно: ЯМР-структуры второй трансмембранной спирали белка дикого типа и мутанта [5]. В отсутствие кристаллографических структур высокого разрешения разработка лекарств ведется на основании сравнительного моделирования и анализа влияния направленного мутагенеза на функции белка. Получение кристаллографической структуры белка с высоким разрешением становится очень важным для фундаментального понимания работы рецептора и более успешной разработки лекарств.
Основной сложностью структурных исследований рецепторов, сопряженных с G-белком, является получение необходимого количества стабильного и функционального препарата рецептора. Многие мембранные белки вне мембранного окружения теряют свою стабильность, что приводит к уменьшению количества выделяемого препарата, препятствует кристаллизации и получению структуры высокого разрешения. Далее описан способ получения MC4R в необходимых для кристаллизации количествах. Также приведён анализ функциональной активности полученного препарата белка.
2. Результаты
2.1. Создание генетических конструкций и экспрессия белка
2.2. Очистка белка
Так как получение кристаллов хорошего качества зачастую оказывается весьма сложным, для более эффективного поиска подходящих условий требуется большое количество белка. Также одним из наиболее важных требований, предъявляемых к образцу для кристаллизационных тестов, является гомогенность.
При производстве белков в кишечной палочке возможно достичь высоких уровней экспрессии. Работа с кишечной палочкой относительно проста и позволяет получить большую клеточную массу за короткий срок. Другим достоинством кишечной палочки является отсутствие большинства посттрансляционных модификаций, что особенно важно для кристаллизации.
Поскольку эффективность экспрессии чужеродной ДНК в клетках кишечной палочки может сильно зависеть от состава кодонов и вторичной структуры мРНК [6], фрагмент ДНК-, кодирующий MC4R, был синтезирован таким образом, что неоптимальные для экспрессии в кишечной палочке кодоны были заменены на оптимальные, а на основании вторичной структуры мРНК были выбраны варианты синтетического гена, содержащие наименьшее количество «шпилек». Для последующей очистки с помощью аффинной хроматографии в плазмидную конструкцию к С-концу белка был добавлен участок ДНК, кодирующий б гистидиновых остатков.
Из-за природы мембранных белков для их выделения из мембранного окружения и удержания в растворенном виде часто используют детергенты для их солюбилизации. Так как используемый детергент существенно влияет на стабильность белка и степень его очистки, предварительно были проведены солюбилизационные тесты в малом объеме. Первоочередной целью было получение достаточного количества белка в пересчете на литр культуры, и по результатам сравнительных тестов для последующих очисток в большом объеме был выбран фос-холин 12 (ҒС12). В результате был достигнут стабильный выход MC4R (порядка б мг) из литра бактериальной культуры.
Однако экспериментальные данные свидетельствуют о том, что фос-холин является «жестким» детергентом и может ингибировать связывание белка с лигандом [7]. Поэтому для очисток в больших объемах также были выбраны детергенты DDM и Brij35, экстрагирующие существенно меньшую часть белка из мембран.
Общая последовательность очистки заключалась в следующем: клетки с экспрессированным белком подвергались механическому разрушению при помощи гомогенизатора высокого давления, после чего мембранная часть осаждалась центрифугированием; мембраны ресуспендировались в буфере с добавлением детергента в течение 16-ти часов, после чего нерастворенный остаток удалялся центрифугированием; надосадочная жидкость связывалась с металл-аффинным носителем, который подвергался последующей промывке. Затем белок элюировался и концентрировался для дальнейшей очистки при помощи гель-фильтрации.
В табл. 1 приведено сравнение эффективностей очистки для указанных детергентов.
2.3. Проверка фупкуиоиалъиости белка, очищеппого при помощи фос-холииа
2.4. Репатурация белка
Таблица!
|
Использованный детергент |
мкг из литра культуры |
|
FC12 |
>5000 |
|
DDM |
60 |
|
Brij |
<180 |
Таким образом, типичный выход белка в случае с фос-холином составил порядка нескольких (5-6) мг из литра бактериальной культуры. В случае DDM и Brij выход белка получился крайне низким, при этом белок агрегировал в процессе гель-фильтрации.
Наличие белка в анализируемых фракциях, а также чистота препарата оценивалась при помощи акрил-амидного гель-электрофореза и иммуноблоттинга. Для более точного измерения концентрации белка проводились спектрофотометрические измерения гельфильтрационных фракций.
Одной из функций MC4R является его способность к связыванию с лигандами. Эффективным способом проверки связывания белка с лигандом является метод микротермофореза, основанный на анализе термодиффузии в микрообъемах [8]. Для функциональных тестов был выбран HS014 - синтетический аналог а- меланоцитстимулирующего гормона [9]. MC4R, солюбилизированный в фос-холине и окрашенный флуоресцентным красителем AlexaFluor 647, был объединен с лигандом в различных концентрациях, измерения проводились при помощи MonolithNT115. В качестве отрицательного контроля был использован белок, денатурированный додецилсульфатом натрия (SDS) перед связыванием с лигандом. На рис. 1 представлены результаты измерений. Соотношение сигнала к шуму в полученных зависимостях флуоресценции от концентрации лиганда не позволяет сделать вывод о функциональности белка, очищенного при помощи фос-холина.
Поскольку белок, очищенный при помощи фос-холина, не связывал лиганд достаточно эффективно в проведенных экспериментах, мы попытались изменить протокол очистки для получения препарата с большей активностью. Во многих случаях при выделении мембранных белков при помощи детергентов первые теряют свои нативные свойства, подвергаются денатурации и агрегируют, что делает невозможным их дальнейшее исследование. В некоторых случаях удается сохранить часть белка, подобрав условия очистки и стабилизируя его дополнительными соединениями или ренатурируя его в другом детергенте. В данной работе для ренатурации белка был использован детергент неопентил-гликоль (NG310), который может стабилизировать некоторые мембранные белки [10].
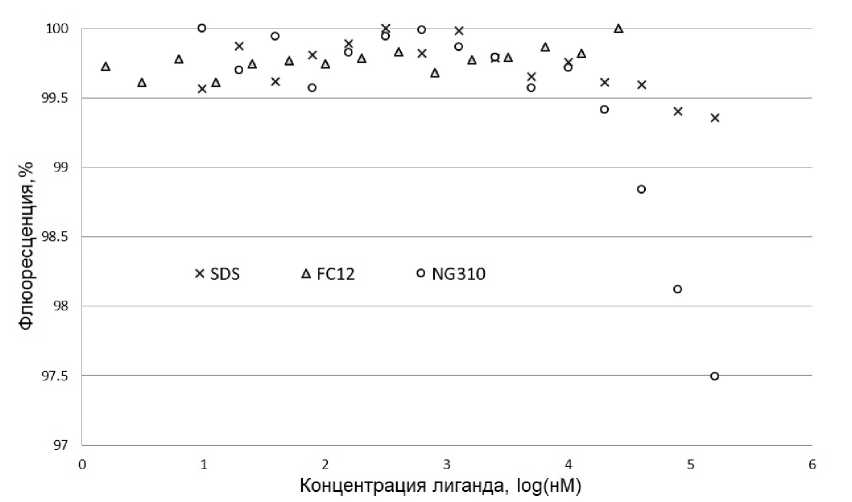
Рис. 1. Зависимость флюоресценции от концентрации лиганда, при термодиффузии MC4R в присутствии HS014. Белок, денатурированный в SDS, и белок, очищенный в ҒС12, имеют схожие зависимости флуоресценции от концентрации лиганда, с незначительным соотношением сигнала, к шуму на. всем диапазоне концентраций. Значения флуоресценции нормализованы
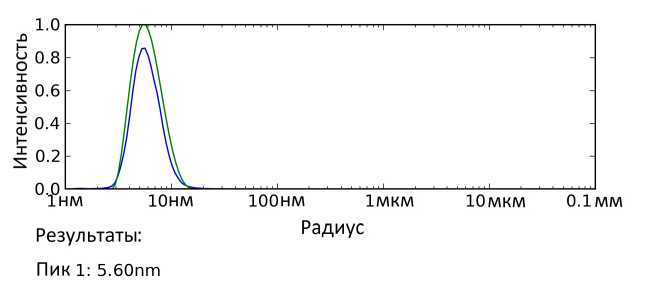
Сначала, последовательность очистки осталась такой же по сравнению с очисткой с фос-холином. Как было выяснено при помощи иммуноблоттинга надосадочной жидкости мембран, солюбилизированных в NG310, неопентил-гликоль сам по себе оказался крайне неэффективным для солюбилизации MC4R непосредственно из липидных мембран Е. coll. Поэтому для повышения эффективности очистки мембраны были солюбилизированы сначала в фос-холине, а перевод белка в другой детергент происходил на последующих этапах очистки. Белок солюбилизировали и связывали с NiNTA-сефарозой в буфере с фос-холином, который затем заменяли на. NG310. Результаты эксклюзионной хроматографии образца после аффинной очистки, иммуноблоттинг гель-фильтрационных фракций и ДРС-анализ показаны на рис. 2.
Таким образом, по результатам гель-фильтрации видно, что образец, элюированный с NiNTA-сефарозы, частично агрегировал (8-11 мл), однако часть белка оставалась гомогенной (11, 5-13 мл). Образец, взятый из этих фракций, показал единичный пик (метод ДРС). Характерный выход белка, для такой очистки составил около 3 мг из литра, бактериальной культуры, однако эффективность варьировалась от случая к случаю из-за частичной агрегации белка на металл-аффинном носителе. Эффективность очистки с неопентилом по сравнению с очисткой при помощи фос-холина упала примерно в 2 раза, однако количества, белка, которое получалось таким образом, достаточно для кристаллографических целей.
2.5. Проверка функциональности ренатурированного белка
Функциональные тесты с MC4R, очищенным в NG310, проводились как описано выше. На рис. 1 показаны кривые зависимости интенсивности флюоресценции в зависимости от концентрации лиганда.
Полученные в эксперименте с ренатурированным белком кривые имеют вид типичных сигмоидальных кривых связывания белка с лигандом. С помощью полученных данных невозможно было рассчитать константу диссоциации, поскольку в эксперименте насыщение не было достигнуто, однако полученные зависимости позволяют говорить о связывании ренатурированного белка с лигандом.
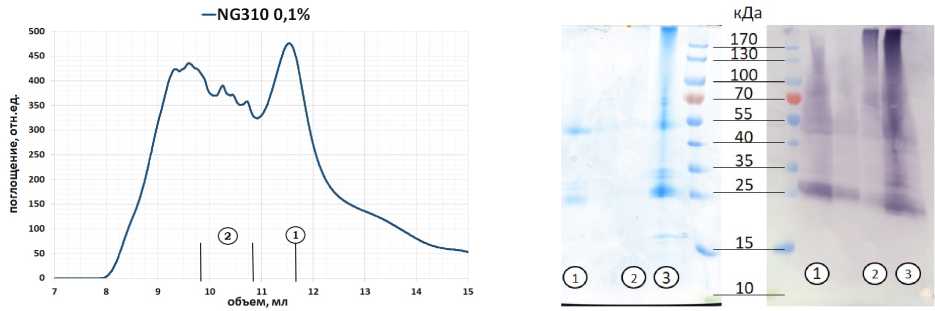
в)
Рис. 2. Результаты (а) - гель-фильтрации препарата на колонке Superdex200i, (б) - анализа фракций после металл-афинной хроматографии и гельфильтрации при помощи иммуноблоттинга и белкового гель-электрофореза (в) - динамического рассеяния света образца, распределение интенсивности света по размеру частиц. 1 - образец гельфильтрационных фракций с 11,5 по 11,75 мл; 2 - образец остаточных агрегатов; 3 - образец белка, элюированного с металл-аффинного носителя
-
3. Выводы
Был предложен способ выделения MC4R из мембран Е. coU. В зависимости от детергента, используемого для солюбилизации, выход белка варьировался от десятков микрограмм до нескольких миллиграмм из литра культуры. При очистке при помощи фос-холина выход белка составил около 6 миллиграмм из литра культуры, однако эксперименты по связыванию белка с лигандом подтвердили предположение о том, что фос-холин ингибирует активность MC4R при данном способе очистки.
Способ получения белка, основанный на ренатурирации в неопентил-гликоле, позволяет получить до 3 мг из литра бактериальной культуры. Это существенно меньше по сравнению с очисткой при помощи фос-холина, однако этого количества достаточно для кристаллизационных тестов. Сложно привести сравнение эффективности полученных протоколов с опытом других исследователей, поскольку в литературе описаны способы получения полноразмерного белка из клеток млекопитающих, и, так как исследователи не ставили перед собой целей повышения эффективности экспрессии, выходы белка остаются неуказанными. В исследованиях по получению ЯМР-структуры второй трансмембранной спирали MC4R при экспрессии белка в кишечной палочке и очистке с помощью гуанидин гидрохлорида, выход белка составил 200 мг на литр бактериальной культуры. Этот результат является показателем высокоэффективной очистки [11]. Однако напрямую сравнивать полученные в данной работе результаты нельзя, поскольку эффективность экспрессии полноразмерного белка и его фрагмента могут не коррелировать. Что касается родственных белков, полноразмерных рецепторов, сопряженных с G-белком, примером может быть человеческий Б-2 адренорецептор, полученный в бакуловирусной системе экспрессии клеточной линии Sf9, эффективность данной системы составляла порядка 1мг на 1 литр клеточной культуры [12].
Способность MC4R связываться со специфическим лигандом HS014 была показана при помощи метода термодиффузии в микрообъемах. В условиях нашего эксперимента кривые связывания белка с лигандом не вышли на насыщение. Однако порядок полумаксимальной эффективной концентрации можно оценить в 60-300 мкМ. Разница между наблюдаемыми в эксперименте и описанными в литературе значениями связана с отличиями в дизайне эксперимента и разницей в условиях его проведения [9,13].
Таким образом, здесь представлен протокол получения функционально активного MC4R и показана его способность связывать лиганд. Результаты данной работы позволят продолжить подготовку препарата к дальнейшей кристаллизации и определению его атомарной структуры.
Список литературы Экспрессия и очистка четвертого меланокортинового рецептора
- Gantz I., Fong T.M. The melanocortin system//AJP-Endocrynology. 2003. V. 284. P. E468-E474.
- Breit A. . Alternative G protein coupling and biased agonism: New insights into melanocortin-4 receptor signalling//Molecular and Cellular Endocrinology. 2011. V. 331. P. 232-240.
- Yang Y., Chen M., Loux T. . Molecular Mechanism of the Intracellular Segments of the Melanocortin-4 Receptor for NDP-MSH Signaling//Biochemistry. 2005. V. 44. N 18. P. 6971-6979.
- Progress in Molecular Biology and Translational Science. V. 88. G Protein-Coupled Receptors in Health and Disease, Part A//Chapter 6 Mutations in Melanocortin-4 Receptor and Human Obesity/ed. by Tao Y. Elsevier, 2009.
- Yun J., Kim M., Kim K. . Solution structure of the transmembrane 2 domain of the human melanocortin-4 receptor in sodium dodecyl sulfate (SDS) micelles and the functional implication of the D90N mutant//Biochimica et Biophysica Acta. 2015. V. 1484. P. 1294-1302.
- Boel G. . Codon influence on protein expression in E. coli correlates with mRNA levels//Nature. 2016. V. 529. P. 358-363.
- Reithmeier R. Structural biology of membrane proteins//Methods. 2007. V. 41, I. 4. P. 353-364.
- Gudim I., Lofstad M., Hammerstad M. . Measurement of FNR-NrdI Interaction by Microscale Thermophoresis (MST)//Bio-Protocol. 2017. V.7, I. 8.
- Schioeth H.B. . Discovery of novel melanocortin4 receptor selective MSH analogues//British journal of pharmacology. 1998. V. 124, I. 1. P. 75-82.
- Chae P., Rasmussen R., Rana R. . Maltose-neopentyl glycol (MNG) amphiphiles for solubilization, stabilization and crystallization of membrane proteins//Nature Methods. 2010. V. 7, I. 12, P. 1003-1008.
- Park T., Choi S., Gang G. . High-level expression and purification of the second transmembrane domain of wild-type and mutant human melanocortin-4 receptor for solid-state NMR structural studies//Protein expression and purification. 2008. V. 62, I. 2. P. 139-145.
- Kobilka B.K. . Use of fluorescence spectroscopy to study conformational changes in the beta 2-adrenoceptor//Methods Enzymol. 2002. V. 343. P. 170-182.
- Yang Y., Chen M., Lai Y. . Molecular determination of agouti-related protein binding to human melanocortin-4 receptor//Molecular pharmacology. 2003. V. 64, I. 1. P. 94-103.


