Экспрессия Lag-3 на В-лимфоцитах как маркер прогноза ответа на терапию у больных хроническим лимфолейкозом
Автор: Селютина О.Н., Лысенко И.Б., Гуськова Н.К., Новикова И.А., Златник Е.Ю., Пушкарева Т.Ф., Николаева Н.В., Камаева И.А., Саманева Н.Ю., Капуза Е.А.
Журнал: Сибирский онкологический журнал @siboncoj
Рубрика: Клинические исследования
Статья в выпуске: 2 т.22, 2023 года.
Бесплатный доступ
Цель исследования - изучить уровень экспрессии LAG-3 на В-лимфоцитах и возможность его применения в качестве маркера прогноза ответа на терапию у больных хроническим лимфолейкозом (ХЛЛ). материал и методы. В исследование включены 40 больных с впервые установленным диагнозом ХЛЛ. Пациенты были разделены на две группы: I - ХЛЛ стадии A по Binet, которым не требовалось проведение терапии, II - ХЛЛ стадии С, которым проводилась иммунохимиотерапия в режимах RB и FCR. В зависимости от схемы лечения и гематологического ответа больных на терапию выделены 4 подгруппы: IIА-RB, IIА-FCR, IIБ-RB, IIБ-FCR. В контрольную группу, сопоставимую по возрасту и полу, вошли 20 человек без злокачественных заболеваний. Исходно во всех группах методом проточной цитофлюориметрии определены иммунофенотип и уровень В-лимфоцитов, экспрессия LAG-3, а также минимальная остаточная болезнь в группе II после 6-го курса иммунохимиотерапии. Данные оценены в программе Statistica 13.0. Результаты. Во всех группах больных ХЛЛ до лечения обнаружена экспрессия LAG-3 на В-лимфоцитах в отличие от контрольной группы. Более высокий уровень экспрессии отмечен у больных ХЛЛ стадии С по Binet по сравнению с пациентами с ХЛЛ стадии А. Данные демонстрируют отличия в уровне экспрессии LAG-3 у больных с разным ответом на проводимую терапию. Так, исходно более высокий уровень экспрессии LAG-3 на В-лимфоцитах наблюдается у больных ХЛЛ стадии С по Binet с неудовлетворительным ответом на терапию. Установлено, что при уровне экспрессии LAG-3 на В-лимфоцитах в пределах 14,57 ± 0,66 % можно предполагать хороший гематологический ответ независимо от схемы проводимой терапии, а при значениях 41,95 ± 1,62 % - неудовлетворительный ответ на лечение. заключение. Исходный уровень экспрессии LAG-3 на B-лимфоцитах у больных хроническим лимфолейкозом может быть использован в качестве маркера для прогнозирования и мониторинга ответа на лечение независимо от используемого режима иммунохимиотерапии.
Хронический лимфолейкоз, проточная цитофлуориметрия, lag-3, минимальная остаточная болезнь, иммунофенотипические прогностические маркеры, иммунохимиотерапия
Короткий адрес: https://sciup.org/140300163
IDR: 140300163 | УДК: 616.155.392.2-08-037 | DOI: 10.21294/1814-4861-2023-22-2-34-42
Текст научной статьи Экспрессия Lag-3 на В-лимфоцитах как маркер прогноза ответа на терапию у больных хроническим лимфолейкозом
Хронический лимфолейкоз (ХЛЛ) представляет собой В-клеточное лимфопролиферативное заболевание, характеризующееся накоплением в периферической крови, костном мозге, селезенке и других лимфоидных тканях небольших, зрелых опухолевых моноклональных лимфоидных клеток с иммунофенотипом В-лимфоцитов поздних стадий дифференцировки [1, 2]. Для опухолевых моноклональных В-лимфоцитов при ХЛЛ характерны: яркая экспрессия CD19, CD5, CD23, CD43; слабая экспрессия CD20 и CD22 и отсутствие экспрессии FMC7 [3–6]. ХЛЛ относят к чрезвычайно гетерогенным заболеваниям, течение которого может варьировать от индолентного, не проявляющего себя в течение ряда лет, до агрессивного, требующего незамедлительного начала терапии [7]. Одной из основных задач на момент установления диагноза и до начала лечения является поиск маркеров ответа больных на проводимую терапию и оценки риска прогрессирования заболевания [8, 9].
К наиболее известным прогностическим биомаркерам ХЛЛ относят время удвоения лимфоци- тов, уровень бета-2 микроглобулина, экспрессию CD38, ZAP-70, статус мутации гена тяжелой цепи иммуноглобулина (IgHV) и другие генетические аномалии [10–12]. Используют также международный прогностический индекс (ХЛЛ ‒ IPI), включающий 5 параметров: делеция/мутация 17p/ TP53; статус IgVH; уровень β2-микроглобулина сыворотки крови; возраст; стадию по Binet или Rai. С учетом этих показателей выделяют 4 группы риска: низкую, промежуточную, высокую и очень высокую [13]. Вместе с тем, системы стадирова-ния Rai и Binet не могут выступать единственным критерием прогноза. ПЦР, секвенирование или вестерн-блоттинг, используемые для выявления мутаций и делеций, остаются дорогостоящими, трудозатратными, длительными по времени выполнения методами, имеющими также целый ряд ограничений.
Стандартом терапии первой линии у больных ХЛЛ моложе 65–70 лет с хорошим соматическим статусом является режим FCR (флударабин-циклофосфамид-ритуксимаб) [14]. При невозможности проведения режима FCR альтернативным вариантом первой линии терапии может быть режим BR – комбинация бендамустина и ритук-симаба [15, 16].
Важнейшим этапом в оценке эффекта после завершения иммунохимиотерапии является количественная оценка минимальной остаточной болезни (МОБ). Минимальная остаточная болезнь – чувствительный и высокопрогностический суррогатный параметр ответа на терапию при хроническом лимфолейкозе, который позволяет прогнозировать выживаемость без прогрессирования и общую выживаемость за более короткий срок по сравнению с клиническим наблюдением [17]. Продемонстрировано, что МОБ является полезным маркером ответа на терапию, поскольку химиотерапия в сочетании с моноклональным антителом против CD20 ритуксимаб способны достигать необна-руживаемой MОБ при ХЛЛ [18–21]. Достижение МОБ-отрицательной полной ремиссии является независимым прогностическим фактором длительной выживаемости без прогрессирования и общей выживаемости. Остаточная популяция клеток ХЛЛ в крови <0,01 % свидетельствует о высокой вероятности длительной ремиссии более 5 лет; МОБ 0,01–0,90 % характеризует группу пациентов с медианой выживаемости без прогрессирования около 3 лет, что позволяет рассматривать возможность поддерживающей терапии; МОБ>1 % предвещает ранний рецидив и может служить основанием для смены терапии [22]. Эти данные указывают на необходимость поиска маркеров, позволяющих прогнозировать течение опухолевого процесса и ответ на терапию при мониторинге МОБ.
В современных условиях активно и всесторонне изучаются роль иммунных контрольных точек (ИКТ) в патогенезе хронического лимфолейкоза и возможности их использования в качестве прогностических маркеров. Наибольший интерес с этой точки зрения представляет белок LAG-3 (lymphocyte‐activation gene 3) или CD223, являющийся ингибирующим рецептором, впервые описанным в активированных in vitro Т-клетках [23]. Показано, что при ХЛЛ высокие уровни поверхностного и растворимого LAG-3 на опухолевых лимфоцитах связаны с более короткой медианой времени от постановки диагноза до начала первого лечения [24]. Установлена также корреляция повышенного уровня экспрессии LAG-3 на В-лимфоцитах с немутированным статусом вариабельной области тяжелой цепи иммуноглобулина (UM-IGHV) и сниженной выживаемостью до прогрессирования у пациентов с ХЛЛ [25].
В этой связи изучение уровня экспрессии LAG-3 на лимфоцитах периферической крови во взаимосвязи с ответом больных ХЛЛ на проводимую противоопухолевую терапию при мониторинге МОБ, на наш взгляд, является перспективным для установления возможности его применения в качестве маркера прогноза.
Цель исследования ‒ изучить уровень экспрессии LAG-3 на В-лимфоцитах и возможность его применения в качестве маркера прогноза ответа на терапию у больных хроническим лимфолейкозом.
Материал и методы
В исследование включены 40 больных с впервые установленным диагнозом хронический лим-фолейкоз (24 мужчины, 16 женщин), находящихся под наблюдением в НМИЦ онкологии в период с 2019 по 2022 г. Средний возраст пациентов составил 66,8 ± 2,3 года. Больные разделены на 2 группы: группа I (n=10) – пациенты с ХЛЛ стадии A по J. Binet, которым не требовалось проведение специфической терапии; группа II (n=30) – пациенты с ХЛЛ стадии С по J. Binet, которым планировали проведение иммунохимиотерапии в двух режимах: 6 курсов по схеме RB (Ритуксимаб – 1 цикл: 375 мг/м2, внутривенно капельно, в 1-й день, последующие циклы: 500 мг/м2, внутривенно капельно или 1600 мг, подкожно, в 1-й день. Бендамустин – 90 мг/м2, внутривенно капельно, в 1, 2-й дни) или 6 курсов по схеме FCR (Ритуксимаб – 1 цикл: 375 мг/м2, внутривенно капельно, в 1-й день, последующие циклы: 500 мг/м2, внутривенно капельно или 1600 мг подкожно, в 1-й день. Флударабин – 25 мг/м2, внутривенно капельно, в 1–3-й дни. Циклофосфамид – 250 мг/м2, внутривенно капельно, в 1–3-й дни) [26].
Для определения количества оставшихся после терапии опухолевых В-лимфоцитов, которое невозможно оценить классическими морфологическими методами, исследовали уровень МОБ методом 10-цветной проточной цитофлюориметрии. В зависимости от схемы проводимой ИХТ выделены 2 группы: II-RB (n=12) и II-FCR (n=18), каждая из которых, в свою очередь, в зависимости от ответа больных на лечение была распределена еще на 2 подгруппы: IIА (n=19) – с хорошим ответом (МОБ – от 0,90 до 0 %); IIБ (n=11) – с неудовлетворительным ответом (МОБ>1 %). Таким образом, проведен анализ данных по 4 подгруппам больных: IIА-RB (n=8) и IIА-FCR (n=11), IIБ-RB (n=4) и IIБ-FCR (n=7). В контрольную группу вошли 20 человек, сопоставимых по возрасту и полу, без злокачественных новообразований.
Исходно во всех группах исследованы содержание В-лимфоцитов, их иммунофенотип с оценкой экспрессии LAG-3. Подсчет произведен в процентах от всех лимфоцитов. В группе II после 6-го курса ИХТ определена минимальная остаточная болезнь с применением цитофлуориметра Navios 10/3 (Beckman Coulter, США). Использованная комбинация моноклональных антител, меченных флюорохромами, включала: CD45 PB, CD19 ECD/PC7/APC, CD5 PC7/APC, CD10 PC5, CD20 PC5.5/PC7, CD22 PE, CD23 FITC/PE, CD38 FITC/PB, CD43 APC-A700, FMC7 FITC, CD3 PC7/
APC, CD223 PE, kappa FITC, lambda PE (Beckman Coulter, BD Biosciences, США). Для исследования взяты клетки венозной крови в растворе антикоагулянта К2ЭДТА. Результаты анализировали с применением программного обеспечения Kaluza v2.1 (Beckman Coulter, США). Стратегию гейтирования проводили в соответствии с международным стандартизованным протоколом [27].
Статистическую обработку данных выполняли в программе Statistica 13.0. Данные оценивали с использованием критерия Шапиро‒Уилка (для малых выборок). Выборки соответствовали нормальному распределению. Полученные результаты представлены в виде M ± m, где M – среднее арифметическое значение; m – стандартная ошибка среднего. Сравнение количественных данных в группах (независимые выборки) выполняли с использованием параметрического t-критерия Стьюдента. За уровень статистической значимости принимали p<0,05. Сбор клинической информации, биологического материала, соблюдение правовых норм и правил выполнены, согласно разработанным алгоритмам действий подразделений исследовательских и клинических групп ФГБУ «НМИЦ онкологии» Минздрава России [28].
Результаты
В группах больных ХЛЛ по результатам им-мунофенотипирования обнаружена экспрессия LAG-3 на В-лимфоцитах (CD19+), которая отсутствовала в группе контроля (табл. 1, рис. 1). Обращало внимание, что уровень экспрессии LAG-3 на CD19+клетках у больных группы I был в 10 раз ниже, чем в группе II (p<0,001).
Эффект от проведенной терапии в группе II оценивали по результатам мониторинга МОБ (табл. 2). Определяли процент остаточной попу- ляции опухолевых В-лимфоцитов с иммунофенотипом CD19+/CD5+/CD23+. Отмечены различия в количестве МОБ после 6 курсов ИХТ у больных, пролеченных с использованием разных схем терапии (RB и FCR) и с различным ответом на лечение. Количественная характеристика МОБ в группе IIА с хорошим ответом в 12,1 раза меньше, чем в группе IIБ с неудовлетворительным ответом на лечение. Подтверждением хорошего ответа пациентов на терапию и при RB, и при FCR режимах ИХТ явились существенные различия в значениях МОБ между подгруппами: процент остаточной популяции опухолевых В-лимфоцитов в подгруппе IIА-RB в 81 раз меньше, чем в IIБ-RB, а в IIА-FCR ‒ в 112 раз меньше по сравнению с IIБ-FCR.
Особый интерес представляли результаты мониторинга МОБ у больных, получивших ИХТ в разных режимах. Так, в подгруппе IIA-FCR показатель МОБ в 4,5 раза был ниже значений в подгруппе IIA-RB (p<0,001). Вместе с тем, частота достижения хорошего ответа в подгруппе IIA-FCR была выше, чем в подгруппе IIA-RB, – у 57,9 и 42,1 % пациентов соответственно. Следует отметить, что только в подгруппе IIA-FCR в 36,4 % наблюдений отмечен МОБ-негативный статус, свидетельствующий об отсутствии в крови опухолевых В-лимфоцитов. В подгруппе IIБ-FCR показатель МОБ был в 3,2 раза меньше по сравнению с подгруппой IIБ-RB (p<0,001).
В связи с различным ответом на терапию проведен детальный анализ исходного уровня экспрессии LAG-3 у больных при разных режимах ИХТ: в IIA-RB, IIA-FCR, IIБ-RB, IIБ-FCR подгруппах (табл. 3). Обращает внимание, что независимо от схем проведенной терапии уровень экспрессии LAG-3 на CD19+клетках у больных группы IIА с хорошим ответом был в 2,8 раза ниже, чем у боль-
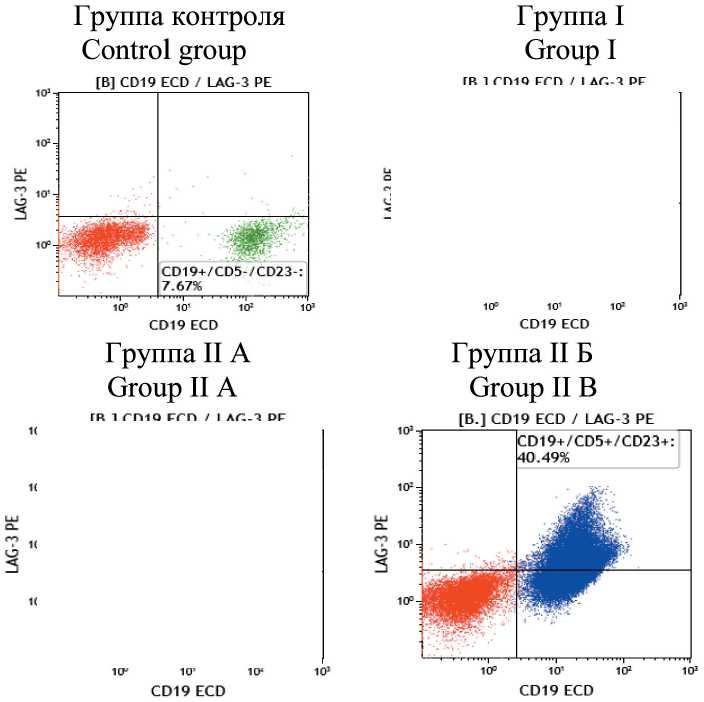
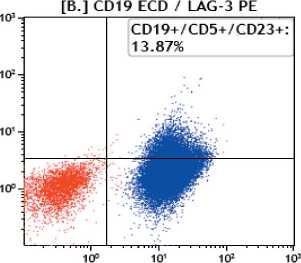
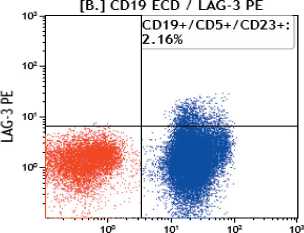
Рис. 1. Результаты иммунофенотипирования лимфоцитов крови методом проточной цитометрии. Точечные графики экспрессии LAG-3 на B-лимфоцитах (CD19): синим цветом выделена популяция клеток хронического лимфолейкоза CD19+/CD5+/CD23+; зеленым – нормальные В-лимфоциты CD19+/CD5-/CD23-; красным цветом обозначены остальные лимфоидные элементы Fig. 1. Immunophenotyping of blood lymphocytes by flow cytometry. Dot plots of LAG-3 expression on B-lympho-cytes (CD19). The population of cells of chronic lymphocytic leukemia CD19+/CD5+/CD23+ is highlighted in blue, normal B-lymphocytes CD19+/CD5-/CD23- are highlighted in green. Other lymphoid elements are marked in red
Òàблицà 1/Table 1
Уðîвåнь эêñпðåññии LAG-3 (CD223) нà B-лимфîцитàõ ó бîльныõ ÕЛЛ дî нàчàлà лåчåния, % îт лимфîцитîв
Level of LAG-3 (CD223) expression on B-lymphocytes in patients with CLL before treatment, % of lymphocytes
|
Обследованные группы/Study groups |
n |
CD19+/CD223+ |
|
Контроль/Control |
20 |
0 |
|
Группа I/Group I |
10 |
2,45 ± 0,56* |
|
Группа II/Group II |
30 |
24,62 ± 2,50*,** |
Примечание: * – статистически значимые отличия от группы контроля (р<0,001); ** – статистически значимые отличия от больных группы I (р<0,001).
Note: * – statistically significant differences with the control group (p<0.001); ** – statistically significant differences with group I patients (p<0.001).
Òàблицà 2/Table 2
Êîличåñтвåннàя õàðàêтåðиñтиêà МÎБ в êðîви бîльныõ ÕЛЛ пîñлå 6-гî êóðñà ИÕÒ Quantitative characteristics of MRD in the blood of patients with CLL after the 6th course of ICT
Количественная характеристика МОБ на этапах обследования
(% от ЯСК остаточной популяции клеток ХЛЛ – CD19+/CD5+/CD23+)/
Группы больных/ Quantitative characteristics of MRD at the stages of the survey
Patient groups (% of NC of the residual CLL cell population –CD19+/CD5+/CD23+)
|
День 0/Day 0 |
После 6-го курса ИХТ/After the 6th course of ICT |
|
|
IIА (n=19): |
88,2 ± 1,13 |
0,15 ± 0,03* |
|
IIА-RB (n=8) |
87,3 ± 0,91 |
0,27 ± 0,02* |
|
IIА-FCR (n=11) |
90,4 ± 0,87 |
0,06 ± 0,02*, ** |
|
IIБ (n=11): |
92,1 ± 1,26 |
12,25 ± 3,23*, *** |
|
IIБ-RB (n=4) |
89,3 ± 1,11 |
21,88 ± 6,22*, **** |
|
IIБ-FCR (n=7) |
92,6 ± 1,56 |
6,74 ± 1,76*,**, ***** |
Примечание: ЯСК – ядросодержащие клетки; * – значимые отличия МОБ от «день 0» (р<0,001); ** – значимые отличия МОБ при разных режимах ИХТ (р<0,05); *** – значимые отличия МОБ по сравнению с группой IIА (р<0,001); **** – значимые отличия МОБ по сравнению с группой IIА-RB (р<0,001); ***** – значимые отличия МОБ по сравнению с группой IIА-FCR.
Note: NC – nucleated cells; * – statistically significant differences between MRD and «day 0» (p<0.001); ** – statistically significant differences in MRD in different modes of ICT (p<0.05); *** – statistically significant differences in MRD in comparison with group IIA (p<0.001); **** – statistically significant differences in MRD in comparison with the IIA-RB group (p<0.001); ***** – statistically significant differences in MRD in comparison with the IIA-FCR group.
Òàблицà 3/Table 3
Уðîвåнь эêñпðåññии LAG-3 LAG-3 (CD223) нà B-лимфîцитàõ дî лåчåния ó бîльныõ ÕЛЛ ñ ðàзличным îтвåтîм нà ИÕÒ, % îт лимфîцитîв
Level of LAG-3 (CD223) expression on B-lymphocytes before treatment in CLL patients with different response to ICT, % of lymphocytes
|
Обследованные группы/Survey groups |
CD19+/CD223+ |
|
IIА (n=19): |
14,57 ± 0,66 |
|
IIА-RB (n=8) |
16,73 ± 0,90 |
|
IIА-FCR (n=11) |
13,01 ± 0,60* |
|
IIБ (n=11): |
41,95 ± 1,62** |
|
IIБ-RB (n=4) |
47,50 ± 1,66 *** |
|
IIБ-FCR (n=7) |
38,79 ± 1,12*, **** |
Примечание: * – значимые отличия LAG-3 при разных режимах ИХТ (p<0,05); ** – значимые отличия LAG-3 по сравнению с группой IIA (p<0,001); *** – значимые отличия LAG-3 по сравнению с группой IIA-RB (p<0,001); **** – значимые отличия LAG-3 по сравнению с группой IIA-FCR (p<0,001).
Note: * – statistically significant differences in LAG-3 with different ICT regimens (p<0.05); ** – statistically significant differences in LAG-3 in comparison with the IIA group (p<0.001); *** – statistically significant differences in LAG-3 in comparison with the IIA-RB group (p<0.001);
**** – statistically significant differences in LAG-3 in comparison with the IIA-FCR group (p<0.001).
|
ных группы IIБ с неудовлетворительным ответом, и составил в среднем 14,57 ± 0,66 % и 41,95 ± 1,62 % соответственно (p<0,001). Также отмечены различия в уровне экспрессии LAG-3 и между подгруп- |
пами, получающими одинаковую схему терапии, но с разным ответом. Так, в подгруппе IIА-RB экспрессия LAG-3 в 2,8 раза ниже значений в подгруппе IIБ-RB (p<0,001), а в подгруппе IIА-FCR в |
3,0 раза ниже по сравнению с экспрессией LAG-3 в IIБ-FCR (p<0,001). Менее значительны различия в уровне экспрессии LAG-3 у больных, получивших ИХТ в разных режимах, но с одинаковым ответом на терапию. Так, экспрессия LAG-3 в подгруппе IIА-FCR в 1,3 раза ниже, чем в подгруппе IIА-RB (p<0,05), в подгруппе IIБ-FCR – в 1,2 раза ниже, чем в подгруппе IIБ-RB (p<0,05).
Обсуждение
В ряде исследований показано, что при ХЛЛ происходит нарушение регуляции LAG-3 на опухолевых В-клетках, связанное с повышением уровня поверхностной экспрессии этой молекулы [29, 30]. Учитывая известные к настоящему времени биологические свойства LAG-3 – угнетение апоптоза и стимуляция выживаемости клеток ХЛЛ при связывании с ними как растворимого, так и мембранного LAG-3 путем взаимодействия с экспрессированными на них молекулами MHCII, в чем могут также участвовать «истощенные» клетки иммунного микроокружения, гиперэкспрессирую-щие LAG-3 [24, 31, 32], – этот рецептор обоснованно считается одной из важнейших иммунных контрольных точек, антагонисты которых разрабатываются и исследуются как новые препараты для иммунотерапии [30, 33]. Описанная в литературе связь LAG-3 с другими молекулярными характеристиками опухолевых клеток, такими как мутация UM-IGHV , гиперэкспрессия PD-1/PD-L1 [17, 34, 35–38], предполагает более высокую эффективность комплексного воздействия на разные ИКТ. Негативное прогностическое значение LAG-3 при злокачественных опухолях, по-видимому, универсально, оно описано при раке молочной железы [39], меланоме [32], светлоклеточном раке почки [40], немелкоклеточном раке легкого [41], активно изучается при ХЛЛ [24, 25].
По результатам нашего исследования у больных ХЛЛ обнаружена экспрессия LAG-3 на поверхности CD19+клеток в отличие от здоровых лиц. При этом более высокий уровень экспрессии LAG-3 отмечен у больных группы II по сравнению с пациентами группы I. Кроме того, полученные данные демонстрируют отличия в уровне экспрессии LAG-3 у больных с разным ответом на проводимую терапию. Так, еще до начала лечения более высокий уровень экспрессии LAG-3 на CD19+клетках наблюдается у больных ХЛЛ стадии С по J. Binet,
Список литературы Экспрессия Lag-3 на В-лимфоцитах как маркер прогноза ответа на терапию у больных хроническим лимфолейкозом
- Kipps T.J., Stevenson F.K., Wu C.J., Croce C.M., Packham G., Wi-erda W.G., O'Brien S., Gribben J., Rai K. Chronic lymphocytic leukaemia. Nat Rev Dis Primers. 2017; 3: 1-22. doi: 10.1038/nrdp.2016.96.
- ChiorazziN., RaiK.R., FerrariniM. Chronic lymphocytic leukemia. N Engl J Med. 2005; 352(8): 804-15. doi: 10.1056/NEJMra041720.
- Yosifov D.Y., WolfC., Stilgenbauer S., Mertens D. From Biology to Therapy: The CLL Success Story. Hemasphere. 2019; 3(2). doi: 10.1097/ HS9.0000000000000175.
- Кравченко Д.В., СвирновскийА.И. Хронический лимфоцитарный лейкоз: клиника, диагностика, лечение. Гомель, 2017. 117 с. [Kravchen-koD.V., SvirnovskyA.I. Chronic lymphocytic leukemia: clinic, diagnosis, treatment. Gomel, 2017. 117 p. (in Russian)].
- Craig F.E., Foon K.A. Flow cytometric immunophenotyping for hematologic neoplasms. Blood. 2008; 111(8): 3941-67. doi: 10.1182/ blood-2007-11-120535.
- ГуськоваН.К., Селютина О.Н., НовиковаИ.А., Максимов А.Ю., Ноздричева А.С., Абакумова С.В. Морфологические и иммунофено-типические особенности моноклональной популяции В-лимфоцитов при хроническом лимфолейкозе. Южно-Российский онкологический журнал. 2020; 1(3): 27-35. [GuskovaN.K., Selyutina O.N., NovikovaI.A., MaksimovA.Yu., NozdrichevaA.S., Abakumova S.V. Morphological and immunofenotypic features of the monoclonal population of B-lymphocytes in chronic lymphocytic leukemia. South Russian Journal of Cancer. 2020; 1(3): 27-35. (in Russian)]. doi: 10.37748/2687-0533-2020-1-3-3.
- Rodríguez-VicenteA.E., DíazM.G., Hernández-Rivas J.M. Chronic lymphocytic leukemia: a clinical and molecular heterogenous disease. Cancer Genet. 2013; 206(3): 49-62. doi: 10.1016/j.cancergen.2013.01.003.
- Eichhorst B., Robak T., Montserrat E., Ghia P., Niemann C.U., Kater A.P., Gregor M., Cymbalista F., Buske C., Hillmen P., Hallek M., Mey U.; ESMO Guidelines Committee. Chronic lymphocytic leukaemia: ESMO Clinical Practice Guidelines for diagnosis, treatment and follow-up. Ann Oncol. 2021; 32(1): 23-33. doi: 10.1016/j.annonc.2020.09.019.
- Baliakas P., MattssonM., Stamatopoulos K., Rosenquist R. Prognostic indices in chronic lymphocytic leukaemia: where do we stand how do we proceed? J Intern Med. 2016; 279(4): 347-57. doi: 10.1111/ joim.12455.
- Brown J.R., Hillmen P., O'Brien S., Barrientos J.C., Reddy N.M., Coutre S.E., Tam C.S., Mulligan S.P., Jaeger U., Barr P.M., Furman R.R., Kipps T.J., Cymbalista F., Thornton P., Caligaris-Cappio F., Delgado J., Montillo M., DeVos S., Moreno C., Pagel J.M., Munir T., Burger J.A., Chung D., Lin J., Gau L., Chang B., Cole G., Hsu E., James D.F., Byrd J.C. Extended follow-up and impact of high-risk prognostic factors from the phase 3 RESONATE study in patients with previously treated CLL/SLL. Leukemia. 2018; 32(1): 83-91. doi: 10.1038/leu.2017.175.
- Taghiloo S., Allahmoradi E., Ebadi R., Tehrani M., Hosseini-Khah Z., Janbabaei G., Shekarriz R., Asgarian-Omran H. Upregulation of Galectin-9 and PD-L1 Immune Checkpoints Molecules in Patients with Chronic Lymphocytic Leukemia. Asian Pac J Cancer Prev. 2017; 18(8): 2269-74. doi: 10.22034/APJCP.2017.18.8.2269.
- Mohammed Basabaeen A.A., Abdelgader E.A., Babekir E.A., Abdelrahim S.O., Eltayeb N.H., Altayeb O.A., Fadul E.A., Sabo A., Ibrahim I.K. TP53 Gene 72 Arg/Pro (rs1042522) Single Nucleotide Polymorphism Contribute to Increase the Risk of B-Chronic Lymphocytic Leukemia in the Sudanese Population. Asian Pac J Cancer Prev. 2019; 20(5): 1579-85. doi: 10.31557/APJCP.2019.20.5.1579.
- JoshiN.S., Cui W., ChandeleA., LeeH.K., UrsoD.R., Hagman J., Gapin L., Kaech S.M. Inflammation directs memory precursor and short-lived effector CD8(+) T cell fates via the graded expression of T-bet transcription factor. Immunity. 2007; 27(2): 281-95. doi: 10.1016/j. immuni.2007.07.010.
- Fischer K., Bahlo J., FinkA.M., Goede V., Herling C.D., Cramer P., Langerbeins P., von Tresckow J.,EngelkeA.,MaurerC., KovacsG., HerlingM., Tausch E., Kreuzer K.A., Eichhorst B., Böttcher S., Seymour J.F., Ghia P., Marlton P., Kneba M., Wendtner C.M., Döhner H., Stilgenbauer S., Hallek M. Long-term remissions after FCR chemoimmunotherapy in previously untreated patients with CLL: updated results of the CLL8 trial. Blood. 2016; 127(2): 208-15. doi: 10.1182/blood-2015-06-651125.
- Fischer K., Cramer P., Busch R., Böttcher S., Bahlo J., Schubert J., Pflüger K.H., Schott S., Goede V., Isfort S., von Tresckow J., Fink A.M., Bühler A., Winkler D., Kreuzer K.A., Staib P., Ritgen M., Kneba M., Döhner H., Eichhorst B.F., Hallek M., Stilgenbauer S., Wendtner C.M. Bendamustine in combination with rituximab for previously untreated patients with chronic lymphocytic leukemia: a multicenter phase II trial of the German Chronic Lymphocytic Leukemia Study Group. J Clin Oncol. 2012; 30(26): 3209-16. doi: 10.1200/JC0.2011.39.2688.
- Eichhorst B., Fink A.M., Bahlo J., Busch R., Kovacs G., Maurer C., Lange E., Köppler H., Kiehl M., Sökler M., Schlag R., Vehling-Kaiser U., Köchling G., Plöger C., Gregor M., Plesner T., Trneny M., Fischer K., Döhner H., KnebaM., Wendtner C.M., Klapper W., KreuzerK.A., Stilgenbauer S., Böttcher S., Hallek M.; international group of investigators; German CLL Study Group (GCLLSG). First-line chemoimmunotherapy with bendamustine and rituximab versus fludarabine, cyclophosph-amide, and rituximab in patients with advanced chronic lymphocytic leukaemia (CLL10): an international, open-label, randomised, phase 3, non-inferiority trial. Lancet Oncol. 2016; 17(7): 928-42. doi: 10.1016/ S1470-2045(16)30051-1.
- Al-Sawaf O., HallekM., Fischer K. The role of minimal residual disease in chronic lymphocytic leukemia. Clin Adv Hematol Oncol. 2022; 20(2): 97-103.
- BöttcherS., RitgenM., FischerK., StilgenbauerS., BuschR.M., Fin-gerle-Rowson G., Fink A.M., Bühler A., Zenz T., WengerM.K., Men-dilaM., Wendtner C.M., Eichhorst B.F., Döhner H., Hallek M.J., Kneba M. Minimal residual disease quantification is an independent predictor of progression-free and overall survival in chronic lymphocytic leukemia: a multivariate analysis from the randomized GCLLSG CLL8 trial. J Clin Oncol. 2012; 30(9): 980-8. doi: 10.1200/JCO.2011.36.9348.
- Goede V, Fischer K., Busch R., Engelke A., Eichhorst B., Wendtner C.M., Chagorova T., de la Serna J., Dilhuydy M.S., Illmer T., Opat S., Owen C.J., Samoylova O., Kreuzer K.A., Stilgenbauer S., Döhner H., LangerakA.W.,RitgenM.,KnebaM., AsikaniusE.,Humphrey K., Wenger M., Hallek M. Obinutuzumab plus chlorambucil in patients with CLL and coexisting conditions. N Engl J Med. 2014; 370(12): 1101-10. doi: 10.1056/ NEJMoa1313984.
- Kovacs G., Robrecht S., Fink A.M., Bahlo J., Cramer P., von Tres-ckow J., Maurer C., Langerbeins P., Fingerle-Rowson G., Ritgen M., Kneba M., Döhner H., Stilgenbauer S., Klapper W., Wendtner C.M., Fischer K., HallekM., EichhorstB., Böttcher S. Minimal Residual Disease Assessment Improves Prediction of Outcome in Patients With Chronic Lymphocytic Leukemia (CLL) Who Achieve Partial Response: Comprehensive Analysis of Two Phase III Studies of the German CLL Study Group. J Clin Oncol. 2016; 34(31): 3758-65. doi: 10.1200/JCO.2016.67.1305.
- DimierN., DelmarP., WardC., Morariu-ZamfirR., Fingerle-Row-son G., Bahlo J., Fischer K., Eichhorst B., Goede V., van Dongen J.J.M., Ritgen M., Böttcher S., Langerak A.W., Kneba M., Hallek M. A model for predicting effect of treatment on progression-free survival using MRD as a surrogate end point in CLL. Blood. 2018; 131(9): 955-62. doi: 10.1182/ blood-2017-06-792333.
- Molica S., Giannarelli D., Montserrat E. Minimal Residual Disease and Survival Outcomes in Patients With Chronic Lymphocytic Leukemia: A Systematic Review and Meta-analysis. Clin Lymphoma Myeloma Leuk. 2019; 19(7): 423-30. doi: 10.1016/j.clml.2019.03.014.
- HuardB., TournierM., Hercend T., TriebelF., Faure F. Lymphocyte-activation gene 3/major histocompatibility complex class II interaction modulates the antigenic response of CD4+ T lymphocytes. Eur J Immunol. 1994; 24(12): 3216-21. doi: 10.1002/eji.1830241246.
- ShapiroM., Herishanu Y., KatzB.Z., DezorellaN., Sun C., Kay S., PolliackA., Avivi I., WiestnerA., Perry C. Lymphocyte activation gene 3: a novel therapeutic target in chronic lymphocytic leukemia. Haematologica. 2017; 102(5): 874-82. doi: 10.3324/haematol.2016.148965.
- Kotaskova J., TichyB., TrbusekM., FrancovaH.S., Kabathova J., Malcikova J., Doubek M., Brychtova Y., Mayer J., Pospisilova S. High expression of lymphocyte-activation gene 3 (LAG3) in chronic lymphocytic leukemia cells is associated with unmutated immunoglobulin variable heavy chain region (IGHV) gene and reduced treatment-free survival. J Mol Diagn. 2010; 12(3): 328-34. doi: 10.2353/jmoldx.2010.090100.
- Никитин Е.А., Бялик Т.Е., Зарицкий А.Ю., Исебер Л., Капла-нов К.Д., Лопаткина Т.Н., Луговская С.А., Мухортова О.В., Осма-новЕА., ПоддубнаяИ.В., СамойловаО.С., СтадникЕ.А., ФалалееваНА., Байков В.В., Ковригина А.М., Невольских А.А., Иванов С.А., Хайло-ваЖ.В., Геворкян Т.Г. Хронический лимфоцитарный лейкоз/лимфома из малых лимфоцитов. Клинические рекомендации. Современная Онкология. 2020; 22(3): 24-44. [NikitinE.A., Bialik T.E., Zaritskii A.I., Ise-berL., KaplanovK.D., Lopatkina T.N., Lugovskaia S.A., Mukhortova O.V., OsmanovEA.,PoddubnayaI.V., SamoilovaO.S., StadníkEA.,Falaleeva N.A., Baikov V.V., Kovrigina A.M., Nevol 'skikh A.A., Ivanov S.A., Khailova Z.V., Gevorkian T.G. Chronic lymphocytic leukemia/small lymphocytic lymphoma. Journal of Modern Oncology. 2020; 22 (3): 24-44. (in Russian)]. doi: 10.26442/18151434.2020.3.200385.
- Rawstron A.C., Villamor N., Ritgen M., Böttcher S., Ghia P., Zehnder J.L., Lozanski G., Colomer D., Moreno C., GeunaM., Evans P.A., Natkunam Y., Coutre S.E., AveryE.D., RassentiL.Z., Kipps T.J., Caligaris-Cappio F., Kneba M., Byrd J.C., Hallek M.J., Montserrat E., Hillmen P. International standardized approach for flow cytometric residual disease monitoring in chronic lymphocytic leukaemia. Leukemia. 2007; 21(5): 956-64. doi: 10.1038/sj.leu.2404584.
- Кит О.И., Тимофеева С.В., Ситковская А.О., Новикова И.А., Колесников Е.Н. Биобанк ФГБУ «НМИЦ онкологии» Минздрава России как ресурс для проведения исследований в области персонифицированной медицины. Современная онкология. 2022; 24(1): 6-11. [Kit O.I., Timofeeva S.V., Sitkovskaya A.O., Novikova I.A., Kolesnikov E.N. The Biobank of the National Medical Research Centre for Oncology as a resource for research in the field of personalized medicine: A review. Modern Oncology. 2022; 24(1): 6-11. (in Russian)]. doi: 10.26 442/18151434.2022.1.201384.
- WierzM., Pierson S., GuyonnetL., Viry E., LequeuxA., OudinA., Niclou S.P., Ollert M., Berchem G., Janji B., Guérin C., Paggetti J., Moussay E. Dual PD1/LAG3 immune checkpoint blockade limits tumor development in a murine model of chronic lymphocytic leukemia. Blood. 2018; 131(14): 1617-21. doi: 10.1182/blood-2017-06-792267.
- Sordo-Bahamonde C., Lorenzo-HerreroS., González-Rodríguez A.P., Payer A.R., González-GarcíaE., López-SotoA., Gonzalez S. LAG-3 Blockade with Relatlimab (BMS-986016) Restores Anti-Leukemic Responses in Chronic Lymphocytic Leukemia. Cancers (Basel). 2021; 13(9): 2112. doi: 10.3390/cancers13092112.
- Woo S.R., Turnis M.E., Goldberg M.V., Bankoti J., Selby M, Nirschl C.J., Bettini M.L., Gravano D.M., Vogel P., Liu C.L., Tangsom-batvisitS., Grosso J.F., Netto G., SmeltzerM.P., ChauxA., UtzP.J., Workman C.J., Pardoll D.M., Korman A.J., Drake C.G., Vignali D.A. Immune inhibitory molecules LAG-3 and PD-1 synergistically regulate T-cell function to promote tumoral immune escape. Cancer Res. 2012; 72(4): 917-27. doi: 10.1158/0008-5472.CAN-11-1620.
- Grosso J.F., Kelleher C.C., Harris T.J., Maris C.H., Hipkiss E.L., De Marzo A., Anders R., Netto G., Getnet D., Bruno T.C., Goldberg M.V., Pardoll D.M., Drake C.G. LAG-3 regulates CD8+ T cell accumulation and effector function in murine self- and tumor-tolerance systems. J Clin Invest. 2007; 117(11): 3383-92. doi: 10.1172/JCI31184.
- Qi Y., Chen L., Liu Q., KongX., Fang Y., Wang J. Research Progress Concerning Dual Blockade of Lymphocyte-Activation Gene 3 and Programmed Death-1/Programmed Death-1 Ligand-1 Blockade in Cancer Immunotherapy: Preclinical and Clinical Evidence of This Potentially More Effective Immunotherapy Strategy. Front Immunol. 2021; 11. doi: 10.3389/fimmu.2020.563258.
- Liu D. Cancer biomarkers for targeted therapy. Biomark Res. 2019; 7: 25. doi: 10.1186/s40364-019-0178-7.
- Grzywnowicz M., Karabon L., Karczmarczyk A., Zajac M., Skorka K., Zaleska J., WlasiukP., Chocholska S., Tomczak W., Bojarska-Junak A., Dmoszynska A., Frydecka I., Giannopoulos K. The function of a novel immunophenotype candidate molecule PD-1 in chronic lymphocytic leukemia. Leuk Lymphoma. 2015; 56(10): 2908-13. doi: 10.3109/10428194.2015.1017820.
- Li M., Sun X.H., Zhu X.J., Jin S.G., Zeng Z.J., Zhou Z.H., Yu Z, Gao Y.Q. HBcAg induces PD-1 upregulation on CD4+T cells through activation of JNK, ERK and PI3K/AKT pathways in chronic hepatitis-B-infected patients. Lab Invest. 2012; 92(2): 295-304. doi: 10.1038/ labinvest.2011.157.
- McClanahan F., Riches J.C., Miller S., Day W.P., Kotsiou E., Neuberg D., Croce C.M., Capasso M., Gribben J.G. Mechanisms of PD-L1/PD-1-mediated CD8 T-cell dysfunction in the context of aging-related immune defects in the E^-TCL1 CLL mouse model. Blood. 2015; 126(2): 212-21. doi: 10.1182/blood-2015-02-626754.
- Ramsay A.G., Clear A.J., Fatah R., Gribben J.G. Multiple inhibitory ligands induce impaired T-cell immunologic synapse function in chronic lymphocytic leukemia that can be blocked with lenalidomide: establishing a reversible immune evasion mechanism in human cancer. Blood. 2012; 120(7): 1412-21. doi: 10.1182/blood-2012-02-411678.
- Табаков Д.В., Заботина Т.Н., Чантурия Н.В., Захарова Е.Н., Воротников И.К., Сельчук В.Ю., Соколовский В.В., Петровский А.В. Взаимосвязь экспрессии GITR, Lag-3 и PD-1 с основными показателями системного и локального иммунитета у больных раком молочной железы. Современная онкология. 2021; 23(3): 457-65. [Tabakov D.V., Zabotina T.N., Chanturia N.V., Zakharova E.N., Vorotnikov I.K., Selchuk V.Yu., Sokolovskiy V.V., PetrovskyA.V. The relationship of GITR, Lag-3 and PD-1 expression with the main indicators of systemic and local immunity in patients with breast cancer. Modern Oncology. 2021; 23(3): 457-65. (in Russian)]. doi: 10.26442/18151434.2021.3.200809.
- Wang Q, Zhang J., Tu H, Liang D, Chang D.W., Ye Y, Wu X. Soluble immune checkpoint-related proteins as predictors of tumor recurrence, survival, and T cell phenotypes in clear cell renal cell carcinoma patients. J Immunother Cancer. 2019; 7(1): 334. doi: 10.1186/s40425-019-0810-y.
- He Y, Wang Y, Zhao S, Zhao C, Zhou C, Hirsch F.R. sLAG-3 in non-small-cell lung cancer patients' serum. Onco Targets Ther. 2018; 11: 4781-4. doi: 10.2147/0TT.S164178.
- EichhorstB, FinkAM, BuschR., Kovacs G., Maurer C., LangeE., Köppler H., KiehlM.G., SoeklerM., Schlag R., Vehling-Kaiser U., Köch-ling G.R.A., Plöger C., Gregor M., Plesner T., Trneny M., Fischer K., DöhnerH., KnebaM., Wendtner C.M., Klapper W., KreuzerK.A., Stilgenbauer S., Böttcher S., Hallek M. Frontline chemoimmunotherapy with fludarabine (F), cyclophosphamide (C), and rituximab (R) (FCR) shows superior efficacy in comparison to bendamustine (B) and rituximab (BR) in previously untreated and physically fit patients (pts) with advanced chronic lymphocytic leukemia (CLL): Final analysis of an international, randomized study of the German CLL Study Group (GCLLSG) (CLL10 study). Blood. 2014; 124 (21): 19. doi: 10.1182/blood.V124.21.19.19.


