Экспрессия макрофаг-ассоциированных генов в опухоли молочной железы: связь с опухолевой прогрессией
Автор: Литвяков Николай Васильевич, Цыганов Матвей Михайлович, Ибрагимова Марина Константиновна, Дерюшева Ирина Валерьевна, Казанцева Полина Вадимовна, Митрофанова Ирина Валерьевна, Фролова Ирина Георгиевна, Булдаков Михаил Александрович, Слонимская Елена Михайловна, Чойнзонов Евгений Лхамацыренович, Кжышковска Юлия Георгиевна, Чердынцева Надежда Викторовна
Журнал: Сибирский онкологический журнал @siboncoj
Рубрика: Лабораторные и клинические исследования
Статья в выпуске: 6 т.16, 2017 года.
Бесплатный доступ
Введение. Опухолeассоциированные макрофаги (ОАМ) являются основными клетками врожденного иммунитета, которые регулируют взаимоотношения инфильтрирующих иммунокомпетентных клеток с опухолевыми клетками и с другими компонентами микроокружения, пролиферацию опухолевых клеток, ангиогенез, а также могут вовлекаться в реализацию ответа на химиотерапию. Целью исследования является оценка прогностической значимости экспрессии маркеров опухолеассоциированных макрофагов YKL39 и CCL18 в опухоли молочной железы до лечения. Методы. Было обследовано 96 больных с морфологически верифицированной инвазивной карциномой молочной железы неспецифического типа IIa-IIIb стадии (T1-4N0-3M0), которые в неоадъювантном режиме получали 2-4 курса химиотерапии. У больных оценивали 5-летнюю безметастатическую выживаемость. Уровень экспрессии генов YKL39 и CCL18 оценивали при помощи количественной ПЦР с обратной транскрипцией в режиме реального времени (qPCR) по технологии TaqMan в опухоли до лечения. При уровне экспрессии гена более 1 (больше, чем в нормальной ткани) говорили о гиперэкспрессии гена. Результаты. Уровень экспрессии изучаемых генов не зависел от основных клинико-патологических показателей заболевания. Выявлен существенно более высокий уровень экспрессии исследуемых генов у пациентов с отсутствием отдаленных метастазов в течение 5-летнего наблюдения после лечения. По методу Каплана - Майера было проведено сравнение безметастатической выживаемости у пациентов с гиперэкспрессией указанных генов в опухоли (группа YKL39+CCL18+) и с разным сочетанием низкого и высокого уровня экспрессии (YKL39-CCL18-, YKL39-CCL18+, YKL39+CCL18-). Без признаков прогрессирования были живы 100 % (10 из 10) больных, имеющих YKL39+CCL18+ макрофагальный фенотип в опухоли, при YKL39+CCL18- фенотипе уровень 5-летней безметастатической выживаемости составил 85 %. Два макрофагальных фенотипа связаны с более низкой 5-летней безметастатической выживаемостью: при YKL39-CCL18+ фенотипе - 71 %, при YKL39-CCL18- фенотипе - 69 %. Полученные данные показали ассоциацию экспрессии маркеров ОАМ в опухоли с показателями безметастатической выживаемости у больных раком молочной железы, получавших предоперационное лечение.
Рак молочной железы, опухолеассоциированные макрофаги, экспрессия генов, опухолевая прогрессия
Короткий адрес: https://sciup.org/140254456
IDR: 140254456 | УДК: 618.19-006.6-036.17-037-018 | DOI: 10.21294/1814-4861-2017-16-6-47-56
Текст научной статьи Экспрессия макрофаг-ассоциированных генов в опухоли молочной железы: связь с опухолевой прогрессией
Системная химиотерапия прочно вошла в арсенал противоопухолевых методов, однако при ее применении у 20–40 % онкологических больных наблюдается прогрессирование злокачественного процесса [1–3], основной причиной которого считается клональная эволюция новообразования, которая происходит в условиях терапевтических воздействий и приводит к отбору резистентных клонов опухолевых клеток [4, 5]. Установлено, что принципиальное значение имеют особенности взаимоотношений опухоли и микроокружения в контексте формирования опухолевой экосистемы [6]. Риск метастазирования определяется как биологическими характеристиками опухоли, так и свойствами микроокружения в первичном очаге, а также локальными и системными факторами, влияющими на формирование метастатических ниш [7, 8].
Опухолeассоциированные макрофаги (ОАМ) являются основными клетками врожденного иммунитета, которые регулируют взаимоотношения инфильтрирующих иммунокомпетентных клеток с опухолевыми клетками и с другими компонентами микроокружения, пролиферацию опухолевых клеток, ангиогенез, а также могут вовлекаться в реализацию ответа на химиотерапию [8–10]. Показано, что ОАМ часто аккумулируются в опухолях после химио- либо радиотерапии и вносят вклад в неэффективность лечения и рецидивирования опухоли [6, 11]. С одной стороны, иммунная система может способствовать противоопухолевой эффективности ряда химиопрепаратов (циклофосфан, доксорубицин, эпирубицин, митоксантрон, оксалиплатин, бортезамиб), а также радиотерапии [12]. С другой стороны, химиотерапия может индуцировать активированный ОАМ механизм восстановления поврежденной ткани опухоли, что способствует стимуляции роста опухоли и снижению противоопухолевого действия лекарственных средств [13, 14] за счет продукции колониестимулирующего фактора КСФ-1, увеличения протеазной активности, индукции ферментов, участвующих в инактивации препаратов, защиты стволовых клеток от влияния химиотерапии [11, 15, 16]. Это указывает на то, что макрофаги могут вносить вклад в процессы опухолевой прогрессии, либо способствуя диссеминации злокачественного процесса, либо, наоборот, снижая риск метастазирования.
Важными маркерами функциональной активности макрофагов рассматриваются хитиназоподобные белки (ХПБ), которые продуцируются воспалительными клетками, сочетают в себе свойства цитокинов и факторов роста, их уровень возрастает при воспалительных процессах и различных видах опухолей [17–19]. Авторы настоящей статьи показали, что ключевой регуляторный фактор прогрессирования опухоли, TGFß, активно стимулирует экспрессию ХПБ YKL39 в макрофагах in vitro [20]. Это указывает на то, что YKL39
может быть биомаркером субпопуляций проопухо-левых макрофагов, прошедших программирование с помощью TGFß в опухолевом микроокружении. Созревание макрофагов в присутствии цитокинов T-хелперов 2-го типа – IL4 и TGF β – приводит к выраженному повышению экспрессии YKL39, т.е. YKL39 может служить в качестве информативного биомаркера для выявления макрофагального ответа при злокачественных новообразованиях [18].
Хемокин CCL18 промотирует опухолевый рост, способствует инвазии, метастазированию и эпителиально-мезенхимальному переходу при РМЖ [21, 22]. CCL18 обладает иммуносупрессорными свойствами и может ингибировать макрофаги, дендритные клетки, индуцировать дифференцировку Тreg лимфоцитов. Хемокин CCL18 способствует созреванию из моноцитов проопухолевых М2 макрофагов в опухоли молочной железы и активно продуцируется опухолеассоциированными макрофагами 2-го типа, но не опухолевыми клетками, что свидетельствует о его ценности для оценки М2 популяции ОАМ [23].
В этой связи актуальным является исследование возможного вклада фенотипа макрофагов в прогрессирование рака молочной железы для понимания механизмов взаимодействия опухоли и микроокружения с целью поиска мишеней для терапевтического воздействия. С другой стороны, на основе патогенетически значимых молекул опухолеассоциированных макрофагов могут быть разработаны новые эффективные маркеры прогноза риска метастазирования и предикторы ответа опухоли на химиотерапию.
Мы проанализировали экспрессию М2 макрофагальных маркеров YKL39 и CCL18 в опухоли до лечения у больных РМЖ, получавших стандартные схемы предоперационной химиотерапии и ретроспективно разделенных на группы с признаками прогрессирования в виде отдаленных метастазов и без них в пятилетний период наблюдения после лечения.
Целью исследования явилась оценка прогностической значимости экспрессии маркеров опухолеассоциированных макрофагов YKL39 и CCL18 в опухоли молочной железы до лечения.
Материал и методы
Было обследовано 96 больных с морфологически верифицированной инвазивной карциномой молочной железы неспецифического типа IIa–IIIb (T1–4N0–3M0) стадии (табл. 1), в возрасте 26–68 лет (средний возраст – 48,21 ± 0,68 года), получавших лечение в клиниках НИИ онкологии Томского НИМЦ (г. Томск, Россия). Исследование проведено в соответствии с Хельсинкской Декларацией 1964 г. (исправленной в 1975 г. и 1983 г.) и с разрешения локального этического комитета института. Все пациенты подписали информированное согласие на исследование.
Больные в соответствии с «Consensus Conference on Neoadjuvant Chemotherapy in Carcinoma of the Breast, April 26–28, 2003, Philadelphia, Pennsylvania» [24] в неоадъювантном режиме получали 2–4 курса химиотерапии по схемам: FAC (5-фторурацил – 600 мг/м2, адриамицин – 50 мг/м2, циклофосфан – 600 мг/м2, 1 раз в 3 нед), CAX (циклофосфан – 100 мг/м2, внутримышечно, адриамицин – 30 мг/м2, внутривенно, капецитабин – 1200 мг/м2, перорально), монотерапию таксотером (100 мг/м2, часовая инфузия в 1-й день), CMX (циклофосфан – 100 мг/м2, внутримышечно, метотрексат – 30 мг/м2, внутривенно, капецитабин – 1200 мг/м2, перорально), CP (циклофосфан – 750 мг/м2, цисплатин – 75 мг/м2, внутривенно 1 раз в 3 нед). Через 3–5 нед после неоадъювантной химиотерапии (НАХТ) проводилась операция в объеме радикальной или подкожной мастэктомии, радикальной резекции, секторальной резекции с аксиллярной лимфаденэктомией или другого вида органосохраняюшей операции. Адъювантную химиотерапию, гормональную терапию и лучевую терапию проводили по показаниям.
Эффективность предоперационной химиотерапии оценивали по критериям ВОЗ и Международного противоракового союза (International Union Against Cancer) с помощью УЗИ и/или маммографии, которые проводили до лечения, после 2 курсов НАХТ и перед операцией. Регистрировали полную регрессию (100 % уменьшение опухоли), частичную регрессию (уменьшение объема опухоли более чем на 50 %), стабилизацию (снижение объема менее чем на 50 % или увеличение не более чем на 25 %) и прогрессирование (увеличение объема опухоли более чем на 25 %). Согласно международным рекомендациям, при проведении предоперационной химиотерапии больные РМЖ со стабилизацией или прогрессированием составляют группу с отсутствием ответа на НАХТ, а больные с полной или частичной регрессией – группу с объективным ответом [1].
Для оценки 5-летней безметастатической выживаемости проводилось наблюдение за больными после окончания лечения путем контрольного обследования на первом году через 3 мес, в дальнейшем – 1 раз в 6 мес. При контрольном обследовании выполнялось общеклиническое обследование с ЭКГ, рентгенография органов грудной клетки, спиральная компьютерная томография с внутривенным контрастированием (по показаниям), УЗИ органов брюшной полости, сцинтиграфия.
Для молекулярных исследований были использованы биопсийные опухолевые образцы (~10 мм3), взятые под контролем УЗИ до лечения. Образцы опухоли помещали в раствор RNAlater (Ambion, USA) и сохраняли при температуре –80ºС (после 24-часовой инкубации при +4ºС) для дальнейшего выделения РНК.
Таблица 1
Клинико-патологические параметры обследованных больных РМЖ
|
Клинико-патологические параметры |
Кол-во больных |
|
|
Возраст, лет |
≤45 |
34 (35 %) |
|
>45 |
62 (65 %) |
|
|
Менструальный |
Пременопауза |
55 (57 %) |
|
статус |
Постменопауза |
41 (43 %) |
|
T1 |
11 (12 %) |
|
|
Размер опухоли |
T2 |
72 (75 %) |
|
T3 |
5 (5 %) |
|
|
T4 |
8 (8 %) |
|
|
N0 |
42 (44 %) |
|
|
Лимфогенное мета- |
N1 |
41 (43 %) |
|
стазирование |
N2 |
5 (5 %) |
|
N3 |
8 (8 %) |
|
|
ER статус |
+ |
64 (67 %) |
|
- |
32 (33 %) |
|
|
PR статус |
+ |
62 (64 %) |
|
- |
34 (36 %) |
|
|
0/+ |
80 (83 %) |
|
|
HER2 статус |
++ |
10 (11 %) |
|
+++ |
6 (6 %) |
|
|
Гистологическая |
Униполярная |
62 (64 %) |
|
форма |
Мультиполярная |
34 (36 %) |
|
Люминальный В |
68 (71 %) |
|
|
Молекулярный тип |
Трижды негативный |
17 (18 %) |
|
HER2-позитивный |
11 (11 %) |
|
|
Полная регрессия |
9 (10 %) |
|
|
Ответ на НАХТ |
Частичная регрессия |
57 (59 %) |
|
Стабилизация |
23 (24 %) |
|
|
Прогрессирование |
7 (7 %) |
|
|
CAX |
20 (21 %) |
|
|
FAC |
48 (50 %) |
|
|
Схема НАХТ |
CMX |
10 (10 %) |
|
Таксотер |
14 (15 %) |
|
|
CP |
4 (4 %) |
|
Тотальная РНК была выделена из 96 биопсийных образцов опухоли до лечения. РНК выделяли с помощью набора RNeasy Plus mini Kit, содержащего ДНК-азу I (Qiagen, Germany, #74134) в соответствии с инструкцией производителя. Для предотвращения деградации РНК в пробирку добавляли ингибитор РНК-аз Ribolock (Thermo Scientific, USA). На спектрофотометре NanoDrop-2000 (Thermo Scientific, USA) оценивали концентрацию и чистоту выделения РНК. Концентрация РНК составила от 80 до 250 нг/мкл, А260/А280= =1,95–2,05; А260/А230=1,90–2,31. Целостность выделенной РНК оценивалась при помощи капиллярного электрофореза на приборе TapeStation (Agilent Technologies, USA) и набора R6K ScreenTape (Agilent Technologies, USA #5067–5367). RIN составил 6,6–8,8. Выделенная РНК хранилась при –80ºС в низкотемпературном морозильнике (Sanyo,
Таблица 2
Последовательность праймеров и проб исследованных генов
|
Ген |
Ампликон |
Последовательность |
|
ACTB NM _001101.3 |
73 bp |
F 5'- gagaagatgacccagatcatgtt -3' R 5'- atagcacagcctggatagcaa -3' |
|
GAPDH NM_002046.3 |
124 bp |
Probe FAM 5'- agaccttcaacaccccagccat -3'BHQ1 F 5'-gccagccgagccacatc-3' R 5'-ggcaacaatatccactttaccaga-3' |
|
YKL39 (CHI3L2- Chitinase 3 Like 2 NM001025197 |
81 bp |
Probe FAM 5'- cgcccaatacgaccaaatccg-3'BHQ1 F 5'- aacaacaaggttatcatcaaggac -3' R 5'- tttgggattcttggttttgag -3' |
|
^^^^™ CCL18 NM_002988 |
95 bp |
Probe FAM 5'- agtgaagtgatgctctaccagaccat - 3'BHQ1 F 5'- ccaagccaggtgtcatcct-3' R 5'- cttcaggtcgctgatgtatttct -3' |
|
Probe FAM 5'- tctgtgctgaccccaataagaagt -3'BHQ1 |
Примечание: все пробы – FAM →BHQ1; NM – номер последовательности РНК в NCBI Nucleotide Database %); bp – base pair; F – прямой праймер; R – обратный праймер. Все праймеры имеют оригинальный дизайн.
Japan) и использовалась для количественной ПЦР и микроматричных исследований.
Уровень экспрессии генов YKL39 и CCL18 оценивали при помощи количественной ПЦР с обратной транскрипцией в режиме реального времени (qPCR) по технологии TaqMan на амплификаторе RotorGene-6000 (Corbett Research, Australia), как это описано в [26, 27]. Для получения кДНК на матрице РНК проводили реакцию обратной транскрипции с помощью набора RevertAid™ (Thermo Scientific, USA) со случайными гексануклеотид-ными праймерами в соответствии с инструкцией к набору. Праймеры и зонды (FAM-BHQ1) были подобраны с использованием программы Vector NTI Advance 11.5 и базы данных NCBI (http://www. (табл. 2). В качестве гена-рефери использовали ген «домашнего хозяйства» фермента GAPDH (glyceraldehydes-3-phosphate dehydrogenase) и ACTB (Actin B) и уровень экспрессии каждого целевого гена нормализовали по отношению к экспрессии GAPDH и ACTB по методу Pfaffl [28]. В качестве калибратора использовалась пулированная от 10 пациентов РНК, выделенная из нормальной ткани молочной железы, полученной во время операции от больных, которым не проводилась НАХТ. В качестве результата использовалось различие в экспрессии генов интереса YKL39 и CCL18 относительно GAPDH, ACTB и нормальной ткани молочной железы. При превышении уровня 1 (более, чем в нормальной ткани) говорили о гиперэкспрессии гена.
Анализ данных осуществляли при помощи прикладного пакета STATISTICA 8.0 for Windows (StatSoft Inc., USA). Для выборок вычисляли среднее значение (M) и ошибку средней (SE). Уровень статистической значимости различий оценивали при помощи непараметрического критерия Вилкоксо-на – Манна – Уитни. Анализ безметастатической выживаемости проведен с использованием метода Каплана – Майера.
Результаты и обсуждение
Мы проанализировали экспрессию М2 макрофагальных маркеров YKL39 и CCL18 в опухоли до лечения у больных РМЖ, получавших неоадъювантную химиотерапию, в зависимости от клинического течения злокачественного процесса, который оценивали по наличию или отсутствию отдаленных метастазов в пятилетний период наблюдения.
Рядом авторов показано, что CCL18 не продуцируется опухолевыми клетками молочной железы, а экспрессируется только в ОАМ, по результатам тестирования белкового продукта in situ с использованием иммуногистохимического исследования [22, 29, 30]. Установлено, что макрофаги также служат основным источником хитиназо-подобных белков, в том числе и YKL39 [31]. Это дает возможность считать, что измеряемая при помощи qPCR экспрессия генов YKL39 и CCL18 осуществляется ОАМ и отражает их функционирование. Таким образом, гиперэкспрессия (более 1, за 1 принимается уровень экспрессии в нормальной ткани молочной железы) генов YKL39 и/или CCL18, определяемая qPCR, показывает наличие высокой М2+ макрофагальной инфильтрации опухоли молочной железы. По результатам экспрессии можно было выделить 3 фенотипа М2 макрофагов: YKL39+CCL18+ (гиперэкспрессия в опухоли генов и YKL39 и CCL18), YKL39+CCL18– и YKL39–CCL18+ М2+ макрофагальный фенотип опухоли молочной железы. В случае гипоэкспрессии обоих генов YKL39-CCL18-можно говорить о М2 отрицательном макрофагальном фенотипе опухоли.
На первом этапе мы оценили связь экспрессии YKL39 и CCL18 с клинико-патологическими характеристиками заболевания, патогенетически значимыми для определения характера клинического течения заболевания и прогноза. Они включают возраст и менструальный статус пациенток, а также ряд показателей первичной опухоли (размер, гормо-
Таблица 3
Влияние клинико-морфологических параметров на экспрессию макрофаг-ассоциированных генов YKL39 и CCL18 в опухоли молочной железы до лечения
|
Клинико-патологические параметры |
YKL39 |
P level |
CCL18 |
P level |
|
|
Возраст, лет |
≤45 |
1,1 ± 0,6 |
0,103 |
7,3 ± 5,5 |
0,629 |
|
>45 |
3,2 ± 1,0 |
10,7 ± 5,3 |
|||
|
Менструальный статус |
Пременопауза Постменопауза |
2,2 ± 0,6 2,9 ± 1,3 |
0,546 |
5,5 ± 3,4 14,8 ± 8,0 |
0,274 |
|
Размер опухоли |
T1–2 |
2,8 ± 0,8 |
0,359 |
8,5 ± 4,0 |
0,957 |
|
T3–4 |
0,5 ± 0,2 |
15,8 ± 14,2 |
|||
|
Состояние регионарных |
N0 |
2,8 ± 1,0 |
0,173 |
14,2 ± 8,2 |
0,712 |
|
лимфоузлов |
N1–3 |
2,2 ± 0,9 |
5,9 ± 3,2 |
||
|
ER статус |
+ |
2,0 ± 0,6 |
0,832 |
14,0 ± 6,3 |
0,356 |
|
- |
2,1 ± 0,9 |
2,5 ± 0,8 |
|||
|
PR статус |
+ |
1,9 ± 0,7 |
0,863 |
13,3 ± 6,6 |
0,191 |
|
- |
2,3 ± 0,8 |
4,4 ± 1,4 |
|||
|
HER2 статус |
0/+ |
2,6 ± 0,8 |
0,249 |
10,2 ± 5,3 |
0,216 |
|
2,4 ± 2,2 |
8,7 ± 6,4 |
||||
|
Гистологическая форма |
Униполярная |
2,5 ± 0,9 |
0,154 |
8,5 ± 4,0 |
0,878 |
|
Мультиполярная |
2,4 ± 1,0 |
11,1 ± 8,4 |
|||
|
1. Люминальный В |
2,5 ± 0,9 |
1–2=0,709 |
12,3 ± 5,6 |
1–2=0,933 |
|
|
Молекулярный тип |
2. Трижды-негативный |
2,9 ± 1,4 |
1–3=0,807 |
3,2 ± 1,3 |
1–3=0,318 |
|
3. HER2-позитивный |
1,7 ± 1,2 |
2–3=0,654 |
2,7 ± 1,2 |
2–3=0,437 |
|
|
ПР + ЧР |
2,0 ± 0,8 |
0,886 |
12,6 ± 5,7 |
0,800 |
|
|
Ответ на НАХТ |
Стабилизация + прогрессирование |
3,5 ± 1,3 |
2,5 ± 0,9 |
||
|
Гематогенные метастазы |
Нет Есть |
3,0 ± 0,9 |
0,041 |
12,1 ± 5,2 |
0,536 |
|
1,0 ± 0,4 |
1,6 ± 0,6 |
||||
Примечание: p level – уровень статистической значимости различий по критерию Вилкоксона – Манна – Уитни.
нальный статус, наличие рецепторов к эстрогенам и прогестерону, эпидермальному фактору роста). При этом важное значение имеет молекулярный подтип новообразования, который в существенной степени определяет ответ опухоли на химиотерапию, ее биологическую агрессивность и статус лимфогенного метастазирования. Уровень экспрессии изучаемых генов не зависел от указанных особенностей заболевания (табл. 3). Однако мы выявили существенно более высокий уровень экспрессии исследуемых генов у пациентов без отдаленных метастазов в течение 5-летнего наблюдения после лечения. Это дает основания считать, что макрофаги, экспрессирующие YKL39 и CCL18, могут вносить вклад в опухолевую прогрессию.
Для оценки прогностической значимости экспрессии макрофагальных маркеров в опухоли молочной железы до лечения были построены кривые безметастатической выживаемости по методу Каплана – Майера в зависимости от фенотипа внутриопухолевых макрофагов, определяемого по генной экспрессии макрофаг-ассоциированных молекул YKL39 и CCL18. Проведено сравнение безметастатической выживаемости у пациенток с высокой экспрессией указанных генов в опухоли (группа YKL39+CCL18+) и с разным сочетанием низкого и высокого уровня экспрессии (YKL39– CCL18–, YKL39–CCL18+, YKL39+CCL18–).
Независимо от того, какой непосредственный ответ опухоли на предоперационную химиотерапию был зарегистрирован у той или иной пациентки, 100 % (10 из 10) больных, имеющих YKL39+CCL18+ фенотип в опухоли, были живы без признаков прогрессирования (отдаленного метастазирования) в течение 5-летнего наблюдения (рис. 1). При YKL39+CCL18– фенотипе гематогенные метастазы в течение 5 лет после лечения возникли у 3/20 больных (безметастатическая выживаемость – 85 %). При двух макрофагальных фенотипах отмечены наиболее низкие показатели 5-летней безметастатической выживаемости. Гематогенные метастазы при YKL39–CCL18+ фенотипе развились у 7/24 больных (безметастатическая выживаемость составила 71 %), при YKL39–CCL18– фенотипе метастазы отмечались у 13/42 больных (безметастатическая выживаемость – 69 %).
Статистическая значимость различий в показателях безметастатической выживаемости наблюдается между больными с YKL39+CCL18+ фенотипом и YKL39–CCL18+ или YKL39–CCL18– фенотипом. Таким образом, наиболее благоприятным в прогностическом плане является YKL39+CCL18+ макрофагальный фенотип опухоли, при котором отмечена 100 % выживаемость, неблагоприятными являются YKL39–CCL18+ и YKL39–CCL18– макрофагальные фенотипы опухоли.
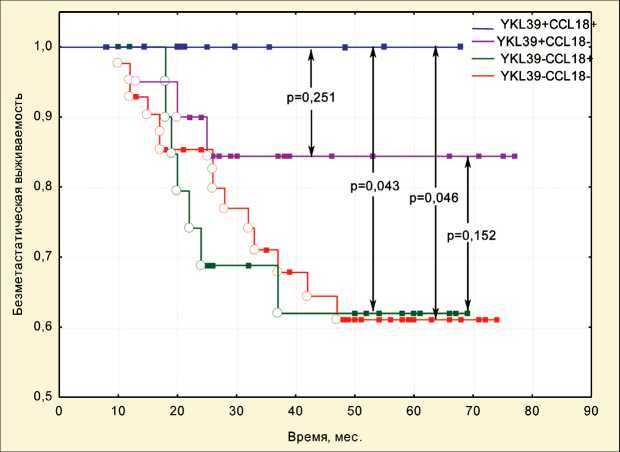
Рис. 1. Безметастатическая выживаемость больных раком молочной железы в зависимости от макрофагального фенотипа опухоли до лечения
В этом отношении особо следует отметить, что деление макрофагов на 2 субпопуляции, разные по функциям (М1 и М2 макрофаги), как оказалось, не отражает действительной сложности процессов, происходящих в опухоли. Экспрессионное профилирование субпопуляций макрофагов в разных контекстах опухолевого микроокружения показало наличие целого ряда функционально различных типов макрофагов. Опухолeассоциированные макрофаги являются высокопластичными клетками и способны переключаться между подтипами в зависимости от специфических сигналов и стимулов внутри опухоли, приводящих к транскрипционной перестройке генного профиля ОАМ. В частности, выявлены функционально специфические, раз- личающиеся по спектру цитокинов субпопуляции макрофагов, стимулирующих ангиогенез, промотирующих метастазирование, осуществляющих иммуносупрессивную функцию либо поддерживающих стволовые раковые клетки [33]. Следует особо отметить, что большая часть макрофагального белка YKL39 локализуется не в цитоплазматических везикулах, а в ядерных гранулах, что позволяет предположить не только внеклеточную роль YKL39 как белка, секретируемого макрофагами, но и его регуляторную функцию для «программирования» самих макрофагов.
Заключение
Полученные данные показали ассоциацию экспрессии маркеров ОАМ в опухоли с показателями безметастатической выживаемости больных РМЖ, получавших предоперационное лечение. Актуальным на данный момент является поиск дополнительных маркеров, позволяющих оценить риск развития отдаленных метастазов опухоли, для уточнения тактики лечения. Независимость выявленной связи от других факторов, которые бы могли модифицировать характер клинического течения заболевания, и представительные данные последних лет о существенной роли макрофагов опухолевого микроокружения в определении биологического поведения опухоли и ее судьбы в условиях химиотерапии, указывают на ценность полученных результатов для разработки маркеров прогноза и дальнейших исследований в направлении поиска терапевтических мишеней.
Список литературы Экспрессия макрофаг-ассоциированных генов в опухоли молочной железы: связь с опухолевой прогрессией
- Kaufmann M., von Minckwitz G., Mamounas E.P., Cameron D., Carey L.A., Cristofanilli M., Denkert C., Eiermann W., Gnant M., Harris J.R., Karn T., Liedtke C., Mauri D., Rouzier R., Ruckhaeberle E., Semiglazov V., Symmans W.F., Tutt A., Pusztai L. Recommendations from an international consensus conference on the current status and future of neoadjuvant systemic therapy in primary breast cancer. Ann Surg Oncol. 2012; 19 (5): 1508-16. DOI: 10.1245/s10434-011-2108-2
- Liu B., Ezeogu L., Zellmer L., Yu B., Xu N., Joshua Liao D. Protecting the normal in order to better kill the cancer. Cancer Med. 2015; 4 (9): 1394-403. DOI: 10.1002/cam4.488
- Kim E.S. Chemotherapy Resistance in Lung Cancer. Lung Cancer and Personalized Medicine: Springer. 2016: 189-209. DOI: 10.1007/978-3-319-24223-1_10
- Findlay J.M., Castro-Giner F., Makino S., Rayner E., Kartsonaki C., Cross W., Kovac M., Ulahannan D., Palles C., Gillies R.S., MacGregor T.P., Church D., Maynard N.D., Buffa F., Cazier J.B., Graham T.A., Wang L.M., Sharma R.A., Middleton M., Tomlinson I. Differential clonal evolution in oesophageal cancers in response to neo-adjuvant chemotherapy. Nat Commun. 2016 Apr 5; 7: 11111. DOI: 10.1038/ncomms11111
- Ibragimova M., Tsyganov M., Litviakov N. Natural and chemotherapy-induced clonal evolution of tumors. Biochemistry (Mosc). 2017 Apr; 82 (4): 413-425. DOI: 10.1134/S0006297917040022


