Экспрессия маркеров CD44 и CD24 в биопсийном материале больных тройным негативным раком молочной железы до лечения
Автор: Смирнова Светлана Гурьевна, Орлова Нина Владимировна, Смирнова Ия Алексеевна, Двинских Нина Юрьевна, Харитонова Алена Андреевна, Киселева Марина Викторовна, Замулаева Ирина Александровна
Журнал: Сибирский онкологический журнал @siboncoj
Рубрика: Лабораторные и экспериментальные исследования
Статья в выпуске: 4 т.19, 2020 года.
Бесплатный доступ
Индивидуальные особенности экспрессии CD44 и CD24 при раке молочной железы (РМЖ) изучаются во многих лабораториях мира в рамках поиска прогностических маркеров агрессивности опухолевого процесса и эффективности противоопухолевой терапии, что во многом обусловлено участием этих белков в процессах опухолевого роста, метастазирования и формирования популяции опухолевых стволовых клеток (ОСК), которые составляют наиболее резистентную часть злокачественных новообразований к радиационным и многим химиотерапевтическим воздействиям. Особый интерес представляет исследование экспрессии CD44 и CD24 в случае тройного негативного (ТН) РМЖ - наиболее агрессивного среди различных молекулярных подтипов злокачественных новообразований данной локализации. Цель исследования - выяснение возможной взаимосвязи экспрессии маркеров CD44 и CD24 в биопсийном материале больных ТН РМЖ до лечения с клинико-морфологическими характеристиками опухоли. Материал и методы. В исследование включено 67 больных ТН РМЖ I-IV стадии. С помощью проточной цитометрии в биоптатах из первичного опухолевого очага 65 больных и лимфоузлов 6 больных определяли долю клеток с иммунофенотипом ОСК, которые характеризуются наличием на клеточной мембране CD44 при низкой экспрессии CD24 или отсутствии таковой (CD44+/ CD24"/low). Кроме того, оценивали долю клеток со всеми возможными комбинациями экспрессии этих поверхностных белков. Результаты. Клетки с иммунофенотипом ОСК выявлены в первичном очаге всех больных при широкой индивидуальной вариабельности их доли - от 0,4 до 77,0 % (медиана -10,9 %). Не обнаружено различий доли ОСК в первичном очаге и в лимфоузлах. Ни при одно-, ни при многофакторном анализе не установлено значимой корреляции доли ОСК ни с одним из клинико-морфологических показателей, включая размер и степень дифференцировки опухоли, наличие регионарных и отдаленных метастазов, размер фракции пролиферирующих клеток, оцениваемый по экспрессии Ki67. Также не установлено ассоциации указанных показателей (кроме Ki67) ни с одним из преобладающих в исследованном материале иммунофенотипов. В первичном опухолевом очаге высокая доля Ю67-позитивных клеток была ассоциирована с фенотипом CD44"CD24". Заключение. Экспрессия маркеров CD44 и CD24 в клетках биопсийного материала больных ТН РМЖ до лечения не коррелирует с клинико-морфологическими характеристиками опухоли, кроме экспрессии Ki67.
Тройной негативный рак молочной железы, опухолевые стволовые клетки, проточная цитометрия
Короткий адрес: https://sciup.org/140254370
IDR: 140254370 | УДК: 618.19-006.6-076:577.2 | DOI: 10.21294/1814-4861-2020-19-4-79-87
Текст научной статьи Экспрессия маркеров CD44 и CD24 в биопсийном материале больных тройным негативным раком молочной железы до лечения
Тройной негативный рак молочной железы (ТН РМЖ) характеризуется наиболее агрессивным течением заболевания по сравнению с другими подтипами РМЖ. Он составляет 15–25 % среди всех видов РМЖ и по гистологическим характеристикам чаще всего (около 70 %) относится к базальноподобному низкодифференцированному протоковому раку с высокой метастатической активностью и высоким митотическим потенциалом. Отличительной особенностью ТН РМЖ является отсутствие на поверхности клеток 3 типов клинически значимых рецепторов: эстрогенов, прогестерона и эпидермального фактора роста HER2/ neu. Именно эти рецепторы в настоящее время являются мишенями таргетного воздействия, их отсутствие ограничивает возможности направленной терапии.
Как и при других злокачественных новообразованиях, при ТН РМЖ наблюдается значительная вариабельность индивидуального ответа на терапевтическое воздействие даже при одинаковых клинико-морфологических характеристиках опухоли. При этом у ряда больных отмечается частичная регрессия опухоли и происходит прогрессирование заболевания. Одной из основных причин низкой эффективности лечения является гетерогенность опухолевых клеток одного и того же новообразования по чувствительности к противоопухолевым воздействиям. Это явление изучается не один десяток лет, но в последнее время рассматривается с позиции концепции о существовании опухолевых стволовых клеток (ОСК), что позволило достичь определенных успехов в решении этой проблемы. Можно считать доказанным, что популяция ОСК устойчива ко многим терапевтическим воздействиям, поэтому для успешной противоопухолевой терапии необходимо найти способы воздействия на эти клетки. Для идентификации ОСК РМЖ и, в частности, его тройной негативной формы предложен ряд биомаркеров, среди которых CD44 и CD24 занимают заметное место, поскольку именно с их помощью было впервые показано существование ОСК в солидных опухолях, они входят в число наиболее часто использующихся маркеров при выявлении
ОСК РМЖ. Было установлено, что экспрессия этих маркеров отличается в опухолях с различными клиническими характеристиками и молекулярными подтипами РМЖ [1–3]. Отмечается, что наибольшая доля опухолей с ОСК, выявляемыми по фенотипу CD44+/CD24-/low, а также наибольшая доля таких клеток встречаются в новообразованиях с базальноподобным подтипом, в частности в тройных негативных опухолях. Предполагается, что популяция ОСК и относительное количество этих клеток могут иметь значение для уточняющей диагностики опухолевого процесса, прогноза течения и эффективности лечения, а также выбора метода терапии. Это предположение подвергается интенсивному исследованию во многих лабораториях мира, однако полученные результаты достаточно противоречивы.
Поэтому целью исследования , состоящего из двух этапов, является выяснение возможной взаимосвязи экспрессии маркеров CD44 и CD24 в клетках биопсийного материала больных ТН РМЖ до лечения с клинико-морфологическими характеристиками опухоли, а также оценка прогностического значения доли ОСК в первичной опухоли и количественных изменений данного показателя в процессе терапии в отношении ближайших и отдаленных результатов лечения. В статье представлены результаты первого этапа исследования.
Материал и методы
Объектом исследования являлся биопсийный материал пациенток с ТН РМЖ, находившихся на лечении в МРНЦ им. А.Ф. Цыба – филиале ФГБУ «НМИЦ радиологии» Минздрава России с 2015 по 2018 г. До начала лечения обследовано 67 больных РМЖ I–IV стадии со средней или низкой степенью дифференцировки опухоли, в возрасте от 27 до 79 лет (в среднем – 55 лет). Во всех случаях диагноз ТН РМЖ установлен иммуногистохимически. Большинство опухолей (97 %) характеризовалось как инвазивная протоковая карцинома неспецифического типа, остальные – как инвазивная дольковая карцинома. Анализ биопсийного материала из первичного очага проведен у 65 человек, из них у 4 пациенток также проанализирован биопсийный материал лимфоузлов. У двух пациенток проведен анализ только материала лимфоузлов.
Биопсийный материал первичной опухоли и лимфоузлов получали методом трепан-биопсии, при этом 2–3 фрагмента ткани помещали в пробирку с полной питательной средой RPMI-1640 (ПанЭко, РФ), содержащей 10 % фетальной сыворотки (ФС) крупного рогатого скота («Gibco», США), пенициллин (50000 ед/л) (ПанЭко, РФ), стрептомицин (50 мг/л) (ПанЭко, РФ), глютамин (292 мг/л) (ПанЭко, РФ) и доставляли в лабораторию в течение 1 ч для дальнейшего исследования.
Анализ маркеров CD44 и CD24 в биопсийном материале проводили с помощью проточной цитометрии. Для этого ткань механически разобщали до 1 мм3 и помещали в среду RPMI-1640, содержащую коллагеназу (1 мг/мл, Sigma), ДНКазу (0,02 %, Sigma) и Hepes-буфер (20 мкл/мл, Sigma). Инкубировали при +37 ºСв течение 40–60 мин при постоянном перемешивании. После удаления среды с ферментами действие коллагеназы останавливали добавлением холодной (+4 ºС) среды RPMI-1640, содержащей 10 % инактивированной ФС. Образцы промывали в фосфатно-солевом буфере (PBS), pH 7,4 (ПанЭко, РФ) и фильтровали через нейлоновый фильтр с диаметром пор 45 мкм. Клетки подсчитывали под фазово-контрастным микроскопом в камере Горяева. Отбирали аликвоты по 105 клеток. Затем клетки первой аликвоты окрашивали меченными флуорохромами моноклональными антителами к следующим поверхностным маркерам: CD44-FITC (Becton Dickinson – BD, Германия), CD24-PE и CD45-PE–Cy5 (BD, Германия). CD45 использовали в качестве маркера лимфоидных клеток для их отрицательной селекции. Для контроля неспецифического связывания использовали вторую аликвоту клеток, которые инкубировали с моноклональными антителами соответствующих изотипов к гемоцианину улитки, конъюгированными с теми же флуорохромами, что и антитела к указанным поверхностным маркерам (BD, Германия). Инкубацию проводили в течение 20 мин, затем клетки отмывали в PBS от несвязавшихся антител. Для идентификации ядросодержащих клеток и избавления от клеточных обломков, неизбежно возникающих в процессе дезагрегации ткани, использовали флуоресцентный краситель Hoechst 33342 (Но) (Calbiochem, CШA). Суспензию клеток фильтровали через нейлоновый фильтр с диаметром пор 45 мкм и анализировали на проточном цитометре FACS Vantage (BD, США), оснащенном 2 лазерами с длинами волн 488 нм и 365 нм.
Анализ клеток проводили по шести параметрам: интенсивности прямого и бокового светорассеяния, флуоресценции FITC, PE, PE–Cy5 и Но. Полученную информацию записывали в файл. Компьютерную обработку проводили с использованием программы CellQuestPro (BD, США). Cреди CD45-Но+ клеток определяли долю клеток с фенотипами CD44+/CD24-/low; CD44+/CD24+; CD44+/ CD24- ; CD44-/CD24+ и CD44-/CD24-. На рис. 1 показаны типичные графики распределения клеток по интенсивности флуоресценции CD44 и CD24.
Принадлежность опухоли к одному из 4 фенотипов (CD44+/CD24+; CD44+/CD24-;CD44-/CD24+ и CD44-/CD24-) определяли согласно принципу, использованному в работе [4]. Опухоль определялась как CD44-/CD24-, если ни один из остальных 3 фенотипов не был более 10 %. Опухоль относили к одному из остальных фенотипов, если доля клеток этого фенотипа была больше 10 %. Если доля двух
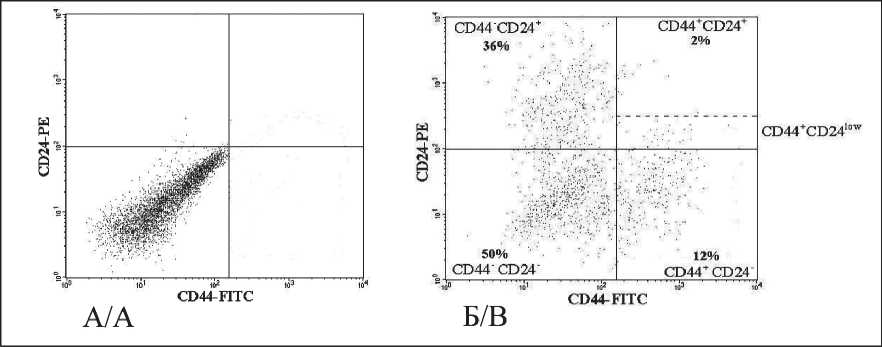
Рис. 1. Проточноцитометрические графики распределения CD45- Но+ клеток биопсийного материала первичного очага ТН РМЖ по интенсивности связывания антител к CD44 и CD24: А – изотипический контроль неспецифического связывания, Б – реакция с антителами
Fig. 1. Flow cytometric graphs of the distribution of CD45- Но+ cells of the biopsy material of the primary tumor of breast cancer by the intensity of binding of antibodies to CD44 and CD24: A – isotypic control of nonspecific binding, B – reaction with antibodies
или трех положительных фенотипов была больше 10 %, то выбирали тот, который имел большее значение.
Статистическую обработку результатов проводили с помощью пакета программ Statistica 6.0 (StatSoft, Inc., США). Для описательной статистики доли клеток с изучаемыми фенотипами использовали медиану и размах квартилей. Значимость различий показателей в двух выборках оценивали по U-критерию Манна – Уитни. Различия считали статистически значимыми при р<0,05. Множественный регрессионный анализ проводили по методу, реализованному в программе Statistica 6.0.
Результаты и обсуждение
Клетки с фенотипом CD44+/CD24-/low, который, по данным многочисленных авторов, соответствует ОСК, были обнаружены нами в биоптатах первичной опухоли всех обследованных больных. Их доля среди CD45-Но+ клеток составляла от 0,4 до 77,0 % в разных образцах. Значения данного показателя имели распределение, отличное от нормаль-
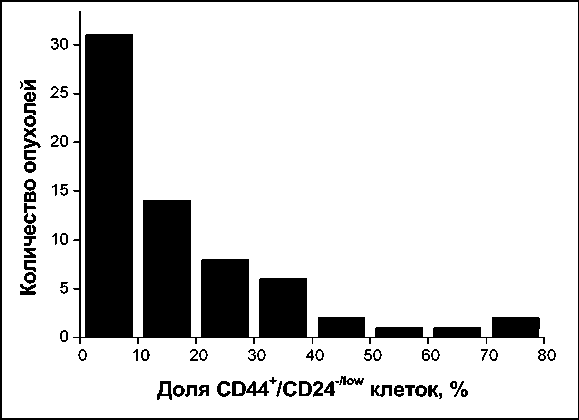
Рис. 2. Гистограмма распределения опухолей по доле клеток с фенотипом CD44+/CD24-/low
Fig. 2. Histogram of the distribution of tumors by the proportion of cells with a phenotype CD44+/CD24-/low ного (рис. 2). В 48 % опухолей (31/65) доля этих клеток была ≤10 %; в 46 % опухолей (30/65) – в интервале 10–50 %; и в 4 случаях доля составляла >50 %. Медиана доли ОСК составляла 10,9 %.
Если сравнивать полученные нами результаты с данными, представленными в литературе, то можно отметить следующее. По данным разных исследователей, процент опухолей, имеющих популяцию CD44+/CD24-/low клеток, сильно различается [1, 5–8]. Авторами отмечается, что чаще всего эти клетки встречаются в опухолях базальноподобной подгруппы, характеризующихся отсутствием рецепторов эстрогенов, прогестерона и эпидермального фактора роста HER2/neu, и особенно часто – в группе ТН РМЖ (до 100 %). В этих опухолях наблюдается и более высокий процент таких клеток. В целом наши данные по количеству опухолей, имеющих популяцию CD44+/CD24-/low клеток, и по доле ОСК в опухолях согласуются с данными, полученными другими авторами [7, 10].
У 6 человек был проведен анализ биопсийного материала лимфоузлов на содержание ОСК (табл. 1). При этом для 4 человек результаты можно было сравнить с данными, полученными для соответствующей первичной опухоли. Согласно нашим немногочисленным данным, значения доли CD44+/CD24-/low клеток в первичных опухолях и лимфоузлах практически одинаковы.
В литературе данные по экспрессии маркеров ОСК в первичном очаге и лимфоузлах достаточно противоречивы. В одних работах показано, что доля CD44+/CD24- клеток больше в микромета-статических сторожевых лимфоузлах [11] или подмышечных лимфатических узлах, имеющих вторичное метастазирование [8], чем в исходной опухоли. В то же время имеются данные о том, что доля этих клеток в лимфоузлах, метастазах и рецидивирующих опухолях не меняется по сравнению с исходной опухолью [6, 10, 12–13].
таблица 1/table 1
Доля Cd44+/Cd24-/low клеток в первичных опухолях и лимфоузлах proportion of Cd44+/Cd24-/low cells in primary tumors and lymph nodes
Доля Cd44+/Cd24-/low и Cd44-/Cd24+ клеток в опухолях с различными клиническо-морфологическими характеристиками proportion of Cd44+/Cd24-/low and Cd44-/Cd24+ cells in tumors with different clinical and morphological characteristics
|
Клинические характеристики/ Clinical characteristics |
Пациенты/ Patients |
CD44+/CD24-/low, медиана (квартили*)/ CD44+/CD24-/low, median (quartiles *) |
р |
CD44-/CD24+, медиана (квартили*)/ CD44-/CD24+, median (quartiles *) |
р |
|
Размер опухоли/Tumor size |
|||||
|
Т1 |
10 (15,4 %) |
10,2 % (5,2–30,5) |
26,2 % (15,7–30,4) |
||
|
Т2 |
29 (44,6 %) |
12,3 % (4,4–27,5) |
14,5 % (6,6 – 29,8) |
0,1** |
|
|
Т3 |
5 (7,7 %) |
16,7 % (10,9–33,4) |
27,3 % (13,8–32,0) |
||
|
Т4 |
21 (32,3 %) |
10,0 % (5,5–16,6) |
29,5 % (12,5–47,7) |
||
|
Количество вовлеченных регионарных лимфоузлов/The number of regional lymph nodes involved |
|||||
|
0 |
27 (41,5 %) |
7,8 % (3,4–27,5) |
0,21 |
18,8 % (8,3–32,0) |
|
|
1–3 |
38 (58,5 %) |
12,1 % (6,6–26,0) |
19,9 % (11,0–33,9) |
||
|
Количество отдаленных метастазов/The number of distant metastases |
|||||
|
0 |
62 (95,4 %) |
11,2 % (5,4–27,3) |
19,4 % (10,3–32,7) |
||
|
1 |
3 (4,6 %) |
||||
|
Степень дифференцировки/Differentiation degree |
|||||
|
G1 |
1 (1,5 %) |
||||
|
G2 |
34 (52,3 %) |
10,7 % (5,4–30,5) |
18,7 % (6,6–33,0) |
||
|
G3 |
30 (46,2) |
10,9 % (5,2–19,0) |
19,4 % (12,5–32,7) |
||
Ki67
|
120 % |
10 (15,4 %) |
10,3 % (4,3–33,4) |
25,9 % (17,5–41,7) |
|
2150 % |
22 (33,8 %) |
10,3 % (7,3–30,0) |
14,9 % (12,5–33,0) |
|
51100 % |
33 (50,8 %) |
11,4 % (5,2–22,0) |
20,0 % (8,3–32,0) |
Примечание: * – (Q1Q3); ** – сравнивались наиболее представленные по численности группы: Т2 (n=29) и Т4 (n=21).
Notes: * – (Q1Q3); ** – the most represented groups were compared: T2 (n=29) and T4 (n=21).
Анализ возможной корреляции доли CD44+/CD24-/low клеток с клинико-морфологическими характеристиками опухоли
Данные о доле CD44+/CD24-/low клеток в опухолях с разными клиническими характеристиками представлены в табл. 2. Так как распределение данного параметра отличается от нормального, для его характеристики были использованы медиана и квартили. При проведении однофакторного анализа нам не удалось выявить каких-либо корреляций доли ОСК с клиническими параметрами. Только в случае наличия вовлеченных лимфоузлов наблюдалась тенденция к увеличению доли ОСК. Был проведен также множественный регрессионный анализ. При этом значимых корреляций установлено не было. Результаты, представленные по этому вопросу в литературе, очень противоречивы. В большей части работ отмечается корреляция доли ОСК с отдельными клиническими показателями [8, 14]. Чаще всего более высокая доля ОСК ассоциирована с наличием вовлеченных лимфоузлов [10, 13, 15] и отдаленными метастазами [9]. В ряде работ показано отсутствие корреляций с таблица 3/table 3
Фенотип опухоли и пролиферативный индекс Ki67
tumor phenotype and proliferative index Ki67
|
Фенотип CD44/CD24/ Phenotype CD44/CD24 |
n |
Ki67, медиана (квартили)/ Ki67, median (quartiles) |
|
+/- |
21 |
40 % (30–80) |
|
+/+ |
1 |
40 % |
|
-/+ |
35 |
60 % (30–80) |
|
-/- |
8 |
85 % (60–92)* |
Примечание: * – р=0,05 по сравнению с группой CD44+/CD24-; р =0,09 по сравнению с группой CD44-/CD24+.
Note: * – p=0.05 compared to группой CD44+/CD24- group; p=0.09 compared with CD44-/CD24+group.
какими-либо клиническими характеристиками [2, 6, 16–18]. Имеются также данные [7], в которых установлена корреляция доли CD44+/CD24-/low клеток со многими клиническими показателями, такими как возраст больных, размер опухоли, степень дифференцировки, уровень экспрессии Ki67, количество вовлеченных лимфоузлов.
Экспрессия клетками опухоли маркеров CD44 и CD24
В некоторых статьях, посвященных РМЖ, было показано, что клетки опухоли часто экспрессируют либо CD44, либо CD24 и реже позитивны по обоим маркерам [1]. Пока остается неясным, связаны ли эти различия с какими-либо клиническими показателями. Чтобы выяснить это, нами был проведен анализ четырех вариантов экспрессии маркеров CD44 и CD24 клетками опухоли. Опухоль относили к одному из возможных 4 фенотипов согласно принципу, описанному в разделе «Материал и методы».
В 21 образце из 65 (32,3 %) наиболее высокий процент составляли клетки с фенотипом CD44+/ CD24-; в 35 (53,8 %) образцах – с фенотипом CD44-/CD24+; только в 1 образце (1,5 %) выявлен высокий процент клеток (17 %), экспрессирующих оба маркера; и в 8 (12,3 %) образцах преобладали клетки с фенотипом CD44-/CD24- (все остальные фенотипы <10 %).
Для сравнения приведем данные, полученные в работе [4] при аналогичном анализе, проведенном у 145 пациентов с ТН РМЖ с помощью метода иммуногистохимии. Четыре разных фенотипа были представлены в соотношении: CD44+/CD24-(30,3 %), CD44-/CD24+ (22,8 %), CD44+/ CD24+ (3,4 %), CD44-/CD24- (43,4%). Наибольшую группу в этом исследовании представляли опухоли с двойным негативным фенотипом, тогда как в нашей работе большая часть опухолей имела фенотип CD44-/CD24+. Эти различия могут быть обусловлены гетерогенностью опухолей, взятых в анализ, и особенностями использованных методик анализа материала. Как известно, проточная цитометрия не позволяет точно идентифицировать опухолевые клетки (в отличие от метода иммуногистохимии), а иммунофенотип CD44-/CD24+ может относиться не только к опухолевым, но и стромальным клеткам, поэтому при проточноцитометрическом исследовании возможна переоценка этого иммунофенотипа при классификации опухолей.
Нами было проведено сопоставление фенотипа опухолей с клинико-морфологическими показателями. Для установления связи между фенотипом опухоли и представленными клиническими показателями был проведен множественный регрессионный анализ. При этом статистически значимая связь установлена только с уровнем экспрессии маркера клеточной пролиферации Ki67 (p=0,05) (табл. 3).
Таким образом, значения Ki67 и, следовательно, размер фракции пролиферирующих клеток статистически значимо выше в опухолях с высокой долей CD44-/CD24- клеток по сравнению с опухолями с фенотипом CD44+/CD24- (p=0,05), в то время как при сравнении их с опухолями с высокой долей CD44-/CD24+ клеток отмечается только тенденция (р =0,09). Интересно, что опухоли с высокой долей CD44+/CD24- клеток (иммунофенотип, который соответствует части ОСК) характеризовались самой низкой пролиферативной активностью по критерию экспрессии Ki67, что соответствует данным литературы и ранее полученным собственным результатам о состоянии покоя ОСК в стабильных культурах опухолевых клеток различных линий [19].
По данным ряда авторов [5, 20], преобладание CD44+/CD24- клеток чаще встречается при неблагоприятных клинических характеристиках опухолевого процесса (поздняя стадия, метастазирование в лимфоузлы), по данным других исследователей [15], – при благоприятных характеристиках. Во многих работах отмечается отсутствие корреляции какого-либо фенотипа с клиническими характеристиками опухоли [21].
Доля клеток с фенотипомCD44-/CD24+ в первичной опухоли
В ряде работ [19, 22] отмечается корреляция между экспрессией CD24 и характеристиками опухоли, имеющими неблагоприятное прогностическое значение, в частности характеристиками, определяющими тройной негативный подтип.
Большая часть (53,8 %) ТН опухолей, проанализированных нами, имела фенотип CD44-/CD24+. Как известно, CD24 является гликопротеином, принимающим участие в клеточной адгезии. Его роль в опухолевом процессе при РМЖ пока еще не ясна, но предполагают, что он может способствовать росту опухоли и ее метастазированию [3].
Клетки с фенотипом CD44-/CD24+ были обнаружены в биоптатах всех опухолей. Значения данного показателя варьировали у разных больных от 0,5 до 87,1 % и имели распределение, отличное от нормального. В 53,8 % опухолей (35/65) доля этих клеток была ≤20 %; в 30,8 % опухолей (20/65) – в интервале 20–40 %); и в остальных 10 случаях доля составляла >40 %. Медиана доли CD44-/CD24+ клеток – 10,9 %.
При сопоставлении доли клеток с фенотипом CD44-/CD24+ с клиническими характеристиками опухолей значимых корреляций не установлено (табл. 2). Наблюдалась только тенденция положительной корреляции с размером опухоли. Аналогичные данные представлены в работе [19], где показано отсутствие корреляции доли CD44-/CD24+ клеток с такими характеристиками опухоли, как размер, вовлеченность лимфоузлов, наличие отдаленных метастатических очагов. При этом была отмечена положительная корреляция с ответом на химиотерапию. При исследовании ТН опухолей получена ассоциация экспрессии CD24 с инвазивным протоковым типом [22].
Список литературы Экспрессия маркеров CD44 и CD24 в биопсийном материале больных тройным негативным раком молочной железы до лечения
- Honeth G., Bendahl P. O., Ringner M., Saal L.H., Gruvberger-Saal S.K., Lövgren K., Grabau D., Fernö M., Borg A., Hegardt C. The CD44+/ CD24- phenotype is enriched in basal-like breast tumors. Breast Cancer Res. 2008; 10(3): R53. doi: 10.1186/bcr2108.
- Ma F., Li H, Wang H., Shi X., Fan Y., Ding X., Lin C, Zhan Q, QianH., Xu B. Enriched CD44(+)/CD24(-) population drives the aggressive phenotypes presented in triple-negative breast cancer (TNBC). Cancer Lett. 2014 Oct 28; 353(2): 153-9. doi: 10.1016/j.canlet.2014.06.022.
- Shima H., Yamada A., Ishikawa T., Endo I. Are breast cancer stem cells the key to resolving clinical issues in breast cancer therapy? Gland Surg. 2017 Feb; 6(1): 82-88. doi: 10.21037/gs.2016.08.03.
- WangH., WangL., Song Y., Wang S., HuangX., Xuan Q., KangX., Zhang Q. CD44+/CD24- phenotype predicts a poor prognosis in triple-negative breast cancer. Oncol Lett. 2017 Nov; 14(5): 5890-5898. doi: 10.3892/ol.2017.6959.
- Idowu M.O., KmieciakM., Dumur C., Burton R.S., GrimesM.M., Powers C.N., Manjili M.H. CD44(+)/CD24(-/low) cancer stem/progenitor cells are more abundant in triple-negative invasive breast carcinoma phenotype and are associated with poor outcome. Hum Pathol. 2012 Mar; 43(3): 364-73. doi: 10.1016/j.humpath.2011.05.005.
- Perrone G., Gaeta L.M., Zagami M., Nasorri F., Coppola R., Bor-zomati D., Bartolozzi F., Altomare V., Trodella L., Tonini G., Santini D., Cavani A., Muda A.O. In situ identification of CD44+/CD24- cancer cells in primary human breast carcinomas. PLoS One. 2012; 7(9): e43110. doi: 10.1371/journal.pone.0043110.
- Camerlingo R., Ferraro G.A., De Francesco F., Romano M., Ni-coletti G., Di Bonito M., Rinaldo M., D'Andrea F., Pirozzi G. The role of CD44+/CD24-/low biomarker for screening, diagnosis and monitoring of breast cancer. Oncol Rep. 2014 Mar; 31(3): 1127-32. doi: 10.3892/ or.2013.2943.
- Makki J., Myint O., Wynn A.A., Samsudin A.T., John D.V. Expression distribution of cancer stem cells, epithelial to mesenchymal transition, and telomerase activity in breast cancer and their association with clinicopathologic characteristics. Clin Med Insights Pathol. 2015; 8: 1-16. doi: 10.4137/CPath.S19615.
- Abraham B.K., Fritz P., McClellan M., Hauptvogel P., Athelogou M., Brauch H. Prevalence of CD44+/CD24-/low cells in breast cancer may not be associated with clinical outcome but may favor distant metastasis. Clin Cancer Res. 2005 Feb 1; 11(3): 1154-9.
- TiezziD.G., ValejoF.A., MaranaH.R., CarraraH.H., BenevidesL., Antonio H.M., Sicchieri R.D., Milanezi C.M., Silva J.S., de Andrade J.M. CD44+/CD24- cells and lymph node metastasis in stage I and II invasive ductal carcinoma of the breast. Med Oncol. 2012; 29(3): 1479-85. doi: 10.1007/s12032-011-0014-x.
- Kai M., Onishi H., Souzaki M., Tanaka H., Kubo M., Tanaka M., KatanoM. Semi-quantitative evaluation of CD44(+) /CD24(-) tumor cell distribution in breast cancer tissue using a newly developed fluorescence immunohistochemical staining method. Cancer Sci. 2011; 102(12): 2132-8. doi: 10.1111/j.1349-7006.2011.02063.x.
- Guler G., Balci S., Costinean S., Ussakli C.H., Irkkan C., SurenD., SariE., AltundagK., Ozisik Y., Jones S., Bacher J., Shapiro C.L., HuebnerK. Stem cell-related markers in primary breast cancers and associated metastatic lesions. Mod Pathol. 2012 Jul; 25(7): 949-55. doi: 10.1038/ modpathol.2012.37.
- Zhong Y., Shen S., Zhou Y., Mao F., Guan J., Lin Y., Xu Y., Sun Q. ALDH1 is a better clinical indicator for relapse of invasive ductal breast cancer than the CD44+/CD24- phenotype. Med Oncol. 2014 Mar; 31(3): 864. doi: 10.1007/s12032-014-0864-0.
- Liu C., Luo Y., Liu X., Lu P., Zhao Z. Clinical implications of CD44+/CD24- tumor cell ratio in breast cancer. Cancer Biother Radiop-harm. 2012 Jun; 27(5): 324-8. doi: 10.1089/cbr.2011.1155.
- 15.MylonaE., GiannopoulouI., FasomytakisE.,NomikosA.,Magkou C., Bakarakos P., Nakopoulou L. The clinicopathologic and prognostic significance of CD44+/CD24(-/low) and CD44-/CD24+ tumor cells in invasive breast carcinomas. Hum Pathol. 2008 Jul; 39(7): 1096-102. doi: 10.1016/j.humpath.2007.12.003.
- LuX., Xu K., Lu H., Yin Y., Ma C., Liu Y., Li H., Suo Z. CD44(+)/ CD24(-) cells are transit progenitors and do not determine the molecular subtypes and clinical parameters in breast carcinomas. Ultrastruct Pathol. 2011 Apr; 35(2): 72-8. doi: 10.3109/01913123.2010.544843.
- Uchôa Dde M., Graudenz M.S., Callegari-Jacques S.M., Hartmann C.R., FerreiraB.P., Fitarelli-KiehlM., EdelweissM.I. Expression of cancer stem cell markers in basal and penta-negative breast carcinomas--a study of a series of triple-negative tumors. Pathol Res Pract. 2014 Jul; 210(7): 432-9. doi: 10.1016/j.prp.2014.03.005.
- Yang F., Cao L., Sun Z., Jin J., Fang H., Zhang W., GuanX. Evaluation of Breast Cancer Stem Cells and Intratumor Stemness Heterogeneity in Triple-negative Breast Cancer as Prognostic Factors. Int J Biol Sci. 2016 Dec 7; 12(12): 1568-1577. doi: 10.7150/ijbs.16874.
- Матчук О.Н., Замулаева И.А., Ковалев О.А., Саенко А.С. Механизмы радиорезистентности клеток sp культуры мышиной меланомы В16. Цитология. 2013; 55(8): 553-9. [Matchuk O.N., Za-mulaeva I.A., Kovalev O.A., Saenko A.S. Radioresistance mechanisms of side population cells in mouse melanoma cell line B16. Tsitologiia. 2013; 55(8): 553-9. (in Russian)].
- Chen Y, Song J, Jiang Y, Yu C., Ma Z. Predictive value of CD44 and CD24 for prognosis and chemotherapy response in invasive breast ductal carcinoma. Int J Clin Exp Pathol. 2015; 8(9): 11287-11295.
- KapucuogluN, BozkurtK.K., Baqpmar ¡¡¡., KoferM., Eroglu H.E., AkdenizR., AkfilM. The clinicopathological and prognostic significance of CD24, CD44, CD133, ALDH1 expressions in invasive ductal carcinoma of the breast: CD44/CD24 expression in breast cancer. Pathol Res Pract. 2015 Oct; 211(10): 740-7. doi: 10.1016/j.prp.2015.05.011.
- Collina F., Di Bonito M., Li Bergolis V., De Laurentiis M., Vita-gliano C, Cerrone M., Nuzzo F., Cantile M., Botti G. Prognostic Value of Cancer Stem Cells Markers in Triple-Negative Breast Cancer. Biomed Res Int. 2015; 2015: 158682. doi: 10.1155/2015/158682.


