Экспрессия рецепторов цитокинов с общей y-цепью как маркеров функциональных фенотипов PD-1- и TIM-3-позитивных Т-клеток при множественной миеломе
Автор: Баторов Е.В., Аристова Т.А., Ушакова Г.Ю., Сизикова С.А., Денисова В.В., Шевела Е.Я., Останин А.А., Черных Е.Р.
Журнал: Сибирский онкологический журнал @siboncoj
Рубрика: Лабораторные и экспериментальные исследования
Статья в выпуске: 1 т.22, 2023 года.
Бесплатный доступ
Т-клетки, экспрессирующие чек-поинт рецепторы PD-1, TIM-3 и др., являются потенциальной мишенью для таргетной иммунотерапии при множественной миеломе (ММ), однако включают в себя различные популяции клеток, дисрегуляция которых может приводить к развитию нежелательных реакций. Целью исследования явилось изучение маркеров активации, рецепторов гомеостатических цитокинов и транскрипционных факторов, экспрессируемых PD-1- и TIM-3-позитивными Т-клетками у больных ММ на этапе индукционной терапии. Материал и методы. Было исследовано относительное содержание циркулирующих PD-1- и/или TIM-3-позитивных и негативных Т-клеток, экспрессирующих рецепторы цитокинов с общей γ-цепью CD25, CD122, CD127, фосфорилированный STAT5 и транскрипционный фактор EOMES, ассоциированный с Т-клеточным истощением, методом проточной цитометрии у 17 здоровых доноров, 22 больных ММ в состоянии ремиссии и 7 больных ММ с прогрессирующим течением. Результаты. Пул T-лимфоцитов, экспрессирующих ингибиторные чек-поинт рецепторы PD-1 и/или TIM-3, у больных ММ включал в себя: CD25+EOMES- активированные клетки, CD4+CD25+CD127-FOXP3+ регуляторные Т-клетки (Трег), CD4+CD25-EOMES+ дисфункциональные клетки. CD25+ Т-клетки здоровых доноров и больных ММ независимо от экспрессии исследованных чек-поинт рецепторов были EOMES-негативными. Не выявлено такой ассоциации для рецепторов цитокинов CD122 и CD127. EOMES в большей степени является маркером Т-клеточного истощения для CD4+ Т-клеток, но не для CD8+ Т-клеток, в которых он более ассоциирован с активацией. Доля CD4+ Трег среди циркулирующих PD-1+ и TIM-3+ Т-клеток была относительно невысока. Более высокое содержание рецепторов цитокинов в популяции TIM-3+ Т-клеток может свидетельствовать о преимущественном вовлечении TIM-3 в контроль гомеостатической пролиферации зрелых Т-клеток в условиях лимфопении, в то время как экспрессия PD-1 может быть более ассоциирована с регуляцией активации через Т-клеточной рецептор. Уровни PD-1+ и/или TIM-3+ активированных, дисфункциональных и регуляторных Т-клеток в перспективе могут быть использованы для прогноза безопасности и эффективности таргетной иммунотерапии.
Множественная миелома, pd-1, tim-3, cd25, cd122, eomes, т-клеточное истощение, регуляторные т-клетки
Короткий адрес: https://sciup.org/140297843
IDR: 140297843 | УДК: 616-006.448:612.112.94 | DOI: 10.21294/1814-4861-2023-22-1-43-54
Текст научной статьи Экспрессия рецепторов цитокинов с общей y-цепью как маркеров функциональных фенотипов PD-1- и TIM-3-позитивных Т-клеток при множественной миеломе
Множественная миелома (ММ), второе по распространенности опухолевое заболевание системы крови, остается неизлечимым состоянием, несмотря на разработку и внедрение в практику ингибиторов протеасом и иммуномодулирующих препаратов (леналидомид, помалидомид), а также высокодозной химиотерапии с трансплантацией аутологичных гемопоэтических стволовых клеток (ауто-ТГСК) [1, 2].
Ранее было показано, что при ММ, как и при большинстве других опухолей, повышено содержание Т-клеток, экспрессирующих ингибиторные сигнальные («чек-поинт») рецепторы PD-1, TIM-3 и др. [3–6]. Транзиторная экспрессия чек-поинт рецепторов ассоциирована с активацией Т-клеток, а устойчивая – с Т-клеточным истощением, состоянием дисфункции Т-клеток памяти, возникающим при длительной антигенной стимуляции [7]. Контакт экспрессированных на опухолевых и стромальных клетках и растворимых чек-поинт лигандов (PD-L1/PD-L2 для PD-1, галектин-9 для TIM-3 и т.д.) с «истощенными» Т-клетками приводит к значительному ослаблению функциональной активности последних. Состояние Т-клеточного истощения обратимо на ранних этапах, блокада чек-поинт молекул моноклональными антителами предотвращает ускользание опухоли из-под иммунного надзора [7, 8].
Попытки использования моноклональных антител (ингибиторов чек-поинт рецептора PD-1), эффективных при ряде солидных опухолей и лимфоме Ходжкина, при ММ сопровождались снижением показателей выживаемости вследствие частого развития нежелательных явлений и низкой частоты объективного ответа на терапию [9, 10]. Неудовлетворительный ответ на таргетную анти-PD-1 терапию при ММ и большинстве неходжкинских лимфом может быть связан не с восстановлением функции истощенных Т-клеток, а с нарушением регулирования активированных Т-клеток, например, вирус-специфических или аутореактивных популяций, а также регуляторных Т-клеток (Трег). Ранее была показана возможность экспрессии PD-1 и TIM-3 эффекторными Т-клетками при стимуляции цитокинами с общей γ-цепью (IL-2, IL-7, IL-15, IL-21) in vitro и в процессе гомеостатической пролиферации in vivo [11–13], блокада ингибиторами чек-поинт молекул также может приводить к нарушению регуляции пролиферирующих Т-клеток с последующим развитием аутоиммунных нежелательных реакций. Также могут отличаться свойства Т-клеток, экспрессирующих разные ингибиторные сигнальные молекулы; по-видимому, TIM-3+ и особенно PD-1+TIM-3+Т-клетки относятся к более «истощенным» по сравнению с PD-1+, в значительной мере сохраняющим цитотоксический и цитокин-продуцирующий потенциал [6]. Изучение дополнительных фенотипических маркеров функционального состояния Т-клеток, экспрессирующих чек-поинт рецепторы, вероятно, позволит прогнозировать развитие иммуноопосредованных побочных реакций таргетной иммунотерапии.
Целью исследования явилось изучение маркеров активации, рецепторов гомеостатических цитокинов и транскрипционных факторов, экспрессируемых PD-1- и TIM-3-позитивными Т-клетками.
Материал и методы
В исследование включено 29 больных ММ (таблица), находившихся на стационарном лечении в отделении гематологии с февраля 2021 г. по апрель 2022 г. Данным пациентам ранее не проводили высокодозную химиотерапию с ауто-ТГСК. В качестве группы сравнения было обследовано 17 здоровых доноров, сопоставимых по полу и возрасту. Исследования проводились после получения от всех участников письменного информированного согласия и были одобрены решением локального этического комитета НИИФКИ. Набор образцов периферической крови (ПК) проводили перед очередным курсом химиотерапии при абсолютном содержании лейкоцитов более 1×109/л.
Лизис эритроцитов проводили раствором VersaLyse («Beckman Coulter», Франция) в соответствии с инструкцией. Методом проточной цитометрии оценивали относительное содержание субпопуляций Т-клеток, позитивных по одному из ингибиторных сигнальных рецепторов (PD-1 или TIM-3) – PD-1+TIM-3- и TIM-3+PD-1-, а также двойных позитивных PD-1+TIM-3+ клеток в пуле CD4+ и CD8+ T-лимфоцитов, используя анти-CD3 (FITC, PerCP), анти-CD8 (FITC, PE-Cy7), анти-CD4 (FITC, PerCP), анти-PD-1 (APC), анти-TIM-3 (PE, PerCP/Cy 5.5, BV421) моноклональные антитела («BD Biosciences», “Biolegend”, США). В каждой из PD-1- и/или TIM-3-позитивных субпопуляций, а также в CD4+ и CD8+ Т-клетках, не экспрессирующих ингибиторные сигнальные рецепторы PD-1 и TIM-3 (PD-1-TIM-3-), оценивали относительное содержание клеток, экспрессирующих рецепторы гомеостатических цитокинов/поверхностных маркеров активации: CD25 (PE), CD122 (BV510), CD127 (Alexa Fluor 647). Также проведена оценка внутриклеточного содержания фосфорилированного преобразователя сигнала и активатора транскрипции 5 (STAT5, signal transducer and
Таблица/Table
Характеристика пациентов Patient characteristics
Показатель/Characteristics Значение/Value
Возраст, годы; медиана (мин-макс)/Age, years; median (min-max) 57 (37–64)
Пол, женщины/мужчины/Gender, female/male17/12
Стадия по Durie–Salmon/Durie–Salmon stage II11
III18
Вариант/Types
IgG18
IgA7
Бенс–Джонса/Bence Jones3
Нет данных/Not available1
Ответ на терапию на момент исследования/Disease status at the time of the study
Полная ремиссия, очень хороший частичный ответ/
Complete remission, very good partial response Частичный ответ/Partial remission14
Минимальный ответ, рецидивирующая/рефрактерная множественная миелома/
Minimal response, relapsed/refractory multiple myeloma
Количество режимов химиотерапии перед исследованием/
Chemotherapy regimens before the analysis
-
1 (бортезомиб-содержащие режимы)/
1 (bortezomib-based regimens)
-
2 (+ леналидомид-содержащие режимы или DCEP/EDAP/
-
2 (+ lenalidomide-containing regimens or DCEP/EDAP)
≥3 (+ леналидомид-содержащие режимы + DCEP/EDAP/
≥3 (+ lenalidomide-containing regimens + DCEP/EDAP)
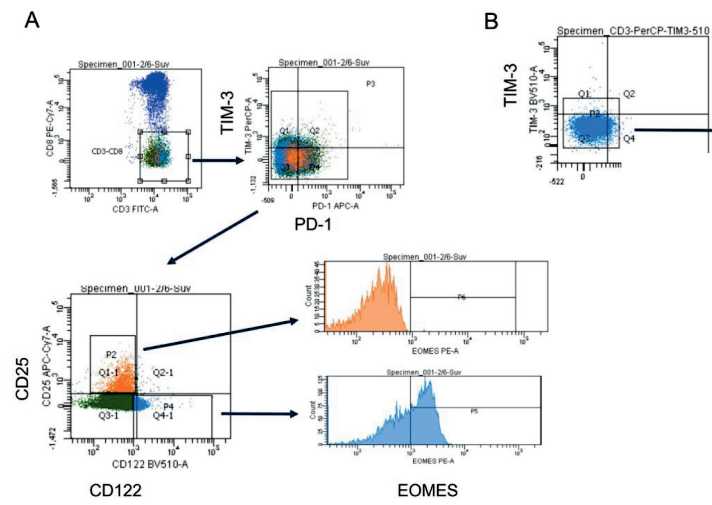
activator of transcription 5), транскрипционных факторов EOMES и FOXP3 (анти-pSTAT5 (PE, BD Biosciences), анти-EOMES (PE, Invitrogen), анти-FOXP3 (PerCP-Cy 5.5, BD Biosciences) соответственно). Для изучения pSTAT5 106 монону-клеарных клеток (МНК) активировали в течение 15 мин с интерлейкином-2 (IL-2; «Ронколейкин®», «БИОТЕХ НПК», Россия; конечная концентрация 100 нг/мл суспензии клеток), после чего обрабатывали рекомендуемым фиксирующим раствором BD Fix Buffer I и пермеабилизировали ледяным раствором BD Perm Buffer III (содержит 87,68 % метанол) при -20 °С на льду в соответствии с инструкцией. Фиксацию и пермеабилизацию МНК для оценки внутриклеточной экспрессии EOMES и FOXP3 проводили после инкубации клеток с моноклональными антителами против поверхностных антигенов; использовали набор растворов для фиксации/пермеабилизации Transcription Factor Buffer Set («BD Biosciences»). В качестве контролей были использованы набор контрольных частиц BD™ CompBeads Anti-mouse Ig, κ/Negative Control Compensation Particles Set, немеченые МНК, оценка флюоресценции всех маркеров, кроме одного (“fluorescence-minus-one”). Содержание погибших клеток оценивали по включению 7-AAD. Исследование проводили по общепринятой методике с использованием параметров прямого и бокового светорассеяния и флюоресценции на проточном цитометре FACS Canto II (BD Biosciences). Анализ проводили после накопления 5×104-105 событий в регионе CD8+ Т-клеток. Стратегия гейтирования представлена на рис. 1.
Статистическую обработку данных проводили с помощью пакета программ Statistica 6.0 (StatSoft). Для оценки значимости различий между независимыми группами использовали U-критерий Манна–Уитни. Для оценки значимости различий зависимых выборок использовали критерий Вил-коксона для парных выборок. Данные в тексте и таблицах представлены в виде медианы и интерквартильного диапазона, если не указано другого. Различия считали статистически значимыми при р<0,05 (двустороннем).
Результаты
Относительное содержание PD-1- и TIM-3-позитивных субпопуляций Т-клеток представлено на рис. 2. Количество CD4+PD-1+TIM-3+ и CD8+PD-1+TIM-3+Т-клеток ПК было выше у больных ММ в ремиссии по сравнению со здоровыми донорами. Содержание исследуемых популяций было выше у больных с прогрессирующим течением по сравнению как с донорами, так и с пациентами в состоянии ремиссии (кроме CD4+TIM-3+ и CD8+TIM-3+ Т-клеток).
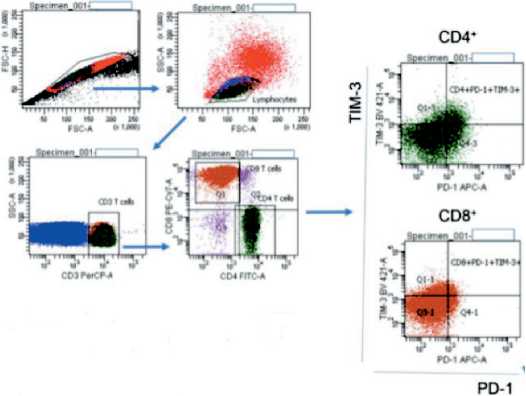
Рис. 1. Стратегия гейтирования Т-клеток, экспрессирующих ингибиторные сигнальные молекулы PD-1 и TIM-3 и маркеры активации CD25, CD122 больного множественной миеломой.
Представлены данные репрезентативного пациента
Fig. 1. Gating strategy of T cells expressing inhibitory signal molecules PD-1 and TIM-3 and activation markers CD25, CD122 in multiple myeloma patient. Representative multiple myeloma patient data are presented
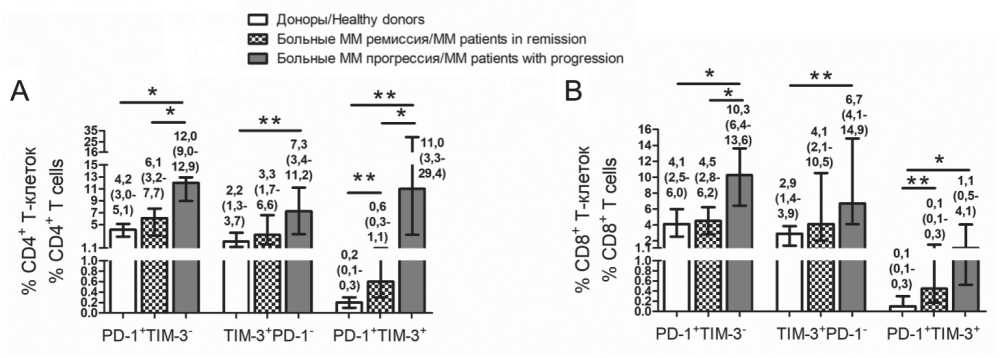
Рис. 2. Относительное содержание PD-1+ и TIM-3+ субпопуляций Т-клеток периферической крови здоровых доноров и больных множественной миеломой. Представлено относительное количество PD-1+TIM-3-, TIM-3+PD-1- и PD-1+TIM-3+ CD4+ (А) и CD8+ (В) Т-клеток в ПК здоровых доноров (n=17), больных ММ в состоянии ремиссии (n=22) и с прогрессирующим течением (n=7).
Значимость различий: * – pu<0,05, ** – pu<0,005 по U-критерию Манна–Уитни
Fig. 2. Relative counts of PD-1+ and TIM-3+ T cell subsets in peripheral blood of healthy donors and multiple myeloma patients. Relative counts of PD-1+TIM-3-, TIM-3+PD-1-, PD-1+TIM-3+ CD4+ (А) and CD8+ (В) Т cells in peripheral blood of healthy donors (n=17), MM patients in remission (n=22) and with progressive disease (n=7) are presented. P-values are assessed with Mann–Whitney U-test.
* – pu<0.05, ** – pu<0.005
Для оценки функционального потенциала проведено сравнительное исследование экспрессии рецепторов цитокинов/маркеров активации CD25, CD122, CD127 четырьмя популяциями T-клеток, различающихся по экспрессии ингибиторных рецепторов PD-1 и TIM-3 – PD-1-TIM-3-, PD-1+TIM-3-, TIM-3+PD-1-, PD-1+TIM-3+, в образцах ПК здоровых доноров, больных ММ в состоянии ремиссии и у пациентов с прогрессией болезни.
У здоровых доноров PD-1- и TIM-3-позитивные популяции CD4+ и CD8+ T-клеток отличались более высокой долей CD122+ клеток по сравнению с PD-1-TIM-3- клетками. Среди СD4+PD-1+TIM-3+ клеток было выше относительное количество CD25+ и CD122+ клеток по сравнению с PD-1+ и TIM-3+ популяциями (рис. 3А). Доля CD122+ клеток была выше среди TIM-3+ и PD-1+TIM-3+ СD8+ T-клеток по сравнению с PD-1-ТIM-3- и PD-1+ популяциями (рис. 3В).
Различия между Т-клетками, изолированно экспрессирующими PD-1 или TIM-3, были более выражены у больных ММ в ремиссии заболевания. Большее относительное количество TIM-3+ и PD-1+TIM-3+ СD4+и СD8+ T-клеток экспрессировали рецепторы цитокинов с общей γ-цепью CD25, CD122, CD127 по сравнению с PD-1-ТIM-3- и PD-1+ Т-клетками, при этом среди PD-1+ Т-клеток доля CD25+ и CD127+ клеток была значимо ниже по сравнению с PD-1-ТIM-3- клетками (рис. 3C-D).
У больных ММ с прогрессированием болезни не было различий по экспрессии рецепторов гомеостатических цитокинов между PD-1-ТIM-3-и PD-1+ CD4+ клетками. Доля CD25+ клеток была значимо выше в субпопуляциях TIM-3+ и PD-1+TIM-3+ СD4+ Т-клеток, а CD122+ клеток – в PD-1+TIM-3+ СD4+ Т-клетках по сравнению с PD-1+ СD4+ Т-клетками (рис. 3Е). В пуле CD8+TIM-3+ Т-клеток было выше содержание CD25+ клеток по сравнению с PD-1+ популяцией, и CD122+ клеток – по сравнению с PD-1-ТIM-3- клетками (рис. 3F).
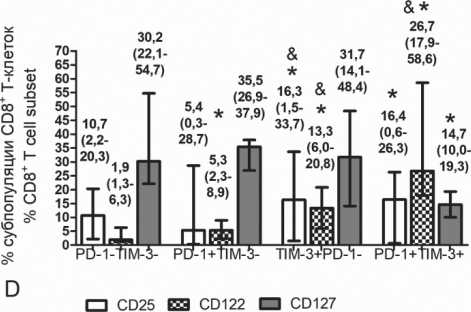
По сравнению со здоровыми донорами у больных ММ в ремиссии повышено содержание CD25+ клеток в пуле CD4+TIM-3+ Т-клеток (pu=0,039). У больных с прогрессирующим течением была выше доля CD122+ клеток среди CD4+PD-1+ и CD4+PD-1-ТIM-3- Т-клеток по сравнению со здоровыми донорами (pu=0,012 и pu=0,0061 соответственно) и больными ММ в ремиссии (pu=0,032 и pu=0,013 соответственно). У больных ММ с прогрессированием заболевания повышено содержание CD122+ клеток в пуле CD8+PD-1+ Т-клеток по сравнению со здоровыми донорами и больными в ремиссии (pu=0,047 и pu=0,015 соответственно) и среди CD8+TIM-3+ Т-клеток по сравнению с больными в ремиссии (pu=0,049). У больных ММ в ремиссии и с прогрессирующим течением было значимо меньшее количество CD127+ CD8+PD-1+ клеток по сравнению с донорами (pu=0,0025 и pu=0,045 соответственно). Эффекты гомеостатических цитокинов, передаваемые через рецепторы с общей γ-цепью (CD25, CD122, CD127, CD132), реализуются посредством активации-фосфорилирования STAT5 [14]. Состояние Т-клеточного истощения и в ряде случаев активации ассоциировано с транскрипционным фактором EOMES [15–17]. Была проведена оценка внутриклеточного содержания фосфорилированного STAT5 (pSTAT5) и EOMES в PD-1-TIM-3-, PD-1+, TIM-3+, PD-1+TIM-3+Т-клетках. CD4+ и CD8+ Т-клетки доноров и больных ММ сохраняли способность продуцировать pSTAT5 независимо от экспрессии PD-1 и TIM-3 (рис. 4). Значимое снижение pSTAT5+ клеток отмечено только среди CD4+TIM-3+ субпопуляции по сравнению с PD-1-TIM-3-и PD-1+CD4+ Т-клетками (рис. 4С).
У здоровых доноров и у больных ММ большинство PD-1- и TIM-3-позитивных популяций CD4+ и CD8+ T-клеток отличалось более высокой долей EOMES+ клеток по сравнению с PD-1-TIM-3- популяцией (рис. 4). При этом CD4+ Т-клетки, не экспрессировавшие PD-1 и TIM-3, у доноров и больных в ремиссии содержали незначительное количество EOMES+ клеток (5,4 и 4,6 % по медианам, соответственно), в то время как среди CD8+PD-1-TIM-3- Т-клеток содержание EOMES+ популяции составляло 27,9 и 39,4 % для доноров и больных в ремиссии соответственно. Это может свидетель- ствовать о разных функциях данного транскрипционного фактора в CD4+ и CD8+ Т-клетках.
Относительное содержание EOMES+ CD8+TIM-3+ клеток у доноров было значимо ниже по сравнению с CD8+PD-1+TIM-3+ клетками (рис. 4В); количество EOMES+ CD8+TIM-3+ клеток у больных ММ независимо от течения болезни было значимо ниже по сравнению с CD8+PD-1+ и CD8+PD-1+TIM-3+ клетками (рис. 4D, F).
У больных ММ с прогрессирующим течением было значимо выше количество EOMES+ клеток в популяции CD4+ Т-лимфоцитов независимо от
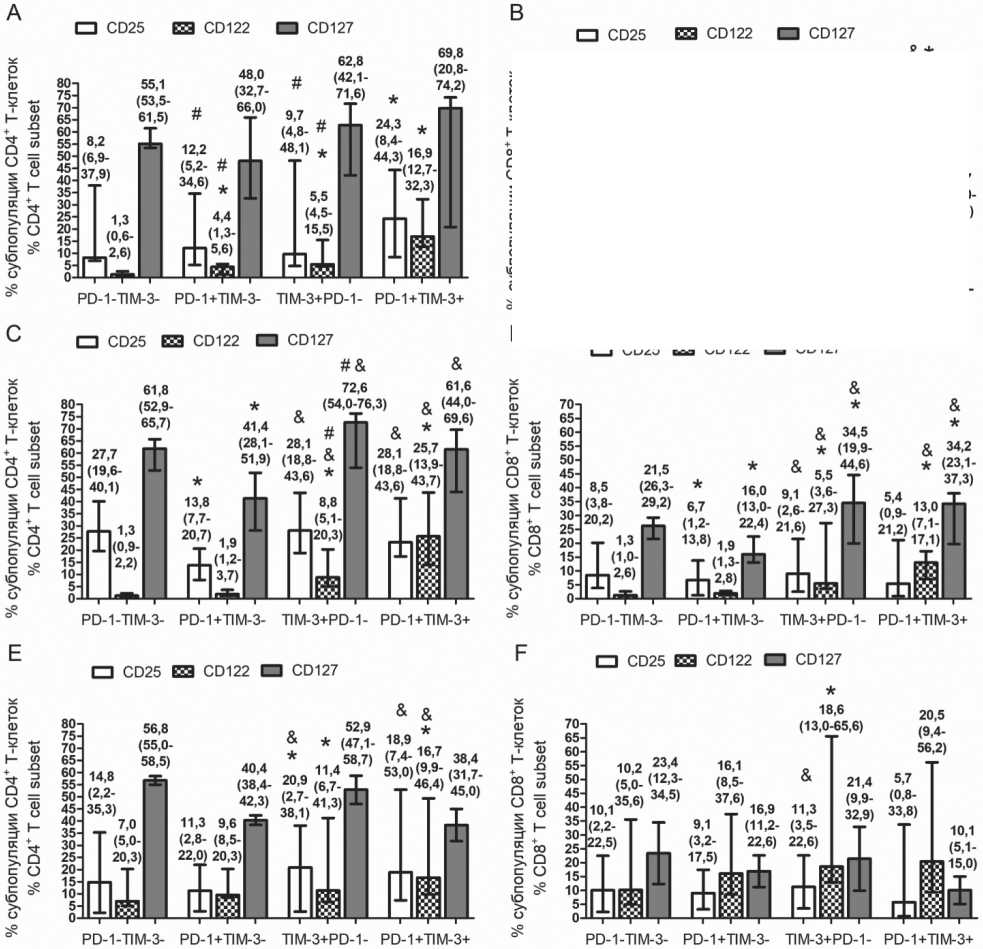
Рис. 3. Доля клеток, экспрессирующих рецепторы цитокинов CD25, CD122, CD127, в PD-1- и TIM-3-позитивных и негативных субпопуляциях Т-клеток периферической крови здоровых доноров и больных множественной миеломой. Представлено относительное количество CD25+, CD122+, CD127+ клеток среди PD-1-и TIM-3-позитивных и негативных CD4+ и CD8+ Т-клеток в ПК здоровых доноров (n=17) (А, В), больных ММ в состоянии ремиссии (n=19) (С, D) и с прогрессирующим течением (n=7) (E, F).
Значимость различий p<0,05 по критерию Вилкоксона для парных выборок:
* – p<0.05 comparing with PD-1-TIM-3- cells; #– р<0.05 comparing with PD-1+TIM-3+ cells; & – р<0.05 comparing with PD-1+TIM-3- cells
экспреcсии PD-1 и TIM-3 по сравнению с донорами (pu<0,05 для всех исследованных субпопуляций).
Интересно, что все CD25+ Т-клетки здоровых доноров и больных ММ, являясь pSTAT5+, независимо от экспрессии исследованных чек-поинт рецепторов были EOMES-негативными (рис. 5). Ранее такой закономерности не описано. Не выявлено такой ассоциации для рецепторов цитокинов CD122 и CD127.
Регуляторные Т-клетки, обладающие супрессорной активностью, также могут экспрессировать чек-поинт рецепторы PD-1 и TIM-3. Относительное содержание циркулирующих CD4+CD25hiCD127-FOXP3+ Трег составило 1,5 % (1,3–1,9 %), 1,9 % (1,4-2,2 %), 3,5 % (1,3-5,9 %) у здоровых доноров, больных ММ в ремиссии и больных ММ с прогрессированием болезни соответственно.
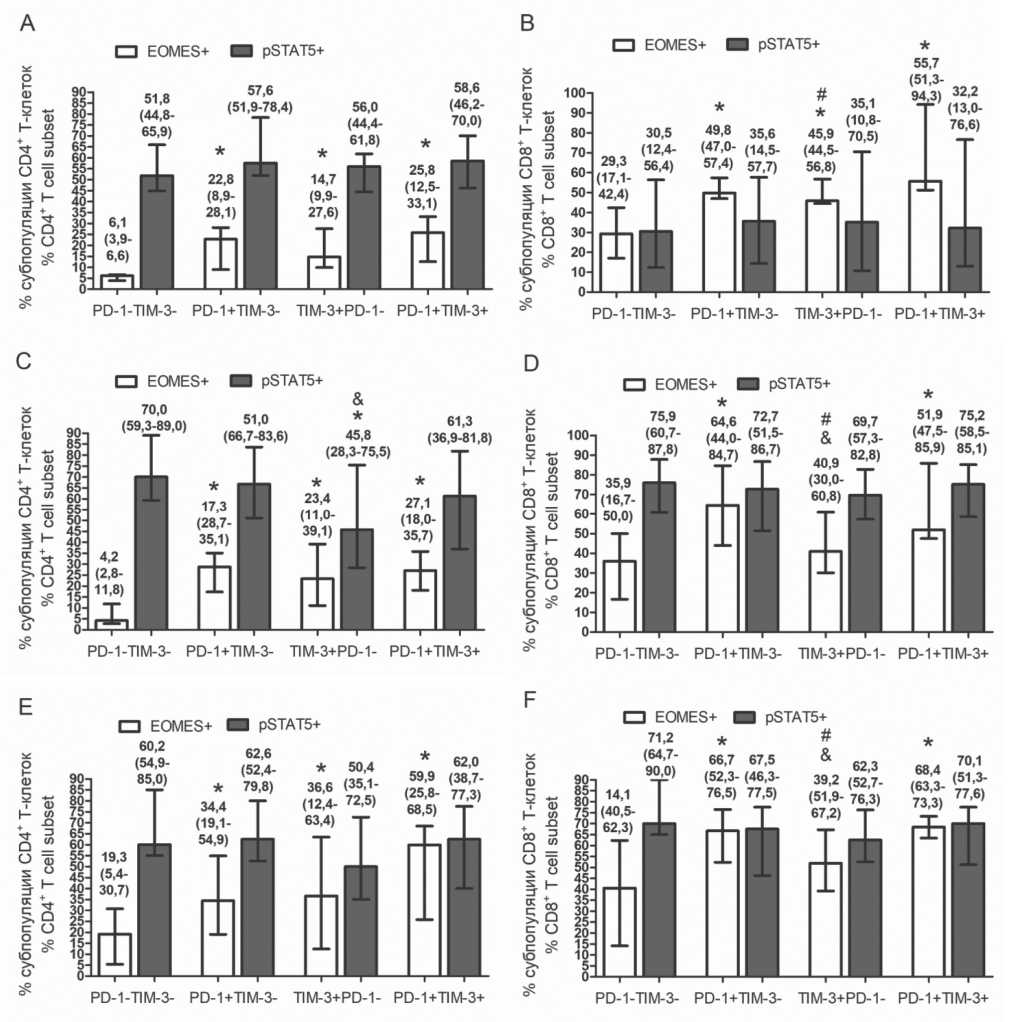
Рис. 4. Доля клеток, внутриклеточно экспрессирующих pSTAT5 и EOMES, в PD-1- и TIM-3-позитивных и негативных субпопуляциях Т-клеток периферической крови здоровых доноров и больных множественной миеломой. Представлено относительное количество EOMES+ и pSTAT5+ клеток среди PD-1-и TIM-3-позитивных и негативных CD4+ и CD8+ Т-клеток в ПК здоровых доноров (n=10) (А, В) больных ММ в состоянии ремиссии (n=9) (С, D) и с прогрессирующим течением (n=6) (E, F). Значимость различий р<0,05 по критерию Вилкоксона для парных выборок:
* - по сравнению с PD-1 — TIM-3- клетками; # - по сравнению с PD-1 + TIM-3 + клетками: & - по сравнению с PD-1 + TIM-3- клетками Fig. 4. Frequencies of cells with intracellular expression pSTAT5 и EOMES in PD-1- and TIM-3-positive and negative Т cell subsets in peripheral blood of healthy donors and multiple myeloma patients. Relative counts of EOMES+ and pSTAT5+ cells in PD-1- and TIM-3positive and negative CD4+ and CD8+ Т cells in peripheral blood of healthy donors (n=10) (A, B), MM patients in remission (n=9) (C, D) and with progressive disease (n=6) (E, F) are presented.
P-values are assessed with Wilcoxon matched pairs test: * – p<0.05 comparing with PD-1-TIM-3- cells; #– p<0.05 comparing with PD-1 + TIM-3 + cells; & - p<0.05 comparing with PD-1 + TIM-3-cells
П|-----1 I I Hill] I I II ПП| I to3 10* 10s
PD-1 APC-A
PD-1
Specimen CD3-PerCP-TIM3-510-14
Q
Ql-l
Q3-T
Q4-1
pSTATS PE-A pSTAT5
Рис. 5. CD25+ Т-клетки не экспрессируют транскрипционный фактор EOMES. CD25+ CD4+ Т-клетки не содержат EOMES+ клеток независимо от экспрессии чек-поинт рецепторов PD-1 и TIM-3 (А). Значительная часть СD122+ CD4+ Т-клеток EOMES-позитивна (А). CD25+ CD4+ Т-клетки являются pSTAT5+ независимо от экспрессии чек-поинт рецепторов PD-1 и TIM-3 (В).
Представлены данные репрезентативного пациента Fig. 5. CD25+ Т cells did not express transcription factor EOMES. CD25+ CD4+ Т cells were EOMES-negative irrespectively of checkpoint receptor PD-1 and TIM-3 expression (A). A substantial part of CD122+ CD4+ Т cells were EOMES-positive (A). CD25+ CD4+ Т cells were pSTAT5-positive irrespectively of checkpoint receptor PD-1 and TIM-3 expression (B). Representative multiple
myeloma patient data are presented
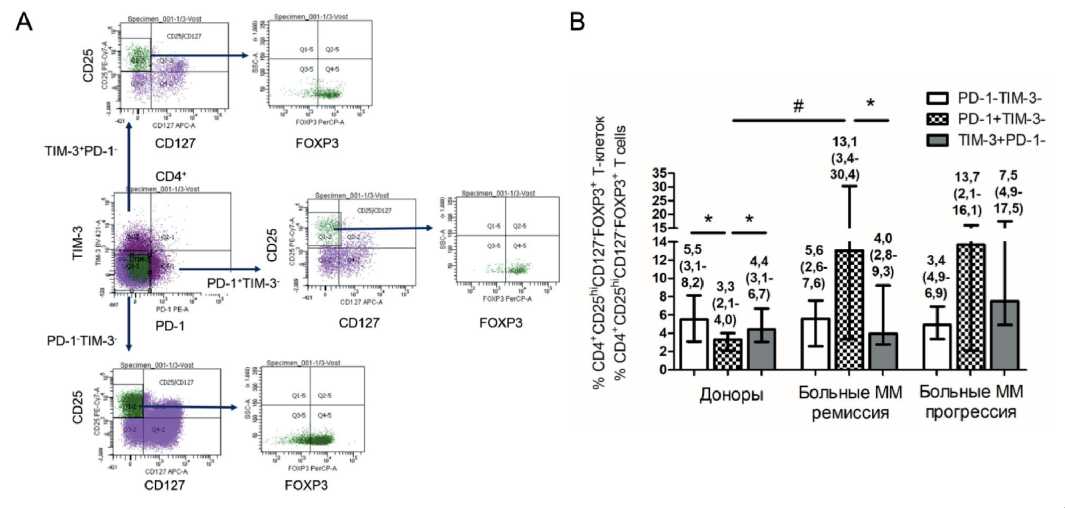
Рис. 6. Доля CD4+CD25hiCD127-FOXP3+ регуляторных Т-клеток в PD-1- и TIM-3-позитивных и негативных субпопуляциях Т-клеток периферической крови здоровых доноров и больных множественной миеломой. Представлены (А) стратегия гейтирования репрезентативного пациента и (В) относительное количество CD4+CD25hiCD127-FOXP3+ Трег среди CD4+PD-1-TIM-3-, CD4+PD-1+, CD4+TIM-3+ Т-клеток в ПК здоровых доноров (n=12), больных ММ в состоянии ремиссии (n=11) и с прогрессирующим течением (n=6). Значимость различий: * – p<0,05 по критерию Вилкоксона для парных выборок; # – pu<0,05 по U-критерию Манна–Уитни Fig. 6. Frequencies of CD4+CD25hiCD127-FOXP3+ regulatory Т cells in PD-1- and TIM-3-positive and negative Т cell subsets in peripheral blood of healthy donors and multiple myeloma patients. Gating strategy (A) and relative counts of CD4+CD25hiCD127-FOXP3+ regulatory Т cells in CD4+PD-1-TIM-3-, CD4+PD-1+, CD4+TIM-3+ Т cells in peripheral blood of healthy donors (n=12), MM patients in remission (n=11) and with progressive disease (n=6) are presented. P-values are assessed with Wilcoxon matched pairs test (* – p<0.05) and with Mann–Whitney U-test (#– pu<0.05)
Содержание Трег среди CD4+PD-1+ Т-клеток было значимо выше у больных ММ в ремиссии по сравнению со здоровыми донорами. Относительное количество Трег в пуле CD4+TIM-3+ Т-клеток не отличалось от CD4+PD-1-TIM-3- популяции у здоровых доноров и больных ММ, а также между донорами и больными ММ (рис. 6).
Обсуждение
Клинические испытания анти-PD-1 моноклональных антител при рецидивирующей/рефрак-терной ММ были прерваны в связи с тяжелыми побочными реакциями и снижением показателей выживаемости [9, 10]. Неудовлетворительный ответ на таргетную иммунотерапию может быть следствием чрезмерной активации PD-1+ Т-клеток, пул которых включает в себя истощенные, активированные, пролиферирующие под влиянием цитокинов с общей ɣ-цепью эффекторные Т-клетки, а также Трег [13, 18]. В этой связи представляется важным поиск доступных маркеров функционального состояния Т-клеток с фенотипом активиро-ванных/истощенных. Настоящая работа посвящена сравнительной характеристике циркулирующих PD-1- и TIM-3-позитивных Т-клеток, экспрессирующих рецепторы цитокинов с общей ɣ-цепью, у здоровых лиц и у больных ММ. В представленном исследовании, как и в большинстве более ранних работ, показано увеличение Т-клеток, экспрессирующих чек-поинт рецепторы, при ММ; неблагоприятное течение заболевания ассоциировано с увеличением экспрессии чек-поинт молекул [3–6].
По сравнению с донорами и больными ММ в ремиссии у больных ММ с прогрессирующим течением увеличено содержание CD8+PD-1+ и CD8+TIM-3+ Т-клеток, экспрессирующих CD122, β-цепь рецептора IL-2 и IL-15. CD8+CD122+ Т-клетки человека, как правило, относят к активированным клеткам памяти и, реже, к CD8+ регуляторным Т-клеткам [19–22]. В мышиной модели CD8+PD-1+CD122+ продуцировали IL-10 и предотвращали отторжение аллотрансплантата [23, 24]. Значение экспрессии PD-1 и TIM-3 этой субпопуляцией у человека в норме и при патологии неизвестно и требует дальнейшего изучения.
Часть PD-1+ и TIM-3+Т-клеток экспрессировали CD25, высокоаффинную ɑ-цепь рецептора IL-2. Увеличение экспрессии CD25 контролируется pSTAT5 и наблюдается при активации Т-лимфоцитов через Т-клеточный рецептор и при гомеостатической пролиферации. Нами впервые показано, что CD25+ Т-клетки здоровых доноров и больных ММ не экспрессировали транскрипционный фактор EOMES, ассоциируемый с Т-клеточным истощением и терминальной активацией [15–17]. Для других рецепторов гомеостатических цитокинов такой связи выявлено не было. Таким образом, CD25 может заменить внутриклеточное определение EOMES для оценки функционального состояния Т-клеток. Вероятнее всего, коэкспрессия CD25 и чек-поинт рецепторов могут быть индикатором активированных (неистощенных) и/или пролиферирующих в условиях лимфопении Т-клеток, учитывая выявленную сохранную способность PD-1+ и TIM-3+ Т-клеток фосфорилировать STAT5 при кратковременной стимуляции IL-2, а также маркером активированных CD4+CD25+CD127-FOXP3+ естественных регуляторных Т-клеток.
В нашем исследовании относительно небольшая часть TIM-3+ и несколько бóльшая PD-1+ CD4+CD25+ Т-клеток больных ММ были идентифицированы как CD4+CD25hiCD127-FOXP3+ Трег. Увеличение PD-1- и/или TIM-3-экспрессирующих
Трег описано в моделях опухолей и при различных онкологических заболеваниях, в большинстве исследований отмечается выраженный супрессорный потенциал PD-1+/TIM-3+ Трег [25–28]. Клиническое значение этих Трег, равно как и последствия анти-PD-1 блокады, остаются предметом дискуссий.
Нужно отметить, что ценность определения EOMES как маркера истощения в пуле CD8+ Т-клеток, по-видимому, снижена, так как и у здоровых доноров, и у больных ММ значительная часть PD-1/TIM-3-негативных CD8+ Т-клеток, в отличие от CD4+ Т-клеток, была EOMES+. В литературе также есть указания на то, что для CD8+ Т-клеток экспрессия EOMES ассоциирована как с активацией [29, 30], так и с терминальным Т-клеточным истощением, характеризующимся выраженным снижением функциональной активности и отсутствием ответа на анти-PD-1 таргетную терапию [16, 31].
Т-клетки, экспрессирующие TIM-3 (TIM-3+PD-1- и PD-1+TIM-3+), отличались более высокой долей CD25+ и CD122+ клеток по сравнению с PD-1+ популяцией Т-клеток. Более высокое содержание рецепторов гомеостатических цитокинов в популяции TIM-3+ Т-клеток может говорить о преимущественном вовлечении этой ингибиторной молекулы в контроль гомеостатической пролиферации зрелых Т-клеток в условиях лимфопении, в то время как молекула PD-1 может быть более ассоциирована с регуляцией активации через Т-клеточной рецептор. Ранее нами были описаны различия в функциональной активности между PD-1+ и TIM-3+ (включая PD-1+TIM-3+) Т-клетками при ММ; значительная часть CD8+PD-1+ и CD4+PD-1+ Т-клеток обладала выраженным цитотоксическим и цитокин-продуцирующим потенциалом, не отличаясь от PD-1-негативного компартмента либо превосходя его, в то время как TIM-3+ и PD-1+TIM-3+ Т-клетки были более ассоциированы с состоянием Т-клеточного истощения [6].
Выявленные различия подчеркивают неоднородность пула Т-клеток, относимых к дисфункциональным и «истощенным», экспрессирующих разные чек-поинт рецепторы и их комбинации. Ограничением настоящего этапа исследований является небольшое число наблюдений пациентов с прогрессирующим течением заболевания. Тем не менее изучение экспрессии маркеров активации Т-клеток позволяет точнее определить степень Т-клеточной дисфункции при ММ и в перспективе может быть использовано для прогноза безопасности и эффективности таргетной иммунотерапии.
Заключение
Пул T-лимфоцитов, экспрессирующих ингибиторные чек-поинт рецепторы PD-1 и/или TIM-3, у больных ММ включает в себя: CD25+EOMES-активированные клетки (содержание выше в популяции TIM-3+ Т-клеток по сравнению с PD-1+),
CD4+CD25+CD127-FOXP3+регуляторные Т-клетки (PD-1>TIM-3), по-видимому, CD8+CD122+ регуляторные Т-клетки, CD4+CD25-EOMES+ дисфункциональные клетки. Оценка поверхностной экспрессии CD25 может заменить определение внутриклеточного содержания транскрипционного фактора EOMES. EOMES в бóльшей степени маркер истощения для CD4+ Т-клеток, но не для CD8+ Т-клеток, в которых он более ассоциирован с активацией. Доля CD4+ Трег среди циркулирующих PD-1+ и TIM-3+Т-клеток невысока. Функциональные свойства PD-1+ и TIM-3+ CD8+CD122+ Т-клеток требуют дальнейшего изучения. Более
Список литературы Экспрессия рецепторов цитокинов с общей y-цепью как маркеров функциональных фенотипов PD-1- и TIM-3-позитивных Т-клеток при множественной миеломе
- Kazandjian D. Multiple myeloma epidemiology and survival: A unique malignancy. Semin Oncol. 2016; 43(6): 676-81. https://doi.org/10.1053/j.seminoncol.2016.11.004.
- Cowan A.J., Green D.J., Kwok M., Lee S., Coffey D.G., Holmberg L.A., Tuazon S., Gopal A.K., Libby E.N. Diagnosis and Management of Multiple Myeloma: A Review. JAMA. 2022; 327(5): 464-77. https://doi.org/10.1001/jama.2022.0003.
- Zelle-Rieser C., Thangavadivel S., Biedermann R., Brunner A., Stoitzner P., Willenbacher E., Greil R., Jöhrer K. T cells in multiple myeloma display features of exhaustion and senescence at the tumor site. J Hematol Oncol. 2016; 9(1): 116. https://doi.org/10.1186/s13045-016-0345-3.
- Tan J., Chen S., Huang J., Chen Y., Yang L., Wang C., Zhong J., Lu Y., Wang L., Zhu K., Li Y. Increased exhausted CD8+ T cells with programmed death-1, T-cell immunoglobulin and mucin-domain-containing-3 phenotype in patients with multiple myeloma. Asia Pac J Clin Oncol. 2018; 14(5): 266-74. https://doi.org/10.1111/ajco.13033.
- Görgün G., Samur M.K., Cowens K.B., Paula S., Bianchi G., Anderson J.E., White R.E., Singh A., Ohguchi H., Suzuki R., Kikuchi S., Harada T., Hideshima T., Tai Y.T., Laubach J.P., Raje N., Magrangeas F., Minvielle S., Avet-Loiseau H., Munshi N.C., Dorfman D.M., Richardson P.G., Anderson K.C. Lenalidomide Enhances Immune Checkpoint Blockade-Induced Immune Response in Multiple Myeloma. Clin Cancer Res. 2015; 21(20): 4607-18. https://doi.org/10.1158/1078-0432.CCR-15-0200.
- Batorov E.V., Aristova T.A., Sergeevicheva V.V., Sizikova S.A., Ushakova G.Y., Pronkina N.V., Shishkova I.V., Shevela E.Y., Ostanin A.A., Chernykh E.R. Quantitative and functional characteristics of circulating and bone marrow PD-1and TIM-3-positive T cells in treated multiple myeloma patients. Sci Rep. 2020; 10(1). https://doi.org/10.1038/s41598-020-77941-y.
- Wherry E.J., Kurachi M. Molecular and cellular insights into T cell exhaustion. Nat Rev Immunol. 2015; 15(8): 486-99. https://doi.org/10.1038/nri3862.
- Robert C. A decade of immune-checkpoint inhibitors in cancer therapy. Nat Commun. 2020; 11(1): 3801. https://doi.org/10.1038/s41467-02017670-y.
- Usmani S.Z., Schjesvold F., Oriol A., Karlin L., Cavo M., Rifkin R.M., Yimer H.A., LeBlanc R., Takezako N., McCroskey R.D., Lim A.B.M., Suzuki K., Kosugi H., Grigoriadis G., Avivi I., Facon T., Jagannath S., Lonial S., Ghori R.U., Farooqui M.Z.H., Marinello P., SanMiguel J.; KEYNOTE-185 Investigators. Pembrolizumab plus lenalidomide and dexamethasone for patients with treatment-naive multiple myeloma (KEYNOTE-185): a randomised, open-label, phase 3 trial. Lancet Haematol. 2019; 6(9): 448-58. https://doi.org/10.1016/S2352-3026(19)30109-7.
- Mateos M.V., Blacklock H., Schjesvold F., Oriol A., Simpson D., George A., Goldschmidt H., Larocca A., Chanan-Khan A., Sherbenou D., Avivi I., Benyamini N., Iida S., Matsumoto M., Suzuki K., Ribrag V., Usmani S.Z., Jagannath S., Ocio E.M., Rodriguez-Otero P., San Miguel J., Kher U., Farooqui M., Liao J., Marinello P., Lonial S.; KEYNOTE-183 Investigators. Pembrolizumab plus pomalidomide and dexamethasone for patients with relapsed or refractory multiple myeloma (KEYNOTE-183): a randomised, open-label, phase 3 trial. Lancet Haematol. 2019; 6(9): 459-69. https://doi.org/10.1016/S2352-3026(19)30110-3.
- Kinter A.L., Godbout E.J., McNally J.P., Sereti I., Roby G.A., O'Shea M.A., Fauci A.S. The common gamma-chain cytokines IL-2, IL-7, IL-15, and IL-21 induce the expression of programmed death-1 and its ligands. J Immunol. 2008; 181(10): 6738-46. https://doi.org/10.4049/jimmunol.181.10.6738.
- Mujib S., Jones R.B., Lo C., Aidarus N., Clayton K., Sakhdari A., Benko E., Kovacs C., Ostrowski M.A. Antigen-independent induction of Tim-3 expression on human T cells by the common γ-chain cytokines IL-2, IL-7, IL-15, and IL-21 is associated with proliferation and is dependent on the phosphoinositide 3-kinase pathway. J Immunol. 2012; 188(8): 3745-56. https://doi.org/10.4049/jimmunol.1102609.
- Marshall N., Hutchinson K., Marron T.U., Aleynick M., Hammerich L., Upadhyay R., Svensson-Arvelund J., Brown B.D., Merad M., Brody J.D. Antitumor T-cell Homeostatic Activation Is Uncoupled from Homeostatic Inhibition by Checkpoint Blockade. Cancer Discov. 2019; 9(11): 1520-37. https://doi.org/10.1158/2159-8290.CD-19-0391.
- Waickman A.T., Park J.Y., Park J.H. The common γ-chain cytokine receptor: tricks-and-treats for T cells. Cell Mol Life Sci. 2016; 73(2): 253-69. https://doi.org/10.1007/s00018-015-2062-4.
- Crawford A., Angelosanto J.M., Kao C., Doering T.A., Odorizzi P.M., Barnett B.E., Wherry E.J. Molecular and transcriptional basis of CD4⁺ T cell dysfunction during chronic infection. Immunity. 2014; 40(2): 289-302. https://doi.org/10.1016/j.immuni.2014.01.005.
- Li J., He Y., Hao J., Ni L., Dong C. High Levels of Eomes Promote Exhaustion of Anti-tumor CD8+ T Cells. Front Immunol. 2018; 9: 2981. https://doi.org/10.3389/fimmu.2018.02981.
- Llaó-Cid L., Roessner P.M., Chapaprieta V., Öztürk S., Roider T., Bordas M., Izcue A., Colomer D., Dietrich S., Stilgenbauer S., Hanna B., Martín-Subero J.I., Seiffert M. EOMES is essential for antitumor activity of CD8+ T cells in chronic lymphocytic leukemia. Leukemia. 2021; 35(11): 3152-62. https://doi.org/10.1038/s41375-021-01198-1.
- Ramos-Casals M., Brahmer J.R., Callahan M.K., Flores-Chávez A., Keegan N., Khamashta M.A., Lambotte O., Mariette X., Prat A., SuárezAlmazor M.E. Immune-related adverse events of checkpoint inhibitors. Nat Rev Dis Primers. 2020; 6(1): 38. https://doi.org/10.1038/s41572-020-0160-6.
- Anthony S., Schluns K.S. Emerging roles for IL-15 in the activation and function of T-cells during immune stimulation. Research and Reports in Biology. 2015; 6: 25-37. https://doi.org/10.2147/RRB.S57685.
- Zhao Y., Cai C., Samir J., Palgen J.L., Keoshkerian E., Li H., Bull R.A., Luciani F., An H., Lloyd A.R. Human CD8 T-stem cell memory subsets phenotypic and functional characterization are defined by expression of CD122 or CXCR3. Eur J Immunol. 2021; 51(7): 1732-47. https://doi.org/10.1002/eji.202049057.
- Li S., Xie Q., Zeng Y., Zou C., Liu X., Wu S., Deng H., Xu Y., Li X.C., Dai Z. A naturally occurring CD8(+)CD122(+) T-cell subset as a memory-like Treg family. Cell Mol Immunol. 2014; 11(4): 326-31. https://doi.org/10.1038/cmi.2014.25.
- Villarreal D.O., Allegrezza M.J., Smith M.A., Chin D., Luistro L.L., Snyder L.A. Targeting of CD122 enhances antitumor immunity by altering the tumor immune environment. Oncotarget. 2017; 8(65): 109151-60. https://doi.org/10.18632/oncotarget.22642.
- Elizondo D.M., Andargie T.E., Haddock N.L., da Silva R.L.L., de Moura T.R., Lipscomb M.W. IL-10 producing CD8+ CD122+ PD-1+ regulatory T cells are expanded by dendritic cells silenced for Allograft Inflammatory Factor-1. J Leukoc Biol. 2019; 105(1): 123-30. https://doi.org/10.1002/JLB.1A0118-010RR.
- Liu H., Qiu F., Wang Y., Zeng Q., Liu C., Chen Y., Liang C.L., Zhang Q., Han L., Dai Z. CD8+CD122+PD-1+ Tregs Synergize With Costimulatory Blockade of CD40/CD154, but Not B7/CD28, to Prolong Murine Allograft Survival. Front Immunol. 2019; 10: 306. https://doi.org/10.3389/fimmu.2019.00306.
- Sakuishi K., Ngiow S.F., Sullivan J.M., Teng M.W., Kuchroo V.K., Smyth M.J., Anderson A.C. TIM3+FOXP3+ regulatory T cells are tissuespecific promoters of T-cell dysfunction in cancer. Oncoimmunology. 2013; 2(4). https://doi.org/10.4161/onci.23849.
- Banerjee H., Nieves-Rosado H., Kulkarni A., Murter B., McGrath K.V., Chandran U.R., Chang A., Szymczak-Workman A.L., Vujanovic L., Delgoffe G.M., Ferris R.L., Kane L.P. Expression of Tim-3 drives phenotypic and functional changes in Treg cells in secondary lymphoid organs and the tumor microenvironment. Cell Rep. 2021; 36(11). https://doi.org/10.1016/j.celrep.2021.109699.
- Dahlhoff J., Manz H., Steinfatt T., Delgado-Tascon J., Seebacher E., Schneider T., Wilnit A., Mokhtari Z., Tabares P., Böckle D., Rasche L., Martin Kortüm K., Lutz M.B., Einsele H., Brandl A., Beilhack A. Transient regulatory T-cell targeting triggers immune control of multiple myeloma and prevents disease progression. Leukemia. 2022; 36(3): 790-800. https://doi.org/10.1038/s41375-021-01422-y.
- Kim M.J., Ha S.J. Differential Role of PD-1 Expressed by Various Immune and Tumor Cells in the Tumor Immune Microenvironment: Expression, Function, Therapeutic Efficacy, and Resistance to Cancer Immunotherapy. Front Cell Dev Biol. 2021; 9. https://doi.org/10.3389/fcell.2021.767466.
- Pearce E.L., MullenA.C., Martins G.A., Krawczyk C.M., HutchinsA.S., Zediak V.P., Banica M., DiCioccio C.B., Gross D.A., Mao C.A., Shen H., Cereb N., Yang S.Y., Lindsten T., Rossant J., Hunter C.A., Reiner S.L. Control of effector CD8+ T cell function by the transcription factor Eomesodermin. Science. 2003; 302(5647): 1041-3. https://doi.org/10.1126/science.1090148.
- Intlekofer A.M., Takemoto N., Wherry E.J., Longworth S.A., Northrup J.T., Palanivel V.R., Mullen A.C., Gasink C.R., Kaech S.M., Miller J.D., Gapin L., Ryan K., Russ A.P., Lindsten T., Orange J.S., Goldrath A.W., Ahmed R., Reiner S.L. Effector and memory CD8+ T cell fate coupled by T-bet and eomesodermin. Nat Immunol. 2005; 6(12): 1236-44. https://doi.org/10.1038/ni1268. Erratum in: Nat Immunol. 2006; 7(1): 113.
- Paley M.A., Kroy D.C., Odorizzi P.M., Johnnidis J.B., Dolfi D.V., Barnett B.E., Bikoff E.K., Robertson E.J., Lauer G.M., Reiner S.L., Wherry E.J. Progenitor and terminal subsets of CD8+ T cells cooperate to contain chronic viral infection. Science. 2012; 338(6111): 1220-5. https://doi.org/10.1126/science.1229620.


