Экспрессионный профиль микроРНК при плоскоклеточном раке головы и шеи
Автор: Веряскина Юлия Андреевна, Какурина Гелена Валерьевна, Журавлев Евгений Сергеевич, Титов Сергей Евгеньевич, Кондакова Ирина Викторовна, Черемисина Ольга Владимировна, Шишкин Дмитрий Александрович, Жимулев Игорь Федорович, Чойнзонов Евгений Лхамацыренович, Колесников Николай Николаевич
Журнал: Сибирский онкологический журнал @siboncoj
Рубрика: Лабораторные и экспериментальные исследования
Статья в выпуске: 6 (72), 2015 года.
Бесплатный доступ
Плоскоклеточные карциномы головы и шеи (ПКГШ) отличаются высокой агрессивностью и длительным бессимптомным течением. Диагностика заболевания на ранних стадиях и оценка риска метастазирования, а также прогноза течения опухолевого процесса являются приоритетной задачей современной клинической онкологии, что требует поиска и разработки новых прогностических маркеров заболевания. Такими маркерами могут служить микроРНК (миРНК) - относительно недавно открытый класс малых некодирующих РНК. На основании литературных данных и собственных исследований мы выбрали 12 миРНК (миРНК-21, -221, -222, -155, -205, -20a, -125b, -146b, -181b, -200a, -126, -451), участвующих в процессе канцерогенеза ПКГШ. Методом ПЦР в реальном времени определены изменения уровня экспрессии выбранной группы миРНК в опухоли по сравнению с неизмененной тканью. Установлено увеличение уровня экспрессии 5 миРНК: миРНК-21, -155, -181b, -126, -451 (p
Опухоли головы и шеи, микрорнк, метастазирование
Короткий адрес: https://sciup.org/14056596
IDR: 14056596 | УДК: 617.51/.617.57-006.61:577.218
Текст научной статьи Экспрессионный профиль микроРНК при плоскоклеточном раке головы и шеи
Клиническое течение плоскоклеточных карцином головы и шеи (ПКГШ) отличается высокой агрессивностью и длительным бессимптомным развитием, местные рецидивы ПКГШ и метастазы в лимфоузлы шеи сокращают 5-летнюю выживаемость пациентов практически вдвое [6]. Для улучшения результатов лечения важно определить риск развития рецидива опухоли и метастазов до их клинической реализации, что требует поиска и разработки новых прогностических маркеров заболевания. Предложено много новых белковых маркеров для прогнозирования течения ПКГШ: матриксные металлопротеиназы и их ингибиторы, протеасомная и кальпаиновая системы [5, 14]. Активно ведется поиск новых биомаркеров ПКГШ с использованием протеомных [1, 2] и транскриптомных технологий [3]. Открытие нового класса малых некодирующих РНК – микроРНК (миРНК) (~22 нуклеотида) определило новое направление в онкологии. МиРНК, комплементарно связываясь с 3’ концевым районом гена, модулируют экспрессию белок-кодирующих генов, причем как одна миРНК имеет более десятка генов-мишеней, так и один ген может находиться под контролем нескольких миРНК. К настоящему времени показано, что миРНК не только ассоциированы с различными типами опухолей, но могут сами выступать в роли онкогенов и супрессоров новообразований, т.е. быть первопричиной злокачественных превращений наряду с соматическими мутациями в генах [10]. Анализ литературных данных о роли миРНК в канцерогенезе при ПКГШ показал, что для оценки возможности их использования в качестве маркеров или терапевтических мишеней необходимы дальнейшие исследования.
Цель исследования – поиск новых диагностических маркеров путем изучения профилирования экспрессии миРНК в образцах ткани пациентов с плоскоклеточными карциномами гортани на основе выявления ассоциативной связи между выбранными миРНК (миРНК-21, -221, -222, -155, -205, -20a, -125b, -146b, -181b, -200a, -126, -451) и клиникоморфологическими параметрами заболевания.
Материал и методы
В работе представлены результаты исследования операционного и биопсийного материала, полученного от 60 пациентов с верифицированным диагнозом плоскоклеточной карциномы разной степени дифференцировки: T1N0M0 (n=14), T2N0M0 (n=14), T3N0M0 (n=15), T4N0M0 (n=8), T3–4N0–3M0–1 (n=9), поступивших на лечение в отделение опухолей головы и шеи Томского НИИ онкологии. Средний возраст больных – 53 ± 5,3 года. Работа проведена с соблюдением принципов добровольности и конфиденциальности в соответствии с «Основами законодательства РФ об охране здоровья граждан» (Указ Президента РФ № 2288, от 24.12.93), получено разрешение этического комитета Томского НИИ онкологии.
Для хранения и транспортировки операционного материала использовался раствор для стабилизации РНК RNAlater, позволяющий выделять РНК из тканей и клеток без замораживания в жидком азоте. Выделение суммарного пула РНК проводили с помощью набора «РеалБест экстракция 100» (ЗАО «Вектор-Бест», г. Новосибирск) в соответствии с инструкцией производителя. Концентрация и качество выделенной РНК оценивались на спектрофотометре NanoDrop 2000C (ThermoScientific, США). Чистоту препарата оценивали как отношение поглощения при длинах волн 260 нм/280 нм и 260 нм/230 нм. Для чистой РНК соотношение A260/280– 2,8, А260/230 – 1,8–2,2. Обратная транскрипция была проведена при помощи специфичных праймеров к миРНК: hsa-miR-21, hsa-miR-221, hsa-miR-222, hsa-miR-155, hsa-miR-205, hsa-miR-20a, hsa-miR-125b, hsa-miR-146b, hsa-miR-181b, hsa-miR-200a, hsa-miR-126, hsa-miR451. Реакцию обратной транскрипции проводили с использованием готовой реакционной смеси «РеалБест Мастер микс ОТ» (ЗАО «Вектор-Бест», г. Новосибирск). Полученную кДНК, в объеме 3 мкл, сразу использовали в качестве матрицы для проведения ПЦР.
Измерение уровней экспрессии миРНК проводили методом ПЦР в реальном времени на амплифика-торе CFX96 (Bio-Rad Laboratories, США) [8]. В качестве референсного гена использовали малую РНК U6. Реакцию ПЦР проводили в объеме 30 мкл с использованием готовой реакционной смеси «РеалБест Мастер микс» (ЗАО «Вектор-Бест», г. Новосибирск) и раствора прямого и обратного праймеров (5 мкМ) и зонда (2.5 мкМ). Статистическая обработка проводилась с применением непараметрического U-критерия Манна – Уитни в программе Statistica 10.0.
Результаты и обсуждение
Профилирование экспрессии миРНК у больных ПКГШ T1–4N0M0 стадии
Геном человека насчитывает около 1 900 генов миРНК. Для одной миРНК характерно более 100 генов-мишеней (Release 21, http://www.mirbase. org/). В зависимости от их роли в процессе канцерогенеза все миРНК разделены на онкогены и онкосупрессоры. В то же время одна миРНК может выступать как в роли онкогена, так и в роли опухолевого супрессора в зависимости от её гена-мишени и ткани, в которой она экспрессируется. На основе базы mirBase, анализа литературных и собственных экспериментальных данных выбраны миРНК, относящиеся к «онкомиру» и характерные для большинства видов карцином. Анализ уровня экспрессии выбранных 12 миРНК в опухолевых образцах, взятых у больных с плоскоклеточной карциномой гортани T1–4N0M0 стадии, показал увеличение уровня экспрессии 9 миРНК: миРНК -21, -221, -22, -155, - 205, -146b, -181b, -200a, -126, -451 – и снижение уровня экспрессии трех миРНК: миРНК -20a, -125b, -200a (рис. 1).
Мы полагаем, что выявленные незначительные различия уровней экспрессии миРНК -221, -222, -205, -20a, -125b, -146b, -200a в опухоли и прилежа-
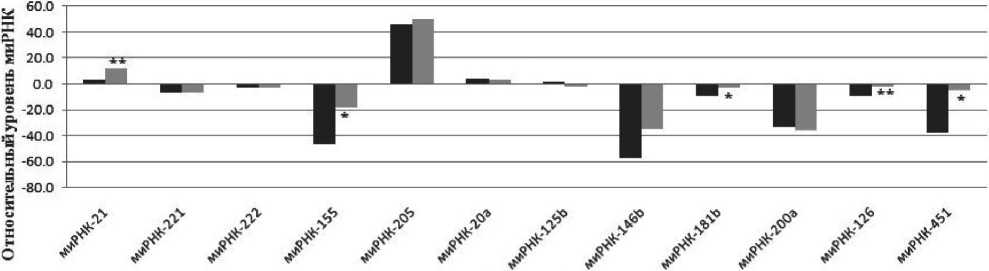
Рис. 1. Изменение экспрессии миРНК в образцах ПКГШ по сравнению с неизмененной тканью: столбцы черного цвета обозначают медианное значение миРНК для группы неизмененной ткани, столбцы серого цвета – медианное значение миРНК для группы опухолевой ткани. * – различия статистически значимы в опухолевой ткани по сравнению с неизмененной тканью (p<0,05); ** – различия статистически значимы в опухолевой ткани по сравнению с неизмененной тканью (p<0,001)
щей неизменённой ткани являются характерными для ПКГШ, в отличие от опухолей других локализаций [4]. Нами наблюдалось увеличение уровня экспрессии миРНК-21 в опухоли по сравнению с неизмененной тканью более чем в 3 раза (p<0,001). МиРНК-21 является онкогеном с множеством доказанных мишеней-онкосупрессоров [16], и ее экспрессия повышена в различных злокачественных опухолях [4], в том числе и при ПКГШ [13]. Мы наблюдали увеличение уровня экспрессии миРНК-155 более чем в 2 раза в опухолевой ткани в сравнении с неизмененной тканью (p<0,05). МиРНК-155 также является онкогеном, играет важную роль в различных биологических процессах, таких как гемопоэз, дифференцировка, воспаление, рак [15, 20]. Экспрессия миРНК-155 повышена практически во всех типах рака, включая ПКГШ [21]. Уровень миРНК-181b был увеличен почти в 3 раза в опухолевой ткани по сравнению с неизмененной тканью (p<0,001). Согласно литературным данным, миРНК-181b обладает различными свойствами в зависимости от типа ткани, в которой она экспрессируется. Так, в клетках глиомы человека миРНК-181b является онкосупрессором и участвует в регуляции апоптоза опухолевых клеток [17]. В ПКГШ миРНК-181b является онкогеном и играет важную роль в злокачественной трансформации клеток [7, 18]. В представленной работе показано увеличение уровня миРНК-126 в опухолевой ткани более чем в 5 раз по сравнению с неизмененной тканью (p<0.001). МиРНК-126 является онкосупрессором, а также участвует в процессах ангиогенеза [11]. X. Yang et al. показали, что экспрессия миРНК-126 in vitro значительно снижает пролиферацию клеток, прогрессию клеточного цикла и инвазию [19]. Кроме того, миРНК-126 регулирует многие аспекты эндотелиальной клеточной биологии, включая миграцию клеток, реорганизацию цитоскелета, стабильность капиллярных сетей, и требуется для поддержания сосудистой системы [12]. Уровень миРНК-451 был увеличен более чем в 7 раз (p<0.05) по сравнению с неизмененной тканью. Возможно, это связано с участием миРНК-451 в процессах инвазии [9].
Профилирование экспрессии миРНК у больных ПКГШ T3–4N0–3M0–1 стадии
На втором этапе работы проводилось сравнение экспрессии выбранной группы миРНК у больных c ПКГШ T3–4N0M0 (n=23) и T3–4N0–3M0–1 (n=9). Анализ профиля миРНК в сравнительных группах выявил тенденцию к увеличению уровня экспрессии всех исследуемых миРНК. Однако статистически значимое различие наблюдается только для миРНК-126 (p<0,05) (рис. 2). Вероятно, повышение уровня миРНК-126 в образцах тканей больных с ПКГШ T3–4N0–3M0–1 стадии по сравнению с T3–4N0M0 связано со способностью регулировать процессы ангиогенеза и миграцию клеток. Полученные результаты говорят о перспективности использования миРНК-126 в качестве маркёра метастазирования при ПКГШ.
Заключение
Выявленные изменения уровней экспрессии выбранной группы миРНК позволили сформировать профиль миРНК, характерный для ПКГШ, который может отражать процессы, происходящие в опухолевой ткани во время прогрессирования данного заболевания. Учитывая различия в содержании миРНК-126 в опухолях у больных с наличием и без метастазов в регионарные лимфоузлы (p<0,05), мы полагаем, что этот показатель может быть важным для понимания процессов метастазирования и разработки нового прогностического маркёра.
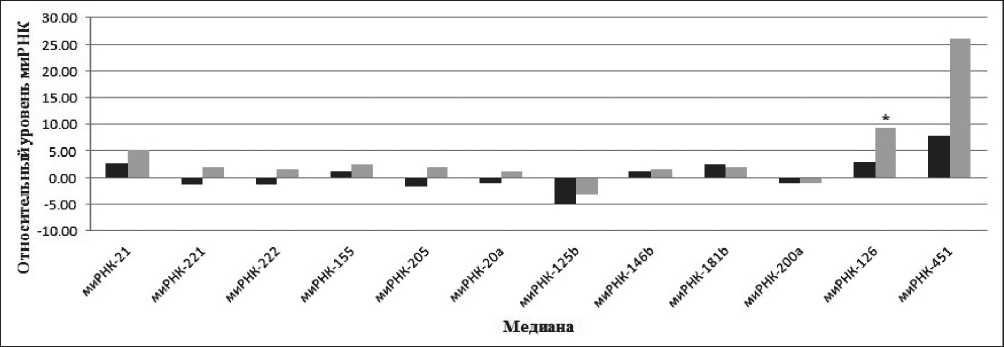
Рис. 2. Изменение экспрессии миРНК в образцах у больных с ПКГШ T3–4N0M0 стадии по сравнению с больных с ПКГШ T3–4N0–3M0–1 стадии:
столбцы черного цвета обозначают медианное значение миРНК для опухолевой ткани при ПКГШ T3–4N0M0 стадии, столбцы серого цвета – медианное значение миРНК для опухолевой ткани при ПКГШ T3–4N0–3M0–1 стадии; * – различия статистически значимы по сравнению с группой больных без метастазов (p<0,05)
Список литературы Экспрессионный профиль микроРНК при плоскоклеточном раке головы и шеи
- Какурина Г.В., Кондакова И.В., Чойнзонов Е.Л. Постгеномные технологии в прогнозе метастазирования плоскоклеточных карцином головы и шеи//Российский биотерапевтический журнал. 2011. Т. 10, № 3. С. 31-36
- Какурина Г.В., Кондакова И.В., Чойнзонов Е.Л., Шишкин Д.А., Черемисина О.В. Особенности протеома сыворотки крови больных плоскоклеточными карциномами головы и шеи//Сибирский онкологический журнал. 2013. № 2. С. 62-66.
- Какурина Г.В., Кондакова И.В., Чойнзонов Е.Л. Прогнозирование метастазирования плоскоклеточных карцином головы и шеи//Вопросы онкологии. 2012. Т. 58, № 1. С. 26-32.
- Колесников Н.Н., Титов С.Е., Веряскина Ю.А., Карпинская Е.В., Шевченко С.П., Ахмерова Л.Г., Иванов М.К., Козлов В.В., Елисафенко Е.А., Гуляева Л.Ф., Жимулёв И.Ф. МикроРНК, эволюция и рак//Цитология. 2013. Т. 55, № 3. С. 159-164.
- Спирина Л.В., Кондакова И.В. Роль внутриклеточного специфического протеолиза в онкогенезе//Вопросы онкологии. 2008. Т. 54, № 6. С. 690-694.
- Чойнзонов Е.Л., Балацкая Л.Н., Кицманюк З.Д., Мухамедов М.Р., Дубский С.В. Реабилитация больных опухолями головы и шеи. Томск, 2003. 296 с.
- Cervigne N.K., Reis P.P., Machado J., Sadikovic B., Bradley G., Galloni N.N., Pintilie M., Jurisica I., Perez-Ordonez B., Gilbert R., Gullane P., Irish J., Kamel-Reid S. Identification of a microRNA signature associated with progression of leukoplakia to oral carcinoma//Hum. Mol. Genet. 2009. Vol. 18 (24). P. 4818-4829 DOI: 10.1093/hmg/ddp446
- Chen C., Ridzon D.A., Broomer A.J., Zhou Z., Lee D.H., Nguyen J.T., Barbisin M., Xu N.L., Mahuvakar V.R., Andersen M.R., Lao K.Q., Livak K.J., Guegler K.J. Real-time quantification of microRNAs by stemloop RT-PCR//Nucleic Acids. Res. 2005. Vol. 33 (20):e179
- Chen D., Huang J., Zhang K., Pan B., Chen J., De W., Wang R., Chen L. MicroRNA-451 induces epithelial-mesenchymal transition in docetaxel-resistant lung adenocarcinoma cells by targeting proto-oncogene c-Myc//Eur. J. Cancer. 2014. Vol. 50 (17). P. 3050-3067. doi:10.1016/j.ejca.2014.09.008.
- Croce C.M. Causes and consequences of microRNA dysregulation in cancer//Nat. Rev. Genet. 2009. Vol. 10 (10). P. 704-714 DOI: 10.1038/nrg2634
- Ebrahimi F., Gopalan V., Smith R.A., Lam A.K. MiR-126 in human cancers: clinical roles and current perspectives//Exp. Mol. Pathol. 2014. Vol. 96 (1). P. 98-107 DOI: 10.1016/j.yexmp.2013.12.004
- Fish J.E., Santoro M.M., Morton S.U., Yu S., Yeh R.F., Wythe J.D., Ivey K.N., Bruneau B.G., Stainier D.Y., Srivastava D. MiR-126 regulates angiogenic signaling and vascular integrity//Dev. Cell. 2008. Vol. 15 (2). P. 272-284 DOI: 10.1016/j.devcel.2008.07.008
- Jamali Z., Asl Aminabadi N., Attaran R., Pournagiazar F., Ghertasi Oskouei S., Ahmadpour F. MicroRNAs as prognostic molecular signatures in human head and neck squamous cell carcinoma: Asystematic review and meta-analysis//Oral. Oncol. 2015. Vol. 51 (4). P. 321-331. doi: 10.1016/j. oraloncology.2015.01.008.
- Kondakova I.V., Klisho E.V., Savenkova O.V., Kakurina G.V., Choinzonov E.L., Shishkin D.A., Mukhamedov M.R. Matrix metalloproteinases 2 and 9 as the factors of head and neck tumor metastases//Biochemistry (Moscow) Supplement Series B: Biomedical Chemistry. 2008. Vol. 2, № 3. P. 298-301.
- Lind E.F., Ohashi P.S. Mir-155, a central modulator of T-cell responses//Eur. J. Immunol. 2014. Vol. 44 (1). P. 11-15.
- Pennelli G., Galuppini F., Barollo S., Cavedon E., Bertazza L., Fassan M., Guzzardo V., Pelizzo M.R., Rugge M., Mian C. The PDCD4/miR-21 pathway in medullary thyroid carcinoma//Hum. Pathol. 2015. Vol. 46 (1). P. 50-57 DOI: 10.1016/j.humpath.2014.09.006
- Shi L., Cheng Z., Zhang J., Li R., Zhao P., Fu Z., You Y. Hsa-mir-181a and hsa-mir-181b function as tumor suppressors in human glioma cells//Brain Res. 2008. Vol. 1236. P. 185-193. doi: 10.1016/j. brainres.2008.07.085.
- Yang C.C., Hung P.S., Wang P.W., Liu C.J., Chu T.H., Cheng H.W., Lin S.C. MiR-181 as a putative biomarker for lymph-node metastasis of oral squamous cell carcinoma//J. Oral Pathol. Med. 2011. Vol. 40 (5). P. 397-404 DOI: 10.1111/j.1600-0714.2010.01003.x
- Yang X., Wu H., Ling T. Suppressive effect of microRNA-126 on oral squamous cell carcinoma in vitro//Mol. Med. Rep. 2014. Vol. 10 (1). P. 125-130 DOI: 10.3892/mmr.2014.2171
- Zeng H., Fang C., Nam S., Cai Q., Long X. The clinicopathological significance of microRNA-155 in breast cancer: a meta-analysis//Biomed. Res. Int. 2014. 2014: 724209 DOI: 10.1155/2014/724209
- Zhang J., Cheng C., Yuan X., He J.T., Pan Q.H., Sun F.Y. MicroRNA-155 acts as an oncogene by targeting the tumor protein 53-induced nuclear protein 1 in esophageal squamous cell carcinoma//Int. J. Clin. Exp. Pathol. 2014. Vol. 7 (2). P. 602-610. eCollection 2014.


