Экстракция церия нафтеновыми кислотами
Автор: Девяткин П.Н.
Журнал: Вестник Мурманского государственного технического университета @vestnik-mstu
Статья в выпуске: 4 т.10, 2007 года.
Бесплатный доступ
В работе исследована принципиальная возможность и целесообразность использования альтернативных экстракционных реагентов при экстракционном выделении церия из растворов. В качестве таковых экстракционных реагентов рассмотрены катионообменные экстрагенты, широкое распространение среди которых нашли карбоновые кислот, и, в частности, нафтеновая кислота. Экспериментально установлено, что при использовании в качестве экстракционного реагента нафтеновой кислоты (существенно более дешёвого реагента по сравнению с используемыми в настоящее время) можно повысить извлечение церия до 73.5 % и исключить необходимость применения высаливателя, и, в конечном итоге, сократить материальные затраты.
Короткий адрес: https://sciup.org/14293889
IDR: 14293889 | УДК: 669.24,
Текст научной статьи Экстракция церия нафтеновыми кислотами
Из промышленных способов отделения церия от других редких металлов наиболее изученной на настоящее время является экстракция церия из смесей электролитов (или систем с высаливателем) различными фосфорорганическими соединениями, наибольшее применение среди которых, бесспорно, нашёл трибутилфосфат ( Коровин и др ., 1969). Однако на практике экстракцию приходится проводить в несколько стадий (для достижения приемлемой полноты извлечения) и с использованием дорогого экстракционного реагента. Поэтому целью настоящих исследований являлся поиск альтернативного экстракционного реагента при экстракции церия, который позволил бы, с одной стороны, снизить материальные затраты, и с другой – улучшить технологические показатели данного процесса.
В качестве такового экстракционного реагента исследовалась возможность применения катионообменных экстрагентов, широкое распространение среди которых нашли карбоновые кислоты. Согласно результатам работ ( Пискунов и др ., 1969; Воронин , 1994), экстракция металлов карбоновыми кислотами протекает при значениях рН, близких к величинам рН гидратообразования этих металлов, что приводит к одновременному выделению с редкими металлами железа, алюминия и других нежелательных компонентов.
Наличие в растворе таких примесей как кальций, цинк и др., обуславливает необходимость использования в качестве экстрагента нафтеновых кислот, так как кислоты алифатического ряда образуют с этими металлами соединения, мало растворимые в углеводородах и в избытке экстрагента. Высокая вязкость нафтеновых кислот и, особенно, солей приводит к необходимости использования их только в виде растворов в углеводородах (например, при промышленном использовании – в керосине или в органических разбавителях типа РЭД-1, РЭД-2, позволяющих работать при более высоких температурах) концентрацией не выше 1-1.5Н ( Пискунов и др ., 1969).
Экспериментальная часть исследований данного раздела работы проведена на исходном водном растворе, содержащем ~ 0.65 г/л церия, моделирующем по концентрации гидрометаллургические растворы, циркулирующие при экстракционном выделении церия. В качестве экстрагента использовался 0.5Н раствор дистиллированной нафтеновой кислоты в декане. Нафтеновая кислота получена перегонкой технического асидола-1 Бакинского нефтеперерабатывающего завода в интервале температур 165-190 ° С при остаточном давлении 5-7 мм рт. ст. Средняя мольная масса исследованной фракции нафтеновой кислоты составила 226 г/моль, концентрация 4.4 моль/л. Элементарным анализом установлена средняя формула кислоты C 14 H 28 O 2 . Средняя константа диссоциации характеризовалась величиной рК д =5.1 ( Девяткин и др ., 2003). Величину рН регулировали расходом гидроксида натрия или соляной кислоты (в зависимости от необходимого значения рН). Концентрацию церия в водной фазе и в исходном растворе определяли фотометрическим методом на фотоколориметре КФК-3.
Девяткин П.Н. Экстракция церия нафтеновыми кислотами
К настоящему времени экстракция нафтеновыми кислотами катионов тяжелых металлов широко изучена ( Fletcher, Flett , 1968; Иллювиева , 1966; Алекперов , 1969; Берестовой и др ., 1985). Основные выводы этих работ, имеющие практическое значение для реализации экстракции катионов тяжелых металлов, сводятся к следующим:
– рекомендованный расход нафтеновой кислоты на 10-25 % превосходит эквивалентный для образования средних нафтенатов извлекаемых металлов;
– экстракция подчиняется уравнению:
Me z + (aq) + z HR (org) = MeR z (org) + z H+ (aq) , (1) где Me z + – извлекаемый катион металла, R – анион нафтеновой кислоты, а соответствующая ему концентрационная константа равновесия (константа экстракции К ех ) равна:
К ех = ([ MeR z (org) ][ H+ (aq) ]z)/ ([ Mez+ (aq) ][ HR (org) ]z); (2)
– зависимость логарифма коэффициента распределения ( Д ) от рН является линейной и отвечает уравнению:
lg( Д ) = lg K ех + z lg[ HR (org) ] + z pH, (3) которое получено логарифмированием уравнения (2), где Д = [ MeRz (org) ]/[ Mez+ (aq) ]) и предполагает постоянство [HR (org) ] в процессе экстракции при разных значениях рН.
Наличие свободной нафтеновой кислоты в органической фазе при жидкостной экстракции способствует увеличению растворимости в ней нафтенатов извлекаемых металлов. Вышеприведенные результаты изучения экстракции катионов тяжелых металлов нафтеновыми кислотами были положены в основу исследований экстракции церия этим же экстракционным реагентом.
2. Жидкостная экстракция церия
Исследовалась жидкостная экстракция церия раствором нафтеновой кислоты в декане. Опыты проводили при различных значениях рН в интервале 3-6.5 и расходах нафтеновой кислоты: при расходе, эквивалентном образованию средних нафтенатов церия в экстракте, т.е. 3.6 моль нафтеновой кислоты на 1 моль Се (с 10-25 % избытком) и при расходе 2.4 моль нафтеновой кислоты на 1 моль Се (с 10-25 % избытком). В первом случае достигался эффект наличия свободной нафтеновой кислоты в органической фазе, а во втором – недостатка и, соответственно, связывания всей нафтеновой кислоты в органической фазе с экстрагированным нафтенатом металла. При различных значениях рН опыты ставили в соответствии со схемой рис. 1.
Увеличение рН>6.0 нецелесообразно ввиду опасности массового выпадения гидроксидов церия (III), что подтверждается экспериментом: уже при рН ∼ 6 начинается выпадение гидроокиси церия (III), а при больших значениях рН этот процесс активизируется самым существенным образом.
Исходный раствор V= 1 л
X рН0=5,5
HCLNaO до pH
HR 0.5И
Перемешивание
т=20 мин.
¥ рНк
Разделение фаз в делительной воронке
Водная фаза Органическая фаза на х/а по Се на регенерацию экстрагента
Рис. 1. Схема опытов экстракции церия
Результаты опытов по жидкостной экстракции церия представлены в табл. 1.
Для количественной характеристики полноты и селективности извлечения целевого компонента в процессе экстракции используются, соответственно, величины коэффициентов распределения ( Д ) и разделения ( К р ). Коэффициент распределения ( Д ) представляет собой отношение равновесной концентрации распределяемого компонента в экстракте к его равновесной концентрации в рафинате. В экстракционных системах значение Д лежит в пределах 1-105. Коэффициент распределения для данного
экстракционного процесса зависит от температуры и концентрации компонента в исходном водном растворе. В разбавленных растворах величина Д практически не зависит от концентрации ( Берестовой , 1977; Трейбал , 1966; Пратт , 1958; Девяткин , Воронин , 2003). Коэффициент (фактор) разделения ( Кр ) для двух компонентов водного раствора равен отношению их коэффициентов распределения.
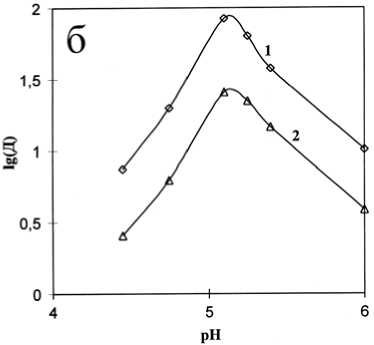
На рис. 2а представлена полученная зависимость извлечения церия в органическую фазу от величины рН равновесной водной фазы, а на рис. 2б – зависимость коэффициента распределения Д (lg Д ) от величины рН равновесной водной фазы.
Таблица 1. Результаты экстракции Се нафтеновой кислотой при различных значениях рН
|
Раствор |
pH |
Концентрация Се, г/л |
Извлечение Се в органическую фазу ε , % при расходе HR (с 20%-м избытком) |
|
|
2.4 моль НR:1моль Ce |
3.6моль НR:1моль Ce |
|||
|
Исходный раствор |
3.00 |
0.652 |
– |
– |
|
Водная фаза после разделения фаз* |
0.652 / 0.652 |
0 |
0 |
|
|
Исходный раствор |
4.00 |
0.652 |
– |
– |
|
Водная фаза после разделения фаз* |
0.652 / 0.652 |
0 |
0 |
|
|
Исходный раствор |
4.45 |
0.658 |
– |
– |
|
Водная фаза после разделения фаз* |
0.547 / 0.607 |
7.80 |
16.9 |
|
|
Исходный раствор |
4.75 |
0.658 |
– |
– |
|
Водная фаза после разделения фаз* |
0.399 / 0.528 |
19.7 |
39.4 |
|
|
Исходный раствор |
5.00 5.10 |
0.648 |
– |
– |
|
Водная фаза после разделения фаз* |
0.172 / 0.352 |
45.7 |
73.5 |
|
|
Исходный раствор |
5.25 |
0.652 |
– |
– |
|
Водная фаза после разделения фаз* |
0.212 / 0.378 |
42.0 |
67.5 |
|
|
Исходный раствор |
5.40 |
0.658 |
– |
– |
|
Водная фаза после разделения фаз* |
0.295 / 0.442 |
32.9 |
55.1 |
|
|
Исходный раствор |
6.00 |
0.648 |
– |
– |
|
Водная фаза после разделения фаз* |
0.486 / 0.574 |
11.0 |
25.0 |
|
|
Исходный раствор |
7.00 |
0.648 |
– |
– |
|
Водная фаза после разделения фаз* |
0.648 / 0.648 |
0 |
0 |
|
– в числителе приводится значение концентрации при расходе HR 3.6:1, в знаменателе – при расходе HR 2.4:1.
3. Заключение
Таким образом, экспериментально подтверждена принципиальная возможность и целесообразность использования в качестве экстракционного реагента при экстракции церия нафтеновой кислоты (т.е. существенно более дешёвого реагента по сравнению с используемыми в настоящее время), что позволяет повысить извлечение данного компонента до 73.5 % и исключает необходимость применения высаливателя, и, в конечном итоге, способствует снижению материальных затрат.
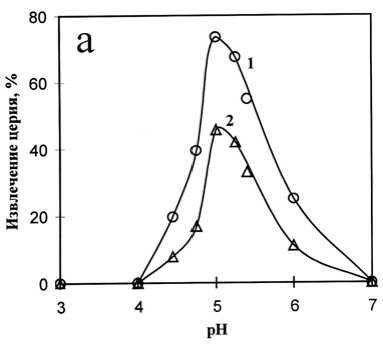
Рис. 2. Влияние рН на извлечение церия (а) ина коэффициент распределения Д (б) при расходе HR: 3.6 моль на моль Се (1) и 2.4 моль на моль Се (2) в исходном водном растворе
Девяткин П.Н. Экстракция церия нафтеновыми кислотами


