Экстрасистолия: неблагоприятные эффекты первого постэкстрасистолического сокращения
Автор: Германова О.А., Германов В.А., Щукин Ю.В., Германов А.В., Пискунов М.В.
Журнал: Вестник медицинского института "РЕАВИЗ": реабилитация, врач и здоровье @vestnik-reaviz
Рубрика: Клиническая медицина
Статья в выпуске: 6 (48), 2020 года.
Бесплатный доступ
До сих пор не изучены неблагоприятные эффекты первого постэкстрасистолического сокращения.Цель: определить неблагоприятные эффекты первого постэкстрасистолического сокращения путем изучения особенностей кинетики магистральных артерий и биомеханики сердца.Материал и методы. В исследование были включены 286 пациентов. На этапе отбора были исключены основные факторы риска атеросклероза. Все больные были отнесены к одной из двух основных групп на основании зарегистрированного количества экстрасистол в сутки: I группа - до 3000, II - 3000 и более экстрасистол. Выполнялся сбор жалоб, анамнеза, лабораторные и инструментальные методы исследования для уточнения характера и тяжести атеросклеротического поражения.Результаты. Было установлено, что атеросклеротическое поражение более выражено и чаще встречалось в группе II, причем при раннем варианте экстрасистолии с систолой желудочков, возникающей в кардиоцикле в фазу быстрого наполнения до открытия митрального клапана или до пика трансмитрального кровотока. Анализируемые параметры (ускорение, скорость, работа, мощность) по данным апекскардиографии (АКГ) и сфигмографии (СГ) артерий эластического и мышечно-эластического типов менялись в первом постэкстрасистолическом сокращении с определенной закономерностью: чем раньше было время появления систолы желудочков экстрасистолы в кардиоцикле, тем более значительное увеличение параметров наблюдалось.Выводы. Первое постэкстрасистолическое сокращение характеризуется неблагоприятными эффектами: происходит возрастание всех параметров кинетики магистральных артерий, биомеханики сердца, что может стать одним из факторов прогрессирования атеросклероза.
Кинетика магистральных артерий, экстрасистолия, биомеханика сердца
Короткий адрес: https://sciup.org/143175586
IDR: 143175586 | УДК: 616.12-008.3 | DOI: 10.20340/vmi-rvz.2020.6.11
Текст научной статьи Экстрасистолия: неблагоприятные эффекты первого постэкстрасистолического сокращения
Cite as: Germanova O.A., Germanov V.A., Shchukin Yu.V., Germanov A.V., Piskunov M.V. Extrasystoles: adverse effects of the first postextrasystolic contraction. Bulletin of the Medical Institute Reaviz. Rehabilitation, Doctor and Health. 2020;6(48):89–97.
Экстрасистолия (ЭС) – самый частый вид нарушения ритма сердца, который, по данным различных авторов, встречается у 95 % населения Земли [1].
Кардиоваскулярные осложнения продолжают оставаться одной из важнейших проблем в кардиологии несмотря на многолетнюю борьбу с данной патологией, разработку методов лечения и профилактики [2–4]. Однако в многочисленных проведенных исследованиях, посвященных изучению факторов риска сердечнососудистых осложнений, нигде не упоминалось о возможной роли нарушений ритма [5, 6]. В литературе до сих пор не проводился анализ влияния гемодинамических эффектов первого постэкстрасистоличе-ского сокращения на изменение основных параметров кинетики магистральных арте- рий, биомеханики сердца, а также развитие кардиоцеребральных осложнений и артериальной эмболии.
Цель исследования: определить неблагоприятные эффекты первого постэкс-трасистолического сокращения путем изучения особенностей биомеханики сердца и кинетики магистральных артерий.
Материал и методы
В исследование были включены 286 пациентов клиник Самарского государственного медицинского университета (СамГМУ), средний возраст – 63,2 ± 8,9 лет (134 женщины и 152 мужчины). Все больные поступали на плановое лечение для верификации и лечения ишемической болезни сердца (ИБС).
Критерии включения пациентов в исследование: подписанное пациентом согласие на участие в исследовании; плановая госпитализация в клиники СамГМУ.
Критерии исключения: хроническая сердечная недостаточность (ХСН) выше НIIА NYHA III; сахарный диабет (СД) 1 и 2 типов; хроническая обструктивная болезнь легких (ХОБЛ) выше легкой степени тяжести; табакокурение более 5 лет; сопровождающиеся синдромом гиперкоагуляции гематологические заболевания; экзогенноконституциональное ожирение (ЭКО) II степени и более; наследственная семейная гиперхолестеринемия; хроническая болезнь почек (ХБП) со снижением скорости клубочковой фильтрации ниже 80 мл/мин.; артериальная гипертензия (АГ) с артериальным давлением на фоне медикаментозной коррекции выше 160 и 100 мм рт. ст.; хронические очаги инфекции различной локализации.
Таким образом, уже на этапе включения больных в исследование мы постарались минимизировать влияние основных общеизвестных и достоверно верифицированных факторов риска развития атеросклероза.
При сборе жалоб и данных анамнеза мы обращали наше внимание на клинические признаки проявлений и осложнений атеросклероза магистральных артерий.
Всем больным в стационаре проводилась стандартная медикаментозная терапия в соответствии с рекомендациями Российского и Европейского общества кардиологов.
Лабораторные методы исследования были нацелены на выявление факторов риска повышенного тромбообразования и атеросклероза: общий анализ крови с подсчетом количества тромбоцитов; определение уровня липидов крови (общий холестерин, липопротеиды низкой плотности (ЛПНП), липопротеиды высокой плотности (ЛПВП), триглицериды, индекс атерогенно-сти), основные показатели гемостаза (фибриноген, активированное частичное тромбопластиновое время (АЧТВ), международ- ное нормализованное отношение (МНО), время свертываемости крови по Сухареву).
Всем пациентам было выполнено суточное мониторирование электрокардиографии (ЭКГ). По результатам данного исследования все больные были отнесены к одной из двух выделенных нами групп:
I группа (ее составили 144 человека) – это больные с ЭС до 3000 в сутки;
II группа (в нее вошли 142 человека) – пациенты с ЭС от 3000 и более в сутки.
С помощью методов апекскардиогра-фии (АКГ) и сфигмографии (СГ) всем больным проводилось вычисление параметров кинетики магистральных артерий и биомеханики сердца (ускорения, скорости, мощности, работы) [7]. При этом параметры измеряли для регулярного, экстрасистоличе-ского и первого постэкстрасистолического сокращений. Выполнялись инструментальные методы исследования: ультразвуковая допплерография брахиоцефальных сосудов (БЦС), трансторакальная или чреспи-щеводныя эхокардиография, ультразвуковое исследование почечных артерий, ветвей аорты, артерий нижних конечностей, суточное мониторирование ЭКГ. По показаниям части больных были проведены стресс-эхокардиография, коронарная или панцеребральная ангиография, ангиография почечных артерий.
Таким образом, обследование было направлено на комплексное изучение клинических проявлений и традиционных факторов риска атеросклероза.
При анализе статистических данных применялись принципы доказательной медицины. Применялся графо-аналитический метод, проводился анализ вариационных рядов, осуществлялось сравнение выделенных групп по основным анализируемым параметрам и определение достоверности полученных результатов с помощью критерия Стьюдента (р). Достоверными мы считали такие различия, когда критерий р был менее 0,05.
Результаты
Разница I и II групп была статистически не значима по возрасту, полу, основной сопутствующей патологии. Анализируемые параметры обеих групп пациентов представлены в таблице 1.
Признаки системного атеросклеротического поражения артерий различных локализаций при расспросе и обследовании выявлялись у пациентов обеих групп. Так, в обеих группах мы диагностировали стенозы ветвей аорты коронарных артерий, бифуркации общей сонной артерии (ОСА), почечных артерий, артерий нижних конечностей (АНК).
Однако мы наблюдали некоторую закономерность.
Факт 1. Атеросклеротическое поражение встречалось чаще, и его проявления носили статистически достоверный, более выраженный характер у пациентов II группы (табл. 2).
Таблица 1. Характеристика групп
|
Параметр |
I группа (N = 144) |
II группа (N = 142) |
р |
|
Возраст больных 40–49 лет, N (%) |
24 (17) |
21 (15) |
0,663 |
|
Возраст больных 50–59 лет, N (%) |
38 (26) |
34 (24) |
0,634 |
|
Возраст больных 60–69 лет, N (%) |
47 (33) |
53 (37) |
0,407 |
|
Возраст больных от 70 лет и старше, N (%) |
35 (24) |
34 (24) |
0,943 |
|
Среднее систолическое АД, mm Hg |
136 |
142 |
– |
|
Средняя частота сердечных сокращений (ЧСС), уд./мин. |
74 |
69 |
– |
|
Индекс массы тела |
22,6 |
23,8 |
– |
|
ХСН NYHA 0-I, N (%) |
112 (78) |
106 (75) |
0,535 |
|
ХСН NYHA II, N (%) |
32 (22) |
36 (25) |
0,535 |
|
Средняя фракция выброса, % |
61 |
58 |
– |
|
Боль за грудиной, N (%) |
36 (25) |
49 (35) |
0,079 |
|
ИБС, N (%) |
30 (21) |
46 (32) |
0,355 |
|
Инфаркт миокарда (ИМ) в анамнезе, N (%) |
14 (10) |
26 (18) |
0,037 |
|
Гипертоническая болезнь (ГБ), N (%) |
56 (39) |
58 (41) |
0,354 |
Таблица 2. Пациенты I и II групп
|
Параметр |
I группа (N = 144) |
II группа (N = 142) |
р |
|
Стеноз бифуркации ОСА (гемодинамически не значимый), N (%) |
34 (24) |
58 (41) |
0,002 |
|
Стеноз бифуркации ОСА (гемодинамически значимый), N (%) |
7 (5) |
26 (18) |
< 0,001 |
|
Стенозы АНК (гемодинамически не значимые), N (%) |
9 (6) |
23 (16) |
0,008 |
|
Стенозы АНК (гемодинамически значимые), N (%) |
3 (2) |
9 (6) |
0,073 |
|
Стенозы почечных артерий (гемодинамически значимые), N (%) |
1 (1) |
5 (4) |
0,096 |
|
Атеросклероз коронарных артерий, N (%) |
32 (22) |
69 (49) |
< 0,001 |
Факт 2. При анализе структуры имеющейся экстрасистолии мы обращали внимание на время возникновения систолы желудочков экстрасистолы в кардиоцикле. Так, мы разделили каждую из выделенных групп на две подгруппы. В подгруппы IA и IIA мы включили тех пациентов, у которых по данным суточного мониторирования ЭКГ регистрировалась ранняя ЭС. Термин
«ранняя» мы применяли к моменту возникновения систолы желудочков экстрасисто-лического сокращения в кардиоцикле. Так, к таким ранним ЭС мы отнесли те, когда систола желудочков ЭС возникала до открытия митрального клапана в фазу изоволюмического снижения внутрижелудочкового давления и до пика трансмитрального кровотока в фазу быстрого наполнения желудочков в кардиоцикле. О подобной градации ЭС мы упоминали ранее в наших работах [7, 8]. В подгруппы IВ и IIB вошли пациенты с остальными вариантами ЭС (табл. 3). Ранняя экстрасистолия является достаточно редкой, поэтому в IA, IIA подгруппы вошло меньшее количество пациентов, чем в IB, IIB подгруппы.
Результаты, полученные нами, регистрировались независимо от локализации эктопического центра ЭС. Так, атеросклеротическое поражение было более выраженным у больных с ранним вариантом ЭС – с систолой желудочков ЭС, возникающей до открытия митрального клапана в фазу изоволюмического снижения внутрижелудочкового давления, а также до пика трансмитрального кровотока в кардиоцикле в фазу быстрого наполнения желудочков. Необходимость и целесообразность подобной градации ЭС по времени возникновения систолы желудочков ЭС мы упоминали ранее в наших работах [7, 8].
Факт 3. В первом постэкстрасистоли-ческом сокращении наблюдалось следующее изменение параметров кинетики магистральных артерий и биомеханики сердца: чем раньше возникала систола желудочков экстрасистолы в кардиоцикле, тем больший прирост параметров наблюдался.
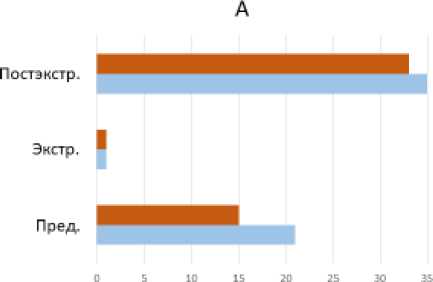
Так, на рисунках 1–3 по данным апекскардиографии и сфигмографии представлено изменение параметра работы как наиболее интегрального параметра – при различных вариантах экстрасистолии, вычисленные на артериях эластического (общей сонной) и мышечно-эластического (задняя артерия голени) типов, что подтверждает выявленную нами закономерность. В первом постэкстрасистолическом сокращении по данным АКГ и СГ магистральных артерий максимальный прирост параметра работы зафиксирован при ранней ЭС, возникающей до открытия митрального клапана в фазу изоволюмического снижения внутрижелудочкового давления (рис. 1–3). Мы производили расчет показателей вариационных рядов с последующим сравнительным анализом.
Таким образом, мы наблюдали увеличение параметра работы (как и других параметров – скорости, ускорения, мощности, работы), которое происходило в первом постэкстрасистолическом сокращении как для левого желудочка по данным АКГ, так и для артерий эластического типа (общей сонной артерии) и артерий мышечноэластического типа (задней артерии голени) по данным СГ.
По нашему мненю, именно время возникновения систолы желудочков ЭС в кардиоцикле определяет то, какие характеристики с точки зрения кинетики будет иметь первое постэкстрасистолическое сокращение. От этого зависит степень активного участия магистральных артерий в перемещении ударного объема крови, изгнанного сердцем.
Таблица 3. Пациенты IA, IB, IIA, IIB подгрупп
|
Параметр |
IA (N = 42) |
IB (N = 102) |
р |
IIA (N = 47) |
IIB (N = 95) |
р |
|
Стеноз бифуркации ОСА (гемодинамически не значимый), N (%) |
14 (33) |
20 (20) |
< 0,05 |
44 (94) |
14 (15) |
< 0,05 |
|
Стеноз бифуркации ОСА (гемодинамически значимый), N (%) |
6 (14) |
1 (1) |
< 0,05 |
19 (40) |
7 (7) |
< 0,05 |
|
Стенозы АНК (гемодинамически не значимые), N (%) |
8 (19) |
1 (1) |
< 0,05 |
15 (32) |
8 (8) |
< 0,05 |
|
Стенозы АНК (гемодинамически значимые), N (%) |
3 (7) |
0 (0) |
< 0,05 |
8 (17) |
1 (1) |
< 0,05 |
|
Стенозы почечных артерий (гемодинамически значимые), N (%) |
1 (2) |
0 (0) |
> 0,05 |
4 (9) |
1 (1) |
< 0,05 |
|
Атеросклероз коронарных артерий, N (%) |
20 (48) |
12 (12) |
< 0,05 |
36 (77) |
33 (35) |
< 0,05 |
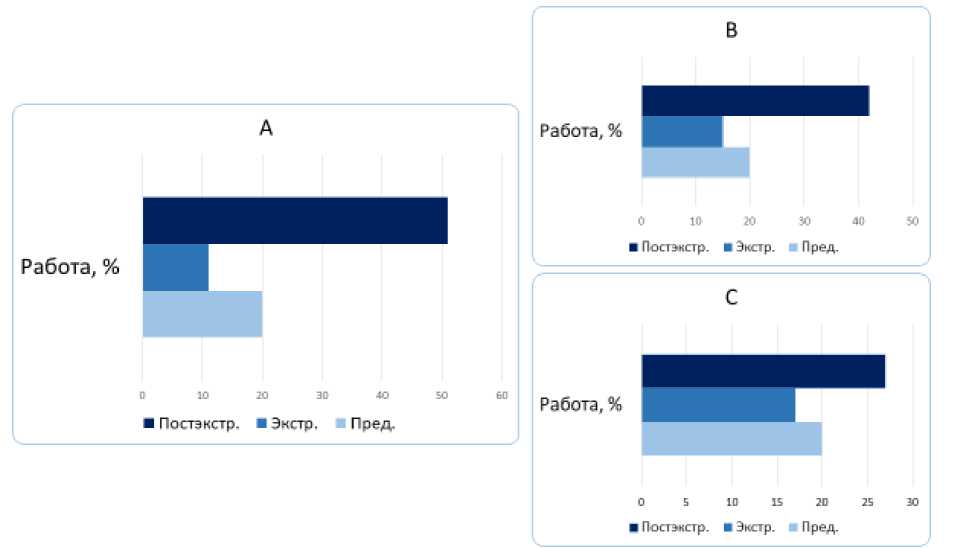
Рис. 1. Биомеханика левого желудочка (работа) при ЭС с систолой желудочков экстрасистолического сокращения до открытия митрального клапана (А), в фазу быстрого наполнения (В) и медленного (С) наполнения (в %). Пред. – предэкстрасистолическое (регулярное) сокращение, экстр. – экстрасистолия, постэкстр. – первое постэкстрасистолическое сокращение (р < 0,05)
■ Опок Приток
В
Постэкстр.
Экстр.
Пред.
О $ 10 15 20 25 Э0 35
-
■ Опок ■ Приток
С
Постэкстр.
Экстр.
Пред.
О S 10 1S 20 25 30 35
-
■ Опок ■ Приток
Рис. 2. Кинетика магистральных артерий (сонная артерия, работа) при ЭС с систолой желудочков экс-трасистолического сокращения до открытия митрального клапана (А), в фазу быстрого (В) и медленного (С) наполнения (в %). Пред. – предэкстрасистолическое (регулярное) сокращение, экстр. – экстрасистолия, постэкстр. – первое постэкстрасистолическое сокращение (р < 0,05). Показатель указан в фазу притока и оттока
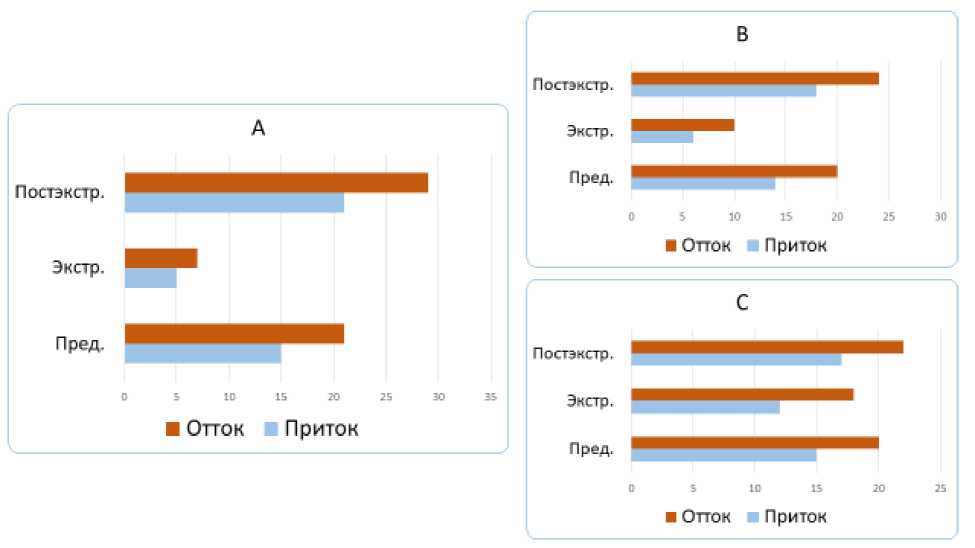
Рис. 3. Кинетика магистральных артерий (задняя артерия голени, работа) при ЭС с систолой желудочков экстрасистолического сокращения до открытия митрального клапана (А), в фазу быстрого (В) и медленного (С) наполнения (в %). Пред. – предэкстрасистолическое (регулярное) сокращение, экстр. – экстрасистолия, постэкстр. – первое постэкстрасистолическое сокращение (р < 0,05). Показатель указан в фазу притока и оттока
При ультразвуковой допплерографии БЦС при гемодинамически значимом стенозе устья внутренней сонной артерии (ВСА) более 70 % при различных вариантах экстрасистолии определялась следующая закономерность: чем раньше ЭС возникала в кардиоцикле, тем выше была линейная скорость кровотока (ЛСК) при прохождении волны первого постэкстрасистоличе-ского сокращения. Так, у пациентов при ранней ЭС с систолой желудочков ЭС до открытия митрального клапана в фазу изоволюмического снижения внутрижелудочкового давления в первом постэкстраси-столическом сокращении прирост ЛСК составил 160 % по сравнению с регулярным ритмом.
Обсуждение
Прежде всего, обращает на себя внимание факт более высокой частоты встречаемости и более тяжелого течения системного атеросклероза у пациентов при экстрасистолии, частота которой превышает 3000 экстрасистол в сутки. Особенно при ранней экстрасистолии – с систолой желудочков ЭС, возникающей в фазу изоволюмического снижения внутрижелудочкового давления до открытия митрального клапана, до пика трансмитрального кровотока в фазу быстрого наполнения желудочков в кардиоцикле. При этом изначально уже на этапе отбора пациентов в исследование традиционные факторы риска атеросклероза были исключены.
Обычно врач функциональной диагностики, при верификации гемодинамически значимого стеноза, проводя измерение ЛСК на артериях при экстрасистолии, анализирует данный параметр только при правильном ритме. Мы, напротив, в нашей работе измеряли ЛСК по данным допплерографии при ультразвуковом исследовании артерий во время прохождения очередной, экстрасистолической и первой постэкстра-систолической пульсовой волны при различных вариантах экстрасистолической аритмии, отличающейся временем возникновения экстрасистолы в кардиоцикле.
При измерении ЛСК по данным ультразвуковой допплерографии в одном и том же артериальном сосуде при гемодинамически значимом стенозе при прохождении первой постэкстрасистолической пульсовой волны скорость возрастала со следующей закономерностью: чем раньше систола желудочков экстрасистолы возникала в кардиоцикле, тем большее увеличение ЛСК наблюдалось. Так, у пациентов с ранней экстрасистолией (экстрасистолией до открытия митрального клапана в фазу изоволюмического снижения внутрижелудочкового давления) возрастание параметра ЛСК в устье ВСА наблюдалось в среднем на 160 % в сравнении с регулярной пульсовой волной.
При вычислении параметров кинетики артерий эластического, мышечноэластического типов, а также параметров биомеханики сердца мы выявили максимальное повышение их при ранней экстрасистолии в первом постэкстрасистоличе-ском сокращении. Всю совокупность изменений, происходящих при прохождении волны первого постэкстрасистолического сокращения, можно охарактеризовать понятием «гидравлический удар». Гидравлический удар – это механическое воздействие на внутреннюю часть сосудистой стенки увеличенными параметрами гемодинамики при прохождении волны первого постэкс-трасистолического сокращения. При этом сила гидравлического удара, а значит, и си- ла механического воздействия, напрямую зависит от момента возникновения систолы желудочков экстрасистолического сокращения в кардиоцикле: чем раньше она возникает, тем больше гидравлический удар. И в этом смысле он может стать той самой неблагоприятной скрытой угрозой, которую несет в себе первое постэкстрасистоличе-ское сокращение. Механическое воздействие гидравлического удара на интиму артериальных сосудов может привести к травме и росту уже имеющихся атером, становясь пусковым моментом для целой цепи патофизиологических механизмов, происходящих при атеросклерозе.
Выводы
-
1. При частой экстрасистолии проявления системного атеросклероза являются более тяжелыми.
-
2. Наибольшую опасность представляет ранняя экстрасистолия, которая приводит к значительному изменению параметров кинетики магистральных артерий и биомеханики сердца в первом постэкстра-систолическом сокращении и первой пост-экстрасистолической пульсовой волне.
-
3. Первое постэкстрасистолическое сокращение сопровождается появлением «гидравлического удара», который является дополнительным травмирующим фактором для всей артериальной системы, что может привести к нестабильности атером, тромбозам и эмболиям.
Список литературы Экстрасистолия: неблагоприятные эффекты первого постэкстрасистолического сокращения
- Затонская Е.В., Матюшин Г.В., Гоголашвили Н.Г. Распространенность и клиническое значение нарушений ритма сердца. Рациональная фармакотерапия в кардиологии 2017;13(3):403-408. DOI: 10.20996/1819-6446-2017-13-3-403-40
- Ежов М.В., Сергиенко И.В. Карманные рекомендации по ведению пациентов с атеросклерозом и дислипидемией 2019. https://www.remedium.ru/doctor/neurology/Epidemiologiya_zabolevaniy_serdechno_sosudistoy_sistemy_ateroskleroticheskogo_geneza
- Руководство по кардиологии. В 4 томах (под ред. Е.И. Чазова). В.В. Кухарчук, В.Н. Титов. Атеросклероз и дислипидемии. Т. 3: 15-58. М.: Практика, 2014.
- Townsend N, Wilson L, Bhatnagar P, Wickramasinghe K, Rayner M, Nichols M. Cardiovascular disease in Europe: epidemiological update 2016. Eur Heart J, 2016, 37(42): 3232-3245. DOI: 10.1093/eurheartj/ehw334
- Российский статистический ежегодник. 2016. https://minzdrav.gov.ru/ministry/61/22/stranitsa-979/statisticheskie-i-informatsionnye-materialy/statisticheskiy-sbornik-2016-god
- Бойцов С.А. Актуальные направления и новые данные в эпидемиологии и профилактике неинфекционных заболеваний. Терапевтический архив, 2016, 88(1): 4-10.
- Германова О.А., Германов А.В., Германов В.А., Пискунов М.В., Борзенкова Г.А., Колесников И.С. Экстрасистолия: гемодинамические аспекты и биомеханика магистральных артерий/ Журнал "Аспирантский вестник Поволжья", № 5-6, 2018.
- Olga Germanova, Yuri Shchukin, Vladimir Germanov, Giuseppe Galati, Andrey Germanov Extrasystolic Arrhythmia: Is It An Additional Risk Factor Of Atherosclerosis? Minerva Cardioangiologica 2021 Jan 11 DOI: 10.23736/S0026-4725.20.05490-0


