Экзометаболическая регуляция роста и свечения бактерий Vibrio harveyi BB170 при разной плотности популяции
Автор: Пшеничнов Р.А., Масленникова И.Л., Никитина Н.М.
Журнал: Вестник Пермского университета. Серия: Биология @vestnik-psu-bio
Рубрика: Микробиология
Статья в выпуске: 2, 2010 года.
Бесплатный доступ
Плотность культуры клеток-продуцентов аутоиндукторов экспоненциальной фазы определяет уровень АИ-2 в экзометаболитах, вызывая адекватную индукцию свечения репортерного штамма V. harveyi ВВ170. Показано, что увеличение количества клеток V. harveyi ВВ152 и E. coli K12 в ходе логарифмической фазы развития культуры снижало выживаемость V. harveyi ВВ170 после 5 ч контакта с соответствующими супернатантами. Выявлена зависимость уровня стимуляции свечения V. harveyi BB170 от исходной плотности сенсора. Оптимально высокая индукция люминесценции штамма V. harveyi ВВ170 с учетом ингибирования роста показана у культуры, содержащей 5105 кл/мл.
Аутоиндуктор-2, биоанализ, биолюминесценция
Короткий адрес: https://sciup.org/147204494
IDR: 147204494 | УДК: 579.222
Текст научной статьи Экзометаболическая регуляция роста и свечения бактерий Vibrio harveyi BB170 при разной плотности популяции
Многие бактерии регулируют экспрессию генов в условиях высокой плотности популяции, используя сигнальные молекулы межклеточной коммуникации, обеспечивая эффект «quorum sensing» (QS) (Henke et al., 2004). У большинства грамотрицательных бактерий аутоиндукторы принадлежат к семейству ацил-гомосеринлактонов (АИ-1), которые варьируют по составу и длине ацильной группы (Вахитов и др., 2006), у грамположительных микроорганизмов аутоиндукторами выступают олигопептиды (Taga et al., 2003).
Морские светящиеся бактерии Vibrio harveyi используют три QS-механизма регуляции оперона свечения: LuxLM/АИ-1, LuxS/АИ-2 (аутоиндуктор-2) (Taga et al., 2003), CqsS/САИ-1 (Henke et al., 2004). Штамм V. harveyi BB170 способен синтезировать все три известных аутоиндуктора, но отвечать только на АИ-2 вследствие инсерции транспозона Tn5 в ген сенсорного киназного белка АИ-1 (LuxN) (Surette et al., 1998). Сокращение темнового лаг-периода и индукция свечения V. harveyi BB170 экзометаболитами определяется только количественным содержанием АИ-2.
Ген luxS, кодирующий синтазу АИ-2, обнаружен в половине секвенированных геномов (Taga et al., 2003; Ahmer, 2004; Waters et al., 2005), супернатанты более 100 видов грамотрицательных и грампо-ложительных бактерий обладают активностью АИ-
2 (Henke et al., 2004). Кроме люминесценции, QS-механизмы, зависимые от АИ-2, модулируют вирулентность Streptococcus pyogenes , Escherichia coli , контролируют формирование биопленок Staphylococcus , подвижность, биосинтез антибиотиков, токсинов, споруляцию и др. (Lyon et al., 2001; Sircili et al., 2004; Kong et al., 2006; Gospodarek et al., 2009).
Необходимость изучения свечения и роста V. harveyi BB170 как сенсора АИ-2 обусловлена тем, что химическое определение АИ-2 методами высокоэффективной жидкостной и газовой хроматографии затруднено вследствие низкой концентрации и нестабильности молекулы аутоиндуктора (Vilchez et al., 2007). А процедура биоанализа со штаммом V. harveyi BB170 проста и позволяет провести скрининг большого количества образцов на присутствие АИ-2.
Однако, по литературным данным, на воспроизводимость реакции влияют многие факторы (Вахитов и др., 2006; Vilchez et al., 2007). В частности, указываются разные исходные концентрации сенсорного штамма 105 кл/мл (Gospodarek et al., 2009), 106–107 кл/мл (Bassler et al., 1994; Turovskiy et al., 2006), что может существенно изменить реакцию указанной тестерной системы на внеклеточные факторы.
Цель работы – изучить влияние плотности культуры штамма V. harveyi BB170 на уровень внутри- и межвидовой экзометаболической регуляции его роста и свечения при действии АИ-2 супернатантов гомологичного и гетерологичного штаммов V. harveyi BB152 и E. сoli K12 соответственно.
Методы исследования
В работе были использованы штаммы светящихся бактерий V. harveyi (любезно предоставлены B.L. Bassler, Princeton University): BB152 (LuxL::Tn5 АИ-1- АИ-2+) в качестве источника внеклеточного АИ-2 (АИ-1 не продуцирует); ВВ170 (LuxN::Tn5 сенсор АИ-1- сенсор АИ-2+) для анализа активности АИ-2 в экзометаболитах (Su-rette et al., 1998). Штамм E. coli K12 (wt) использовали для получения гетерологичных внеклеточных метаболитов.
V. harveyi выращивали на среде LB c добавлением NaCl (20 г/л) (LBS) и AB (Taga et al., 2003). E. coli K12 выращивали на LB с 0,5% глюкозой (LB+гл). Твердые питательные среды содержали агар (15 г/л). Штаммы E. coli K12 (LB+гл) и V. harveyi BB152 (LBS) выращивались при 30оС на качалке (165 об./мин) 16 ч. На следующее утро свежая среда инокулировалась ночной культурой до оптической плотности (ОП) 0,03–0,04 (фотометр КФК-3, кювета 3,0). Культуры выращивались в течение 2, 4, 6, 8, 24 ч при 30оС на качалке. Культуральные бесклеточные жидкости получали после предварительного центрифугирования (7000 об./мин, 15 мин) и пропускания через мембрану c диаметром пор 0,2 мкм (НТЦ «Владипор»). Супернатанты хранили при –20оС.
Сенсор V. harveyi ВВ170 исходно содержал 5×104, 5×105, 5×106, 107 кл/мл. Результаты представлены в виде индекса стимуляции (ИС,%) биолюминесценции, который вычисляли по формуле (Io– Ik) / Ik× 100, где Ik, Io – удельная (в пересчете на количество колонии образующих единиц (КОЕ)) биолюминесценция контроля и опыта соответственно.
Ростовая активность была измерена путем рассева на твердую среду клеточных суспензий соответствующих разведений. Чашки инкубировали в течение ночи в термостате при 30оС, количество колоний подсчитывали на следующий день (КОЕ/мл). Индекс роста (ИР, %) определяли по формуле
(К k – К o ) / К k × 100%, где К k , К o – КОЕ/мл контрольных и опытных вариантов соответственно.
Исследования проводились в трех сериях опытов с тремя повторностями. Статистическая обработка проводилась с использованием программы Excel.
Результаты исследования и их анализ
При изучении динамики развития штаммов – продуцентов метаболитов показано, что удельная скорость и оптическая плотность в конце логарифмической фазы развития культур E. coli K12 и V. harveyi ВВ152 (АВ) были сравнимы, но свечение V. harveyi ВВ170 с культуральной жидкостью штамма своего вида V. harveyi ВВ152 было значительно меньше (таблица). Выращивание V. harveyi ВВ152 на богатой среде LBS достоверно увеличивало его ростовые показатели, а также стимуляцию свечения тестерной культуры супернатантами. Таким образом, плотность культуры клеток-продуцентов аутоиндукторов экспоненциальной фазы, которая зависит от типа среды культивирования, определяет уровень АИ-2 в экзометаболитах, вызывая адекватную индукцию удельного свечения репортерного штамма V. harveyi ВВ170.
Ростовые характеристики бактериальных популяций экспоненциальной фазы развития, влияние на свечение V. harveyi BB170
|
Штамм (среда выращивания) |
ОП (ед. опт. пл) |
µ (ч-1) |
ИС (% от контроля) |
|
E. coli K12 (LB+гл) |
0,68±0,03 |
0,49±0,02 |
18560±406 |
|
V. harveyi BB152 (AB) |
0,57±0,05 |
0,48±0,01 |
1487±101 |
|
V. harveyi BB152 (LBS) |
1,40±0,04 |
0,60±0,04 |
64224±727 |
Выявлено, что с увеличением количества клеток V. harveyi ВВ152 и E. coli K12 в ходе развития культуры повышалась стимуляция свечения V. harveyi ВВ170 на фоне ингибирования роста соответствующими метаболитами после 5 ч контакта (рис. 1). Наибольшее подавление его роста вызывали супернатанты конца экспоненциальной фазы развития (6 ч). Причем, это не связано только с накоплением продуктов метаболизма, так как экзометаболиты стационарной фазы ингибировали
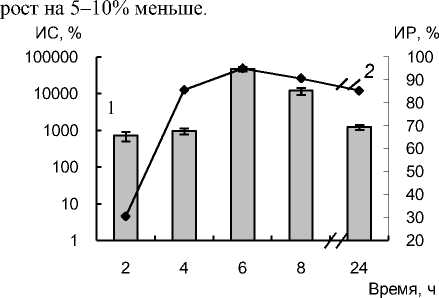
Рис. 1 . Индекс стимуляции свечения (1) и индекс роста (2) культуры штамма V. harveyi BB170 при действии метаболитов V. harveyi BB152 (LBS)
Предполагается, что luxS-зависимая регуляция действует как первая линия защиты, которая обеспечивает клетки жизненно важной информацией об изменении факторов окружающей среды, влияющих на рост (Xavier et al., 2005).
Далее была проведена работа по исследованию чувствительности культуры V. harveyi ВВ170 с разной плотностью клеток к АИ-2 метаболитов V.
harveyi ВВ152 и E. coli K12 конца логарифмической фазы, обладающих самой высокой сигнальной активностью аутоиндуктора.
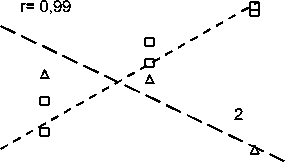
Увеличение исходной плотности тестерной культуры в указанных пределах (рис. 2, а) после 3 ч контакта приводило к увеличению чувствительности ее свечения к действию АИ-2 супернатантов (r = 0.99). Это коррелировало со снижением степени ингибирования роста штамма V. harveyi ВВ170 метаболитами (r = –0.99), и даже стимуляцией его роста при плотности более 5×106 кл/мл (рис. 2, б). Вероятно, полученные данные объясняются присутствием в тестер-ной культуре собственного эндогенного АИ-2 (Surette et al., 1998), шунтирующего влияние экзогенных метаболитов.
10000 100000 1000000 10000000
КОЕ/мл
100,0
80,0
60,0
40,0
20,0
-
-20,0
-40,0
ИР, %
r= - 0,99
10000 100000 1000000 100К0О0Е0/0м0л
Рис. 2. Зависимость биолюминесценции (а) и выживаемости (б) V. harveyi BB170 от исходного числа клеток при действии культуральных жидкостей конца экспоненциальной фазы развития популяций V. harveyi BB152 и E. coli K12 .
Время контакта: 1 – 3 ч; 2 – 5 ч
Дальнейшее культивирование репортерного штамма (5 ч контакта) с метаболитами E. coli K12 показало обратную картину зависимости экспрессии lux-оперона от плотности V. harveyi ВВ170 , особенно при 5×106 кл/мл и более плотных культурах, где ИС не превышал 100% от контроля (рис. 2). А при действии экзометаболитов V. harveyi ВВ152 (LBS) подобная корреляции выявлена у культур с 5×105, 5×106 кл/мл. Таким образом, в данных условиях показан самый высокий индекс стимуляции свечения V. harveyi BB170 , содержащего исходно 5×105 кл/мл.
Экзометаболическая регуляция с участием АИ-
2 и его предшественников считается универсальной, т.к. может включаться во внутри- и межвидовые QS-процессы у многих видов прокариот и эукариот (Xavier et al., 2005). Выявлено, что экзоме-таболическая регуляция роста и свечения штамма V. harveyi BB170 зависит от плотности и фазы развития как гомологичных ( V. harveyi ВВ152 ), так и гетерологичных культур ( E. coli К12 ), являющихся источником аутоиндукторов. Запуск QS-механизмов с помощью сигнальных молекул определяется также числом клеток – их возможных реципиентов, что следует учитывать при количественном определении сигнальной молекулы АИ-2 в составе метаболитов, используя процесс индукции биолюминесценции мутантного штамма V. harveyi BB170 (биоанализ АИ-2).
Проведенные исследования позволили сделать вывод, что стимуляция свечение культуры штамма V. harveyi ВВ170 с плотностью 5×105 кл/мл при действии АИ-2 метаболитов V. harveyi ВВ152 (LBS), E. coli К12 (LB+гл) после 5 ч контакта является оптимально высокой с учетом ингибирования роста сенсора.
Список литературы Экзометаболическая регуляция роста и свечения бактерий Vibrio harveyi BB170 при разной плотности популяции
- Вахитов Т.Я., Петров Л.Н. Регуляторные функции экзометаболитов бактерий//Микробиология. 2006. T. 75, № 4. С. 483-488.
- Ahmer B.M. Cell-to-cell signallig in Escherichia coli and Salmonella enterica//Mol. Microbiology. 2004. Vol. 52. P. 933-945.
- Bassler B.L., Wright M., Silverman M.R. Multiple signalling systems controlling expression of luminescence in Vibrio harveyi: sequence and function of genes encoding a second sensory pathway//Mol. Microbiol. 1994. Vol. 13. P. 273-286.
- Gospodarek E., Bogiel T., Zalas-Wiecek P. Communication between microorganisms as a basis for production of virulence factors//Pol. J. Microbiol. 2009. Vol. 58. P. 191-198.
- Henke J.M., Bassler B.L. Three parallel quorumsensing regulate gene expression in Vibrio harveyi//J. of Bacteriology. 2004. Vol. 186. P. 6902-6914.
- Kong K.F., Vuong C., Otto M. Staphylococcus quorum sensing in biofilm formation and infection//Int. J. Med. Microbiol. 2006. Vol. 296. P. 133-139.
- Lyon W.R., Madden J.C., Levin J. C. Stein J.L., Caparon M.G. Mutation of luxS affects growth and virulence factor expression in Streptococcus pyogenes//Mol. Microbiol. 2001. Vol. 42. P. 145-157.
- Sircili M.P., Walters M., Trabulsi L.R., Sperandio V. Modulation of enteropathogenic Escherichia coli virulence by quorum sensing//Infection and Immunity. 2004. Vol. 72. P. 2329-2337.
- Surette M.G., Bassler B.L. Quorum sensing in Escherichia coli and Salmonella typhimurium//PNAS. USA. 1998. Vol. 95. P. 7046-7050.
- Taga M.E., Bassler B.L. Chemical communication among bacteria//PNAS. USA. 2003. Vol. 100. P. 14549-14554.
- Turovskiy Y., Chikindas M.L. Autoinducer-2 bioassay is a qualitative, not quantitative method influenced by glucose//J. of Microbiological Methods. 2006. Vol. 66. P. 497-503.
- Vilchez R., Lemme A., Thiel V., Schulz S., Sztajer H., Wagner-Dobler I. Analysing traces of autoinducer-2 requires standartization of the Vibrio harveyi bioassay//Anal. Bioanal. Chem. 2007. Vol. 387. P. 489-496.
- Waters C., Bassler B. Quorum sensing: cell-to-cell communication in bacteria//Annu. Rev. Cell Dev. Biol. 2005. Vol. 21. P. 319-346.
- Xavier K.B., Bassler B.L. Regulation of uptake and processing of the quorum-sensing autoinducer AI-2 in Escherichia coli//J. of Bacteriology. 2005. Vol. 187. P. 238-248.


