Электрофизиологические параметры потенциалов действия клеток типа скрытого водителя ритма сердца кролика и мыши при действии лидокаина
Автор: Лебедева Е.А.
Журнал: Известия Коми научного центра УрО РАН @izvestia-komisc
Рубрика: Биологические науки
Статья в выпуске: 3 (15), 2013 года.
Бесплатный доступ
Эффекты лидокаина, блокатора Na+-каналов, на клетки, работающие в режиме скрытого водителя ритма, синусно-предсердного (СП) узла кролика и мыши, были исследованы с помощью стандартной микроэлектродной техники. Эксперименты показали, что лидокаин дозозависимо замедлял скорость фазы быстрой деполяризации (dV/dtmax) потенциала действия у кролика и мыши. Полученные результаты свидетельствуют о значительном вкладе Na+-каналов в формирование фазы быстрой деполяризации клеток СП области.
Синусно-предсердный узел, лидокаин, ионные каналы, кролик, мышь
Короткий адрес: https://sciup.org/14992625
IDR: 14992625 | УДК: 612.17
Текст научной статьи Электрофизиологические параметры потенциалов действия клеток типа скрытого водителя ритма сердца кролика и мыши при действии лидокаина
Синусно-предсердный (СП) узел представляет собой группу клеток, способных самостоятельно генерировать импульсы без участия нервной системы, что обеспечивает одно из главных свойств сердца – автоматию. В отличие от потенциала действия (ПД) клеток рабочего миокарда, клетки СП узла имеют фазу медленной диастолической деполяризации (МДД), которая при достижении порога и переходит в ПД. Несмотря на продолжительное изучение, механизмы, лежащие в основе генерации пейсме-керной активности, до сих пор не установлены.
В частности, до конца не ясна роль Na+-ка-налов. Долгое время считалось, что ионы натрия не участвуют в фазе быстрой деполяризации и значение Na+-тока в пейсмекерной активности клеток СП узла незначительно [1, 2]. Недавние исследования показали, что, кроме сердечной изоформы Na v 1.5 Na+-каналов, в СП узле также присутствует и нейрональная изоформа Na v 1.1, которая располагается равномерно по всему СП узлу и имеет более высокую чувствительность к блокаторам, чем сердечная изоформа [3, 4]. Кроме того, мутация гена Scn5a, кодирующего Na+-каналы, была найдена у многих пациентов с синдромом слабости СП узла [5].
Лидокаин – один из блокаторов потенциалзависимых Na+-каналов, антиаритмик I класса, широко применяемый в кардиологической практике и в качестве локального анестетика. Однако механизм его действия на клетки синусно-предсердной области до сих пор до конца не ясен. Эксперименты на изолированных предсердиях крыс показали, что лидокаин слабо снижает частоту генерации спонтанного ритма [6]. Но работы, проведенные на изолированных миоцитах СП узла кролика [7] и изолированном СП узле мыши [8], демонстрируют более сильное влияние лидокаина на пейсмекерную активность клеток этой области.
Таким образом, цель нашей работы заключалась в исследовании Na+-тока, участвующего в формировании фазы быстрой деполяризации, а также динамики изменения других электрофизиологических параметров ПД при различных концентрациях лидокаина у кролика и мыши.
Материал и методы
Опыты проводили на кроликах породы Шиншилла (возраст 6–7 месяцев, масса тела 3,0–3,5 кг) и белых мышах (возраст 8–16 недель, масса тела
30±5 г). Животных наркотизировали введением зо-летила (кролики, 15 мг/кг массы тела) и в парах эфира (мыши). Экспериментальный протокол был одобрен комиссией по биологической этике Института физиологии Коми НЦ УрО РАН. Сердце извлекали и помещали в растворе Тироде следующего состава (мМ/л): 140 NaCl; 10 NaHCO 3 ; 5,4 KCl; 1,8 CaCl 2 ; 1 MgSO 4 ; 0,33 Na 2 HPO 4 , 10 глюкоза; 5 HЕРЕS (pH 7,4). Удаляли желудочки и предсердия. В результате препарат имел размер 3х3 мм и включал область синусно-предсердного узла, фрагмент правого предсердия с поперечным гребешком ( crista terminalis ) и сегменты верхней и нижней полых вен ( superior и inferior vena cava ). Препарат помещали в проточную, аэрируемую, термостатируемую камеру, заполненную раствором Тироде при температуре 31±1°С. Эффекты лидокаина регистрировали на протяжении 15 мин экспозиции.
Регистрацию внутриклеточных ПД проводили с помощью стандартной микроэлектродной техники. Обработку результатов выполняли с помощью программ Microsoft Office Excel и PowerGraph Professional версия 3.3 (Россия). Данные приведены как среднее арифметическое ± стандартное отклонение (М±σ). Достоверность различий определяли по U-критерию Манна-Уитни. Различия считали достоверными при 0,01< р <0,05.
Результаты исследований
Общая характеристика ПД клеток скрытого водителя ритма кролика и мыши. Синуснопредсердная область состоит из клеток, электрофизиологические параметры которых различаются в зависимости от места регистрации. В наших экспериментах ПД клеток были зарегистрированы вдоль артерии СП узла, ниже поперечного гребешка (рис. 1). Частота генерирования ПД у спонтанно сокращающихся препаратов была равна 108±22 имп / мин (n=6) и 316±40 имп/мин (n=20) у кролика и мыши соответственно. В контрольном растворе Тироде скорость фазы быстрой деполяризации у пейсмекерных клеток в этой области у кролика составила 9±3 В∕с и 16±5 В∕с у мыши. Место регистра- ции ПД и высокая скорость фазы быстрой деполяризации позволяют отнести эти клетки к клеткам, работающим в режиме скрытого водителя ритма.
Эффекты лидокаина на фазу быстрой деполяризации (фаза 0) ПД у кролика и мыши. Дозозависимый эффект лидокаина, блокатора Na+-каналов, исследован в диапазоне от 5 до 1000 мкМ (рис. 2). Установлено, что пороговая концентрация лидокаина для клеток, работающих в режиме скрытого водителя ритма, составила 100 мкМ (n=4) для кролика и 12 мкМ (n=4) для мыши. У обоих видов животных происходило замедление скорости нарастания фазы быстрой деполяризации (dV/dt max ) на 24% ( р <0,05) и 35% ( р <0,05) соответственно. При этом частота генерации ПД уменьшалась незначительно (у мыши на 13% ( р <0,05), у кролика не было отмечено достоверных изменений).
При дальнейшем повышении концентрации лидокаина происходило дозозависимое снижение dV/dt max у обоих видов животных (рис. 2). Анализ дозозависимой кривой показал, что концентрация лидокаина, при которой происходит снижение максимальной скорости деполяризации ПД в фазу 0 на 50% (ЕС 50 ) у клеток синусно-предсердного узла кролика, составила ≈230 мкМ, у мыши – ≈ 20 мкМ. При высоких концентрациях блокатора (1000 мкМ) у кролика наблюдается монотонное замедление dV/dt max , снижение амплитуды ПД, смещение максимального диастолического потенциала (E макс ) в сторону деполяризации и блок генерации ПД на 7-й мин экспозиции (n=5). У клеток СП узла мыши блок спонтанной активности происходил в течение 3 мин (n=3) после добавления лидокаина (1000 мкМ). При удалении блокатора из перфузирующего раствора спонтанная активность препаратов возобновлялась через 5–10 мин.
Лидокаин представляет собой селективный блокатор Na+-каналов. На нейронах крысы показано, что лидокаин (1000 мкМ) полностью блокирует Na+-каналы и генерацию ПД [9]. Однако ряд исследователей свидетельствуют, что кроме Na+-каналов местный анестетик действует на несколько типов Са2+- и К+-каналов [9]. В нейронах концентрация ли-
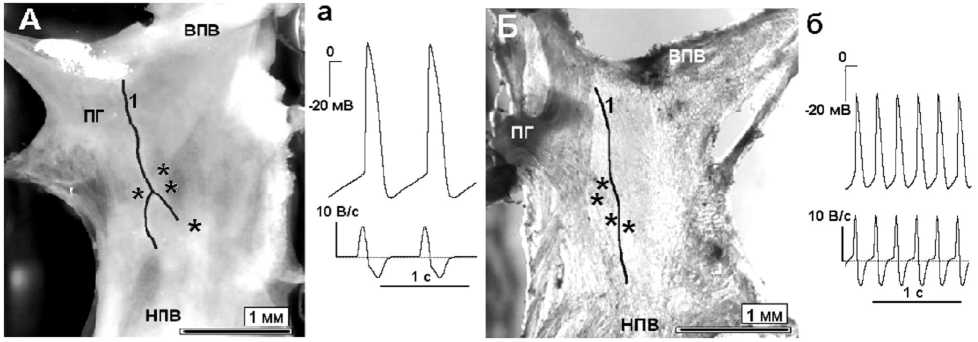
Рис. 1. Препараты синусно-предсердной области кролика (А) и мыши (Б) и потенциалы действия с первой производной (а, б). Примечание: ВПВ – верхняя полая вена; НПВ – нижняя полая вена; ПГ – поперечный гребешок; 1 – артерия синусно-предсердного узла; * – зона регистрации ПД типа скры-
того водителя ритма.
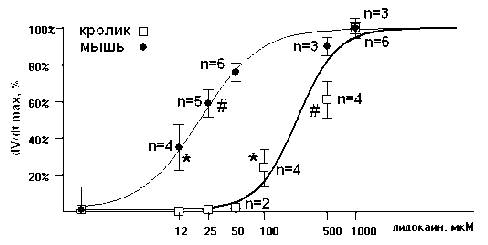
Рис. 2. Дозозависимый эффект лидокаина на скорость нарастания фазы быстрой деполяризации (dV/dt max ) ПД у кролика и мыши.
* – достоверность различий по сравнению с контролем ( р <0,05); # – достоверность различий по сравнению с * ( р <0,05).
докаина, которая блокирует Ca2+-каналы на 50% (ЕС 50 ), составляет ≈ 2,8 мМ [9]. Сродство К+-каналов к действию лидокаина зависит от типа самого канала и примерно в 10 – 80 раз ниже, чем для Nа+-канала [10]. Это в несколько раз больше, чем требуется для полной блокады Na+-каналов.
Таким образом, остановка генерации ПД в клетках СП узла кролика и мыши связана с полным блоком Na+-каналов. Однако стоит отметить, что чувствительность пейсмекерных клеток к низким концентрациям блокатора у этих животных различна. Возможно, что различие в чувствительности клеток к действию лидокаина (≈ в 10 раз) связано с разным соотношением сердечной (Na v 1.5) и нейрональной (Na v 1.1) изоформ Na+-каналов, бо́льшим вкладом быстрого компонента Na+-тока в генерацию пейсмекерной активности в СП узле мыши или в особенностях в строении ионных каналов (Na v 1.5 и Na v 1.1) на молекулярном уровне у этих животных.
Эффекты лидокаина на фазу медленной диастолической деполяризации (фаза 4) ПД у кролика и мыши. В низких концентрациях (100 мкМ для кролика и 12 мкМ для мыши) лидокаин не влиял на длительность и скорость фазы МДД. Повышение концентрации блокатора (500 мкМ для кролика, n=4; 25 мкМ для мыши, n=5) приводило к замедлению скорости фазы МДД (V 4 ) у мыши на 21% ( р <0,05). В клетках СП узла кролика V 4 достоверно не изменялась, но E макс смещался в сторону деполяризации (на 21 %). В результате частота генерации ПД снижалась на 23 и 27% у кролика и мыши соответственно (рис. 3).
В экспериментах на изолированных клетках СП узла кролика Rocchetti и соавт. [7] показали, что лидокаин может блокировать каналы HCN, по которым идет ток, активируемый гиперполяризацией (If), способствующий фазе МДД.
Наши результаты также демонстрируют изменение фазы МДД при действии лидокаина, однако механизм действия блокатора у исследуемых видов животных различен. В СП узле кролика заключительная часть МДД не изменялась, но за счет смещения E макс в сторону деполяризации существенно удлинялась фаза конечной реполяризации и незначительно снижалась спонтанная деполяризация. В СП узле мыши МДД существенно растягивалась в последней трети, а фаза конечной реполяризации не изменялась. Если эти изменения вызваны блоком HCN-каналов, тогда можно предположить, что свойства тока, активируемого гиперполяризацией (I f ), у этих видов животных различны и генерирование фазы МДД имеет свою специфичность.
Заключение
Лидокаин дозозависимо снижал максимальную скорость нарастания потенциалов действия в фазу 0 (dV/dt max ) у клеток синусно-предсердной области сердца кролика и мыши.
При сопоставимых dV/dt max у обоих видов животных пейсмекерные клетки синусно-предсердного узла мыши демонстрировали более высокую чувствительность (в 10 раз) к блокатору Na+-кана-лов лидокаину, чем клетки синусно-предсердного узла кролика.
Остановка спонтанной активности у пейсме-керных клеток кролика и мыши в присутствии лидокаина свидетельствует о том, что наравне с Ca2+-каналами Na+-каналы играют важную роль в формировании фазы быстрой деполяризации клеток синусно-предсердной области.
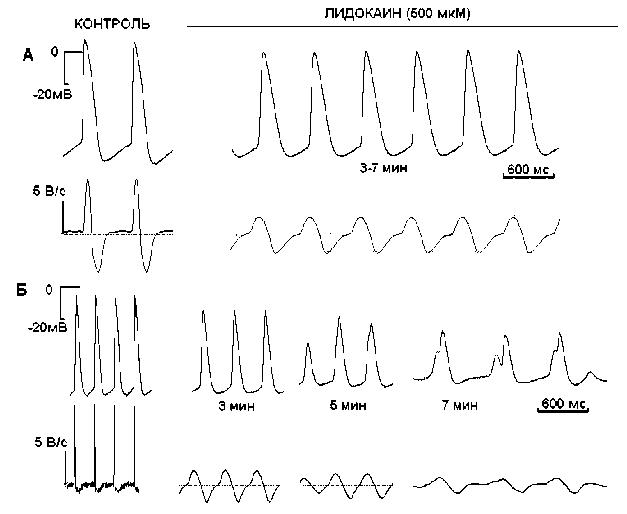
Рис. 3. Изменения конфигурации ПД и первой производной (dV/dt max ) кролика (А) и мыши (Б) при действии лидокаина (500 мкМ).
Список литературы Электрофизиологические параметры потенциалов действия клеток типа скрытого водителя ритма сердца кролика и мыши при действии лидокаина
- Baruscotti M., Robinson R.B. Electrophysiologyand pacemaker function of the developing sinoatrialnode//J. Physiol. Heart. Circ.Physiol. 2007. Vol. 293. P. Н2613-Н2623.
- Boyett M.R., Honjo H., Kodama I. The sinoatrialnode, a heterogeneous pacemakerstructure//Cardiovasc. Res. 2000. Vol. 47.P. 658-687.
- Lei M., Jones S.A., Liu T. et all. Requirementof neuronal-and cardiac-type sodium channelsfor murine sinoatrial node pacemaking//J.Physiol. 2004. Vol. 559. P. 835-848.
- Tellez J.O., Dobrzynski H., Greener I.D. et all.Differential expression of ion channel transcriptsin atrial muscle and sinoatrial node inrabbit//Circ. Res. 2006. Vol. 99. P. 1384-1393.
- Butters T.D, Aslanidi O.V., Inada S. et all.Mechanistic links between Na+ channel(SCN5A) mutations and impaired cardiacpacemaking in sick sinus syndrome//Circ.Res. 2010. Vol. 107. P. 126-137.
- Létienne R., Vié B., Le Grandet B. Pharmacologicalcharacterisation of sodium channels insinoatrial node pacemaking in the rat heart//Eur. J. Pharmacol. 2006. Vol. 530. P. 243-249.
- Rocchetti M., Armato A., Cavalieri B. et all.Lidocaine inhibition of the hyperpolarizationactivatedcurrent (If) in sinoatrial myocytes//J. Cardiovas. Pharmacol. 1999. Vol. 34. Р.434-439.
- Lebedeva E.А., Golovko V.А. An analysis of lidocaineand hyposodium solution effects ongeneration of pacemaker action potential inmouse sinoatrial node//Proc. XXX Ann.Meeting ISHR. Medimond. Bolonga. 2011.№628. P. 31-34.
- Gold M.S., Reichling D.B., Hampl K.F. et all.Lidocaine toxicity in primary afferent neuronsfrom the rat//J. Pharmacol. Exp. Ther. 1998Vol. 285. P. 413-421.
- Scholz A. Mechanisms of (local) anaesthetics onvoltage-gated sodium and other ion channels//Br. J. Anaesth. 2002. Vol. 89. P. 52-61.


