Электрохимический способ получения ферментативных белковых гидролизатов из гидробионтов, используемых для приготовления микробиологических питательных сред
Автор: Кучина Ю.А., Шошина Е.В., Дубровин С.Ю., Путинцев Н.М., Коновалова И.Н., Василевский П.Б.
Журнал: Вестник Мурманского государственного технического университета @vestnik-mstu
Статья в выпуске: 4 т.10, 2007 года.
Бесплатный доступ
Показана возможность использования ферментативных белковых гидролизатов, полученных электрохимическим способом из гидробионтов, в качестве основы микробиологических питательных сред. Питательные среды на основе данного гидролизата имеют хорошую чувствительность к росту и типичную морфологию колоний тест-культур: Corynebacterium xerosis 1911, Staphylococcus aureus Wood - 46, Escherichia coli 055 K59 3912/41, Pseudomonas aeruginosa 27/99, Shigella flexneri la 8516 и Salmonella typhi H- 901.
Короткий адрес: https://sciup.org/14293892
IDR: 14293892 | УДК: 574.5:577.1:[664.951.014:577.112]
Текст научной статьи Электрохимический способ получения ферментативных белковых гидролизатов из гидробионтов, используемых для приготовления микробиологических питательных сред
электролизе обеспечиваются необходимые значения величины рН и температуры для проведения процесса ферментативного гидролиза белоксодержащего сырья. Таким образом, создаются условия ферментолиза без использования агрессивных химических реагентов – кислот и щелочей, а нагрев реакционной среды осуществляется за счет выделения омического тепла при прохождении электрического тока через раствор электролита.
Для расщепления белоксодержащего сырья применяли ферментный препарат панкреатин с активностью 8*USP – 200 ед. (производства США).
Аминокислотный состав полученных белковых гидролизатов сравнивали с коммерческим панкреатическим гидролизатом рыбы производства ОАО "Протеин" (г. Мурманск) и панкреатическим гидролизатом рыбной муки производства НПО "Питательные среды" (г. Оболенск) ( Артюхин и др. , 1990; Телишевская , 2000; Мухин, Новиков , 2001).
Ферментативная электрохимическая технология состоит из следующих операций: измельчение сырья, смешение с раствором электролита, электроэнзиматический гидролиз в электролизере при заданной температуре и рН реакционной среды, термоинактивация фермента, отстаивание, декантация, отделение негидролизованного сырья и веществ липидной природы с помощью фильтрации и сушка.
Гидролиз сырья проводили в электролизере с инертными электродами при постоянном перемешивании и плотности тока 300-400 А/м2.
Для фильтрации использовали фильтровальную ткань-бельтинг и бумажные фильтры "белая лента".
Величину рН растворов определяли с помощью универсального иономера ЭВ-74.
Эффективность процесса ферментолиза белоксодержащего сырья определяли по степени гидролиза (отношение аминного азота к общему азоту – Nам./Nоб., %) и по изменению в процессе гидролиза содержания аминного азота в реакционной среде.
Химический состав полученных гидролизатов изучали согласно ГОСТу 7636-85.
Аминокислотный анализ полученных гидролизатов проводили методом обращенно-фазной высокоэффективной жидкостной хроматографии (ВЭЖХ) с использованием системы ВЭЖХ LC-10АVP ("Shimadzu Corp.", Япония) и колонки SupelcosilТМ LC-18 ("SUPELCO", США). Для регистрации продуктов, содержащих свободные аминогруппы, предварительно проводили их дериватизацию с помощью ортофталевого альдегида (Henderson et al., .
Оценку пригодности электрохимического панкреатического гидролизата рыбы для использования его в составе микробиологических питательных сред проводили согласно требованиям ФС 42-3378-97 в лаборатории ФГУ "Мурманский ЦСМ".
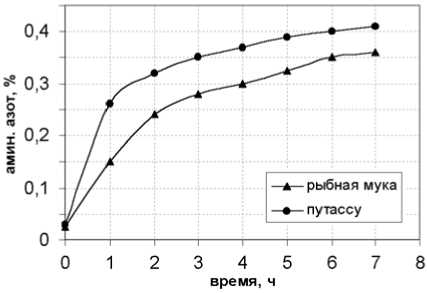
Рис. 1. Изменение концентрации аминного азота в процессе электроэнзиматического гидролиза рыбной муки и путассу
-
3. Обсуждение результатов
Ферментативные электрохимические гидролизаты были получены при тех же условиях, что и коммерческие ферментативные гидролизаты (ТУ-480-00001927-27-93). А именно, гидромодуль 1:1 (соотношение сырье:вода); электроэнзиматический гидролиз вели в течение 6 часов при температуре 48±2°C и рН 7.8-8.0; далее создавали в реакционной среде величину рН = 4.4-4.5, при этом выделившиеся белки (с ММ ≈ 67 кД) отделяли фильтрацией после 12-ти часового отстаивания; доводили величину рН среды до нейтральных значений, фильтровали и сушили. Затем был изучен химический и аминокислотный состав экспериментальных гидролизатов.
На рис. 1 показано изменение концентрации аминного азота в процессе ферментолиза, которое свидетельствует о скорости расщепления белковых молекул с образованием свободных аминокислот и пептидных фрагментов. Для достижения необходимой концентрации аминогрупп в конечном продукте (согласно ТУ-480-00001927-27-93) процесс ферментолиза белоксодержащего сырья необходимо вести 5-6 часов.
В табл. 1 приведены результаты химического и аминокислотного анализа ферментативных гидролизатов, полученных электрохимическим способом, и аналогичные показатели ферментативных гидролизатов, произведенных химическим методом, взятые из литературных источников.
Таблица 1. Химический и аминокислотный состав ферментативных гидролизатов, полученных традиционным химическим и электрохимическим способами
|
Показатель, % |
Ферментативный химический гидролиз |
Электроэнзиматический гидролиз |
||
|
Путассу / Панкреатин |
РМ/ Панкреатин |
Путассу / Панкреатин |
РМ/ Панкреатин |
|
|
N об. % |
10.87 |
13.3 |
10.05 |
12.66 |
|
N ам. % |
4.24 |
4.4 |
3.92 |
3.42 |
|
Степень гидролиза, % |
39.0 |
33.1 |
39.0 |
27.5 |
|
NaCl, % |
7.8 |
9.0 |
17.8 |
|
|
Содержание свободных аминокислот, % |
21.49 |
19.5 |
23.28 |
20.9 |
|
Аспарагиновая |
0.944 |
0.52 |
0.202 |
0.056 |
|
Глутаминовая |
1.714 |
0.673 |
0.569 |
0.093 |
|
Серин |
0.710 |
0.42 |
0.580 |
0.076 |
|
Гистидин |
0.632 |
0.52 |
0.178 |
0.162 |
|
Глицин |
0.248 |
0.20 |
1.422 |
0.583 |
|
Треонин |
0.682 |
0.53 |
0.648 |
0.595 |
|
Аргинин |
2.406 |
2.89 |
5.781 |
6.274 |
|
Аланин |
1.528 |
1.02 |
1.659 |
0.429 |
|
Тирозин |
1.566 |
1.35 |
1.84 |
0.895 |
|
Валин |
1.092 |
1.29 |
1.055 |
0.194 |
|
Метионин |
0.400 |
0.85 |
0.189 |
0.122 |
|
Триптофан |
0.566 |
– |
0.492 |
0.137 |
|
Изолейцин |
– |
1.04 |
0.716 |
0.376 |
|
Фенилаланин |
2.052 |
2.14 |
1.53 |
1.315 |
|
Лейцин |
4.244 |
2.96 |
5.144 |
2.782 |
|
Лизин |
2.704 |
3.08 |
1.279 |
6.059 |
Содержание аминного и общего азота в сравниваемых гидролизатах практически одинаково, содержание NaCl не превышает допустимых значений (согласно ТУ-480-00001927-27-93). Степень гидролиза в ферментативных электрохимических гидролизатах составляет 27-40 %. Этот показатель соответствует высокой степени гидролиза белоксодержащего сырья и позволяет использовать полученные гидролизаты в микробиологии, как компоненты для приготовления питательных сред. Количество свободных аминокислот в электрохимических ферментативных гидролизатах на 5-10 % выше, чем в гидролизатах, полученных по ферментативной химической технологии ( Телишевская , 2000; Мухин, Новиков , 2001; Артюхин и др ., 1990) . Кроме того, данные гидролизаты характеризуются более высоким (в 0.5-2.5 раза) содержанием глицина, аргинина, лейцина в обоих гидролизатах; аланина, тирозина и лейцина в гидролизате из рыбы (путассу) и лизина в гидролизате из рыбной муки.
Низкое содержание аспарагиновой и глутаминовой кислот, по всей видимости, можно объяснить тем, что в щелочной среде происходит ионизация обеих карбоксильных групп, поэтому эти аминокислоты могут легко перемещаться в анодное пространство. Пониженное содержание серина, гистидина и метионина можно объяснить длительным электрохимическим процессом, при котором возможно их электрохимическое разложение, например, декарбоксилирование.
Для определения возможности использования ферментативных электрохимических гидролизатов рыбы и рыбной муки в составе питательных сред были приготовлены питательный бульон и питательный агар на их основе. Анализ микробиологической активности проводили путем сравнения роста шести тест-культур: Corynebacterium xerosis 1911 , Staphylococcus aureus Wood – 46 , Escherichia coli 055 K59 3912/41 , Pseudomonas aeruginosa 27/99 , Shigella flexneri la 8516 и Salmonella typhi H – 901 .
Качество питательного бульона на основе панкреатического гидролизата оценивали по следующим показателям: чувствительность к росту тест-культур; стабильность основных морфологических, культуральных, биохимических (образование индола и сероводорода) свойств; эффективность роста (выход биомассы с 1 мл среды). В качестве контрольной питательной среды использовали коммерческий питательный бульон (ГРМ-бульон), биологическое качество которого регламентируется ФС 42-3378-97.
Результаты чувствительности тест-культур на испытуемых средах приведены в табл. 2.
Таблица 2. Биологические показатели питательного бульона, приготовленного на основе электрохимического панкреатического гидролизата рыбы или рыбной муки и на основе коммерческого ГРМ-агара
|
Основа питательной среды |
Кратность разведения |
ТЕСТ-КУЛЬТУРЫ |
|||||
|
Corynebact erium. xerosis 1911 |
Escherihia Coli 055 K59 3912/41 |
Pseudomonas aeruginosa 27/99 |
Staphilo-coccus аureus Wood-46 |
Shigella Flexneri la 85/16 |
Salmonella typhi H-901 |
||
|
Электрохимич. |
10-6 |
Рост |
Рост |
Рост |
Рост |
Индол |
Н 2 S |
|
панкреатич. |
10-7 |
Рост |
Рост |
Рост |
Рост |
Индол |
Н 2 S |
|
гидролизат рыбной муки |
10-8 |
Рост |
Рост |
Рост |
Рост |
Индол |
Н 2 S |
|
Электрохимич. |
10-6 |
Рост |
Рост |
Рост |
Рост |
Индол |
Н 2 S |
|
панкреатич. |
10-7 |
Рост |
Рост |
Рост |
Рост |
Индол |
Н 2 S |
|
гидролизат рыбы |
10-8 |
Рост |
Рост |
Рост |
Рост |
Индол |
Н 2 S |
|
Коммерческий ГРМ-агар |
10-6 |
Рост |
Рост |
Рост |
Рост |
Индол |
Н 2 S |
|
10-7 10-8 |
Рост Рост |
Рост Рост |
Рост Рост |
Рост Рост |
Индол Индол |
Н 2 S Н 2 S |
|
Как видно из данных табл. 2, питательный бульон, приготовленный на основе панкреатических электрохимических гидролизатов рыбной муки и путассу, по чувствительности тест-культур полностью удовлетворяет требованиям ФС 42-3378-97 к их биологическому качеству и даже превосходит их, так как максимальное разведение, в котором испытуемые штаммы тест-культур давали рост, составляет 10-8, что соответствует 10 КОЕ/мл. Shigella flexneri la 8516 сохраняла свою протеолитическую активность и образовывала индол, соответственно Salmonella typhi H-901 проявляла способность к образованию сероводорода.
Эффективность роста тест-культур или их всхожесть определяли на питательном агаре, для приготовления которого в качестве основы использовали гидролизат рыбной муки. Для сравнения и контроля количества засеваемого материала параллельно делали посев на коммерческий питательный агар, используемый для определения количества мезофильных аэробных и факультативно-анаэробных микроорганизмов. В качестве тест-культур применяли Corynebacterium xerosis 1911 , Staphylococcus aureus Wood – 46 , Escherichia coli 055 K59 3912/41 , Pseudomonas aeruginosa 27/99 .
Результаты посева тест-культур на питательный агар представлены в таблицах 3-4.
Как видно из данных, приведенных в таблицах 3 и 4, эффективность роста всех тест-культур на питательном агаре с использованием электрохимического панкреатического гидролизата рыбной муки сопоставима с всхожестью тест-культур на коммерческом питательном агаре. Эффективность роста тест-культур соответствует количеству микробных клеток в засеваемых объемах при пересчете на исходную взвесь, приготовленную по стандарту мутности на 10 единиц. Морфология колоний на питательном агаре с электрохимическим гидролизатом и на коммерческом питательном агаре является идентичной и соответствует паспортным данным тест-культур. Тест-культура Pseudomonas aeruginosa 27/99 продуцирует пигмент пиоцин сине-зеленого цвета при росте на обеих средах.
Таблица 3. Сравнительная характеристика эффективности роста тест-культур на питательном агаре с использованием гидролизата рыбной муки
|
Разведение и засеваемый объем |
Питательный агар с коммерческим панкреатическим гидролизатом рыбной муки |
|||
|
Escherichia coli 055 K59 3912/41 |
Pseudomonas aeruginosa 27/99 |
Corynebacterium xerosis 1911 |
Staphylococcus aureus Wood – 46 |
|
|
10-6 / 0.1 мл |
0.6×108 |
6.4×108 |
8.2×108 |
3.3×108 |
|
10-7/ 0.5 мл |
2.1×108 |
6.3×108 |
7.1×108 |
4.7×108 |
|
10-8/1.0 мл |
2.0×108 |
5.0×108 |
1.1×108 |
2.5×108 |
|
Всего |
1.5×108 |
5.9×108 |
8.8×108 |
3.5×108 |
|
Питательный агар с электрохимическим панкреатическим гидролизатом рыбной муки |
||||
|
10-6 / 0.1 мл |
1.2×108 |
8.3×108 |
7.4×108 |
3.9×108 |
|
10-7/ 0.5 мл |
1.4×108 |
6.0×108 |
7.9×108 |
3.4×108 |
|
10-8/1.0 мл |
1.0×108 |
0.5×108 |
1.1×108 |
4.0×108 |
|
Всего |
1.2×108 |
7.9×108 |
8.7×108 |
3.8×108 |
Таблица 4. Сравнительная характеристика эффективности роста тест-культур на питательном агаре с использованием гидролизата рыбы
|
Разведение и засеваемый объем |
Питательный агар с коммерческим панкреатическим гидролизатом рыбы |
|||
|
Escherichia coli 055 K59 3912/41 |
Pseudomonas aeruginosa 27/99 |
Corynebacterium xerosis 1911 |
Staphylococcus aureus Wood – 46 |
|
|
10-6 / 0.1 мл |
2.7×108 |
5.4×108 |
8.0×108 |
2.1×108 |
|
10-7/ 0.5 мл |
2.3×108 |
5.0×108 |
9.5×108 |
1.3×108 |
|
10-8/1.0 мл |
1.5×108 |
4.7×108 |
7.5×108 |
1.3×108 |
|
Всего |
2.2×108 |
5.0×108 |
8.7×108 |
1.5×108 |
|
Питательный агар с электрохимическим панкреатическим гидролизатом рыбы |
||||
|
10-6 / 0.1 мл |
2.0×108 |
7.2×108 |
7.0×108 |
3.0×108 |
|
10-7/ 0.5 мл |
3.5×108 |
6.5×108 |
5.6×108 |
2.3×108 |
|
10-8 / 1.0 мл |
3.1×108 |
5.0×108 |
9.0×108 |
1.9×108 |
|
Всего |
3.1×108 |
6.2×108 |
7.5×108 |
2.4×108 |
-
4. Вывод
Применение процесса электролиза водных растворов неорганических солей для получения гидролизатов из рыбы и рыбной муки в присутствии фермента – панкреатина позволяет на 5-10 % увеличить выход свободных аминокислот. В полученных гидролизатах увеличивается содержание глицина, аргинина, лейцина.
Результаты микробиологических исследований подтверждают возможность использования электрохимических гидролизатов для приготовления микробиологических питательных сред. Питательные среды на их основе для большинства тест-культур показали большую чувствительность, чем на коммерческом гидролизате. Полученные питательные среды не имеют отклонений в морфологии колоний. Электрохимические панкреатические гидролизаты рыбы и рыбной муки полностью соответствует требованиям ФС 42-3378-97.


