Электролитические свойства растворов угольной кислоты и инновационные методы оперативного контроля качества вод типа конденсата на ТЭС
Автор: Щербаков Владимир николаевиЧ.
Журнал: Advanced Engineering Research (Rostov-on-Don) @vestnik-donstu
Рубрика: Машиностроение и машиноведение
Статья в выпуске: 4 (83) т.15, 2015 года.
Бесплатный доступ
Целью работы является совершенствование оперативного кондуктометрического контроля качества пара на ТЭС. Для этого разработана методика определения концентраций СО 2 в паре при нейтральном водно-химическом режиме без дозирования аммиака. Использован метод измерений электропроводности конденсата пара при рабочих давлениях парогенераторов и различных температурах. Реализация данного метода с помощью специального устройства обеспечила значительное снижение инерционности контроля и дифференцирование примесей. Проанализированы экспериментальные данные о первых кажущихся константах диссоциации и предельной эквивалентной электропроводности угольной кислоты, константах диссоциации и предельной эквивалентной электропроводности NaCl в жидкой фазе на линии насыщения. На основании данного анализа оценена погрешность определения предложенным методом концентраций СО 2 и примесей в паре в виде NaCl. Рассчитана погрешность аппроксимации для зависимостей, описывающих поведение констант диссоциации и предельной эквивалентной электропроводности угольной кислоты, которые могут быть использованы при расчете концентраций по предложенной методике, а также при организации и ведении водно-химических режимов.
Оперативный контроль, качество пара, кондуктометрические методы, угольная кислота, электролитические свойства
Короткий адрес: https://sciup.org/14250168
IDR: 14250168 | УДК: 621.182.12 | DOI: 10.12737/16069
Текст научной статьи Электролитические свойства растворов угольной кислоты и инновационные методы оперативного контроля качества вод типа конденсата на ТЭС
Введение. При организации и ведении водно-химического режима (ВХР) на ТЭС основными задачами являются замедление процессов коррозии конструкционных материалов и образования отложений в пароводяном тракте энергетических установок [1]. Снижение рН растворов и усиление коррозионных процессов определяются наличием в питательной воде и паре котельных установок угольной кислоты, следовательно, ее содержание необходимо свести к минимуму [1, 2].
Причинами нарушения норм ВХР могут быть:
-
— присосы охлаждающей воды в конденсаторах турбин;
-
— растворение в конденсате CO 2 , содержащегося в воздухе;
-
— попадание в конденсатно-питательный тракт потенциально кислых веществ, разлагающихся при высоких температурах Т с образованием СО2 [3 ,4].
В настоящее время на станциях оперативный контроль качества вод типа конденсата осуществляется путем анализа охлажденных до Т = 298,15К проб, отобранных из контрольных точек.
Авторы [3, 5] предложили новый метод оперативного контроля примесей в конденсатах, позволяющий упростить существующую методику контроля. Суть метода заключается в следующем. Определяется концентрация примесей С путем измерения рН, Т и удельной электропроводности χ охлажденных проб до и после катионообменного фильтра и решаются уравнения, соответствующие математическим моделям ионных равновесий в водных растворах. Значения концентраций примесей в виде ионов Cl –, Na + , HCO 3 – и свободной углекислоты получаются на основании анализа уравнений электронейтральности, электрической проводимости, баланса углекислоты до и после H-фильтра, диссоциации углекислоты по первой ступени.
Но анализ охлажденных проб предполагает наличие устройств отбора, транспортирования, снижения давления и охлаждения пробы. Такая методика связана со значительным транспортным запаздыванием пробы. Это негативно влияет на достоверность полученных результатов и возможность быстрого реагирования в случае внезапного резкого изменения контролируемых параметров в потоке пара.
Значительно уменьшить инерционность процесса измерения и исключить необходимость в пробоотборных линиях и устройствах подготовки пробы позволяет метод контроля, заключающийся в измерении χ конденсата контролируемого пара в кондуктометрической ячейке охлаждаемого датчика, размещенного в потоке пара [6–9]. При этом С примесей в паре определяют из зависимости С = f (χ) [6, 10]. Однако в работах [6, 10] отсутствует подробный анализ возможностей метода для условий, когда в паре энергоблоков с нейтральным ВХР без дозирования аммиака присутствуют примеси в виде диоксида углерода и NaCl. Не была детально разработана и методика определения С на основании данных о χ водных растворов СО 2 с учетом наблюдаемых на станциях реальных значений С и особенностей изменения χ с температурой.
Целью настоящей работы является совершенствование метода определения концентрации примесей в паре, основанного на измерении χ конденсата пара охлаждаемым датчиком [8], и оценка погрешности определения С примесей в конденсате пара, содержащем только СО 2 и NaCl в количестве, характерном для ТЭС при нейтральном ВХР без дозирования аммиака.
Для достижения поставленной цели:
-
— решены задачи, связанные с анализом изменения первых кажущихся констант диссоциации K d1 и предельной эквивалентной электропроводности Λо угольной кислоты и Λо NaCl в жидкой фазе на линии насыщения;
Машиностроение и машиноведение
-
— разработаны методики определения χ на основании данных о K d1 и Λ о для угольной кислоты и определения С на основании данных о χ;
-
— выполнена оценка погрешности аппроксимации для данных о K d1 и Λ о угольной кислоты.
Анализ экспериментальных данных. Для решения поставленных задач были использованы экспериментальные данные авторов [6, 11–16] о K d1 и Λ о для угольной кислоты и данные о Λ о для NaCl [11]. Анализ зависимости K d1 от Т на линии насыщения в жидкой фазе, представленной на рис. 1, показывает, что в диапазоне изменения Т от 298 до 323К Kd1 возрастает от 4,45∙10–7 до 5,19∙10–7 [11], а затем уменьшается до 3,6∙10–7 при 373К и до 1,81∙10–9 при 593К [6]. Причем с увеличением Т K d1 уменьшается все сильнее. Если при увеличении Т от 373 до 473К K d1 уменьшается в 2,46 раза [6], то при увеличении Т от 473 до 573 и до 593К — уже в 14,4 и в 36 раз соответственно. Следует отметить, что на рис. 1 представлены далеко не все экспериментальные данные о K d1 , известные из литературных источников. Это объясняется тем, что разные авторы рассматривают близко расположенные показатели, и графически изобразить такие данные сложно.
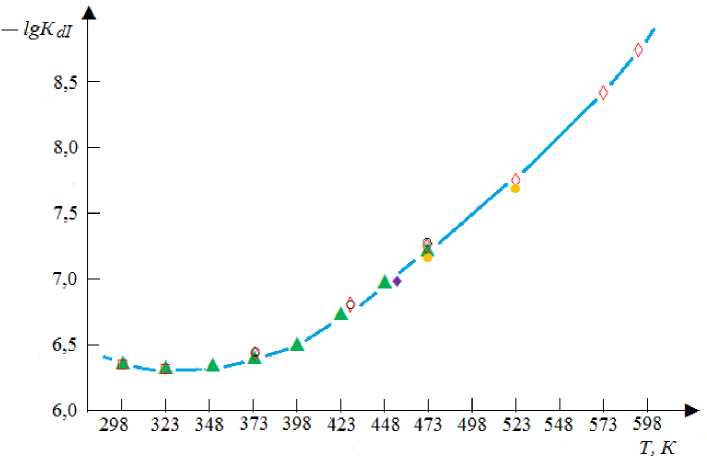
Рис. 1. Зависимость первых констант диссоциации угольной кислоты от температуры: ◊ — [6]; □ — [11]; ▲ — [14]; ○ — [15]; • — [16]; ♦ — [21]
В качестве примеров могут быть приведены работы Диксона и Миллеро [17] ( Т = 273–308К), Шедловского и Маккейна [18] (273–311К), Харнеда и Боннера [19] (273–323К), Накаямы [20] (273–323К), Пака, Кима и Ли [21] (298– 448К), Миллеро, Хуанга, Грэхэма и Пиеррота [22] (273–323К), Петтерсона, Слокума, Бассэя и Месмера [23], Ли и Ду-ана [24]. Данные авторов [23, 24] представлены в виде математической модели для зависимости К dI от Т .
Методика определения χ и С. Значения χ высокоразбавленных растворов NaCl и СО 2 определялись путем расчета с использованием данных о К dI и Λ о [6, 11–13]. На основании анализа данных о К d , Λ о и степеней диссоциации α для NaCl в рассматриваемой области изменения Р, Т, С при выполнении оценочных расчетов полагали, что
Λ NaCl = Λ о NaCl и χ NaCl = Λ о NaCl ∙ С ∙ρ/ρ ну ∙ 10–3, где С — концентрация раствора в кг-экв/м 3 ; ρ — плотность раствора при Т опыта; ρну — плотность раствора при нормальных условиях.
Для нахождения χ растворов Н 2 СО 3 значения α определяли из уравнения
К d1 = α2 ∙ С ∙ f 2/(1 – α), где f — средний коэффициент активности.
Величину f рассчитывали по уравнению Дебая [12]. Значения эквивалентной электропроводности Λ находили из соотношения
α = Λ /Λ i .
Здесь Λ i — эквивалентная электропроводность гипотетически полностью диссоциированного раствора при концентрации α 1 ∙ С , где α 1 = Λ/Λо. Величину Λ i определяли по уравнению Робинсона — Стокса [25], а χ для растворов Н 2 СО 3 — из соотношения между χ и Λ: χ = Λ ∙ С ∙ ρ/ρну ∙10– 3 .
При оценке вклада χ NaCl и вклада χ Н 2 СО 3 в суммарную удельную электропроводность раствора χсум. учитывался характер изменения χ NaCl и χ Н 2 СО 3 при изменении температуры. Результаты расчетов для температур 323,15 и 373,15К и С СО 2 , равных 50, 500 и 5000 мкг/кг при С Na = 5 мкг/кг, представлены в табл. 1.
Таблица 1
Вклад NaCl в суммарную удельную электропроводность конденсата пара, содержащего NaCl и СО 2 , и отношение χ NaCl / χ СО 2
|
Т , К |
С Na = 5 мкг/кг |
|||||
|
С СО 2 = 50 мкг/кг |
С СО 2 = 500 мкг/кг |
С СО 2 = 5000 мкг/кг |
||||
|
323,15 |
0,120* |
0,138** |
0,0336* |
0,0347** |
0,0101* |
0,0102** |
|
373,15 |
0,166* |
0,199** |
0,0495* |
0,0520** |
0,0152* |
0,0154** |
|
*δ 1 = χ NaCl / χ сум ; **δ 2 = χ NaCl / χ СО 2 |
||||||
Значение С Na = 5 мкг/кг выбрано исходя из допустимых максимальных предельных величин, соответствующих правилам технической эксплуатации котельных агрегатов [2]. Как видно из табл. 1, δ2 = χ NaCl / χ СО2 намного меньше единицы. Основной вклад в χсум. с учетом поправки на χ растворителя вносит растворенная СО2. С увеличени- ем С СО2 от 50 до 5000 мкг/кг δ2 уменьшается от 0,138 до 0,0102 при Т = 323,15К и от 0,199 до 0,0154 при Т = 373,15К. С увеличением Т от 323,15 до 373,15К δ2 возрастает в 1,44; 1,50 и 1,51раза при С СО2, равной 50, 500 и 5000 мкг/кг. Величина δ1 с ростом С СО2 от 50 до 500 и 5000 мкг/кг уменьшается в 3,57 и в 11,9 раз при Т = 323,15К и в 10,9 раз при Т = 373,15К. Величина δ1 с ростом С СО2 от 50 до 500 и 5000 мкг/кг уменьшается в 3,57 и в 11,9 раз при T = 323,15К и в 3,35; 10,9 раз при Т = 373,15К.
С ростом Т от 323,15 до 373,15К δ 1 увеличивается в 1,38; 1,47 и в 1,50 раза при С СО 2 , равной 50, 500 и 5000 мкг/кг. Так как δ 1 = χ NaCl / χсум., то из табл. 1 следует, что присутствие NaCl в конденсате пара при С СО 2 = 50 мкг/кг влияет на 12 % на χ сум. при Т = 323,15К и на 16,6% при Т = 373,15К. Однако при увеличении С СО 2 до 500 и 5000 мкг/кг это влияние снижается до 3,36; 4,95 и 1,01 и 1,52 % соответственно.
Современные прецизионные приборы обеспечивают измерение проводимости разбавленных водных растворов электролитов с погрешностью не более 0,05–0,15 % [26]. При С СО 2 , равной 50 и 500 мкг/кг, относительное увеличение χ сум за счет NaCl, равное δ 1 , составляет 0,12; 0,166 и 0,0336; 0,0495 (для Т = 323,15 и 373,15К). При этом относительная погрешность определения χ сум в таких измерениях будет не более 0,5% [6], что приемлемо для оценочных расчетов. При С СО 2 , равной 5000 мкг/кг, δ 1 уменьшается до 0,0101 и 0,0152. В этом случае погрешность определения χсум . , всего в два и в три раза меньше определяемой величины δ 2 , и поэтому достоверная оценка δ 1 затруднена.
С СО 2 и С NaCl по данным о χсум. определяется по разработанной нами методике. Она основана на определении χсум. при Т , равных 323,15 и 373,15К. При Т = 323,15К
χ сум. = χ сум.1 = χ 1 СО 2 + χ 1 NaCl, где χ 1 СО 2 и χ 1 NaCl — вклады в удельную электропроводность χ сум. , обусловленные присутствием в конденсате СО 2 и NaCl.
С изменением Т изменятся χ сум. , χ 1 СО 2 и χ 1 NaCl.
Пусть χ 1 СО 2 при Т = 373,15К изменится в a раз, а χ 1 NaCl — в b раз. Тогда для Т = 373,15К
χ сум = χ сум.2 = a ∙ χ 1 СО 2 + b ∙ χ 1 NaCl.
Значения коэффициентов a и b находятся путем расчета χ по изложенной выше методике для монорастворов СО 2 и NaCl при Т , равных 323,15 и 373,15К.
Решением системы двух представленных линейных уравнений для χсум.1 и χсум.2 находятся неизвестные χ 1 СО 2 и χ 1 NaCl при Т = 323,15К. Затем определяются значения С СО 2 и С NaCl при этой Т на основании ранее полученных для водных монорастворов СО 2 и NaCl градуировочных зависимостей вида χ 1 = f ( C ). Результаты вычислительного эксперимента, выполненного в соответствии с предложенной методикой в рассматриваемом диапазоне изменения С и Т, подтвердили корректность предложенной математической модели.
Оценка погрешности аппроксимации данных о К d1 и Λ о . Для выполнения расчетов с целью определения С СО 2 необходимы данные о К d1 и Λ о угольной кислоты. На основании выполненных нами ранее экспериментальных исследований путем измерения электропроводности водных растворов СО 2 при Т от 373,15 до 593,15К [6] были получены зависимости К d1 и Λо от Т. Нами предложены уравнения, описывающие эти зависимости [27]:
– lgК d1 = 2,49762 ∙ 10–5 ∙ Т 2 – 0,013909088 ∙ Т + 8,167523085; Λ о = 2,960 ∙ 10–5 ∙ Т 3 – 0,054 ∙Т 2 + 33,156 ∙ Т – 5557,36.
Данные о рК d1 = – lgК d1 , Λо и значения относительной погрешности аппроксимации δ представлены в табл. 2.
Таблица 2
Зависимости первых кажущихся констант диссоциации К dI и предельной эквивалентной электропроводности Λ о угольной кислотыот температуры на линии насыщения и относительные погрешности их аппроксимации (δ рК dI и δ Λ о )
|
Т, К |
рК d1 = –lg К d1 , кмоль/м 3 |
δ рК d1 , % |
Λо·10, См∙м2 ∙кг-экв–1 |
δ Λ о , % |
|
373,15 |
6,453 |
0,031 |
793 |
0,260 |
|
429,15 |
6,796 |
0,034 |
1000 |
0,934 |
|
473,15 |
7,186 |
0,110 |
1120 |
1,058 |
|
523,15 |
7,740 |
0,173 |
1160 |
0,306 |
|
573,15 |
8,346 |
0,647 |
1175 |
0,406 |
|
593,15 |
8,742 |
0,424 |
1184 |
0,317 |
Машиностроение и машиноведение
Наименьшие значения δ для К d1 — при Т не более 523,15К. В этом случае δ рК d1 не превышает 0,173 %. С увеличением Т от 523,15 до 573,15К δ возрастает до 0,647 %. Наименьшее значение δ для Λо равно 0,26 % при Т = 373,15К, наибольшее — 1,058 % при Т = 473,15К.
Такую погрешность аппроксимации данных о К d1 и Λ о можно считать приемлемой при выполнении расчетов с использованием указанных величин, учитывая значения погрешности полученных экспериментальных данных [6].
Следует отметить, что мы определяли С СО 2 и С NaCl на основании измерения χ сум. при Т = 323,15 и Т = 373,15К. Аналогичные измерения можно выполнять и при более высоких Т . При этом с уменьшением К d1 уменьшается χ растворов СО 2 и изменятся значения δ 1 и δ 2 , представленные в табл. 1. Такая работа может быть выполнена в рамках отдельного исследования.
Заключение . Разработан метод оперативного кондуктометрического контроля концентраций СО 2 и NaCl в конденсате пара на ТЭС при нейтральном ВХР без дозирования аммиака. Предложено устройство для его реализации, обеспечивающее дифференцирование примесей и значительное снижение инерционности контроля. Выполнена оценка погрешности определения концентраций предложенным методом. Рассчитана погрешность аппроксимации для зависимостей, описывающих поведение первых кажущихся констант диссоциации и предельной эквивалентной электропроводности угольной кислоты при Т от 373,15 до 593,15К, которые можно использовать при расчете концентраций предложенным методом, а также при организации и ведении ВХР.
Информация о концентрации примесей для одних и тех же объектов, полученная одновременно от устройств контроля, реализующих предложенный метод, и от устройств, работающих с охлажденной пробой [4, 5], может быть использована для создания нового контроля, сочетающего в себе преимущества обоих методов и расширяющего возможности совершенствования существующих систем химико-технологического мониторинга ВХР на ТЭС и АЭС [28].
Список литературы Электролитические свойства растворов угольной кислоты и инновационные методы оперативного контроля качества вод типа конденсата на ТЭС
- Воронов, В. Н. Водно-химические режимы ТЭС и АЭС/В. Н. Воронов, Т. И. Петрова. -Москва: Издательский дом МЭИ, 2009. -238 с.
- Правила технической эксплуатации электрических станций и сетей РФ СО 153-34.20.501-2003/Министерство энергетики Российской Федерации. -Москва: Энергосервис, 2003. -145 с.
- Ларин, Б. М. Основы математического моделирования химико-технологических процессов обработки теплоносителя на ТЭС и АЭС/Б. М. Ларин, Е. Н. Бушуев. -Москва: Издательский дом МЭИ, 2009. -306 с.
- Мартынова, О. И. Поведение органики и растворенной углекислоты в пароводяном тракте электростанций/О. И. Мартынова//Теплоэнергетика. -2002. -№ 7. -С. 67-70.
- Бушуев, Е. Н. Исследование и математическое моделирование химико-технологических процессов водообработки на ТЭС: дис. … д-ра техн. наук/Е. Н. Бушуев. -Иваново, 2010. -359 с.
- Щербаков, В. Н. Исследование электрофизических свойств водных теплоносителей при высоких параметрах: дис. … канд. техн. наук/В. Н. Щербаков. -Москва, 1980. -204 с.
- Кондуктометрический датчик: а. с. 958943 СССР: МКИ4 G01N 27/02/Д. Л. Тимрот . -№ 3248961; заявл. 16.02.81; опубл. 15.09.82, Бюл. № 34. -3 с.
- Щербаков, В. Н. Совершенствование кондуктометрического контроля качества конденсата пара при термической очистке вод/В. Н. Щербаков//Вестник Дон. гос. техн. ун-та. -2013. -Т. 13, № 3/4 (72/73). -С. 117-124.
- Экспериментальное и теоретическое обоснование нового метода контроля качества рабочего тела в контурах ТЭС и АЭС/Н. Н. Ефимов //Изв. вузов. Северо-Кавк. регион. Техн. науки. -2012. -№ 3 (166). -С. 28-32.
- Лукашов, Ю. М. Экспериментально-теоретическое обоснование новых методов контроля качества пара и воды современных теплоэнергетических установок: дис. … д-ра техн. наук/Ю. М. Лукашов. -Москва, 1981. -412 с.
- Новый справочник химика и технолога: в 12 т. Т. 7. Химическое равновесие. Свойства растворов/под ред. А. М. Симановой. -Санкт-Петербург: Профессионал, 2004. -998 с.
- Дамаскин, Б. Б. Электрохимия/Б. Б. Дамаскин, О. А. Петрий, Г. А. Цирлина. -Москва: Химия; Колос С, 2006. -672 с.
- Добош, Д. Электрохимические константы. Справочник для электрохимиков/Д. Добош. -Москва: Мир, 1980. -365 с.
- Stefansson, A. Carbonic acid ionization and the stability of sodium bicarbonate and carbonate ion pairs to 200oC -A potentiometric and spectrophotometric study/A. Stefansson, P. Benezeth, J. Schott//Geochimica et Cosmochimica Acta. -2013. -Vol. 120. -P. 600-611.
- Рыженко, Б. Н. Определение констант диссоциации угольной кислоты и расчет степеней гидролиза СО32-и НСО3-ионов в растворах карбонатов и бикарбонатов при повышенных температурах/Б. Н. Рыженко//Геохимия. -1963. -№ 2. -С. 137-148.
- Read, A.-J. The First Ionization Constant of Carbonic Acid from 25 to 250o C and to 2000 bar/A.-J. Read//Journal of Solution Chemistry. -1975. -Vol. 4, № 1. -P. 53-70.
- Dickson, A.-G. A comparison of the equilibrium constants for the dissociation of carbonic acid in seawater media/A. G. Dickson, F. J. Millero//Deep-Sea Research. -1987. -Vol. 34. -P. 1733-1743.
- Shedlovsky, T. The first ionization constant of carbonic acid, 0 to 38 from conductance measurements/T. Shedlovsky, D.-A. MacInnes//Journal of the American Chemical Society. -1935. -Vol. 57. -P. 1705-1710.
- Harned, H.-S. The first ionization of carbonic acid in aqueous solution of sodium chloride/H.-S. Harned, F.-T. Bonner//Journal of the American Chemical Society. -1945. -Vol. 67. -P. 1026-1031.
- Nakayama, F.-S. Thermodynamic functions for the dissociation of NaHCO3, NaCO3-, H2CO3, and HCO3-/F.-S. Nakayama//Journal of Inorganic and Nuclear Chemistry. -1971. -Vol. 33. -P. 1287-1291.
- Spectrophotometric measurement of the first dissociation constants of carbonic acid at elevated temperatures/S.-N. Park //Journal of the Chemical Society Faraday Transactions. -1998. -Vol. 94. -P. 1421-1425.
- The dissociation of carbonic acid in NaCl solutions as a function of concentration and temperature/F.-J. Millero //Geochimica et Cosmochimica Acta. -2007. -Vol. 71. -P. 46-55.
- Carbonate equilibrium in hydrothermal systems -first ionization of carbonic acid in NaCl media to 300o C/C.S. Patterson //Geochimica et Cosmochimica Acta. -1982. -Vol. 46. -P. 1653-1663.
- Li, D. The speciation equilibrium coupling with phase equilibriumin the H2O-CO2-NaCl system from 0 to 250o C, from 0 to 1000 bar, and from 0 to 5 molality of NaCl/D. Li, Z. Duan//Chemical Geology. -2007. -Vol. 244. -P. 730-751.
- Робинсон, Р. Растворы электролитов/Р. Робинсон, Р. Стокс. -Москва: Иностранная литература, 1963. -425 с.
- Первухин, Б. С. Развитие научно-методических основ проектирования кондуктометрических приборов контроля жидкостей и разработка технических средств их метрологического обеспечения: автореф. дис. … д-ра техн. наук/Б. С. Первухин. -Барнаул, 2012. -39 с.
- Щербаков, В. Н. Инновационные электрофизические методы оперативного контроля качества вод типа конденсата на ТЭС/В. Н. Щербаков, Г. А. Власков//Обозрение прикладной и промышленной математики. -2014. -Т. 21, вып. 5. -С. 764-765.
- Егошина, О. В. Современное состояние систем химико-технологиче-ского мониторинга на тепловых станциях на основе опыта МЭИ и НПЦ «Элемент»/О. В. Егошина, В. Н. Воронов, М. П. Назаренко//Теплоэнергетика. -2014. -№ 3. -С. 39-45.


