Электронно-микроскопические особенности парафолликулярных клеток щитовидной железы крыс после 60-дневного введения тартразина и препарата мексидол®
Автор: Лузин В.И., Морозов В.Н.
Журнал: Саратовский научно-медицинский журнал @ssmj
Рубрика: Патологическая анатомия
Статья в выпуске: 2 т.19, 2023 года.
Бесплатный доступ
Цель: установить влияние чистого тартразина, вводимого в течение 60 суток, а также в комбинации с препаратом Мексидол® на структурные особенности парафолликулярных клеток щитовидной железы крыс на электронно-микроскопическом уровне. Материал и методы. Тридцать белых крыс-самцов массой 200-210 г разделены на пять групп по 6 крыс в каждой. I группа - контрольная; II и III группы - крысы в течение 60 суток получали тартразин в концентрации 750 и 1500 мг/кг; IV и V группы - в аналогичных условиях вводили Мексидол® из расчета 50мг/кг Качественные изменения парафолликулярных клеток изучали при помощи электронной микроскопии, а количественные - морфометрии. Результаты. После воздействия тартразина в цистернах гранулярной эндоплазматической сети выявлялось мелкозернистое или волокнистое содержимое, а в некоторых митохондриях - участки разрушенного матрикса. Отношение площадей эу- и гетерохроматина уменьшалось во II и III группах на 5,7 и 56,9% соответственно, а диаметр секреторных гранул - на 12,3 и 19% соответственно по сравнению с контролем. Отношение эу- и гетерохроматина в V группе увеличивалось на 79,6%, а диаметр секреторных гранул - на 8,2 и 6,5% в IV и V группах соответственно, по сравнению сданными II и III групп. Заключение. Введение тартразина в разных дозах в течение 60 дней вызывает дозозависимые качественные и количественные изменения ультраструктуры парафолликулярных клеток, а введение препарата Мексидол® на этом фоне вызывает уменьшение их выраженности.
Мексидол, морфометрия, парафолликулярные клетки, тартразин, ультраструктура, щитовидная железа
Короткий адрес: https://sciup.org/149143911
IDR: 149143911 | УДК: 591.147.1612.086.3]:613.29 | DOI: 10.15275/ssmj1902194
Текст научной статьи Электронно-микроскопические особенности парафолликулярных клеток щитовидной железы крыс после 60-дневного введения тартразина и препарата мексидол®
EDN: LZYKUY
-
1Введение. Тартразин является представителем азокрасителей, имеющим ярко-желтый или оранжевый цвет и хорошую растворимость в воде. Данная пищевая добавка обычно применяется в процессе изготовления продуктов питания, косметики, различных форм лекарственных средств [1]. Обладая насыщенным желтым или оранжевым цветом, тартразин улучшает привлекательность внешнего вида продукта, что пропорционально сопровождается увеличением к нему интереса со стороны покупателей и повышает прибыль для производителей.
Несмотря на то, что содержание тартразина в продуктах регламентируется нормативно-правовыми актами, остаются вопросы о безопасности его использования для здоровья человека. Имеются сведения о генотоксическом и тератогенном действиях тартразина [2, 3], его способности вызывать аллергические реакции (астма, сыпь) [4], изменения поведения у детей (гиперактивность в сочетании с дефицитом внимания), а также морфологии и биохимических маркеров почек и печени, головного мозга [5, 6].
Установлено то, что тартразин также оказывает влияние на метаболизм кальция в организме, увеличивая его внутритканевое содержание и уменьшая его концентрацию в крови [7]. Однако данных о морфологических изменениях парафолликулярных клеток щитовидной железы, которые вовлечены в регуляцию кальциево-фосфорного обмена, в литературе не содержится. Отсутствуют также сведения о возможных фармакологических путях коррекции изменений структурной организации данных клеток в условиях длительного введения тартразина. Учитывая, что одним из механизмов неблагоприятного воздействия тартразина является его способность выступать в роли прооксиданта, в качестве фармакокорректора выбран препарат Мексидол ® , обладающий, помимо прочих, антиоксидантными свойствами [8].
Цель — установить влияние чистого тартразина, вводимого в течение 60 суток, а также в комбинации с препаратом Мексидол® на структурные особенности парафолликулярных клеток щитовидной железы крыс на электронно-микроскопическом уровне.
Материал и методы. Для исследования использовано 30 белых половозрелых крыс-самцов массой 200–210 г. Животных распределили на пять групп по 6 крыс в каждой — четыре экспериментальных и одну контрольную. I группа (К) — контрольная, сформирована из животных, которым внутрижелу-дочно вводили физиологический раствор. Во II группе (Т1) лабораторные животные подвергались 60-суточному воздействию тартразина (в концентрации 750мг/кг) путем его зондового введения; в III группе
(Т2) — аналогичному воздействию, но в удвоенной концентрации (1500 мг/кг). IV и V группы были сформированы для установления эффективности использования препарата Мексидол® для коррекции неблагоприятного воздействия пищевой добавки. С этой целью крысам IV группы (Т1+М) внутримышечно вводили 1 мл 5%-го раствора Мексидол ® в дозе 50 мг/кг в течение 60-суточного воздействия тартразина в дозе 750 мг/кг, а в V группе Мексидол ® (Т2+М) назначался на фоне аналогичного срока действия тартразина в дозировке 1500 мг/кг массы тела (компания-производитель тартразина — Roha Dyechem Pvt Ltd, India; Мексидол ® — общество с ограниченной ответственностью — медицинский центр «Эллара» по заказу научно-производственной компании «Фармасофт», Москва, Россия). Все действия персонала с лабораторными животными в ходе эксперимента, уход за ними в условиях вивария были в соответствии с правилами, установленными Европейской конвенцией по защите животных, используемых в фундаментальных исследованиях [9]. Протокол исследования утвержден на заседании комиссии по биоэтике ГУ ЛНР «Луганский государственный медицинский университет им. Святителя Луки», протокол №2 от 25.03.2022. После завершения срока эксперимента животных выводили из исследования методом декапитации. Обработка кусочков щитовидной железы происходила в соответствии с стандартным протоколом электронномикроскопического исследования [10], после чего срезы железы фотографировались и подвергались анализу. В компьютерной программе Nis-Elements BR 4.60.00 (Nikon Corporation, Japan) осуществляли измерения площади ядер парафолликулярных клеток, площадей эу- и гетерохроматина и высчитывали их соотношение. В цитоплазме клеток проводили замеры диаметров секреторных гранул и средней площади митохондрий. Обработку данных осуществляли с помощью компьютерных программ Statistica 10.0 (StatSoft Inc., USA) и Microsoft Office Excel 2017 (Microsoft, USA) (рассчитывали среднее, стандартную ошибку среднего, медиану). Для оценки типа распределения признаков использовали критерий Шапиро — Уилка. В случаях нормального распределения, а также равенства дисперсий, для сравнения средних использовали Т -критерий Стьюдента. Равенство дисперсий оценивали по F -критерию Фишера. В случае распределений, не соответствующих нормальному закону, а также при неравенстве дисперсий использовали непараметрический U -критерий Манна — Уитни. Статистически значимыми считали различия при p <0,05.
Результаты. Парафолликулярные клетки щитовидной железы половозрелых крыс контрольной группы имеют типичное строение. После воздействия тартразина первой концентрации (750 мг/кг/массы тела) парафолликулярные клетки щитовидной железы были крупных размеров, вытянутой формы.
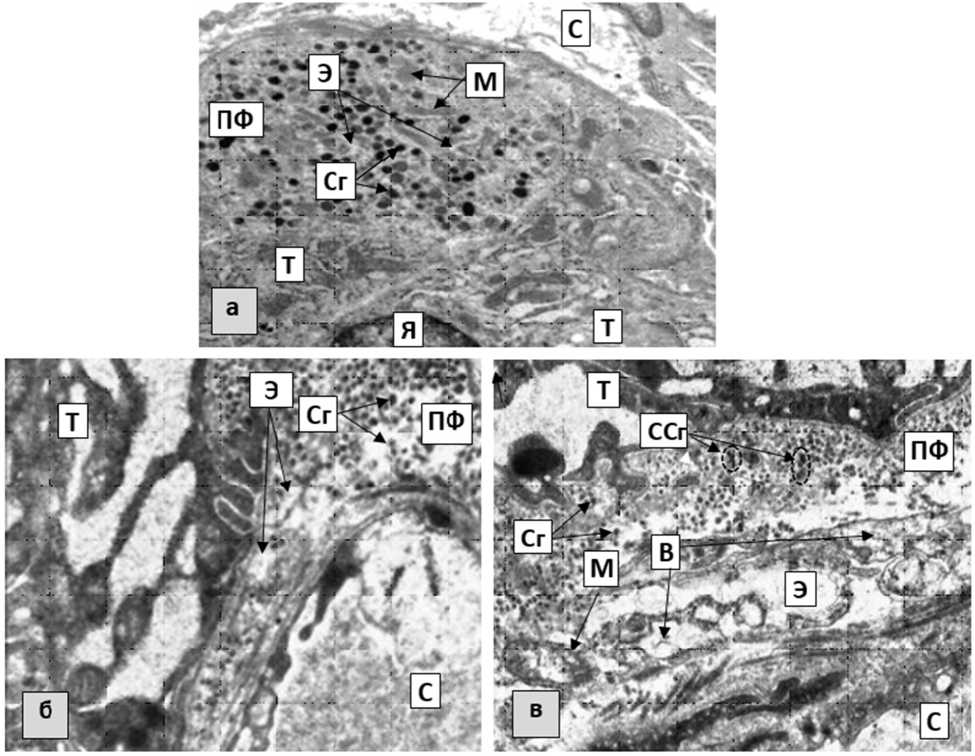
Рис. 1. Участки щитовидной железы половозрелых крыс:
а — контрольная группа, б — экспериментальная группа, принимающая тартразин в концентрации 750мг/кг/массы тела, в — экспериментальная группа, принимающая тартразин в концентрации 1500мг/кг/массы тела: Т — тироцит, ПФ — парафолликулярная клетка, Я — ядро, Э — шероховатая эндоплазматическая сеть, М — митохондрии, Сг — секреторные гранулы, ССг — электронно-плотные скопления секреторных гранул, В — единичные волокнистые структуры, С — сосуд. Увеличение х 12000
Ядро содержало скопления гетерохроматина преимущественно под кариолеммой. Участки гранулярной эндоплазматической сети были неравномерно расширены с мелкозернистым содержимым умеренной электронной плотности. Митохондрии имели овальную форму, с умеренным электронно-плотным содержимым. Секреторные гранулы были многочисленны, преимущественно мелкие, разной электронной плотности, неравномерно распределялись в цитоплазме клетки (рис. 1).
При использовании тартразина удвоенной концентрации (1500 мг/кг/массы тела) парафолликулярные клетки имели крупные размеры и вытянутую форму. Ядро содержало скопления гетерохроматина, который располагался на периферии ядра, а также в виде глыбок в центральных участках кариоплазмы. В цитоплазме цистерны гранулярной эндоплазматической сети были неравномерно расширены. В некоторых участках в просветах канальцев встречались единичные волокнистые структуры разной ориентации и расположенные рыхло друг к другу. Митохондрии имели овальную форму и умеренную электронную плотность. Некоторые из них содержали электронно-светлые участки неправильной формы с разрушенным содержимым. Секреторные гранулы были многочисленными, преимущественно мелкими, разной электронной плотности, неравномерно распределенными в цитоплазме клетки. Некоторые из них располагались очень близко друг к другу, поэтому выглядели в виде электронно-плотных скоплений.
При измерениях структурных компонентов парафолликулярных клеток во II группе было выявлено то, что площадь ядра была меньше аналогичного показателя контрольной группы на 20,5%, площадь, занимаемая эухроматином, — на 22,3%, гетехрома-тином — на 17,5%, а соотношение площадей эух-роматина и гетехроматина — на 5,7%. В III группе площадь ядра уменьшалась на 28,7%, площадь, занимаемая эухроматином, — на 52,1%, соотношение площадей эухроматина и гетехроматина — на 56,9%, а площадь гетехроматина — напротив, возрастала на 11,1%. Диаметр секреторных гранул в цитоплазме парафолликулярных клеток во II и III группах был меньше, чем у крыс контрольной группы, на 12,3 и 19% соответственно, а средняя площадь митохондрий в цитоплазме — на 15,8 и 24,8% соответственно (таблица).
Морфометрические показатели парафолликулярных клеток щитовидной железы крыс контрольной и экспериментальных групп, M±m
|
Показатели |
Группа |
||||
|
I |
II |
III |
IV |
V |
|
|
Площадь ядра, мкм2 |
14,28±0,16 |
11,36±0,21* |
10,19±0,11* |
12,25±0,14 ‣ |
11,11±0,20 ‣ |
|
Площадь, занимаемая эухрома-тином, мкм2 |
9,00±0,10 |
7,00±0,10* |
4,32±0,07* |
7,59±0,09 ‣ |
6,32±0,09 ‣ |
|
Площадь, занимаемая гетерохроматином, мкм2 |
5,28±0,08 |
4,36±0,08* |
5,87±0,07* |
4,66±0,07 ‣ |
4,79±0,09 ‣ |
|
Соотношение площадей эу- и гетерохроматина |
1,70±0,0098 |
1,61±0,0078* |
0,74±0,0032* |
1,63±0,0061 |
1,32±0,0053 ‣ |
|
Диаметр секреторных гранул, нм |
161,58±1,92 |
141,71±1,70* |
130,85±1,90* |
153,38±1,94 ‣ |
139,33±1,58 ‣ |
|
Средняя площадь митохондрий, мкм2 |
10,03±0,14 |
8,45±0,18* |
7,54±0,18* |
9,14±0,08 ‣ |
8,21±0,10 ‣ |
П р и м еч а н и е : * — достоверное отличие показателей II и III групп от контрольных значений; ‣ — достоверное отличие параметров IV и V групп от показателей II и III групп соответственно.
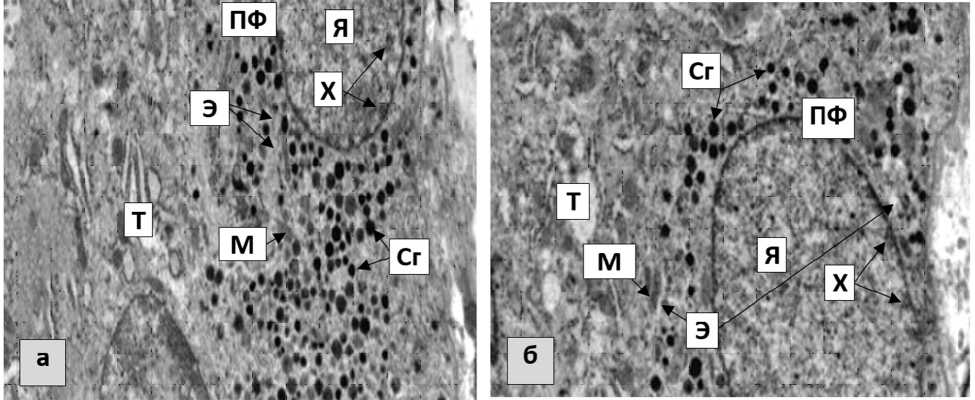
Рис. 2. Участки щитовидной железы половозрелых крыс:
а — экспериментальная группа животных, получавшая Мексидол ® после воздействия тартразина в концентрации 750 мг/кг/массы тела, б — экспериментальная группа животных, получавшая Мексидол ® после воздействия тартразина в концентрации 1500мг/кг/массы тела: Т — тироцит, ПФ — парафолликулярная клетка, Я — ядро, Х — гетерохроматин, Э — шероховатая эндоплазматическая сеть, М — митохондрии, Сг — секреторные гранулы. Увеличение х 12000
После воздействия Мексидол ® у животных, получавших тартразин в концентрации 750мг/кг/массы тела, наблюдалось приближение морфологических особенностей строения парафолликулярных клеток щитовидной железы к таковым у контрольной группы. Клетки были крупных размеров, овальной формы. Вытянутое или круглое ядро имело небольшие глыбки хроматина в кариоплазме. В цитоплазме гранулярная эндоплазматическая сеть образовывала уплощенные цистерны с содержимым средней электронной плотности, определялось умеренное количество преимущественно овальных митохондрий. Многочисленные секреторные гранулы разных размеров, электронной плотности занимали околоя-дерную и базальную части клетки.
После воздействия Мексидол® у животных, получавших тартразин в концентрации 1500мг/кг/массы тела, также наблюдалось частичное нивелирование морфологических изменений парафолликулярных клеток щитовидной железы. Сохранялись участки гранулярной эндоплазматической сети с расширенными цистернами, выявлялись одиночные или расположенные группами, разного размера секреторные гранулы в цитоплазме (рис. 2).
В IV и V группах использование Мексидол ® в качестве корректора позволило уменьшить выраженность изменений морфометрических параметров парафолликулярных клеток щитовидной железы крыс. В IV группе площадь ядра была больше аналогичного параметра группы без введения Мексидол® на 7,8%, площадь, занимаемая эухроматином, — на 8,5%, а площадь, занимаемая гетехроматином, и соотношение площадей эу- и гетерохроматина — статистически значимо не изменялись. В V группе площадь ядра увеличилась на 9%, площадь, занимаемая эухроматином, — на 46,5%, площадь, занимаемая гетехроматином, уменьшилась на 18,7%, а соотношение площадей эу- и гетерохроматина было больше на 79,6%. Диаметр секреторных гранул и средняя площадь митохондрий в цитоплазме парафолликулярных клеток возрастали, по сравнению с данными групп без введения препарата Мексидол ® ,
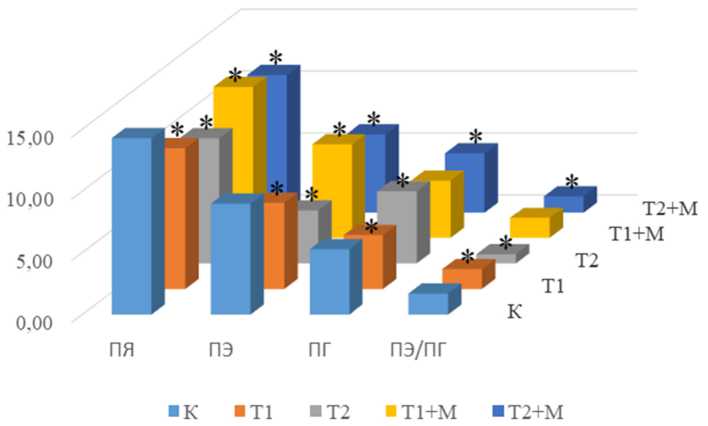
Рис. 3. Параметры ядра парафолликулярных клеток:
ПЯ — площадь ядра, ПЭ — площадь, занимаемая эухроматином, ПГ — площадь, занимаемая гетерохроматином, ПЭ/ПГ — соотношение площадей эу- и гетерохроматина
180.00
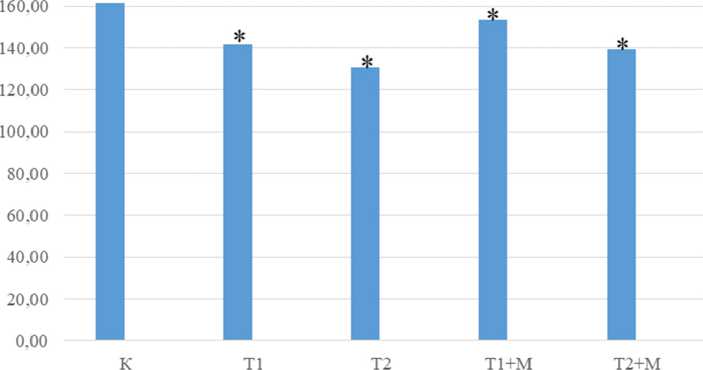
Рис. 4. Изменения диаметра секреторных гранул в цитоплазме парафолликулярных клеток, нм
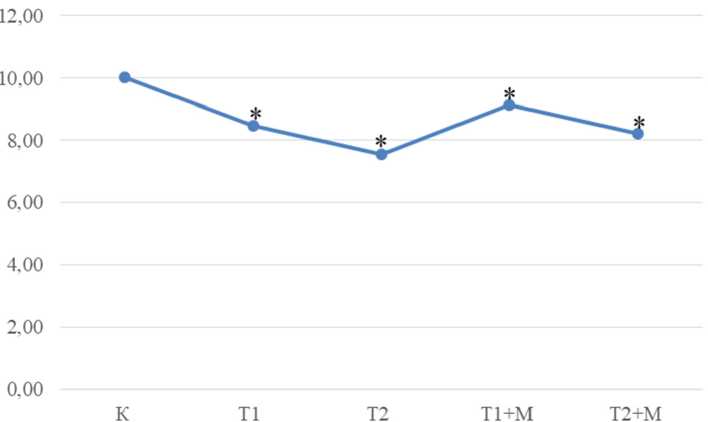
Рис. 5. Изменения средней площади митохондрий в цитоплазме парафолликулярных клеток, мкм2
на 8,2; 6,5% и на 8,1; 8,8% в IV и V группах соответственно (рис. 3, 4, 5).
Обсуждение. Парафолликулярные клетки (каль-цитониноциты) щитовидной железы контрольной группы половозрелых крыс имеют сходные морфологические особенности строения с данными, полученными J. Dadan с соавт. [11].
Использование тартразина вызывало дозозависимые изменения парафолликулярных клеток щитовидной железы половозрелых крыс (значительное скопления гетерохроматина под кариолеммой, неравномерно расширенные цистерны гранулярной эндоплазматической сети, в некоторых случаях с волокнистыми структурами разной ориентации, мелкие гранулы разной электронной плотности, в ряде случаев расположенные в виде скоплений и наличие единичных митохондрий с поврежденными кристами). По результатам исследования G. E. El-Desoky с соавт., тартразин снижает уровень глутатионпероксидазы, супероксиддисмутазы, увеличивает количество маркеров оксидативного стресса, одним из основных последствий которого, по данным С. P Gonzalez-Hunt, M. Wadhwa, L. H. Sanders, является повреждение генетического материала [12, 13]. Так, согласно исследованиям 2019 г. S. Shakoor с со-авт., тартразин оказывает генотоксический эффект в клетках нервной, соединительной и эпителиальной тканей, что может нарушать синтез белка и выведение его из канальцев и вызывает так называемый стресс эндоплазматической сети [14], таким образом оказывая действие непосредственно на парафолликулярные клетки. Необходимо также отметить: по данным S. Shakoor с соавт. 2022 г., использование пищевого красителя достоверно уменьшает уровень трийодтиронина (Т3) и тироксина (Т4) у экспериментальных крыс, что косвенно свидетельствует о гипофункции тироцитов [15]. При этом в работах J. Dadan с соавт., а также А. М. Махмурова, М. А. Юлдашевой, А. Ю. Юлдашева обращено внимание на однонаправленные ультрамикроскопические изменения ти-роцитов и парафолликулярных клеток щитовидной железы экспериментальных животных, что указывает на паракринное воздействие одних клеток на другие [11, 16]. Согласно материалам L. Alioui с соавт. [17] употребление тартразина уменьшает уровень свободного кальция, а также, исходя из результатов исследования M. Cemek с соавт., повышает уровень тканевого кальция в печени экспериментальных животных, что может снижать эндогенный синтез кальцитонина [6]. Анализ изложенных данных литературы позволяет объяснить то, что выявленные ультрами-кроскопические особенности парафолликулярных клеток щитовидной железы крыс после воздействия тартразина связаны со снижением функциональной активности данных клеток путем прямого механизма действия препарата на клетки, опосредованно — через воздействие на уровень кальция в крови и тканях, а также паракринно — через влияние тироцитов на парафолликулярные клетки.
После воздействия препарата Мексидол® наблюдается позитивная дозозависимая динамика (чем меньше концентрация тартразина, воздействующего на организм, тем более выражена позитивная динамика изменений в строении парафолликулярных клеток) изменений морфологической картины в сторону приближения структурных особенностей парафолликулярных клеток к контрольным значениям. По данным А. В. Щулькина, Мексидол® способен снижать уровень маркеров оксидативного стресса (в частности малонового диальдегида, нейтрализовать продукты перекисного окисления липидов), повышать активность глутатионпероксидазы, а также препарат способен проникать в митохондриальный матрикс и связывать активные формы кислорода, таким образом оказывая антиоксидантный и анти-гипоксический эффекты [8]. Данные материалы позволяют предположить то, что антиоксидантный эффект указанного препарата позволяет снизить генотоксический эффект и нивелировать оксидатив-ный стресс, вызванный использованием тартразина в разных концентрациях на клетки щитовидной железы крыс, что соответственно частично или полностью позволяет восстановить биосинтез белка и синтез секреторных гранул с гормоном.
Выводы.
Список литературы Электронно-микроскопические особенности парафолликулярных клеток щитовидной железы крыс после 60-дневного введения тартразина и препарата мексидол®
- Kobun R, Shafiquzzaman S, Sharifudin MS. Review of extraction and analytical methods for the determination of tart-razine (E 102) in foodstuffs. Crit Rev Anal Chem. 2017; 47 (4): 309-24. DOI: 10.1080/10408347.2017.1287558.
- Khayyat L, Essawy A, Sorour J, et al. Tartrazine induces structural and functional aberrations and genotoxic effects in vivo. Peer J. 2017; (5):e3041. DOI: 10.7717/peerj.3041.
- Ovalioglu АО, Ovalioglu TC, Canaz G, et al. Effects of tartrazine on neural tube development in the early stage of chicken embryos. Turk Neurosurg. 2020; 30 (4): 583-7. DOI: 10.5137/1019-5149. JTN.28793-19.6.
- Matsyura O, Besh L, Besh O, et al. Hypersensitivity reactions to food additives in pediatric practice: two clinical cases. Georgian Med News. 2020; (307): 91-5.
- Bhatt D, Vyas K, Singh S, et al. Tartrazine induced neu-robiochemical alterations in rat brain sub-regions. Food Chem Toxicol. 2018; (113): 322-7. DOI: 10.1016/j.fct.2018.02.011.
- Cemek M, Buyukokuroglu ME, Sertkaya F, et al. Effects of food color additiveson antioxidant functions and bioel-ement contents of liver, kidney and brain tissues in rats. Journal of Food and Nutrition Research. 2014; 2 (10): 686-91. DOI: 10.12691/jfnr-2-10-6.
- Albasher G, Maashi N, Alfarraj S, et al. Perinatal exposure to tartrazine triggers oxidative stress and neurobehavioral alterations in mice offspring. Antioxidants (Basel). 2020; 9 (1): 53. DOI: 10.3390/antiox9010053.
- Schulkin AV. Mexidol: modern aspects of the pharmaco-kinetics and pharmacodynamics. Farmateka. 2016; s4: 65-71.
- European convention for the protection of vertebrate animals used for experimental and other scientific purpose: Council of Europe 18.03.1986. Strasbourg, 1986; 52 p.
- Reynolds ES. The use of lead citrate at high pH as an electron opaque stain in electron microscopy. J Cell Biol. 1963; 17(1): 208-12. DOI: 10.1083/jcb.17.1.208.
- Dadan J, Zbucki R, Andrzejewska A, et al. Activity of thyroid parafollicular (C) cells in rats with hyperthyroidism — preliminary ultrastructural investigations. Roczniki Akademii Medycznej w Biatymstoku. 2004; 49 (1): 132-4.
- El-Desoky GE, Wabaidur SM, AlOthman ZA, et al. Regulatory role of nano-curcumin against tartrazine-induced oxidative stress, apoptosis-related genes expression, and genotoxicity in rats. Molecules. 2020; 25 (24): 5801. DOI: 10.3390/mole-cules25245801.
- Gonzalez-Hunt CP, Wadhwa M, Sanders LH. DNA damage by oxidative stress: Measurement strategies for two genomes. Current Opinion in Toxicology. 2018; (47): 87-94. DOI: 10.1016/j.cotox.2017.11.001.
- Shakoor S, AN F, Ismail A, et al. Toxicity of tartrazine, curcumin and other food colorants; possible mechanism of adverse effects. Online Journal of Veterinary Research. 2019; 23 (6): 466-86.
- Shakoor S, Ismail A, Rahman Z, et al. Impact of tartrazine and curcumin on mineral status, and thyroid and reproductive hormones disruption in vivo. International Food Research Journal. 2022; 29 (1): 186-99. DOI: 10.47836/ifrj. 29.1.20.
- Махмуров A.M., Юлдашева M.A., Юлдашев А.Ю. Ультраструктура клеток фолликулов щитовидной железы при гипо- и гиперкальциемии. Вестник экстренной медицины. 2019; 12 (2): 55-60.
- Alioui L, Mehedi N, Youcef В, et al. Tartrazine induced oxidative damage in mice liver and kidney. South Asian Journal of Experimental Biology. 2017; 7 (6): 271-8. DOI: 10.38150/sajeb. 7(6).


