Электронно-пучковые плазменные системы - новые возможности для технологий переработки лигноцеллюлозной биомассы
Автор: Кхин Маунг Хтау, Васильева Т.М., Кувшинова Л.А., Удоратина Е.В.
Журнал: Труды Московского физико-технического института @trudy-mipt
Рубрика: Физика
Статья в выпуске: 2 (46) т.12, 2020 года.
Бесплатный доступ
Описаны применения неравновесной низкотемпературной кислородной электронно-пучковой плазмы для управляемой деструкции лигноцеллюлозы хвойных деревьев. Пучково-плазменное воздействие привело к аморфизации кристаллической части биополимера и образованию дополнительных кислородсодержащих функциональных карбонильных и карбоксильных групп на поверхности лигноцеллюлозных волокон.
Электронно-пучковая плазма, лигноцеллюлоза, плазмохимическая деструкция биополимеров, плазмохимическое модифицирование поверхности
Короткий адрес: https://sciup.org/142229670
IDR: 142229670 | УДК: 544.558,
Текст научной статьи Электронно-пучковые плазменные системы - новые возможности для технологий переработки лигноцеллюлозной биомассы
Лигноцеллюлоза. (ЛЦ) является основным компонентом биомассы и наиболее распространенным возобновляемым органическим ресурсом в природе. Она состоит из целлюлозы, гемицеллюлозы и лигнина, которые прочно связаны друг с другом в единый комплекс посредством ковалентных химических связей и нековалентных взаимодействий [1]. Химические свойства, компонентов лигноцеллюлозных материалов определяют их огромную (био)технологическую ценность [1] и потенциал для производства, большого числа, необходимых химикатов, волокон и топлива. [2]. Кроме того, основной компонент лигноцеллюлозной биомассы - целлюлоза, благодаря своим экологическим свойствам, таким как возобновляемость ресурсов, биосовместимость и способность к биодеградации [2], рассматривается как наиболее перспективная альтернатива, синтетическим органическим полимерам, получаемым из нефтяного сырья.
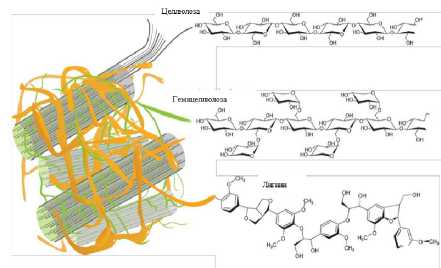
Рис. 1. Структура, лигноцеллюлозы клеточной стенки растений (схема)
Сообщалось о различных вариантах предварительной обработки лигноцеллюлозной массы для ее дальнейшего фракционирования, солюбилизации, гидролиза, и разделения на. отдельные компоненты - целлюлозу, гемицеллюлозу и лигнин. Описаны такие способы обработки, как измельчение, облучение, микроволновое излучение, паровой взрыв, взрыв аммиачного волокна, обработка в сверхкритическом СО2 со взрывом, применение SO2, щелочной гидролиз, жидкостная предварительная обработка горячей водой, органо-сольвентные процессы, мокрое окисление, гидролиз в разбавленных и концентрированных кислотах, озонолиз и биологическая ферментативная обработка. [3]. Общей целью этих методов является уменьшение размеров макромолекул биомассы и открытие их физической структуры. Тем не менее необходимы дальнейшие исследования для того, чтобы сделать процессы деконструкции дешевыми, экологически чистыми и способными превращать ряд типов лигноцеллюлозной биомассы в гидролизаты, которые содержат как можно больше целлюлозных или гемицеллюлозных сахаров для преобразования в топливо и химические вещества, а. также минимизировать энергетические и временные затраты.
В наших предыдущих исследованиях было показано, что в системах, генерирующих неравновесную низкотемпературную электронно-пучковую плазму (ЭПП), возможно модифицировать и деструктурировать отдельные полисахариды (например, хитин, хитозан и целлюлозу) за. счет совместного действия электронов высокой энергии и химически активных частиц без термического повреждения биополимеров [4, 5]. Однако исследования ЭПП-стимулированной деструкции сложного и очень прочного комплекса, в виде которого лигноцеллюлоза, и находится в природе, ранее не проводились и представляют собой отдельную плазмохимическую задачу.
Целью исследования было доказать эффективность применения пучково-плазменных систем для модификации лигноцеллюлозы для повышения реактивности ее поверхности и облегчения дальнейшей химической обработки.
2. Экспериментальная установка
Рис. 2 иллюстрирует конструкцию и работу электронно-пучкового плазменного химического реактора (ЭППР), используемого для модификации биоматериала. Устройство ЭППР и принцип действия, регламенты ЭПП-модификации порошков полисахаридов и оптимизация режимов обработки биоматериала были подробно описаны в [6].
Рис. 2а. иллюстрирует схему ЭПП-модификации порошков биополимеров, а. рис. 26 -сам процесс обработки во вращающемся устройстве. Сформированный в высоком вакууме (~ 10-5 Торр) электронный пучок (ЭП) (3) инжектировался в заполненную плазмообразующей средой реакционную камеру (6) через газодинамическое выводное окно (4), при этом формировалось облако химически активной ЭПП (7). ЭП сканировали в круглый растр с помощью электромагнитной системы (5), что повышало равномерность обработки материала. (10). Лигноцеллюлозный материал помещали во вращающееся перемешивающее устройство (8), изготовленное из кварцевой трубы и оснащенное ребрами (9). Облако ЭПП локализовали внутри данного устройства, в котором формировалась реакционная зона (10) в виде твердого аэрозоля.
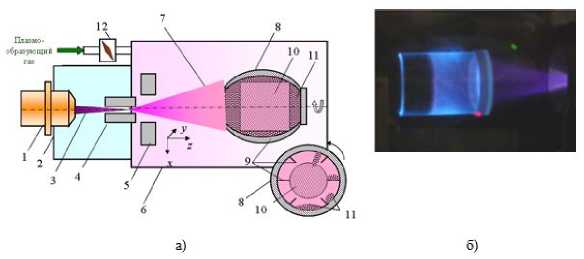
Рис. 2. Схема, плазмохимического реактора, (а) и процедура. ЭПП-стимулироваппой деструкции порошков полисахаридов (б): 1 - электронная пушка; 2 - высоковакуумная камера; 3 - электронный пучок; 4 - выводное устройство; 5 - электромагнитная отклоняющая система; б - рабочая камера; 7 - облако ЭПП; 8 - кварцевая труба; 9 - внутренние ребра; 10 - реакционная зона; 11 - порошок обрабатываемого полисахарида; 12 - регулируемый патекатель
ЛЦ получали путем сольволиза, термомеханической массы хвойных пород с кислотой Льюиса (тетрахлорид титана (ТІС14)) в концентрациях 0,003 мМ/л и 0,209 мМ/л в СаНи) путем кипячения с обратным холодильником при 70 °C в течение 30 минут. Содержание лигнина, в ЛЦ составило 30%. Содержание Ti(IV) - 0,03 мМ/г; СООН-групп - 0,95 мае.%, СНО-групп - 0,33 мае.%. Длина частично разложенных волокон составляла 20-130 цм.
В настоящем исследовании условия ЭПП-обработки ЛЦ были следующими:
• Плазмообразутощая среда, кислород спектроскопического класса, (научно-промышленный центр НИЦ «Курчатовский институт», Россия) при давлении Рт= 670 Па.
• Расстояние между выводным окном и поверхностью образца. - 250 мм.
• Режим сканирования ЭП - концентрические круги с максимальным диаметром 130 мм.
• Время обработки т варьировалось от 2 до 10 мин.
• Для предотвращения термического разрушения образцы обрабатывались при температуре материала Ts = 40 °C. Температуру образца контролировали во время обработки с помощью бесконтактного ИК-пирометра Optris LS (Optris GmbH, Германия). Контроль температуры осуществлялся путем выбора тока ЭП Іь- В большинстве экспериментов Іь составлял 2 мА, некоторые эксперименты с лигноцеллюлозной биомассой проводились при Іь = 5 мА.
3. Результаты
Лигноцеллюлозные порошки, обработанные в ЭПП, затем характеризовались инфракрасной спектроскопией с преобразованием Фурье, рентгеновской дифрактометрией (XRD) и термогравиметрическим анализом (ТГА), который проводили совместно с дифференциальной термогравиметрией (ДТГ) и дифференциальной сканирующей калориметрией (Дек).
ЭПП-обработка при Іь = 2 мА не привела к деградации в лигноцеллюлозном образце, а XRD-анализ не выявил каких-либо заметных изменений в рентгенограммах исходных и обработанных образцов, что позволяет сделать вывод о незначительном разрушении целлюлозных волокон. Однако при увеличении Іь до 5 мА при XRD-анализе была показана интенсивная аморфизация лигноцеллюлозной биомассы. Кроме того, в образце, обработанном при Іь = 5 мА, произошла карбонизация целлюлозных волокон (рис. 3), о чем говорит их потемнение.
Аморфизация и частичное разрушение лигноцеллюлозных волокон во время ЭПП-обработки при Іь = 5 мА были также подтверждены с использованием ТГА, ДТГ и ДСК.

Рис. 3. Изображения образцов лигноцеллюлозы до и после ЭПП-обработки: а) - исходный образец, б), в) - образцы, обработанные в течение 10 мин при 1ь = 2 мА и 5 мА соответственно
Два эндотермических пика в областях Т1 = 70-90 °C (Пик ^1) и Т2 = 330-345 °C (Пик ^2) были обнаружены на кривых ДТГ лигноцеллюлозной массы. Первый пик соответствует десорбции физически связанной воды. Второй пик связан с термической деполимеризацией целлюлозы за счет свободнорадикального процесса, приводящего к превращениям в полимерных внутримолекулярных цепях и получению левоглюкозана. При этой температуре также происходит образование ангидроцеллюлозы. Процесс, протекающий при температурах выше 300 °C, соответствует полной аморфизации целлюлозы вместе с ее значительной потерей массы.
Обработка ЭПП привела к снижению 12, что, вероятно, связано с плазмостимулированной деструкцией и окислением лигноцеллюлозных волокон, в результате чего образуется ряд термически нестабильных легких органических соединений, которые разлагаются при более низкой температуре (табл. 1). ПК-спектроскопия выявила образование дополнительных карбонильных и карбоксильных групп, образовавшихся под действием активных форм кислорода, которые нарабатывались в плазмообразующей среде в процессе ЭПП-обработки. Содержание окисленных функциональных групп содержание -СООН и -СОН было соответственно в 1.3-2.6 и 3.4-7.1 раза больше, чем в исходной лигноцеллюлозе и увеличивалось с повышением 1ь-
Таблица!
Характеристика лигноцеллюлозы, обработанной с ЭПП, термогравиметрическим анализом и дифференциальной термогравиметрией
|
Пик #1 |
Пик #2 |
|||||||
|
Образец |
1ь, мА |
Т1, °C |
mi,% |
"1, % /мин |
Т2, °C |
m2,% |
"2, %/мин |
m resi% |
|
Необработанный |
0 |
90 |
99,6 |
0,11 |
345 |
49,8 |
4,87 |
23,8 |
|
ЭПП-обработка т = 10мин |
5 |
74 |
99,8 |
0,10 |
339 |
54,6 |
2,71 |
28,5 |
Т1, Т 2 - температуры, соответствующие максимальным скоростям потери массы; m1, m2 - процент массы образца при Т 1 и Т2; и 1 и v2 - скорости пот ери массы при Т 1 и Т2; mTes - остаточная масса образца (процентное содержание уголыю-мииералыюго остатка при Т = 600 °C). Исходная масса, образца, использованная для анализа, составляла. 5 мг
Масса, неорганического остатка, образовавшегося при нагревании образцов до 600 °C, была, выше во всех ЭПП-обработанных образцах (табл. 1). Последнее свидетельствует о том, что соединения титана, превращаясь в ТІО2, не изменяли свою массу при дальнейшем нагревании, в отличие от органического компонента, лигноцеллюлозных образцов.
Состав обрабатываемой биомассы влиял и на скороств ЭПП-модификации. Так, использование более концентрированного раствора ТІС14 приводило к более медленному ЭПП-окислению лигноцеллюлозы. Эффект, вероятно, обусловлен ограниченным доступом кислорода к гидроксильным группам на поверхности лигноцеллюлозных волокон, которые покрыты соединениями титана. Удаление соединений титана с поверхности волокна позволяло достичь более высокой скорости и степени окисления.
4. Заключение
Экспериментально доказана возможность окисления лигноцеллюлозной биомассы в ЭПП кислорода. Применение ЭПП является быстрым, ресурсосберегающим и экологическим чистым методом обработки природных биоматериалов и биомассы. Кроме того, ЭПП-обработка является сухим процессом, который не требует высококонцентрированных кислотных и щелочных растворов или других опасных реагентов. Принимая во внимание вышеупомянутые преимущества, ЭПП-обработка может рассматриваться как подход «зеленой» химии.
Работа выполнена при поддержке Минобрнауки, проект № 10А.100.
Список литературы Электронно-пучковые плазменные системы - новые возможности для технологий переработки лигноцеллюлозной биомассы
- Kumar A., Gautam A., Dutt D. Biotechnological transformation of lignocellulosic biomass in to industrial products: an overview // Adv. Biosci. Biotechnol. 2016. V. 7, N 3, P. 149- 168.
- Chundawat S. P.S., Beckham G.T. Deconstruction of lignocellulosic biomass to fuels and chemicals // Annu. Rev. Chem. Biomol. Eng. 2011. V. 2. P. 121-145.
- Dale B.E., Ong R.G.Energy, wealth, and human development: why and how biomass pretreatment research must improve // Biotechnol. Prog. 2012. V. 28, N 4. P. 893-898.
- Vasilieva T., Sigarev A., Kosyakov D., Ul'yanovskii N., Anikeenko E., Chuhchin D., Ladesov A., A.M. Hein and Miasnikov V.Formation of low molecular weight oligomers from chitin and chitosan stimulated by plasma-assisted processes // Carbohydr. Polym. 2017. V. 163. P. 54-61.
- Vasilieva T., Chuhchin D., Lopatin S., Varlamov V., Sigarev A., Vasiliev M.Chitin and cellulose processing in low-temperature electron beam plasma // Molecules. 2017. V.22, N 11. P. 1908.
- Vasilieva T. A beam-plasma source for protein modification technology // IEEE Trans. Plasma Sci. 2010. V. 38, N 8. P. 1903-1907.


