Эмбриогенез в культуре микроспор брокколи
Автор: Домблидес Е.А., Козарь Е.В., Шумилина Д.В., Заячковская Т.В., Ахраменко В.А., Солдатенко А.В.
Журнал: Овощи России @vegetables
Рубрика: Селекция и семеноводство сельскохозяйственных растений
Статья в выпуске: 1 (39), 2018 года.
Бесплатный доступ
Изучен процесс эмбриогенеза и отработаны элементы технологии получения удвоенных гаплоидов брокколи B. oleracea L convar. botryts L) Alef. var. italica Plenck в культуре микроспор in vitro. Было выявлено, что успешное развитие эмбриоидов происходит из микроспор, изолированных из бутонов длиной 4 и 5 мм, где преимущественно содержатся микроспоры - на поздней вакуолизированной, пыльца - на ранней двухклеточной стадии развития. Оптимальным режимом температурной обработки является обработка 32°С в течение первых 2-х суток после введения в культуру. Эмбриоиды были получены из пяти образцов брокколи: Arcadia F1, Everest, Green Valiant, Marathon F1, Furio. Наибольший выход эмбриоидов был получен у образца Green Valiant, где он составил до 140 эмбриоидов на чашку Петри, а наименьший - у Furio (до 3 эмбриоидов/чашку Петри). Первые деления в культуре микроспор у всех образцов наблюдали уже на 2-3 сутки культивирования. Дальнейшее развитие эмбриоидов шло по двум направлениям -путем прямого развития или с образованием суспензороподобных структур. Эмбриоиды, содержащие суспензор, развивались медленнее, чем бессуспензорные. Мы наблюдали образование эмбриоида не только на дистальном (по отношению к микроспоре) конце суспензороподобной структуры, но и образование цепочки из эмбриоидов, а также все возможные близнецовые комбинации эмбриоидов. Было показано, что метод получения эмбриоидов в культуре микроспор in vitro может быть использован не только для получения удвоенных гаплоидных растений, но и служить моделью для фундаментальных исследований по изучению этапов развития зиготических эмбриоидов и суспензоров.
Эмбриогенез, культура микроспор, dh-растения, суспензороподобные структуры, брокколи
Короткий адрес: https://sciup.org/140223741
IDR: 140223741 | УДК: 635.356:581.33
Текст научной статьи Эмбриогенез в культуре микроспор брокколи
Капуста брокколи в последнее время становится все более востребованной у потребителей благодаря своему богатому биохимическому составу и большой питательной ценности. Ее используют в качестве диетического и лечебно- профилактического продукта. Потребительский спрос в условиях современного рынка постоянно растет и меняется. Это создает необходимость наличия у селекционера генотипически разнообразного и стабильного материала, который позволит быстро удовлетворять требования современного производства. Решение этой проблемы возможно за счет применения биотехнологических методов в создании новых высокопродуктив- ных сортов и гибридов. Наиболее сложным, трудоемким и продолжительным звеном в процессе создания гибридов F1 является выведение константных родительских линий, на создание которых уходит от 6 до 12 лет при использовании традиционных методов селекции. В большинстве развитых стран в настоящее время для ускорения селекции широко используются технологии получения удвоенных гаплоидов (DH-технологии) (Dunwell, 2010), что позволяет ускорить селекционный процесс, создавая выровненные линии за 1-2 года. Основные методы получения гаплоидов, их классификация рассмотрены в ряде обзоров (Maluszynski et al., 2003; Dunwell, 2010; Asif, 2013). Одной из самых востребованных технологий, использующейся для ускорения селекционного процесса, является культура изолированных микроспор in vitro. Изолированные микроспоры при определенных условиях (оптимальная комбинация условий культивирования и стрессового воздействия) могут быть переведены с нормального гаметофитного пути развития на спорофитный, образуя при этом эмбриоиды, переходящие в гаплоиды (Hs) или в удвоенные гаплоиды (DH-растения). Отсутствие в культуре микроспор соматических тканей позволяет не ставить под сомнение происхождение полученных растений. Первые успешные исследования по культуре микроспор капустных культур проведены в начале 1980-х годов (Lichter, 1982). Позднее был разработан базовый протокол культуры микроспор рапса, который служит основой DH-технологии для растений рода Brassica L. (Pechan, Keller, 1988). Число работ, касающихся разработки DH-технологии для капусты брокколи, незначительно, несмотря на то, что эта разновидность капусты считается наиболее отзывчивой к андрогенезу (Arnison et al., 1990; Takahata, Keller, 1991; Chauvin et al., 1993; Takahata et al., 1993; Farnham et al., 1998; Dias,1999; Gu et al., 2004).
Целью наших исследований являлось изучение процесса эмбриогенеза в культуре микроспор брокколи для создания эффективной технологии получения удвоенных гаплоидов у этой культуры.
Материалы и методы Растительный материал и условия выращивания донорных растений
В работе использовали сортооб-разцы брокколи, переданные из коллекции ФГБНУ «Федеральный исследовательский центр
Всероссийский институт генетических ресурсов растений имени Н.И. Вавилова» (табл.).
Донорные растения выращивали в климатической камере при режиме 19°С круглосуточно, 16 час день/8 час ночь, освещение – 9000 люкс.
При отборе бутонов проводили цитологическое исследование стадий развития микроспор. Для визуализации микроспор и пыльцы использовали методику дифференциального окрашивания (Alexander,
1969) и микроскоп Axio Imager А2, с помощью которых определяли зависимость между размером бутона и стадией развития микроспор.
Культура микроспор
Бутоны собирали с растений, находящихся на начальной стадии цветения, и стерилизовали 30 с в 96% этаноле, затем в течение 5 мин в 50% водном растворе коммерческого препарата «Белизна» с добавлением Твина-20 (1 капля на 100 мл), с последующим трехкратным промыванием в стерильной дистиллированной воде.
Стерильные бутоны помещали в ½ NLN среду (Lichter, 1982) с 13%-содержанием сахарозы и PH 5,8 из расчета 30 бутонов на 6 мл среды. В пробирку также помещали стерильный магнит, после чего на магнитной мешалке проводили измельчение бутонов. Суспензию микроспор фильтровали через нейлоновый фильтр с размером ячеек 40 μm и осаждали 5 мин на центрифуге типа Eppendorf 5804R (Германия) при 125 g. Осадок с микроспорами ресуспендировали в ½ NLN среде и повторяли центрифугирование. Промывку микроспор проводили дважды.
В каждую чашку Петри до разлива жидкой среды вносили по 250 мкл автоклавированной 1% суспензии активированного угля в 0,5% агарозе. После выделения и промывки микроспоры из 5 бутонов помещали в чашки Петри диаметром 6 см с питательной средой вышеуказанного состава (5 мл), в которой они инкубировались при 32°С в темноте в течение двух суток, далее инкубация проходила при 25°С в темноте до образования эмбриоидов.
Получение растений-регенерантов
Появившиеся эмбриоиды на семядольной стадии (cotyledonstage) своего развития, помещали в чашки Петри на среду В-5 (Gamborg, 1968), содержащую 2% сахарозу и 7,0 г/л агара. Для образования вторичных эмбриоидов экспланты переносили на среду ½ МС (Murashige and Skoog, 1962) с 2% сахарозы, 0,1 мг/л бензиламинопурина (БАП) и 3,0 г/л фитогеля. Образовавшиеся побеги и эмбриоиды отделяли и переносили на среду МС с 2% сахарозы и 3,0 г/л фитогеля. Культивирование проводили на стеллажах с люминесцентными лампами при 25°С и фотопериоде 14 часов, освещенности 2,5 тыс. люкс.
Выращивание растений-регенерантов Растения с нормально развитыми листьями и корневой системой переносили в вегетационные сосуды, заполненные смесью торфа и перлита (7:3), накрывали перфори- рованными пластиковыми стаканчиками для адаптации растений к условиям in vivo. Выращивали растения-регенеранты в тех же условиях, что и донорные растения.
Результаты
Одним из важнейших факторов, влияющих на эмбриогенез в культуре микроспор, является определение оптимальной для введения в культуру in vitro стадии развития мужского гаметофита. Известно, что у растений рода Brassica способностью перехода с гаметофитно-го пути на спорофитный обладают микроспоры поздней одноклеточной стадии и пыльцевые зерна на ранней двухклеточной стадии развития (Pechan, Keller, 1988; Baillie et al., 1992; Telmer et al., 1992; Kott, 1998). Методом дифференциального окрашивания микроспор и последующего анализа фазы развития была изучена зависимость между стадией развития микроспоры/пыльцы и размером бутона капусты брокколи (рис.1.). Известно, что в бутонах одного размера в пыльниках одновременно содержатся микроспо-ры/пыльца на разных стадиях развития, однако преимущественное количество обычно занимают две близлежащие стадии. Было выявлено, что в бутонах 4-5 мм содержатся микроспоры на поздней вакуализи-рованной и ранней двухклеточной стадии развития. На образце Arcadia F1 при введении в культуру мы использовали бутоны от 3 до 6 мм. Было выявлено, что в вариантах, где микроспоры были изолированы из бутонов длиной 4 и 5 мм происходило успешное развитие эмбриоидов, причем из бутонов 4 мм эмбриоидов образовывалось практически в пять раз больше, чем из бутонов 5 мм (11,2±1,78 и 2±0,35 эмбриоидов/на чашку Петри соответственно). Из микроспор на ранней стадии развития (3 мм) и двухклеточной пыльцы (6 мм) регенерации эмбриоидов не происходило. Полученные данные согласуются с литературными данными. Определение зависимости между развитием микроспор и длиной бутона позволило в дальнейших опытах использовать микроспоры на наиболее восприимчивой стадии развития, проводя отбор бутонов по длине.
К числу важных факторов, способных вызывать индукцию эмбриогенеза у представителей рода Brassica , относится тепловая обработка микроспор в чашках Петри сразу после введения в культуру in vitro . Чаще всего для этой цели используют тепловые режимы от 32°С до 40°С с различной временной экспозицией (от 1 до 10 суток) (Шмыкова и др., 2015). Эффективность индукции эмбриогенеза зависит от генотипа, температуры и времени воздействия. В
Таблица. Количество образовавшихся эмбриоидов у образцов брокколи Table. The number of embryoids developed in accessions of broccoli
Выход эмбриоидов достаточно сильно отличался у различных генотипов (табл.1). Наибольший выход эмбриоидов из бутонов размером 4±0,5 мм был получен у образца Green Valiant, где он составил до 140 эмбриоидов на чашку Петри, а наименьший – у Furio (до 3 эмбриои-дов/чашку Петри). Первые деления в культуре микроспор у всех образцов наблюдали уже на 2-3 сутки культивирования. Дальнейшее развитие эмбриоидов шло по двум направлениям – путем прямого развития или с образованием суспензороподобных структур. Второй путь развития наблюдался чаще всего в культуре микроспор образцов Green Valiant и Marathon F1, у которых был отмечен наибольший выход эмбриоидов, причем развитие эмбриоидов у этих двух генотипов происходило по двум путям одновременно.
Изучению процесса развития эмбриоида в процессе эмбриогенеза в культуре микроспор in vitro уделяется в последнее время большое значение, поскольку именно во время перехода эмбриоида от недифференцированной глобулярной стадии развития к сердечковидной и торпедовидной происходит потеря эффективности у большинства опубликованных протоколов. Эксперименты на модельных культурах микроспор (рапс) выявили некоторые факторы (различные регуляторные белки, ауксины, гибберели-новая кислота и другие фитогормоны), которые напрямую или опосредовано вовлечены в развитие эмбриоидов из микроспор (Prem et al., 2012). Многие из них играют общую роль как при эмбриогенезе in vitro , так и во время зиготического эмбриогенеза, где их синтез или регуляция опосредована эндоспермом или другими тканями завязи и семени. Образование и развитие
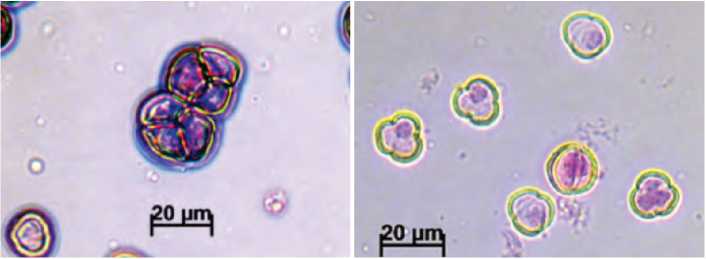
А. Тетрады и ранние одноклеточные микроспоры (форма округлая, цитоплазма плотная, ядро крупное) (бутон 2 мм)
Б. Ранние одноклеточные микроспоры (по мере увеличения размера, форма микроспоры приобретает трехлопастной вид) (бутон 3 мм)
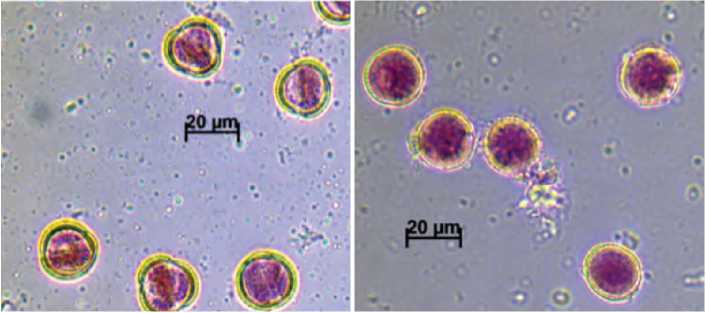
В. Одноклеточные микроспоры и поздние одноклеточные микроспоры (наблюдается образование нескольких мелких вакуолей, которые впоследствии сливаются в одну большую вакуоль, а ядро при этом смещается и занимает пристеночную позицию) (бутон 4 мм)
Г. Поздние одноклеточные микроспоры и двухклеточные пыльцевые зерна (форма поздних микроспор по мере роста становится округлой и на этом этапе происходит ассиметричный митоз, в результате чего образуются двухклеточное пыльцевое зерно) (бутон 5 мм)
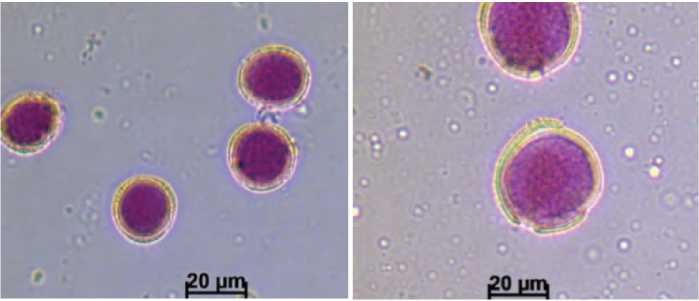
Д. Двухклеточная пыльца (состоит из вегетативной и генеративной клетки, цитоплазма темно окрашена, вакуоли не видны, ядра без предварительной фиксации просматриваются плохо) (бутон 6 мм)
Е. Зрелые пыльцевые зёрна (после второго митотического деления генеративной клетки, образуются два спермия, цитоплазма ярко окрашена, диаметр пыльцевого зерна увеличевается почти в два раза) (бутон 7 мм)
Рис. 1. Микроспоры и пыльца в бутонах брокколи разного размера (окраска дифференциальным красителем).
Figure 1. Microspore and pollen in broccoli buds of different sizes (use of differentiation dye).
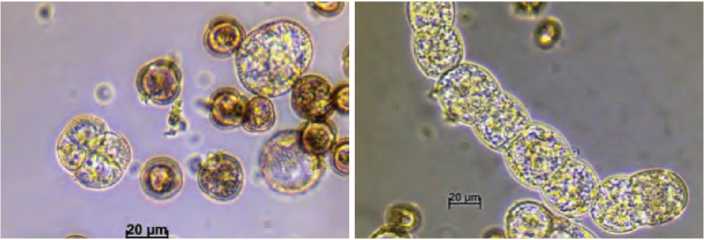
А. первые деления в культуре микроспор (3 суток)
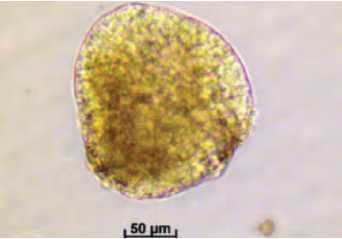
В. (10 суток)
Б. первые деления в культуре микроспор при развитии суспензора (7 суток)
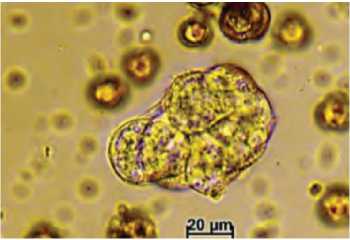
Д. Эмбриоид на глобулярной стадии развития (14 суток)
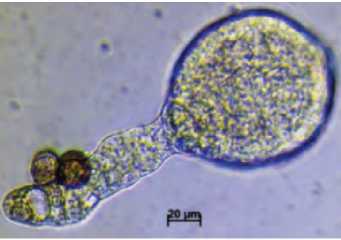
Г. образование эмбриоида на дистальном (по отношению к микроспоре) конце суспензороподобной структуры (14 суток)
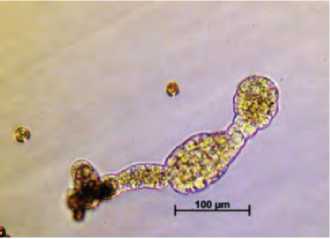
Е.Начальная стадия формирования цепочки из эмбриоидов на суспензороподобной структуре (20 суток)
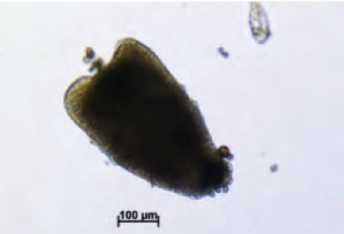
Ж. Эмбриоид на сердцевидной стадии развития (18 суток)
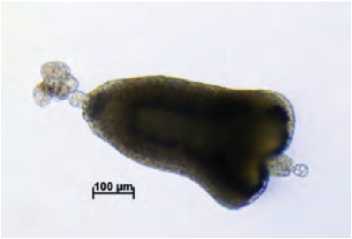
З. Эмбриоид с суспензором на сердцевидной стадии развития (25 суток)
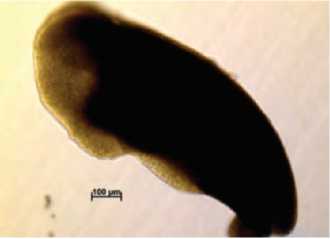
И. Эбриоид на начальной семядольной стадии развития (21 сутки)
Рис. 2. Образование и развитие эмбриоидов в культуре микроспор брокколи (А, В, Д, Ж, И – развитие без суспензора; Б, Г, Е, З, К – развитие с суспензороподобной структурой).
Figure 2. Formation and development of embryoids through culture of isolated microspore of broccoli (А, В, Д, Ж, И – development without suspensor; Б, Г, Е, З, К – development with suspensor-like structures).
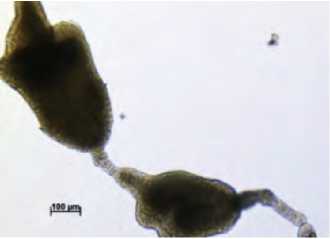
К. Цепочка из эмбриоидов на сердцевидной стадии развития (25 сутки)
зародыша с суспензороподобной структурой в культуре микроспор происходит сходно с развитием зиготического зародыша семейства Капустные, у которого происходит образование суспензора в процессе делений базальной клетки (образующейся при делении зиготы). В случае зиготического зародыша, полностью дифференцированный суспензор напоминает нить, состоящую из 8-13 клеток. Обнаруженная высокая степень полиплоидизации суспензора (некратная величине С) на глобулярной и сердцевидной стадии развития зиготического зародыша свидетельствует о его высокой метаболической активности, которая может быть связана с выполняемой суспензором функцией «выкармливания» зародыша на ранних стадиях его развития (Ермаков, 1990). Суспензор выполняет функцию накопления и транспорта к зародышу питательных веществ, растительных гормонов, таких как гиббереллиновая кислота, ауксин, цитокинины и абсцизовая кислота (Yeung, Meinke, 1993; Friml, 2003). Суспензор может быть как местом синтеза, так и поставщиком фитогормонов. В культуре микроспор суспензороподобные структуры, возможно, выполняют аналогичную роль снабжения эмбриоида запасными веществами и участвуют в регуляции его роста и тканевой дифференциации. В наших опытах развитие эмбриоидов происходило не синхронно, в одной чашке присутствовали эмбриоиды на разных стадиях развития. Было отмечено, что эмбриоиды, содержащие суспензор, развивались медленнее, чем бессуспензорные (рис. 2), что согласуется с данными, полученными при наблюдении за культурой микроспор B. napus (Supena, 2004) и B. rapa ssp. chinensis (Шумилина и др., 2015). Мы наблюдали образование эмбриоида не только на дистальном (по отношению к микроспоре) конце суспензороподобной структуры (рис. 2Г), но и образование цепочки из эмбриоидов (рис. 2Е, 2 К), а также всевозможные близнецовые комбинации эмбриоидов, описанные ранее для рапса (Supena et al., 2008).
На 30 день культивирования большая часть эмбриоидов достигала уже семядольной стадии (cotyledon-stage) и была готова для пересадки на твердую питательную среду для регенерации растений (рис. 3А). На свету уже на 2 день эмбриоиды приобретали зеленую окраску и значительно увеличивались в размере (рис. 3Б). Примерно через месяц растения-регенеранты укоренялись (рис. 3С), могли быть высажены в грунт для адаптации к условиям in vivo (рис. 3Д).
В результате проведенных исследований был изучен процесс эмбриогенеза и отработаны элемен- ты технологии получения удвоенных гаплоидов брокколи в культуре микроспор in vitro. Полученные DH-растения брокколи после самоопыления и оценки по хозяйственно ценным признакам могут быть включены в селекционный процесс в качестве гомозиготных линий, а также использоваться в молекулярно-генетических исследованиях. Изучение процесса эмбриогенеза в культуре микроспор in vitro свидетельствуют о том, что этот метод может быть использован не только для получения удвоенных гаплоидных растений, но и служить моделью для фундаментальных исследований по изучению этапов развития зиготических эмбриоидов и суспензоров.

-
А. Эмбриоиды в чашке Петри на семядольной стадии развития (cotyledon-stage) – 30 дней культивирования


Б. Активация хлорофилла и зеленой пигментации семядолей/эмбриода на 5 сутки культивирования на агаризованнойсреде В-5 с 2% сахарозой

-
В. Укоренение растений-регенерантов на среде МС с 2% сахарозой и 3,0 г/л фитогеля
Г. Адаптация растений-регенерантов к условиям in vivo
Рис. 3. Регенерация растений брокколи из эмбриоидов.
Figure 3. Broccoli plant regeneration from embryoids.
Список литературы Эмбриогенез в культуре микроспор брокколи
- Эмбриология растений: использование в генетике, селекции, биотехнологии: /под ред. И. П. Ермакова. -М., Агропромиздат, 1990. Т. 2/пер. с англ. Э. С. Терехина . -1990. -461 с.
- Шмыкова Н.А., Шумилина Д.В., Супрунова Т.П. Получение удвоенных гаплоидов у видов рода Brassica L.//Вавиловский журнал генетики и селекции. 2015; 19(1): 111 -120 DOI: 10.1134/S1062359015040135
- Шумилина Д.В., Шмыкова Н. А., Бондарева Л. Л., Супрунова Т. П. Влияние генотипа и компонентов среды на эмбриогенез в культуре микроспор капусты китайской Brassica rapa ssp. ohinensis сорта Ласточка//Известия РАН, серия биологическая, 2015. № 4. С. 368-375 DOI: 10.7868/S000233291504013X
- Alexander M.P. Differential staining of aborted and nonaborted pollen.//Stain technol. 1969. V.44. №3. P.117-122.
- Arnison P.G., Keller W.A. A survey of the anther culture response of Brassica oleracea L cultivars grown under field conditions.//Plant Breed.1990. V.104. P.125-133.
- Asif M (2013), Progress and Opportunities of Doubled Haploid Production, SpringerBriefs in Plant Science DOI 10.1007/978-3-319-00732-8_1
- Baillie A.M.R., Epp D.J., Hutcheson D. and Keller W.A. In vitro culture of isolated microspores and regeneration of plants in Brassica campestris//Plant Cell Rep. 1992. V.11. P.234-237.
- Chauvin J. E., Yang Q., Jeune B. Le., Herve Y. Odention d'embryons par culture d'anthtres chen le chou-fleur et le brocoli et evaluation des potentialites du materiel obtenu pour la creation varietale.//Agronomie, 1993. V.13. P.579-590.
- Dias J.S. Effect of activated charcoal on Brassica oleracea microspore culture embryogenesis//Euphytica. 1999. P.108. V.65-69.
- Dunwell J.M. (2010) Haploids in flowering plants: origins and exploitation. Plant Biotechnol. J., 2010, 8: 377-424 ( ) DOI: 10.1111/j.1467-7652.2009.00498.x
- Farnham M.W. Doubled-haploid broccoli production using anther culture effect of anther source and seed set characteristics of derived lines//J. Amer. Hort Sci. 1998. V.123. P.73-77.
- Friml J., Vieten A., Sauer M., Weijers D., Schwarz H., Hamann T., Offringa R. & Jergens G. Efflux-dependent auxin gradients establish the apical-basal axis of Arabidopsis//Nature.2003. V.426. P. 147-153.
- Gamborg O.L., Miller R.A., Ojima K. Nutrients requirements of suspension cultures of soybean root cells//Exp Cell Res. 1968. V.50. P.151-158.
- Gu H.H., Hagberg P., Zhou W.J. Cold pretreatment enhances microspore embryogenesis in oilseed rape (Brassica napus L.). Plant Growth Regul. 2004;42:137-143
- Kott L.S. Application of double haploid technology in breeding of oilseed Brassica napus//AgBiotech News Inf.1998. V. 10(3). P.69-74.
- Lichter R. Induction of haploid plants from isolated pollen of Brassica napus. Z. Pflanzenphysiol., 1982, 105: 427-434.
- Maluszynski M, Kasha KJ, Forster BP, Szarejko I (2003) Doubled haploid production in crop plants: a manual. Kluwer, Dordrecht
- Murashige T., Skoog F. A revised medium for rapid growth and bio assays with tobacco tissue cultures. Physiologia Plantarum, 1962, 15: 473-497
- Pechan P.M., Keller W.A. Identification of potentially embryogenic microspores in Brassica napus//Physiol Plant.1988. V. 74. P. 377-384.
- Prem et al.: A new microspore embryogenesis system under low temperature which mimics zygotic embryogenesis initials, expresses auxin and efficiently regenerates doubled-haploid plants in Brassica napus. BMC Plant Biology 2012 12:127 DOI: 10.1186/1471-2229-12-127
- Supena E.D.J. Innovations in micrcspore embryogenesis in Indonesian hot pepper (Capsicum annuum L.) and Brassica napus L.//Ph.D. thesis Wageningen University, Wageningen, The Netherlands. 2004. PP 131.
- Supena EDJ, Winarto B, Riksen T, Dubas E, van Lammeren A, Offringa R, Boutilier K, Custers J. Regeneration of zygotic-like microspore-derived embryos suggests an important role for the suspensor in early embryo patterning. J Exp Bot. 2008;59:803-814 DOI: 10.1093/jxb/erm358
- Takahata Y., Keller W.A. (1991) High frequency embryogenesis and plant regeneration in isolated microspore of Brassica oleracea L. Plant Sci,74:235-242.
- Takahata Y., Takany Y., Kaisuma N. Determination of microspore population to obtain high frequency embryogenesis in broccoli (Brassica oleracea L.).//Plant Tiss Cult Lett. 1993. V.10. P.49-53.
- Telmer C.A., Simmonds D.H., Newcomb W. Determination of developmental stage to obtain high frequencies of embryogenic microspores in Brassica napus//Physiol Plant.1992. V.84. P.417-424.
- Yeung E.C. and Meinke D.W. Embryogenesis in angiosperms: development of the suspensor//Plant Cell. 1993. V.5. P.1371-1381.


