Эмбриональные опухоли центральной нервной системы у взрослых. Три наблюдения из практики. Обзор литературы
Автор: Мацко Марина Витальевна, Мацко Дмитрий Евгеньевич, Имянитов Евгений Наумович, Скляр Софья Сергеевна, Улитин Алексей Юрьевич, Яковенко Игорь Васильевич, Иевлева Аглая Геннадиевна, Ершов Геннадий Альбертович, Романько Александр Андреевич, Нечаева Анастасия Сергеевна
Журнал: Сибирский онкологический журнал @siboncoj
Рубрика: Опыт работы онкологических учреждений
Статья в выпуске: 1 т.20, 2021 года.
Бесплатный доступ
Актуальность. Эмбриональные опухоли центральной нервной системы - злокачественные новообразования, которые преимущественно встречаются у пациентов детского возраста c пиком заболевания в 4 года. По своим морфологическим характеристикам данные опухоли относятся к группе мелкокру-глоголубоклеточных и низкодифференцированных, поэтому гистологическая диагностика сопряжена с определенными трудностями. Метод и описание случаев. Представлены три клинических наблюдения пациентов с эмбриональными опухолями центральной нервной системы супратенториальной локализации. В двух случаях (возраст пациентов - 33 и 52 года) при иммуногистохимии верифицирована нейробластома (Syn (+), NSE (+), CD (+) и Ki67 10/40 %) и в третьем (возраст - 37 лет) - ганглионей-робластома (Syn (+), NSE (+), CD99 (+) и Ki67 40 %). Всем пациентам проведена лучевая терапия СОД 60 Гр на область оперативного вмешательства и 6 циклов химиотерапии в адъювантном режиме: больные с нейробластомой получили химиотерапию по схеме EP (цисплатин + этопозид), пациент с ганглионейробластомой - темозоломид. Результат. В каждом случае в результате лечения был получен объективный ответ. Безрецидивная продолжительность жизни в первом случае (нейробластома) составила 51 мес, общая продолжительность жизни - более 105 мес (8 лет 9 мес); во втором случае (нейробластома) - 25 мес 2 нед и более 26 мес соответственно, у пациента с ганглионейробластомой безрецидивная продолжительность жизни составила 87 мес, общая продолжительность жизни - более 93 мес (7 лет 9 мес 3 нед). Заключение. Эмбриональные опухоли центральной нервной системы у взрослых являются исключительно редкими новообразованиями, которые отличаются длительным ответом на стандартные лечебные воздействия.
Эмбриональные опухоли цнс, нейробластома, ганглионейробластома, мутации в генах idh1/2, ген mgmt, ген еrсс1, ген vegf, ген pdgfra
Короткий адрес: https://sciup.org/140254405
IDR: 140254405 | УДК: 616.8-006 | DOI: 10.21294/1814-4861-2021-20-1-105-114
Текст научной статьи Эмбриональные опухоли центральной нервной системы у взрослых. Три наблюдения из практики. Обзор литературы
Background. Еmbryonal tumors of the central nervous system are malignant neoplasms that mainly occur in pediatric patients with a peak incidence at the age of 4 years. These tumors usually have small round blue cell histology and low differentiation. Method and case description. A report of three cases with embryonal CNS tumors of supratentorial localization has been presented. Immunohistochemical analysis classified these tumors as neuroblastoma (2 cases: Syn (+), NSE (+), CD (+) and Ki67 10/40 %; ages were 33 and 52 years) or ganglioneuroblastoma (1 case: Syn (+), NSE (+), CD99 (+) and Ki67 40 %; age was 37 year). All patients underwent RT in a total dose of 60 Gy delivered to the area of the removed tumor and 6 cycles of adjuvant chemotherapy: patients with neuroblastoma received chemotherapy using EP regimen (cisplatin + etoposide), and patient with ganglioneuroblastoma received temozolomide. Results. An objective response to therapy was achieved in all 3 patients. The relapse-free survival (RFS) in the first case of neuroblastoma was 51 months, the overall survival (OS) was more than 105 months (8 years 9 months); in the second case of neuroblastoma, RFS was 25 months 2 weeks and OS was more than 26 months. Both neuroblastomas contained IDH1(R132H) mutation. In the patient with ganglioneuroblastoma, the RFS was 87 months, and the OS was over 93 months (7 years, 9 months, 3 weeks). conclusion. Supratentorial embryonal tumors of the central nervous system in adults are exceptionally rare and have a relatively favorable response to the standard treatment.
Эмбриональные опухоли центральной нервной системы (ЦНС) – гетерогенная группа новообразований, агрессивных по своему биологическому поведению, поражающих преимущественно детей и лиц молодого возраста. Они представлены недифференцированными или слабо дифференцированными нейроэпителиальными клетками, которые сохраняют способность к дифференцировке в нескольких направлениях (нейрональном, астроцитарном, эпендимарном), что затрудняет диагностику этих опухолей на этапе гистологического исследования ввиду отсутствия молекулярных маркеров, которые способны обеспечить надежное «перекрытие» с другими нейроэпителиальными опухолями высокой степени злокачественности. В зависимости от локализации выделяют две основные группы – эмбриональные опухоли с расположением в задней черепной ямке (чаще встречаются у детей и представлены медуллобластомой) и с супратенториальной локализацией. Последние рассматриваются как эмбриональные новообразования, которые построены из недифференцированных нейроэпителиальных клеток. При их нейрональной дифференцировке опухоль обозначают как «ЦНС нейробластома GIV», а при наличии крупных ганглионарных клеток речь идет о «ЦНС ганглионейробластоме GIV».
Согласно данным Регистра Опухолей Мозга США (Central Brain Tumor Registry of the United States (CBTRUS), на долю этой патологии у больных старше 15 лет приходится всего 1,5 % от всех первичных опухолей ЦНС, а заболеваемость ЦНС нейробластомой (ЦНС-НБGIV) и ЦНС ган-глионейробластомой (ЦНС-ГНБGIV) в данной возрастной категории составляет 0,04 случая на 100 000 населения [1]. Именно ввиду редкости этих новообразований ЦНС у больных старше 18 лет число посвященных им публикаций ограничено, а крупные исследования отсутствуют [2, 3]. Наиболее масштабной представляется работа A. Korshunov et al. (2016), в которой изучена частота разных альтераций (метилирование промотора гена MGMT; потеря генетического материала в 3q, 4q, 10q, 13q; увеличение копийности в 1q и 7 хромосомах; амплификация ряда генов) в образцах опухолевой ткани глиобластомы (ГБ) и ЦНС-НБ (22 случая) с мутацией H3F3A G34, которая в будущем, возможно, станет диагностически значимой для ЦНС-НБ. В исследование были включены как дети, так и взрослые пациенты в возрасте от 12 до 39 лет. Возможно, ввиду присутствия мутации H3F3A G34 метилирование промотора гена MGMT в ЦНС-НБ встречалось с необычно высокой частотой – 67 %. В другой работе метилирование промотора гена MGMT было выявлено лишь у одного из 5 пациентов, что составило 20 % (данные о том, получал ли больной темозоломид, отсутствуют) [4]. Проблема целенаправленной терапии больных с эмбриональными опухолями ЦНС темозоломидом при определении статуса гена MGMT остается нерешенной, невзирая на имеющиеся редкие публикации, свидетельствующие об эффективности темозоломида при супратенториальных эмбриональных опухолях ЦНС и медуллобластомах у взрослых (в этих работах экспрессия гена MGMT или метилирование промотора гена не определялись) [5–8].
Присутствие мутаций в генах IDH1/2 в супратенториальных эмбриональных опухолях ЦНС и их прогностическое значение также не изучены. Ниже будут приведены три клинических наблюдения пациентов с ЦНС-НБ и ЦНС-ГНБ, которые получили лучевую терапию (ЛТ) и химиотерапию (ХТ) в первой линии темозоломидом и по схеме EP (цисплатин+этопозид).
Клинический случай 1
Пациент, 33 лет, 07.06.11 выполнено субтотальное удаление опухоли (более 80 % от начального объема опухоли). После иммуногистохимического исследования установлен диагноз – ЦНС-НБ (рис. 1 а–г). В опухоли определена мутация в гене IDH1(R132H). При ПЦР в режиме реального времени выявлены низкие уровни экспрессии мРНК гена MGMT ( ∆ Ct=3,7), гена ERCC1 ( ∆ Ct=2,0) (рис. 2 а, б), а также низкие уровни экспрессии мРНК генов VEGF ( ∆ Ct=2,3) и PDGFA ( ∆ Ct=1,7).
Пациенту проведена ЛТ в СОД 60 Гр на область удаленной опухоли и 6 циклов полихимиотерапии (ПХТ) по схеме EP (цисплатин + этопозид) в адъювантном режиме. Достигнут полный ответ на терапию (рис. 3 а–з).
Безрецидивный интервал после первой линии терапии составил 51 мес. После выявления рецидива заболевания в феврале 2016 г. пациент повторно оперирован с проведением II линии химиотерапии (по схеме карбоплатин + темозоломид) с эффектом стабилизации. Безрецидивная продолжительность жизни на данный момент составляет более 3 лет 8 мес, динамическое наблюдение продолжается, общая продолжительность жизни – более 105 мес (8 лет 9 мес).
Клинический случай 2
Пациент, 52 лет, 29.11.12 выполнена циторедуктивная операция (<50 % – биопсия). После иммуногистохимического исследования установлен диагноз – ЦНС-НБ (рис. 4 а–г). В опухоли выявлена мутация в гене IDH1(R132H). При ПЦР в режиме реального времени определены низкие уровни экспрессии мРНК гена MGMT ( ∆ Ct=5,0) и гена ERCC1 ( ∆ Ct=3,1) (рис. 5 а, б), средние уровни экспрессии мРНК гена VEGF ( ∆ Ct= -0,4) и гена PDGFA ( ∆ Ct=0,2).
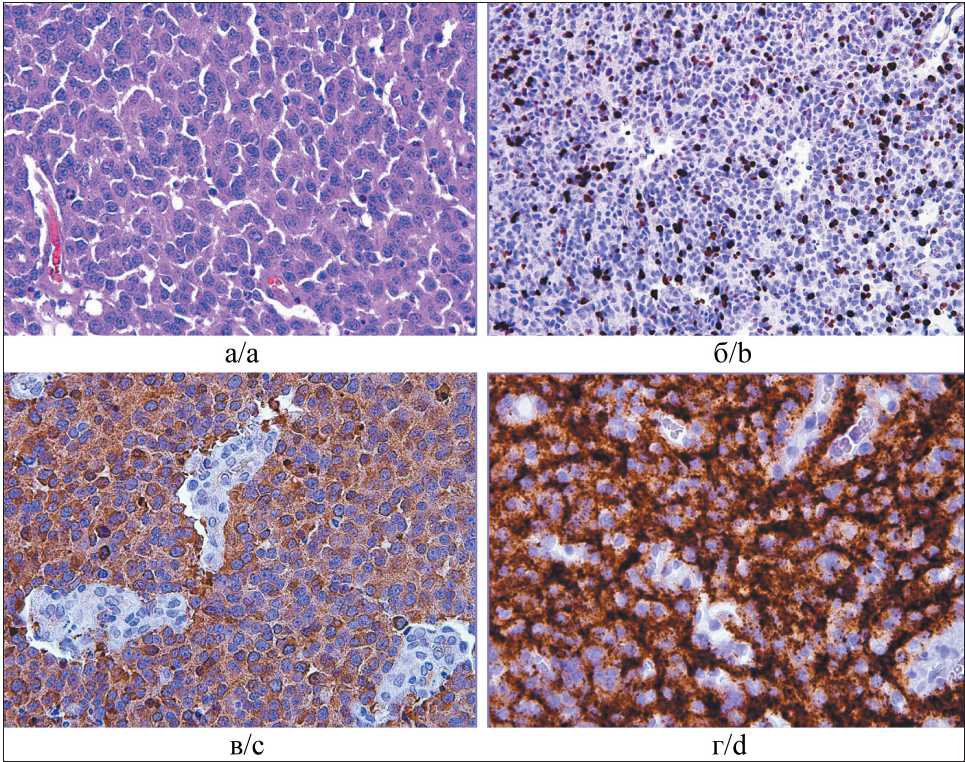
Рис. 1. Гистологическая картина ЦНС-НБ: а – картина мелкокруглоголубоклеточной опухоли, окраска гематоксилином и эозином; ×200; б – иммуногистохимия, ядерное окрашивание антителом Ki67 40 %; ×100; в – иммуногистохимия, окрашивание антителом NSE; ×200; г – иммуногистохимия, окрашивание антителом Syn; ×200
Fig. 1. Histopathological image of CNS neuroblastoma: a – image of a small-blue-cell tumor, stained with hematoxylin and eosin; ×200; b – immunohistochemistry, nuclear staining with antibody Ki67 40 %; ×100; c – immunohistochemistry, staining with antibody NSE; ×200; d – immunohistochemistry, staining with antibody Syn; ×200
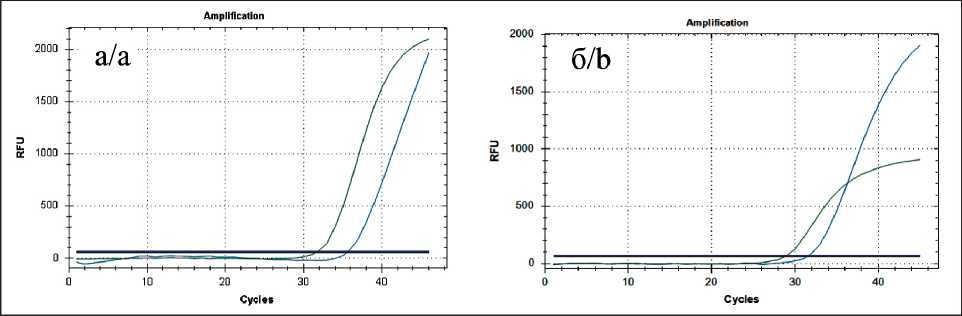
Рис. 2. Кривые ПЦР-амплификации: а – уровень экспрессии мРНК гена MGMT; б – уровень экспрессии мРНК гена ERCC1 Fig. 2. PCR amplification curves: a – the level mRNA expression gene MGMT;
b – the level mRNA expression gene ERCC1
Пациенту проведена ЛТ в СОД 60 Гр на область удаленной опухоли и 6 циклов ПХТ по схеме EP в адъювантном режиме. Достигнут частичный ответ на терапию (рис. 6 а–г). Безрецидивный период составил 25 мес 2 нед. После того как был диагностирован рецидив заболевания, контакт с пациентом и его родственниками утерян. Общая продолжительность жизни на тот момент была более 26 мес (2 года 2 мес).
Клинический случай 3
Пациент, 37 лет, 30.05.11 выполнено частичное удаление опухоли (более 50 %, но менее 80 % от начального объема опухоли). После иммуногистохимического исследования установлен диагноз – ЦНС-ГНБ (рис. 7 а–г). При ПЦР в режиме реального времени определен низкий уровень экспрессии мРНК гена MGMT (∆Ct=3,6) и низкий уровень экспрессии мРНК гена ERCC1 (∆Ct=2,8) (рис. 8 а, б).
Пациенту проведена ЛТ в СОД 60 Гр на область удаленной опухоли и 6 циклов монохимиотерапии темозоломидом в адъювантном режиме, достигнут частичный ответ (рис. 9 а–г). Безрецидивный интервал – 87 мес (7 лет 3 мес 1 нед). В марте
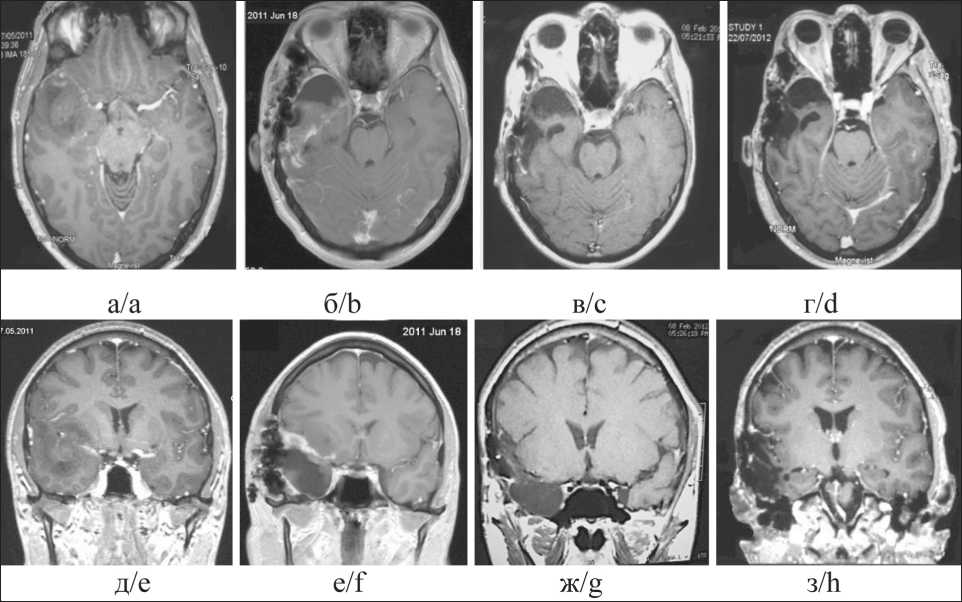
Рис. 3. ЦНС-НБ. МРТ с контрастным усилением: а, д – МРТ до операции, размеры опухоли 64×46×49 мм, без накопления контраста; б, е – МРТ после субтотальной циторедукции; в, ж – МРТ после 6 циклов ПХТ по схеме EP, полный ответ на терапию;
г, з – МРТ спустя 6 мес после ЛТ и ПХТ, полный ответ на терапию сохраняется
Fig. 3. CNS neuroblastoma. MRI with contrast enhancement: a, e – MRI before surgery, tumor size 64×46×49 mm without contrast accumulation; b, f – MRI after subtotal resection; c, g – MRI after 6 cycles of chemotherapy EP,complete response to therapy;
d, h – MRI 6 months after radiotherapy and chemotherapy, complete response to therapy is maintained
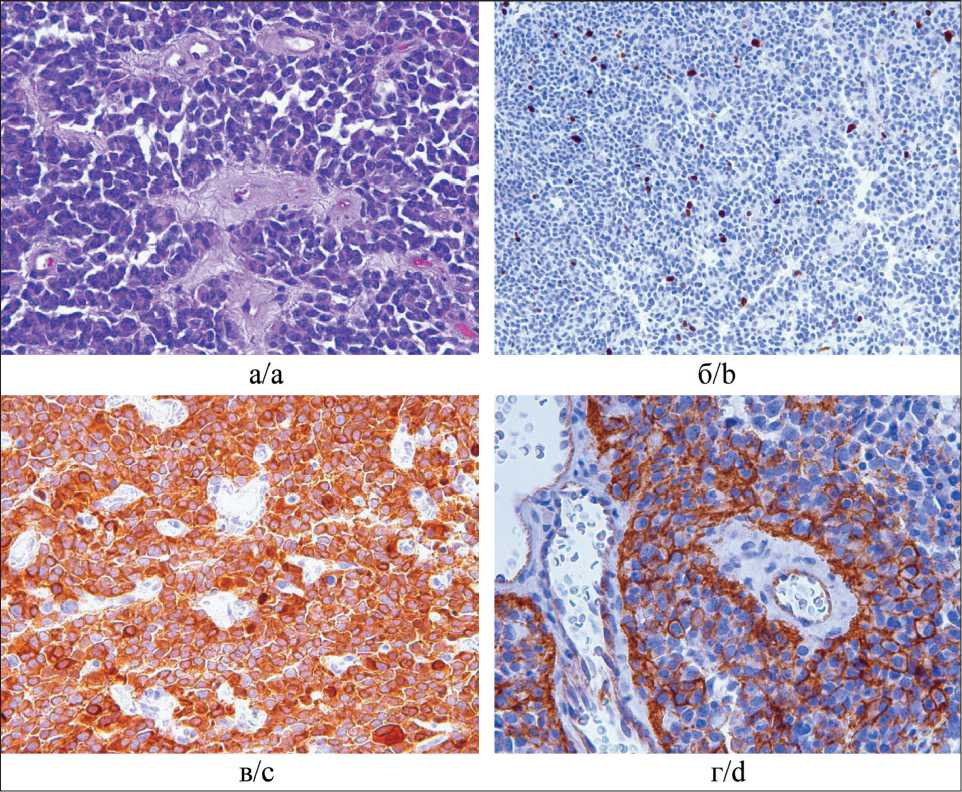
Рис. 4. Гистологическая картина ЦНС-НБ: а – картина мелкокруглоголубоклеточной опухоли c пролиферацией сосудов и эндотелия, окраска гематоксилином и эозином; ×200; б – иммуногистохимия, ядерное окрашивание антителом Ki67 около 10 %; ×100; в – иммуногистохимия, окрашивание антителом NSE; ×200; г – иммуногистохимия, окрашивание антителом CD99; ×200
Fig. 4. Histopathological image of CNS neuroblastoma: a – image of a small-blue-cell tumor with proliferation of vessels and endothelium, staining with hematoxylin and eosin; ×200; b – immunohistochemistry, nuclear staining with Ki67 antibody about 10 %; ×100; c – immunohistochemistry, staining with NSE antibody; ×200; d – immunohistochemistry, staining with CD99 antibody; ×200
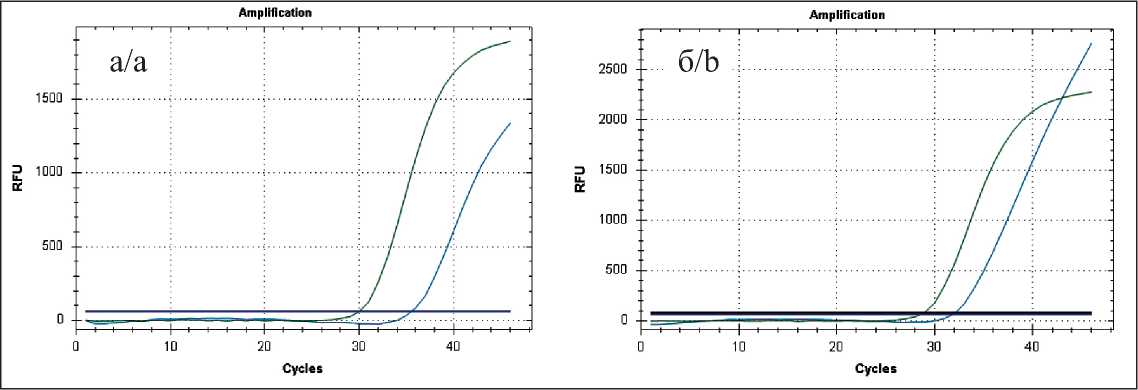
Рис. 5. Кривые ПЦР-амплификации: а – уровень экспрессии мРНК гена MGMT; б – уровень экспрессии мРНК гена ERCC1 Fig. 5. PCR amplification curves: a – the level mRNA expression gene MGMT;
b – the level mRNA expression gene ERCC1
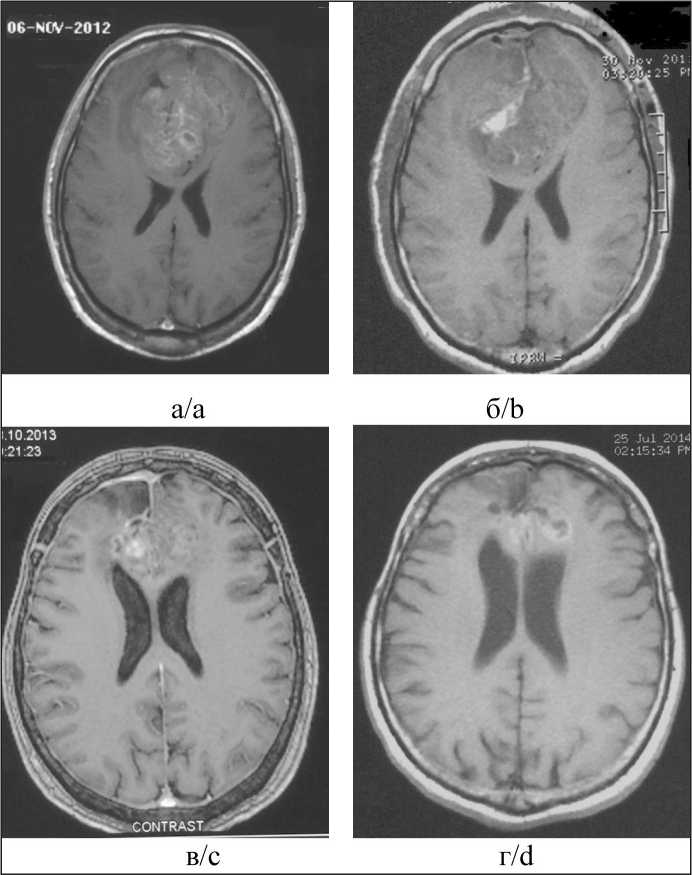
Рис. 6. ЦНС-НБ. МРТ с контрастным усилением: а – МРТ до операции, размеры опухоли 68×61×47 мм с накоплением контраста; б – МРТ после биопсии опухоли; в – МРТ после 6 циклов ПХТ по схеме EP, размеры опухоли 42×40×36 мм, положительный ответ на терапию; г – МРТ спустя 6 мес после ЛТ и ПХТ, размеры опухоли 34×30×26 мм, частичный ответ на терапию сохраняется
Fig. 6. CNS neuroblastoma. MRI with contrast enhancement: a – MRI before surgery, tumor size is 68×61×47 mm with the accumulation of contrast; b – MRI after tumor biopsy;
c – MRI after 6 cycles of chemotherapy according to the scheme EP, tumor size is 42×40×36 mm, positive response to therapy was registered; d – MRI 6 months after radiotherapy and chemotherapy, tumor size is 34×30×26 mm,partial response to therapy is maintained
2019 г. пациент повторно оперирован. Динамическое наблюдение продолжается, общая продолжительность жизни на данный момент – 93 мес 3 нед (7 лет 9 мес 3 нед).
Обсуждение
Число публикаций, посвященных диагностике и лечению больных старше 18 лет с нейробластомой и ганглионейробластомой ЦНС супратенториальной локализации, очень мало. Даже в самых крупных изданиях этой патологии уделено немного места [14–16], а в классификации ВОЗ (2016) данной нозологии посвящено всего 2 страницы. В популярной среди онкологов базе данных Рubmed обнаружено 14 работ, посвященных данной теме, однако в них молекулярно-генетические особенности этой группы эмбриональных опухолей ЦНС иногда рассматриваются наряду с другими нейроэпителиальными опухолями высокой степени злокачественности у пациентов всех возрастных групп [17]. Крупных исследований по изучению эффективности цитостатической терапии у взрослых больных с эмбриональными опухолями ЦНС супратенториальной локализации в зависимости от активности гена MGMT нет. Публикаций с наблюдениями из практики мало [4, 18, 19]. В одном из них есть описание случая, когда у пациентки с лептоменингеальной диссеминацией нейробластомы и проведенной высокодозной ХТ в первой линии терапии с пересадкой костного мозга после выявления метилирования промотора гена MGMT и назначения темозоломида (во II линии терапии) наблюдался полный ответ опухоли с продолжительностью безрецидивного периода более 24 мес [19]. В некоторых других случаях при терапии темозоломидом удалось добиться полного ответа при наличии как интракраниальных отсевов (мозжечок), так и экстракраниальных метастазов (легкие (?), твердая мозговая оболочка на уровне L4-L5, C6-C7), но ни метилирование промотора гена MGMT, ни его экспрессия в этих работах не определялись [20, 21].
В представленных нами случаях подтверждается зависимость ответа опухоли на химиотерапию
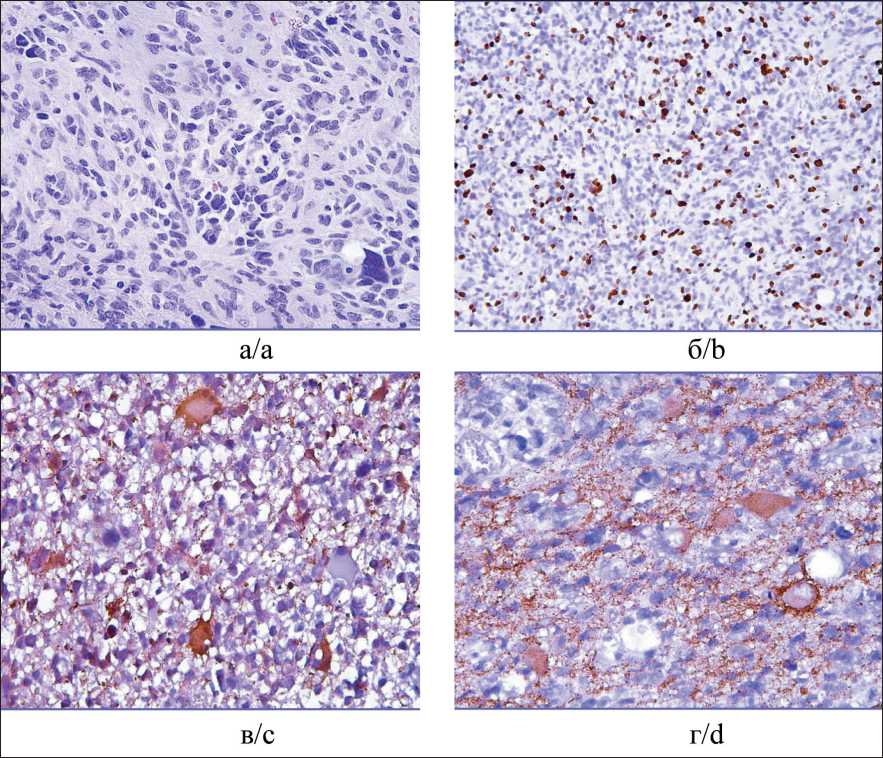
Рис. 7. Гистологическая картина ЦНС-ГНБ: а – мелкокруглоголубоклеточная опухоль с крупными ганглионарными клетками, окраска гематоксилином и эозином; ×200; б – иммуногистохимия, ядерное окрашивание антителом Ki67 40 %; ×100; в – иммуногистохимия, окрашивание антителом NSE с позитивной реакцией, в том числе и в анапластических ганглионарных клетках; ×200; г – иммуногистохимия, окрашивание антителом Syn с позитивной реакцией, в том числе и в анапластических ганглионарных клетках; ×200
Fig. 7. Histopathological image of CNS ganglioneuroblastoma: a – small-blue-cell tumor with large ganglion cells, staining with hematoxylin and eosin; ×200; b – immunohistochemistry, nuclear staining with antibody Ki-67 40 %; ×100; c – immunohistochemistry, staining by the NSE antibody positive reactions including anaplastic in the ganglion cells; ×200; d – immunohistochemistry, staining with antibody Syn positive reactions including anaplastic in the ganglion cells; ×200
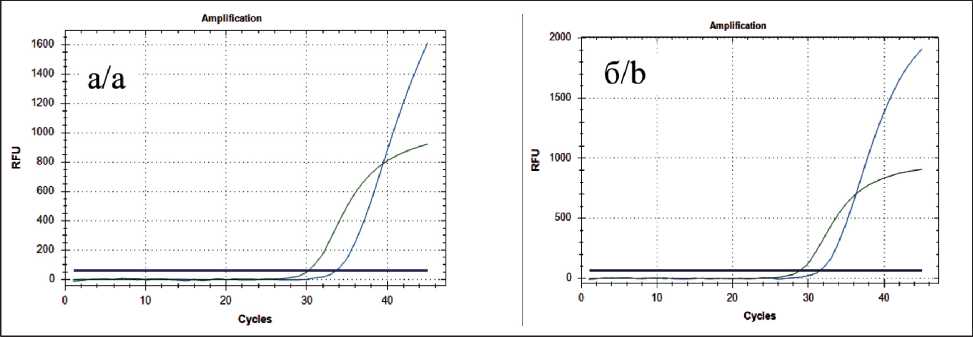
Рис. 8. Кривые ПЦР-амплификации: а – уровень экспрессии мРНК гена MGMT; б – уровень экспрессии мРНК гена ERCC1 Fig. 8. PCR amplification curves: a – the level mRNA expression gene MGMT;
b – the level mRNA expression gene ERCC1
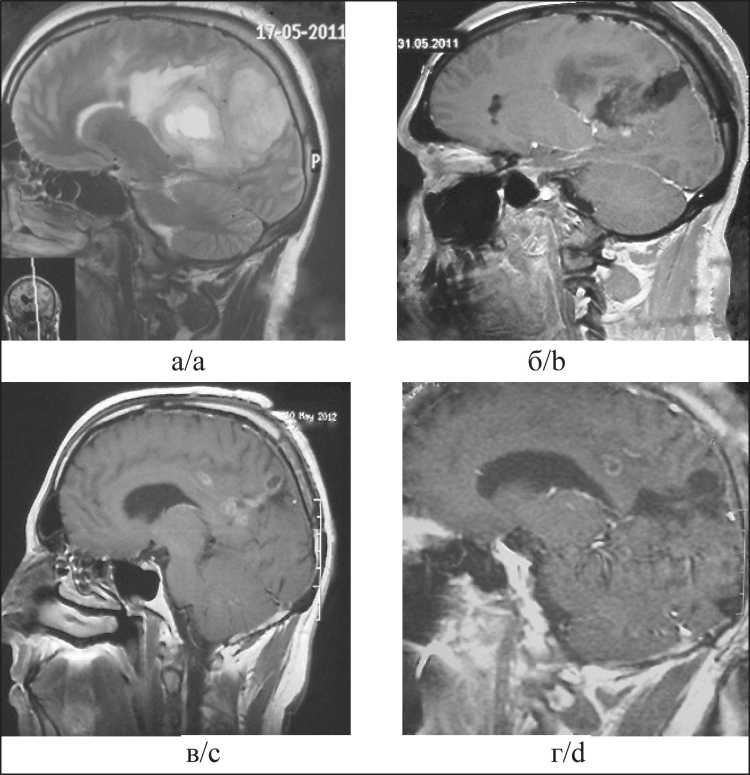
Рис. 9. ЦНС-НБ. МРТ с контрастным усилением: а – МРТ до операции, размеры опухоли 75×48×55 мм с фокальным накоплением контраста; б – МРТ после частичной циторедукции, размеры резидуальной опухоли 37×34×40 мм; в – МРТ после 6 циклов МХТ темозоломидом, размеры опухоли 32×18×16 мм, положительный ответ на терапию; г – МРТ спустя 6 мес после ЛТ и ХТ, размеры опухоли 10×12×12 мм, частичный ответ на терапию сохраняется Fig. 9. CNS ganglioneuroblastoma: MRI with contrast enhancement. a – MRI before surgery, tumor size is 75×48×55 mm with focal contrast accumulation; b – MRI after partial resection, residual tumor size is 37×34×40 mm; c – MRI after 6 cycles of chemotherapy by temozolomide, tumor size is 32×18×16 mm, positive response to therapy; d – MRI 6 months after radiotherapy and chemotherapy, tumor size is 10×12×12 mm, partial response to therapy is maintained темозоломидом и платиносодержащей схемой EP в зависимости от уровней экспрессии мРНК генов MGMT и ERCC1. Обращает на себя внимание вдвое больший безрецидивный период в первом случае по сравнению со вторым (51 мес vs 25 мес 2 нед). Пациенты были с одинаковым гистологическим диагнозом (нейробластома), низкими уровнями экспрессии мРНК генов MGMT и ERCC1, а также получили одинаковую ПХТ (схема EP, 6 циклов). Отличия в этих случаях заключались в разных уровнях экспрессии генов VEGF и PDGFA – низкие в первом случае и средние во втором. Кроме этого, во втором наблюдении при иммуногистохимическом исследовании более чем в 80 % опухолевых клеток была выявлена экспрессия гена P53, в первом – лишь в 20 %.
Стандартов лечения больных с нейробластомой и ганглионейробластомой супратенториальной
Список литературы Эмбриональные опухоли центральной нервной системы у взрослых. Три наблюдения из практики. Обзор литературы
- Ostrom Q.T., Gittleman H., Truitt G., Boscia A., Kruchko C., Barnholtz-Sloan J.S. CBTRUS Statistical Report: Primary Brain and Other Central Nervous System Tumors Diagnosed in the United States in 20112015. Neuro Oncol. 2018 Oct 1; 20(suppl_4): iv1iv86. https://doi.org/10.1093/neuonc/noy131.
- Gill P., Litzow M., Buckner J., Arndt C., Moynihan T., Christianson T., Ansell S., Galanis E. High-dose chemotherapy with autologous stem cell transplantation in adults with recurrent embryonal tumors of the central nervous system. Cancer. 2008 Apr 15; 112(8): 1805-11. https://doi.org/10.1002/cncr.23362.
- Nishihara H., Ozaki Y., Ito T., Yoshinaga T., Tabu K., Tanino M., Nagashima K., Tanaka S. A case of cerebral ganglioneuronal tumor in the parietal lobe of an adult. Brain Tumor Pathol. 2008; 25(1): 45-9. https://doi.org/10.1007/s10014-008-0229-5.
- Mellai M., Monzeglio O., Piazzi A., Caldera V., Annovazzi L., Cassoni P., Valente G., Cordera S., Mocellini C., Schiffer D. MGMT promoter hypermethylation and its associations with genetic alterations in a series of 350 brain tumors. J Neurooncol. 2012 May; 107(3): 617-31. https://doi.org/10.1007/s11060-011-0787-y.
- O'Reilly S.M., Newlands E.S., Glaser M.G., Brampton M., Rice-Edwards J.M., Illingworth R.D., Richards P.G., Kennard C., Colquhoun I.R., Lewis P. Temozolomide: a new oral cytotoxic chemotherapeutic agent with promising activity against primary brain tumours. Eur J Cancer. 1993; 29A(7): 940-2. https://doi.org/10.1016/s0959-8049(05)80198-4.
- Durando X., Thivat E., Gilliot O., Irthum B., Verrelle P., Vincent C., Bay J.O. Temozolomide treatment of an adult with a relapsing medulloblastoma. Cancer Invest. 2007 Sep; 25(6): 470-5. https://doi.org/10.1080/07357900701518164.
- Poelen J., Bernsen H.J., Prick M.J. Metastatic medulloblastoma in an adult; treatment with temozolomide. Acta Neurol Belg. 2007 Jun; 107(2): 51-4.
- Gill P., Litzow M., Buckner J., Arndt C., Moynihan T., Christianson T., Ansell S., Galanis E. High-dose chemotherapy with autologous stem cell transplantation in adults with recurrent embryonal tumors of the central nervous system. Cancer. 2008 Apr 15; 112(8): 1805-11. https://doi.org/10.1002/cncr.23362.
- Metzger R., Leichman C.G., Danenberg K.D., Danenberg P.V., Lenz H.J., Hayashi K., Groshen S., Salonga D., Cohen H., Laine L., Crookes P., Silberman H., Baranda J., Konda B., Leichman L. ERCC1 mRNA levels complement thymidylate synthase mRNA levels in predicting response and survival for gastric cancer patients receiving combination cisplatin and fluorouracil chemotherapy. J Clin Oncol. 1998 Jan; 16(1): 309-16. https://doi.org/10.1200/JCO.1998.16.1.309.
- Rosell R., Cobo M., Isla D., Sanchez J.M., Taron M., Altavilla G., Santarpia M., Moran T., Catot S., Etxaniz O. Applications of genomics in NSCLC. Lung Cancer. 2005 Dec; 50 Suppl 2: S33-40.
- Matsubara J., Nishina T., Yamada Y., Moriwaki T., Shimoda T., Kajiwara T., Nakajima T.E., Kato K., Hamaguchi T., Shimada Y., Okayama Y., Oka T., Shirao K. Impacts of excision repair cross-complementing gene 1 (ERCC1), dihydropyrimidine dehydrogenase, and epidermal growth factor receptor on the outcomes of patients with advanced gastric cancer. Br J Cancer. 2008 Feb 26; 98(4): 832-9. https://doi.org/10.1038/sj.bjc.6604211.
- Liu Z.G., Chen H.Y., Cheng J.J., Chen Z.P., Li X.N., Xia Y.F. Relationship between methylation status of ERCC1 promoter and radiosensitivity in glioma cell lines. Cell Biol Int. 2009; 33(10): 1111-7. https://doi.org/10.1016/j.cellbi.2009.07.004.
- Chen H.Y., Shao C.J., Chen F.R., Kwan A.L., Chen Z.P. Role of ERCC1 promoter hypermethylation in drug resistance to cisplatin in human gliomas. Int J Cancer. 2010 Apr 15; 126(8): 1944-1954. https://doi.org/10.1002/ijc.24772.
- Matsko D.E. Neirokhirurgicheskaya patologiya. SPb., 2015. 424 s.
- Ulitina A.Yu., Matsko D.E., Olyushin V.E. Neiroepitelial'nye opukholi golovnogo mozga. SPb., 2014. 446 s.
- Burger P.C., Scheithauer B.W. Tumors of the Central Nervous System. Washington: American Registry of Pathology, 2007. 596 p.
- Sturm D., Orr B.A., Toprak U.H., Hovestadt V., Jones D.T.W., Capper D., Sill M., Buchhalter I., Northcott P.A., Leis I., Ryzhova M., Koelsche C., Pfaff E., Allen S.J., Balasubramanian G., Worst B.C., Pajtler K.W., Brabetz S., Johann P.D., Sahm F., Reimand J., Mackay A., Carvalho D.M., Remke M., Phillips J.J., Perry A., Cowdrey C., Drissi R., Fouladi M., Giangaspero F., Łastowska M., Grajkowska W, Scheurlen W., Pietsch T., Hagel C., Gojo J., Lötsch D., Berger W., Slavc I., Haberler C., Jouvet A., Holm S., Hofer S., Prinz M., Keohane C., Fried I., Mawrin C., Scheie D., Mobley B.C., Schniederjan M.J., Santi M., Buccoliero A.M., Dahiya S., Kramm C.M., von Bueren A.O., von Hoff K., Rutkowski S., Herold-Mende C., Frühwald M.C., Milde T., Hasselblatt M., Wesseling P., Rößler J., Schüller U., Ebinger M., Schittenhelm J., Frank S., Grobholz R., Vajtai I., Hans V., Schneppenheim R., Zitterbart K., Collins V.P., Aronica E., Varlet P., Puget S., Dufour C., Grill J., Figarella-Branger D., Wolter M., Schuhmann M.U., Shalaby T., Grotzer M., van Meter T., Monoranu C.M., Felsberg J., Reifenberger G., Snuderl M., Forrester L.A., Koster J., Versteeg R., Volckmann R., van Sluis P., Wolf S., Mikkelsen T., Gajjar A. Aldape K., Moore A.S., Taylor M.D., Jones C., Jabado N., Karajannis M.A., Eils R., Schlesner M., Lichter P., von Deimling A., Pfister S.M., Ellison D.W., Korshunov A., Kool M. New Brain Tumor Entities Emerge from Molecular Classification of CNS-PNETs. Cell. 2016; 164(5): 1060-1072. https://doi.org/10.1016/j.cell.2016.01.015.
- Oh J., Bilbao J.M., Tsao M.N., Fazl M., Guiot M.C., Del Maestro R.F., Perry J.R. Recurrent PNET with MGMT methylation responds to temozolomide. Can J Neurol Sci. 2009 Sep; 36(5): 654-7. https://doi.org/10.1017/s0317167100008209.
- Yamada A., Moritake H., Shimonodan H., Yokogami K., Takeshima H., Marutsuka K., Nunoi H. Efficacy of temozolomide in a central nervous system relapse of neuroblastoma with O 6 -methylguanine methyltransferase (MGMT) promoter methylation. J Pediatr Hematol Oncol. 2013 Jan; 35(1): e38-41. https://doi.org/10.1097/MPH.0b013e318270a361.
- Rao R.D., Robins H.I., Mehta M.P. Late recurrence of a primitive neuro-ectodermal tumor. Oncology. 2001; 61(3): 189-91. https://doi.org/10.1159/000055373.
- Terheggen F., Troost D., Majoie C.B., Leenstra S., Richel D.J. Local recurrence and distant metastasis of supratentorial primitive neuroectodermal tumor in an adult patient successfully treated with intensive induction chemotherapy and maintenance temozolomide. J Neurooncol. 2007 Mar; 82(1): 113-6. https://doi.org/10.1007/s11060-006-9249-3.
- Beckmann P.J., Larson J.D., Larsson A.T., Ostergaard J.P., Wagner S., Rahrmann E.P., Shamsan G.A., Otto G.M., Williams R.L., Wang J., Lee C., Tschida B.R., Das P., Dubuc A.M., Moriarity B.S., Picard D., Wu X., Rodriguez F.J., Rosemarie Q., Krebs R.D., Molan A.M., Demer A.M., Frees M.M., Rizzardi A.E., Schmechel S.C., Eberhart C.G., Jenkins R.B., Wechsler-Reya R.J., Odde D.J., Huang A., Taylor M.D., Sarver A.L., Largaespada D.A. Sleeping Beauty Insertional Mutagenesis Reveals Important Genetic Drivers of Central Nervous System Embryonal Tumors. Cancer Res. 2019 Mar 1; 79(5): 905-917. https://doi.org/10.1158/0008-5472.CAN-18-1261.


