Эмпирические модели прогнозирования второй метахронной опухоли после химиолучевой терапии первой в диспансеризации онкологических больных
Автор: Шунько Е.Л., Важенин А.В., Шаназаров Н.А.
Рубрика: Научные статьи
Статья в выпуске: 1 т.31, 2022 года.
Бесплатный доступ
Проведена оценка возможности применения эмпирических моделей прогнозирования второй метахронной опухоли после химиолучевой терапии первой для повышения эффективности диспансеризации онкологических больных. Исследование является ретроспективным и проведено по архивным данным Челябинского областного клинического центра онкологии и ядерной медицины (ГБУЗ «ЧОКЦО и ЯМ», Челябинск). Объектами исследования являются истории болезни, медицинские и лучевые карты, электронные базы данных по химиолучевому лечению онкологических больных, выгрузки из базы данных по лечению больных с первично-множественными злокачественными новообразованиями за период 1990-2015 гг. Экспериментальную группу составили 168 пациентов после химиолучевой терапии (ХЛТ) и контрольную группу - 300 больных после хирургического лечения первой опухоли. Модели прогнозирования второй метахронной опухоли построены с помощью модуля «Анализ выживаемости STATISTICA» («Statistica Version 10.0.0.0») с применением многофакторного анализа (модель Кокса) с учётом всех осложнений, приведших к изменениям в лечении (схема, интервал между курсами). Соответствие эмпирической модели данным исследования проверялось по критерию хи-квадрат (c2). В среднем в экспериментальной группе больные получили 2,83 курса химиотерапии и 1,15 курса лучевой терапии, длительность химиотерапии и лучевой терапии составила соответственно 3,37 и 1,87 мес. при длительности перерыва в лечении 2,33 и 1,30 мес. соответственно. Осложнения при проведении ХЛТ отмечались у 47,6% (80 больных). Построенные нами эмпирические модели прогнозирования второй метахронной опухоли после химиолучевой терапии первой показали наиболее высокую вероятность появления второй метахронной опухоли в пяти временных интервалах: 3804,09-4564,91 дней (10,42-12,51 года), 6847,36-7608,18 дней (18,76-20,84 лет), 7608,18-8369,00 дней (20,84-22,93 лет) и 3043,27-3804,09 дней (8,34-10,42 года). Знание о сроках возникновения второй метахронной опухоли после химиолучевой терапии первой позволяет более точно составлять и при необходимости корректировать план диспансерного наблюдения индивидуально для каждого онкологического больного.
Злокачественные новообразования, полинеоплазии, первично-множественные опухоли, метахронные злокачественные опухоли, химиолучевое лечение, модели прогнозирования риска
Короткий адрес: https://sciup.org/170194030
IDR: 170194030 | УДК: 616-006-615.849.1/28:616-084-037
Текст научной статьи Эмпирические модели прогнозирования второй метахронной опухоли после химиолучевой терапии первой в диспансеризации онкологических больных
В настоящее время риск развития первично-множественных злокачественных новообразований (ПМ ЗНО) представляет собой серьёзную проблему для лучевой и химиотерапии, в частности, для таких категорий онкологических больных, как дети и взрослые моложе 65 лет. Увеличение числа случаев ПМ ЗНО у пациентов после лучевой терапии (ЛТ) и химиотерапии (ХТ) первой опухоли стало главной проблемой онкологии в последние два десятилетия во всём мире и достаточно широко освещается в современной литературе [1-5]. В России контингент пациентов с ПМ ЗНО на конец 2018 г. составил 204792 (5,4%), в 2017 г. – 191095 (5,3%) от общего числа
Шунько Е.Л.* – доцент, к.м.н., ФГБОУ ВО Тюменский ГМУ Минздрава России. Важенин А.В. – зав. кафедрой, д.м.н., проф., академик РАН, ФГБОУ ВО ЮУГМУ Минздрава России. Шаназаров Н.А. – зам. директора, д.м.н., проф., БМЦ Управления делами Президента РК.
пациентов, состоящих под диспансерным наблюдением. В Челябинской области – 6128 (7,1%), в 2017 г. – 5591 (6,4%) [6, 7].
Несколько крупных исследований свидетельствуют о заметном увеличении количества ПМ ЗНО в результате последовательного применения ЛТ и ХТ или их сочетания [8], уровень риска возрастал со временем от 5 до 8% через пять лет и далее в течение 25 лет после лечения [9]. При исследовании влияния химиолучевой терапии (ХЛТ) обнаружили, что при одновременном применении ЛТ и ХТ наблюдается более высокий риск индуцированных лечением ПМ ЗНО, чем при их последовательном применении [10].
Сегодня не вызывает сомнений, что онкологические больные после химиолучевого лечения являются группой риска возникновения полинеоплазий, и только правильная организация динамического наблюдения позволит провести наиболее раннюю диагностику опухолей второй локализации и выполнить органосохраняющее лечение [5, 8, 9, 11]. При этом одним из возможных инструментов прогнозирования метахронных полинеоплазий являются эмпирические модели Кокса, которые позволяют более точно определить возможные интервалы времени для развития второй метахронной опухоли после ХЛТ первой, что позволяет скорректировать сроки диспансерного наблюдения для данной категории онкологических больных.
Цель работы – оценить возможность применения эмпирических моделей прогнозирования второй метахронной опухоли после химиолучевой терапии первой для повышения эффективности диспансеризации онкологических больных.
Материалы и методы
Исследование является ретроспективным и проведено по архивным данным Челябинского областного клинического центра онкологии и ядерной медицины (ГБУЗ «ЧОКЦО и ЯМ»). Изучены истории болезни, медицинские и лучевые карты 468 больных с метахронными ПМ ЗНО. Экспериментальную группу составили 168 пациентов после ХЛТ и контрольную группу – 300 больных после хирургического лечения первой опухоли, размер выборки предварительно не рассчитывался.
Этическая экспертиза исследования была проведена Этическим комитетом ГБОУ ВПО «ЧелГМА Минздравсоцразвития России» (Протокол № 1 от 25.01.2012 г.) и ГБОУ ВПО «ЮУГМУ Минздрава России» (протокол № 5 от 25.05.2016 г.) – исследование разрешено как не противоречащее принципам медицинской этики.
Для классификации ПМ ЗНО по последовательности развития опухолей (метахронные, синхронные, метахронно-синхронные, синхронно-метахронные) использовали классификации С.М. Слинчака (1968), Д.М. Абдурасулова и К.Е. Никишина (1968), И.Ф. Зисмана и Г.Д. Кириченко (1978). Для классификации ПМ ЗНО по локализации применяли классификацию Д.М. Абдурасу-лова и К.Е. Никишина (1968). В соответствии с рекомендациями, представленными в литературе (Петров Н.Н. 1947, 1961; Важенин А.В. и соавт., 2000), критерием метахронности считали интервал между диагностируемыми опухолями не менее 12 мес. и не менее 6 мес. для рака in situ .
Модели прогнозирования второй метахронной опухоли построены с помощью модуля «Анализ выживаемости STATISTICA» (пакет прикладных программ «Statistica Version 10.0.0.0» для анализа данных на базе персонального компьютера) с применением многофакторного анализа (модель Кокса) с учётом всех осложнений, приведших к изменениям в лечении (схема, интервал между курсами). Соответствие эмпирической модели данным исследования проверялось по критерию хи-квадрат (χ2).
Результаты и обсуждение
При изучении закономерностей развития ПМ ЗНО мы провели оценку длительности периодов от появления и первого дня лечения первой опухоли до появления второй метахронной опухоли в исследуемых группах (табл. 1).
Таблица 1
Интервалы времени от появления и начала терапии первой опухоли до появления второй метахронной опухоли
|
Показатели |
Интервал |
Группы больных по виду лечения первой опухоли |
|
|
экспериментальная группа (химиолучевая терапия) n=168 |
контрольная группа (хирургическое лечение) n=300 |
||
|
Интервал от появления первой опухоли до появления второй опухоли |
мес. (95% ДИ) лет (95% ДИ) |
59,02 (45,17-72,87) 4,92 (3,76-6,07) |
81,67 (73,70-89,63) 6,81 (6,14-7,47) |
|
Размах интервала в группе |
мес. лет |
12-207 1-17,25 |
12-377 1-31,42 |
|
Интервал от начала терапии первой опухоли до появления второй опухоли |
мес. (95% ДИ) лет (95% ДИ) |
55,88 (42,70-69,04) 4,66 (3,56-5,75) |
78,51 (70,63-86,39) 6,54 (5,89-7,20) |
|
Размах интервала в группе |
мес. лет |
1-207 0,08-17,25 |
7-376 0,58-31,33 |
В экспериментальной группе интервал времени от появления первой опухоли до появления второй метахронной опухоли составил в среднем 59,02 мес. (95% ДИ 45,17-72,87), интервал времени от начала ХЛТ первой опухоли до появления второй опухоли составил в среднем 55,88 мес. (95% ДИ 42,70-69,04). Период от появления первой до появления второй метахронной опухоли в контрольной группе составил в среднем 81,67 мес. (95% ДИ 73,70-89,63), от оперативного лечения до появления второй опухоли – в среднем 78,51 мес. (95% ДИ 70,63-86,39) (табл. 1). Сочетания опухолей после химиолучевой терапии показаны в табл. 2.
Таблица 2
Сочетания метахронных опухолей после химиолучевого лечения
|
Локализация второй метахронной опухоли |
||||||||||
|
Локализация 1 опухоли |
Количество |
Всего |
ЗНО губы, полости рта и глотки (С00-С14) |
ЗНО женских половых органов (С51-С58) |
ЗНО кожи (С43-С44) |
ЗНО лимфоидной, кроветворной и родственных им тканей (С81-С96) |
ЗНО молочной железы (С50) |
ЗНО мочевых путей (С64-С68) |
ЗНО органов дыхания и грудной клетки (С30-С39) |
ЗНО органов пищеварения (С15-С26) |
|
ЗНО губы, полости |
абс. |
16 |
4 |
0 |
0 |
4 |
0 |
4 |
4 |
0 |
|
рта и глотки |
ож.* |
16,0 |
0,4 |
0,8 |
2,8 |
0,8 |
7,2 |
1,2 |
0,8 |
2,4 |
|
(С00-С14) |
% |
9,5 |
2,4 |
0,0 |
0,0 |
2,4 |
0,0 |
2,4 |
2,4 |
0,0 |
|
ЗНО женских |
абс. |
20 |
0 |
0 |
8 |
0 |
4 |
0 |
0 |
8 |
|
половых органов |
ож.* |
20,0 |
0,4 |
0,8 |
3,2 |
0,8 |
9,2 |
1,6 |
0,8 |
2,8 |
|
(С51-С58) |
% |
11,9 |
0,0 |
0,0 |
4,8 |
0,0 |
2,4 |
0,0 |
0,0 |
4,8 |
|
ЗНО молочной железы (С50) |
абс. ож.* % |
104 104,0 61,9 |
0 2,4 0,0 |
8 4,8 4,8 |
16 17,2 9,5 |
4 4,8 2,4 |
68 47,2 40,5 |
4 7,6 2,4 |
0 4,8 0,0 |
4 14,8 2,4 |
|
ЗНО органов |
абс. |
12 |
0 |
0 |
4 |
0 |
0 |
0 |
4 |
4 |
|
дыхания и грудной |
ож.* |
12,0 |
0,4 |
0,4 |
2,0 |
0,4 |
5,6 |
0,8 |
0,4 |
1,6 |
|
клетки (С30-С39) |
% |
7,1 |
0,0 |
0,0 |
2,4 |
0,0 |
0,0 |
0,0 |
2,4 |
2,4 |
|
ЗНО органов |
абс. |
16 |
0 |
0 |
0 |
0 |
4 |
4 |
0 |
8 |
|
пищеварения |
ож.* |
16,0 |
0,4 |
0,8 |
2,8 |
0,8 |
7,2 |
1,2 |
0,8 |
2,4 |
|
(С15-С26) |
% |
9,5 |
0,0 |
0,0 |
0,0 |
0,0 |
2,4 |
2,4 |
0,0 |
4,8 |
|
абс. |
168 |
4 |
8 |
28 |
8 |
76 |
12 |
8 |
24 |
|
|
Всего |
ож.* |
168,0 |
4,0 |
8,0 |
28,0 |
8,0 |
76,0 |
12,0 |
8,0 |
24,0 |
|
% |
100,0 |
2,4 |
4,8 |
16,7 |
4,8 |
45,2 |
7,1 |
4,8 |
14,3 |
|
– ожидаемое количество.
Самым распространённым расположением для первого новообразования являлась молочная железа – 61,9%, женские половые органы – 11,9%, губа, полость рта и глотка, органы пищеварения – по 9,5%, органы дыхания – 7,1%; для второго – молочная железа – 45,2%, кожа – 16,7%, органы пищеварения – 14,3%, мочевые пути – 7,1%. Сочетания полинеоплазий после ХЛТ подробно показано в табл. 2 и подтверждено статистически значимыми различиями по критериям χ2 и LR (χ2=48,837; р=0,009 и LR=42,644; р = 0,038).
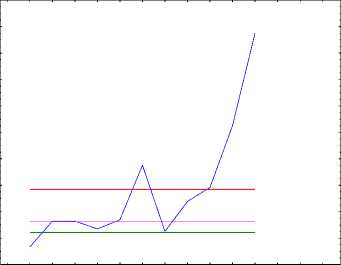
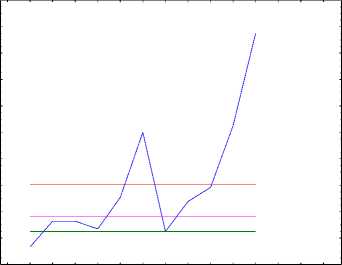
Мы провели анализ влияния химиотерапии и лучевой терапии раздельно для более полной оценки вклада каждого метода в составе химиолучевой терапии на сроки возникновения второй метахронной опухоли (рис. 1).
0,0010
0,0009
0,0008
0,0007
0,0006
I 0,0005
0,0004
0,0003
0,0002
0,0001
0,0000
LS Estimates of Hazard Function
Model: Exponential
Note: Weights: 1=1., 2=1./V, 3=N(I)*H(I)
0,00000 1521,64 3043,27 4564,91 6086,55 7608,18 9129,82
Interval Start
Observed
Weight 1
Weight 2
Weight 3
0,0010
0,0009
0,0008
0,0007
0,0006
I 0,0005
0,0004
0,0003
0,0002
0,0001
0,0000
LS Estimates of Hazard Function Model: Exponential
Note: Weights: 1=1., 2=1./V, 3=N(I)*H(I)
0,00000 1521,64 3043,27 4564,91 6086,55 7608,18 9129,82
Interval Start
Observed
Weight 1
Weight 2
Weight 3
Химиотерапия предшествовала лучевой терапии Лучевая терапия предшествовала химиотерапии
Рис. 1. Модель Кокса «Оценка функции мгновенного риска возникновения второй метахронной опухоли после химиолучевой терапии первой опухоли» (по оси ординат – риск, по оси абсцисс – дни).
Для построения модели риска появления второй метахронной опухоли учитывались все «значимые» осложнения лечения, которые приводили к удлинению интервала между курсами или замене химиопрепарата, или изменению схемы лечения (учитывали степень лейкопении, тромбоцитопении, эритроцитопении, длительность интервала между курсами, лучевые осложнения). Количество больных с осложнениями при проведении ХЛТ первой опухоли составило 47,6% (80 больных). В среднем в экспериментальной группе больные получили 2,83 курса ХТ и 1,15 курса ЛТ, длительность ХТ и ЛТ составила соответственно 3,37 и 1,87 мес. при длительности перерыва в лечении 2,33 и 1,30 мес. соответственно.
На предварительном этапе построения эмпирических моделей было определено, что теоретические распределения, полученные тремя различными методами оценивания (методом наименьших квадратов и двумя методами взвешенных наименьших квадратов – Weight 1, Weight 2, Weight 3), в двух наборах теоретических данных значимо не расходятся с экспериментальными данными как для ХТ (χ2=13,70009 и р=0,187176; χ2=4,42143 и р=0,926326; χ2=4,21267 и р=0,937231 соответственно для набора данных Weight 1, Weight 2, Weight 3), так и для ЛТ (χ2=16,01527 и р=0,099253; χ2=7,81202 и р=0,647190; χ2=6,99130 и р=0,726256 соответственно для набора данных Weight 1, Weight 2, Weight 3).
Эмпирическая модель «Оценка функции мгновенного риска» (Модель Кокса) для второй метахронной опухоли после химиолучевой терапии первой представлена на рис. 1.
Эмпирическая модель «Оценка функции мгновенного риска» (Модель Кокса) для второй метахронной опухоли после ХЛТ первой опухоли показала, что отношение величин риска (hazard ratio, HR) в экспериментальной и контрольной группах не превышает 0,000875, что составляет 0,087% шанса развития второй метахронной опухоли после ХЛТ по сравнению с пациентами после хирургического лечения первой опухоли. При этом необходимо отметить для пациентов после ХЛТ несколько периодов выживания с наиболее высоким риском для развития второй метахронной опухоли: 3804,09-4564,91 дней (10,42-12,51 года; для химиотерапии HR=2,14; шанс развития второй метахронной опухоли составляет 68,2%; для лучевой терапии HR=2,00; шанс 66,7%); 6847,36-7608,18 дней (18,7620,84 лет; для химиотерапии HR=1,75; шанс 63,6%; для лучевой терапии HR=1,91; шанс 65,6%), 7608,18-8369,00 дней (20,84=22,93 лет; для химиотерапии HR=1,71; шанс 63,1%; для лучевой терапии HR=1,67; шанс 62,5%). Выявлены ещё два интервала высокого риска: 3043,27-3804,09 дней (8,34-10,42 года) и 5325,73-6086,55 (14,59-16,67 лет), для ЛТ соответственно HR=1,92; шанс 65,9% и HR=2,00; шанс 66,70%; для ХТ за аналогичный интервал времени HR=1,35; шанс 57,45% и HR=1,56; шанс 60,94% соответственно.
Помимо вышеизложенного, при анализе рис. 1 необходимо отметить, что локальные максимумы риска возникновения второй метахронной опухоли, как при проведении ХТ, предшествующей ЛТ в составе ХЛТ, так и при проведении ЛТ, предшествующей ХТ в составе ХЛТ, практически совпадают по времени. Такое достаточно близкое совпадение по времени локальных максимумов риска возникновения второй метахронной опухоли было нами прогнозируемо и графически показано, так как у всех пациентов экспериментальной группы применялась ХЛТ первой опухоли, различие было только в первоочередности проведения ХТ или ЛТ (рис. 1).
Экспоненциальная модель риска возникновения второй метахронной опухоли после ХЛТ первой опухоли «Оценка плотности вероятности» представлена на рис. 2.
LS Estimates of Probability Density LS Estimates of Probability Density
Model: Exponential Model: Exponential
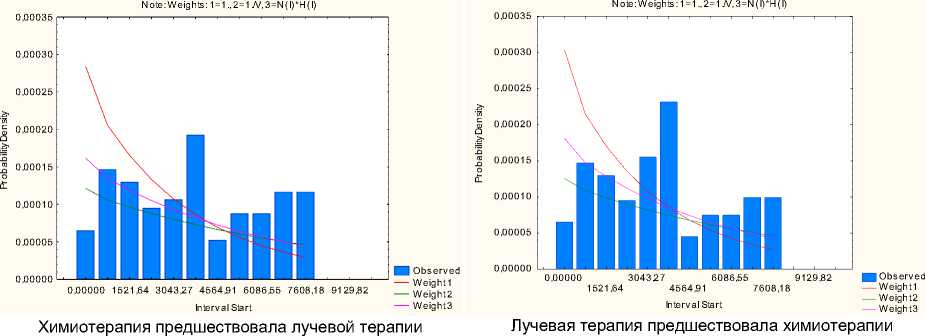
Рис. 2. Экспоненциальная модель «Оценка плотности вероятности возникновения второй метахронной опухоли после химиолучевой терапии первой опухоли» (по оси ординат – плотность вероятности, по оси абсцисс – дни).
Экспоненциальная модель «Оценка плотности вероятности» для второй метахронной опухоли после ХЛТ первой опухоли показала, что наиболее высокая плотность вероятности (0,000192 и 0,000230 соответственно при ХТ и ЛТ) для второй метахронной опухоли соответствует 4564,91 дней (12,51 лет) от начала ХЛТ. Достаточно высокие показатели плотности: 0,000146 и 0,000148; по 0,00013 для ХТ и ЛТ отмечаются соответственно и для временных отметок 1521,64 дней (4,17 года), 2282,45 дней (6,25 лет) от начала ХЛТ. На отметках времени 6086,55 и 6847,36 дней (16,67 и 18,76 лет), а также 7608,18 и 8369,00 дней (20,84 и 22,93 лет) плотность вероятности практически одинакова и составляет по 0,00009 и 0,00012 для ХТ и 0,000075 и 0,00010 для ЛТ соответственно. Необходимо указать и отметку времени 3804,09 дней (10,42 года) – плотность вероятности составляет 0,000155 для ЛТ, хотя для ХТ – всего 0,000108.
При этом необходимо отметить, что уже к 760,82 дням (2,08 года) от начала лечения плотность вероятности (0,000055 и 0,000062 – соответственно для ХТ и ЛТ) и риск (по 0,000075 для ХТ и ЛТ) возникновения второй метахронной опухоли повышаются, и в последующем не снижаются ниже 54,6% и 62,5% шанса возникновения второй метахронной опухоли соответственно для ХТ и ЛТ.
Предлагаемые нами эмпирические модели прогнозирования второй метахронной опухоли после ХЛТ первой показали наиболее высокую вероятность второй метахронной опухоли в пяти временных интервалах: 3804,09-4564,91 дней (10,42-12,51 года; для химиотерапии HR=2,14; риск 68,2%; для лучевой терапии HR=2,00; риск 66,7%), 6847,36-7608,18 дней (18,76-20,84 лет; для химиотерапии HR=1,75; риск 63,6%; для лучевой терапии HR=1,91; риск 65,6%), 7608,18-8369,00 дней (20,84-22,93 лет; для химиотерапии HR=1,71; риск 63,1%; для лучевой терапии HR=1,67; риск 62,5%); 3043,27-3804,09 дней (8,34-10,42 года; для лучевой терапии HR=1,92; шанс 65,9%; для химиотерапии HR=1,35; риск 57,45%) и 5325,73-6086,55 (14,59-16,67 лет; для лучевой терапии HR=2,00; риск 66,70%; для химиотерапии HR=1,56; риск 60,94%).
В настоящее время лучевая и химиотерапия широко и эффективно применяются в лечении злокачественных новообразований как самостоятельно, так и в комбинации друг с другом, несмотря на увеличение количества осложнений и риск развития новой злокачественной опухоли или лейкоза [1-4, 12]. В связи с этим уже сегодня возникла острая необходимость уменьшения риска развития индуцированных лечением опухолей и поиск решения проблемы выбора адекватных подходов к лечению и диспансерному наблюдению данной категории онкологических больных. За последние годы в зарубежной литературе представлено несколько эмпирических многомерных моделей регрессии Кокса, но все они выполнены для одной локализации первой опухоли [13-15] и позволяют предположить только возможную локализацию второй метахронной опухоли, но не содержат информации о примерных сроках возникновения второй опухоли. Кроме того, по сравнению с нашим исследованием, ни одна из вышеуказанных моделей не построена для онкологических больных после химиолучевой терапии первой опухоли.
Заключение
В нашем исследовании впервые построены эмпирическая модель «Оценка функции мгновенного риска» (Модель Кокса) и экспоненциальная модель «Оценка плотности вероятности» для второй метахронной опухоли после химиолучевой терапии первой опухоли. Разработаны поправки в сроки диспансерного наблюдения больных с первично-множественными метахронными злокачественными новообразованиями после химиолучевой терапии первой опухоли. Знание о сроках возникновения второй метахронной опухоли после химиолучевой терапии первой позволяет более точно составлять и при необходимости корректировать план диспансерного наблюдения индивидуально для каждого онкологического больного после химиолучевого лечения первой опухоли.
Список литературы Эмпирические модели прогнозирования второй метахронной опухоли после химиолучевой терапии первой в диспансеризации онкологических больных
- Важенин А.В., Бехтерева Е.И., Бехтерева С.А., Гюлов Х.Я. Очерки первичной множественности злокачественных опухолей. Челябинск: Иероглиф, 2000. 213 с.
- Bartkowiak D., Humble N., Suhr P., Hagg J., Mair K., Polivka B., Schneider U., Bottke D., Wiegel T. Second cancer after radiotherapy, 1981-2007 //Radiother. Oncol. 2012. V. 105, N 1. P. 122-126.
- Berrington de Gonzalez A., Curtis R.E., Kry S.F., Gilbert E., Lamart S., Berg Ch.D., Stovall M., Ron E. Proportion of second cancers attributable to radiotherapy treatment in adults: a cohort study in the US SEER cancer registries //Lancet Oncol. 2011. V. 12, N 4. P. 353-360.
- Shin D.W., Baik Y.Ji., Kim Y.W., Oh J.H., Chung Ki-W., Kim S.W., Lee W.-Ch., Yun Y.H., Cho J. Knowledge, attitudes, and practice on second primary cancer screening among cancer survivors: a qualitative study //Patient Educ. Couns. 2011. V. 85, N 1. P. 74-78.
- Tubiana M. Can we reduce the incidence of second primary malignancies occurring after radiotherapy? A critical review //Radiother. Oncol. 2009. V. 91, N 1. P. 4-15.
- Злокачественные новообразования в России в 2017 году (заболеваемость и смертность) /под ред. А.Д. Каприна, В.В. Старинского, Г.В. Петровой. М.: МНИОИ им. П.А. Герцена - филиал ФГБУ «НМИЦ радиологии» Минздрава России, 2018. 250 с.
- Злокачественные новообразования в России в 2018 году (заболеваемость и смертность) /под ред. А.Д. Каприна, В.В. Старинского, Г.В. Петровой. М.: МНИОИ им. П.А. Герцена - филиал ФГБУ «НМИЦ радиологии» Минздрава России. 2019. 250 с.
- De Vathaire F., Hawkins M., Campbell S., Oberlin O., Raquin M.-A., Schlienger J.-Y., Shamsaldin A., Diallo I., Bell J., Grimaud E., Hardiman C., Lagrange J., Daly-Schveitzer N., Panis X., Zucker J.-M. H., Sancho-Garnier H., Eschwege F., Chavaudra J., Lemerle J. Second malignant neoplasms after a first cancer in childhood: temporal pattern of risk according to type of treatment //Br. J. Cancer. 1999. V. 79, N 11-12. P. 1884-1893.
- Jenkinson H.C., Hawkins M.M., Stiller C.A., Winter D.L., Marsden H.B., Stevens M.C.G. Long-term population-based risks of second malignant neoplasms after childhood cancer in Britain //Br. J. Cancer. 2004. V. 91, N 11. P. 1905-1910.
- Guerin S., Guibout C., Shamsaldin A., Dondon M.-G., Diallo I., Hawkins M., Oberlin O., Hartmann O., Michon J., Le Deley M.-C., de Vathaire F. Concomitant chemo-radiotherapy and local dose of radiation as risk factors for second malignant neoplasms after solid cancer in childhood: a case-control study //Int. J. Cancer. 2007. V. 120, N 1. P. 96-102.
- Федоров В.Э., Барсуков В.Ю., Попова Т.Н., Селезнева Т.Д. Особенности течения и трудности диагностики множественных злокачественных новообразований //Мед. альманах. 2011. № 2 (15). С. 157-160.
- Berrington de Gonzalez A., Curtis R., Gilbert E., Berg C.D., Smith S.A., Stovall M., Ron E. Second solid cancers after radiotherapy for breast cancer in SEER cancer registries //Br. J. Cancer. 2010. V. 102, N 1. P. 220-226.
- Lang B.H-H., Wong I.O.L., Wong K.P., Cowling B.J., Wan K.-Y. Risk of second primary malignancy in differentiated thyroid carcinoma treated with radioactive iodine therapy //Surgery. 2012. V. 151, N 6. P. 844-850.
- Grantzau T., Mellemkj^r L., Overgaard J. Second primary cancers after adjuvant radiotherapy in early breast cancer patients: a national population based study under the Danish Breast Cancer Cooperative Group (DBCG) //Radiother. Oncol. 2013. V. 106, N 1. P. 42-49.
- Liu C-H., Chen H.-J., Wang P.-C., Chen H.-S., Chang Y.-L. Patterns of recurrence and second primary tumors in oral squamous cell carcinoma treated with surgery alone //Kaohsiung J. Med. Sci. 2013. V. 29, N 10. P. 554-559.


