Эндогенные и экзогенные модификаторы активности Na,К-АТФазы
Автор: Андреев Владимир Петрович, Зачиняева Анна Владимировна
Журнал: Ученые записки Петрозаводского государственного университета @uchzap-petrsu
Рубрика: Биология
Статья в выпуске: 2 (147), 2015 года.
Бесплатный доступ
Преинкубация гомогената мозга или печени крыс с ацетилхолином (норадреналином) приводит к уменьшению (увеличению) активности Na,К-АТФазы и высвобождению диализуемого низкомолекулярного активатора (ингибитора) фермента интактных микросом. Ацетилхолин (норадреналин) индуцирует синтез фактора-активатора (ингибитора) и вызывает ускорение (замедление) синтеза фермента. Низкомолекулярный ингибитор из мозга крупного рогатого скота выделен в индивидуальном состоянии и охарактеризован. Некоторые производные N-оксидов пиридина и хинолина в концентрациях 10 -4-10 -10 M ингибируют активность Na,К-АТФазы микросом мозга. Обнаружен новый активатор (N-оксид 2-(2,4-диметоксистирил)хинолина) Na,К-АТФазы, способный активировать фермент в концентрациях 10 -6-10 -9 М. Так как эти соединения изменяют активность фермента в очень низких концентрациях, они могут оказаться эффективными препаратами при лечении заболеваний, связанных с нарушениями функций Na,К-АТФазы.
Nа, k-атфаза, нейромедиаторы, ацетилхолин, норадреналин, эзерин, ингибиторы, активаторы, мозг, печень, гетероароматические n-оксиды
Короткий адрес: https://sciup.org/14750835
IDR: 14750835
Текст научной статьи Эндогенные и экзогенные модификаторы активности Na,К-АТФазы
Предположение о прямом влиянии нейромедиаторов на процессы биосинтеза РНК и белков нервных клеток появилось в середине 60-х годов прошлого века. Оно основывалось на допущении возможности поступления этих соединений в нервные клетки, так как известно, что 20–30 % общего количества ацетилхолина (АХ) и норадреналина (НА) в нервной ткани составляет фонд так называемого свободного медиатора, находящегося в цитоплазме, содержание которого изменяется в зависимости от чередования возбуждения и покоя [9].
При изучении вопроса об их влиянии на процессы транскрипции было обнаружено, что АХ и НА в низких концентрациях (с максимумом при 10 –7 –10 –5 М) изменяют включение предшественников в РНК клеточных ядер [9]. Однако для подтверждения вывода о прямом воздействии медиаторов на экспрессию генов нервных клеток необходимо было детальное исследование синтеза продуктов индивидуальных генов. В качестве такого обьекта нами был выбран фермент Na,K-АТФаза.
Na,K-ATФаза – интегральный белок, встроенный в цитоплазматическую мембрану и обеспечивающий асимметричное распределение ионов Na + и K + между клеткой и внеклеточной средой, играет исключительно важную роль в поддержа-
нии процессов возбудимости и водно-солевого обмена в организме животных и человека. Поэтому не удивительно, что большое количество публикаций посвящено изучению механизмов регуляции функционирования этого фермента.
Особенное внимание в последнее время уделяется поиску и выделению эндогенных (природных) и экзогенных (искусственного происхождения) модификаторов активности Na,K-ATФазы, которые могут оказывать на нее как прямое, так и опосредованное воздействие. Решение этой проблемы имеет не только научное, но и практическое значение. В частности, изменение концентрации таких веществ в организме человека, как полагают, связано с развитием и течением гипертонии, сердечной недостаточности, некоторых форм рака и многих других заболеваний [27].
Имевшиеся до наших работ литературные данные [1] не давали основания для достаточно обоснованного заключения о возможности регуляции этими нейромедиаторами АТФазы in situ, так как, во-первых, были противоречивы, а во-вторых, действующие концентрации слишком высоки – 10–2–10–3 М [9]. Очевидно, что наблюдаемое in vitro обычно небольшое изменение активности фермента было обусловлено сдвигом ионных или буферных свойств среды при добавлении нейромедиатора, поскольку в таком же диапазоне изменялась активность энзима в зависимости от природы буфера.
В качестве модельной системы, позволяющей выяснить механизмы воздействия на Na,K-АТФа-зу ацетилхолина, норадреналина и ксенобиотиков, мы выбрали гомогенат мозга крыс, в котором имеются все вещества и органеллы нервных клеток, необходимые для биосинтетических процессов.
Проведенные нами исследования [12] показали, что регуляторное влияние АХ на уровень активности Na,K-ATФазы в гомогенате мозга крыс заключается в индукции синтеза низкомолекулярного фактора-активатора при одновременном снижении синтеза самого фермента.
Однако в опытах in vivo нами было обнаружено, что внутрибрюшинное введение крысам эзерина в нетоксических дозах (0,2 и 0,4 мг/кг), но вызывающих многократное увеличение содержания АХ в мозге [26], оказывает действие, противоположное тому, которое АХ индуцирует в гомогенате: снижение Na,K-ATФазной активности недиализованных микросом и существенное увеличение активности диализованных.
Оказалось, что в этом случае добавление к интактным микросомам лиофилизированного материала, прошедшего через мембрану при диализе микросомно-цитоплазматической фракции, выделенной из мозга животных, получавших эзерин, вызывает снижение их Na,K-ATФазной активности, то есть при воздействии эзерина in vivo имеет место образование фактора-ингибитора и активация синтеза самого фермента.
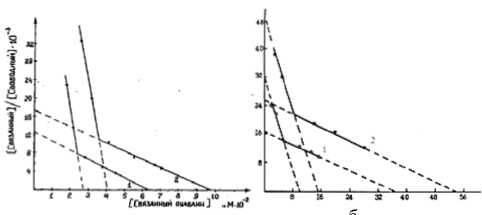
Свидетельством того, что при воздействии эзерина происходит увеличение количества молекул фермента в мембранах, служит факт прироста числа центров связывания 3 H-уабаина микросомами (рис. 1а). Обнаружено, что 3 H-уабаин имеет два типа центров связывания в мембране с различным сродством (что соответствует лите-
а
Рис. 1. Связывание 3H-уабаина (в координатах Скэтчар-да) диализованными микросомами: (а) мозга контрольных животных (1) и животных, получавших эзерин (2), (б) контрольного гомогената (1) и гомогената, преинку-бированного с НА в концентрации 10–4 М (2). По оси абсцисс – связанный уабаин (а) в нМ∙10–2, (б) в нМ∙10–3, по оси ординат – отношение связанного уабаина к свободному (а) ∙10–3 , (б) ∙10–4
ратурным данным [19], [23]), причем количество тех и других увеличивается после воздействия эзерина.
Различия в действии эзерина in vivo и in vitro (в концентрациях, полностью подавляющих активность холинэстераз, его влияние в гомогенате подобно АХ) дают основание предположить, что при нарушении целостности мозга из процессов регуляции уровня активности Na,K-ATФазы исключаются какие-то звенья. Одним из них может быть нарушение межклеточных взаимодействий, например исчезновение влияния на холиноцеп-тивные клетки вставочных нейронов, высвобождающих тормозные медиаторы (норадреналин, дофамин), оказывающих противоположное АХ действие на синтетические процессы [10], [11].
С целью проверить данное предположение мы изучили влияние преинкубации гомогената мозга крыс с норадреналином (НА) на активность Na,K-ATФазы микросом [2], [3] и обнаружили, что при этом происходит снижение активности фермента (табл. 1).
Таблица 1
Влияние преинкубации гомогената мозга и микросомно-цитоплазматической фракции с НА на активность Na,K-АТФазы микросом
|
Преинку-бированная клеточная фракция |
Добавленный агент и его концентрация |
Условия обработки клеточной фракции |
Активность фермента, % от контроля |
|
Гомогенат |
НА 10–6 М |
Без диализа |
93 ± 4 (4) |
|
НА 10–5 М |
86 ± 7 (13)* |
||
|
НА 10–4 М |
81 ± 6 (15)** |
||
|
НА 10–3 М |
95 ± 4 (10) |
||
|
НА 10–4 М |
Диализ |
132 ± 10 (9)** |
|
|
НА 10–4 М + актиномицин D (50 мкг/мл) |
Без диализа |
128 ± 9 (6)* |
|
|
НА 10–4 М + актиномицин D (50 мкг/мл) |
Диализ |
127 ± 10 (9)* |
|
|
НА 10–4 М + рибонуклеаза (100 мкг/мл) |
Без диализа |
102 ± 8 (9) |
|
|
НА 10–4 М + рибонуклеаза (100 мкг/мл) |
Диализ |
98 ± 8 (10) |
|
|
Микросомно-цитоплазматическая фракция |
НА 10–4 М |
Без диализа |
126 ± 7 (9)* |
Примечание. * – Р < 0,05; ** – Р < 0,01; в скобках – число опытов.
Эффект зависит от концентрации НА, и максимум угнетения наблюдается при концентрации 10–4 М. После диализа микросомно-цитоплазматической фракции, полученной из преинкубиро-ванного с норадреналином гомогената, изолированные микросомы обладают более высокой по сравнению с контролем Na,K-АТФазной активностью. Этот факт можно интерпретировать в том смысле, что при преинкубации гомогената с НА имеет место образование диализуемого ин- гибитора Na,K-АТФазы; сам же фермент при этом претерпевает либо активацию, либо количество его в мембранах увеличивается. Справедливость настоящего предположения подтверждается тем, что: а) диализуемый материал при добавлении к интактным микросомам ингибирует их Na,K-АТФазную активность (на 30 %), б) преинкубация гомогената с НА на фоне ингибитора транскрипции актиномицина D вызывает увеличение активности фермента как у недиализованных, так и диализованных микросом (на 20–25 %) (см. табл. 1). Таким образом актиномицин D полностью препятствует появлению фактора-ингибитора Na,K-АТФазы и не затрагивает активирующее действие НА на фермент. Ингибитор же трансляции (рибонуклеаза) полностью снимает влияние норадреналина на активность Na,K-АТ-Фазы как недиализованных, так и диализованных микросом.
Полученные нами экспериментальные результаты позволяют предполагать существование следующих путей воздействия норадреналина на уровень активности Na,K-АТФазы: ускорение синтеза фермента на уровне трансляции и одновременная индукция биосинтеза низкомолекулярного фактора-ингибитора с первичным эффектом норадреналина на уровне транскрипции.
Эффект норадреналина при преинкубации недиализованной микросомно-цитоплазматической фракции является подтверждением справедливости предлагаемой интерпретации. В этом случае наблюдалась активация фермента, то есть при удалении ядер из гомогената НА не индуцирует появление фактора-ингибитора, но сохраняется его активирующий эффект на Na,K-АТФазу.
Свидетельством того, что при воздействии НА происходит увеличение количества молекул Na,K-АТФазы в мембранах, служит факт прироста числа центров связывания 3 H-уабаина микросомами (рис. 1б). После преинкубации гомогената с НА (как и в опытах с эзерином in vivo ) увеличивается количество центров связывания обоих типов.
Полученные результаты дают основание предполагать, что в нервных клетках существует система норадреналиновой регуляции уровня Na,K-ATФазной активности мембран, состоящая в активации синтеза фермента на уровне трансляции и одновременной индукции синтеза низкомолекулярного ингибитора его каталитической активности на уровне транскрипции.
Таким образом, нами показано, что in vitro и in vivo существует сложная система медиаторной регуляции уровня Na,K-АТФазной активности нервных клеток, основные черты которой можно представить следующим образом: при активации синтеза энзима параллельно синтезируется фактор-ингибитор, и наоборот – при угнетении синтеза Na,K-АТФазы образуется фактор-активатор. Очевидно, что эти разнонаправленные процессы являются звеньями единой саморегулирующейся системы поддержания активности фермента на оптимальном функционально обусловленном уровне.
С целью сравнить влияние нейромедиаторов на активность фермента нейрональных и других типов клеток мы провели опыты с гомогенатом печени крыс (табл. 2).
Как и ожидалось, в первом приближении биосинтетические процессы в печени и мозге довольно похожи. Например, преинкубация гомогената с АХ в обоих случаях индуцирует синтез низкомолекулярного диализуемого активатора(ов) Na,K-АТФазы и ингибирует процесс синтеза самого фермента. Внутрибрюшинное же введение эзерина крысам вызывает снижение активности энзима. Однако анализ данных табл. 2 позволяет сделать вывод, что при использовании печени эффект выражен более резко, чем для мозга: эзерин in vivo приводит к гораздо более сильному ингибированию (на 70 %), а АХ – к значительно ярче выраженной активации (на 42 %) фермента и несколько сильнее (на 13 %) подавляет синтез молекул Na,K-АТФазы.
Следует отметить, что данные факты не противоречат литературным данным. В кровь (вследствие их синаптической «утечки» при проведении нервного импульса) поступают АХ, НА и другие нейромедиаторы, которые в дальнейшем могут попадать в клетки тканей со слабо выраженной или отсутствующей медиацией соответствующего типа [9].
Согласно данным работы [13], действие АХ на активность ацетилхолинэстеразы микросом мозга и печени также идентично. Однако бесклеточная система печени более чувствительна к АХ, чем система мозга (хотя максимальный эффект и РНКаз гомогената печени и мозга крыс
Влияние эзерина на активность
Таблица 2 in vivo и НА и АХ in vitro Na,K-АТФазы микросом
|
Условия опыта |
Обьект исследования |
|||
|
Печень |
Мозг |
|||
|
Без диализа |
Диализ |
Без диализа |
Диализ |
|
|
Na,K-АТФазная активность |
||||
|
Эзерин (0,2 мг/кг) |
20 ± 8 (6)** |
– |
90 ± 3 (14)* |
139 ± 6 (9)** |
|
НА (10–4 М) гомогенат |
– |
– |
95 ± 4 (10) |
132 ± 10 (9)** |
|
АХ (10–4М) гомогенат |
172 ± 21 (6)** |
78 ± 9 (9)* |
130 ± 7 (11)*** |
91 ± 4 (9)* |
|
РНКазная активность |
||||
|
Эзерин (0,2 мг/кг) |
83 ± 4 (10)** |
– |
77 ± 3 (8)*** |
– |
|
Эзерин (0,4 мг/кг) |
85 ± 6 (7)* |
– |
87 ± 4 (7)** |
– |
Примечание. * - Р < 0,05; ** - Р < 0,01; *** - Р < 0,001; в скобках – число опытов.
наблюдался при одной и той же концентрации АХ – 10 –5 М). Этот факт имеет свой биологический смысл, учитывая, что содержание АХ в крови ниже, чем в нервной ткани.
Обратимый ингибитор холинэстераз эзерин в нетоксичной дозе, повышающей содержание АХ в крови, существенно снижает РНКазную активность гомогената как печени, так и мозга крыс (этот эффект подобен его влиянию на Na,K-АТФазу, табл. 2), но увеличивает [13] активность АХЭ микросом печени.
Нам представлялись закономерными постановка и решение вопроса о том, универсально ли действие обнаруженных низкомолекулярных факторов – модификаторов активности Na,K-АТФазы, или же они воздействуют на фермент только тех клеток, в которых сами вырабатываются, то есть не существуют ли для каждого типа клеток особые соединения – регуляторы. С этой целью материал, прошедший через мембраны при диализе микросомно-цитоплазматической фракции, полученной после преинкубации гомогената печени с АХ (10 –4 М), инкубировали с микросомами мозга. Наблюдавшееся в этих опытах существенное увеличение активности Na,K-АТФазы (150 %, n = 52, p < 0,0001), по-ви-димому, свидетельствует о том, что фактор – активатор фермента не обладает строгой тканевой специфичностью.
Поскольку в организме животных и человека существуют различные типы низкомолекулярных модификаторов активности Na,K-АТФазы, мы попытались выделить соединения, обладающие подобными свойствами в индивидуальном состоянии.
На первом этапе очистки микросомно-цитоплазматическую фракцию, полученную из гомогената головного мозга крупного рогатого скота, диализовали против 10 объемов дистиллированной воды. Диализат концентрировали в вакууме и разделяли на колонке, заполненной силикагелем. Содержимое полученных фракций анализировали методом ТСХ на силуфоле (рис. 2а) и проверяли их способность изменять активность Na,K-АТФазы.
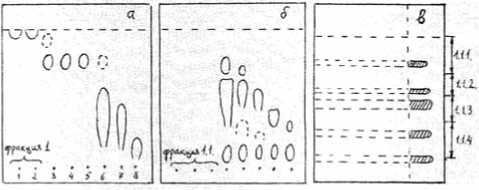
Рис. 2. Анализ методом ТСХ на силуфолах фракций, полученных при разделении колоночной хроматографией на силикагеле диализата микросомно-цитоплазматической (а) и элюата фракции 1 (б) и препаративное разделение на си-луфолах соединений фракции 1.1 (в). Проявление: нингидрином (а, б), «боковое» парами йода (в). Подвижная фаза: вода (а), хлороформ–этанол–вода = 5 : 13 : 5 (б), хлороформ– этанол–вода = 13 : 20 : 5 (в)
Материал первой фракции, полученный с использованием в качестве элюента дистиллированной воды и обладающий способностью ингибировать фермент (М = 66 %, n = 13, p < 0,01), вновь фракционировали на силикагеле, используя в качестве подвижной фазы систему растворителей хлороформ – этанол – вода (5 : 13 : 5) (рис. 2б).
Далее содержимое фракции 1.1 (М = 68 %, n = 8, p < 0,005), не проявляемое нингидрином, разделяли методом ТСХ на силуфоле с использованием системы растворителей хлороформ – этанол – вода (13 : 20 : 5) (рис. 2в).
После «бокового» проявления парами йода вещества с пластинки элюировали водой и вновь анализировали их способность модифицировать активность Na,K-АТФазы (табл. 3).
Таблица 3
Влияние соединений, содержащихся в элюате с силуфола (см. рис. 2), на активность Na,K-АТФазы микросом мозга крупного рогатого скота
|
Фракции |
Эффект в % к контролю |
Число опытов |
Коэф. Стьюдента |
Уровень значимости |
|
1.1.1 |
100 ± 11 |
5 |
0,42 |
|
|
1.1.2 |
63 ± 10 |
7 |
2,48 |
< 0,05 |
|
1.1.3 |
75 ± 5 |
9 |
5,77 |
< 0,001 |
|
1.1.4 |
74 ± 7 |
7 |
4,13 |
< 0,005 |
Согласно данным табл. 3, фракция 1.1 содержит или несколько веществ, способных ингибировать фермент, или одно соединение, существующее в нескольких формах [14].
Далее мы исследовали некоторые свойства компонентов фракции 1.1.3 (самое сильное проявление парами йода). Как было показано методом масс-спектрометрии, эта фракция включает хлористый аммоний, который может иметь как эндогенное, так и экзогенное (в химических лабораториях в воздухе всегда содержатся HCl и аммиак, которые при концентрировании больших объемов растворов загрязняют выделяемые соединения) происхождение. Использование цветной реакции между хлористым аммонием и реактивом Несслера [17] позволило количественно оценить содержание этой соли (70 %).
В ИК-спектре фракции 1.1.3 (рис. 3) наблюдаются следующие полосы поглощения (см –1 ): 3600–2800 (шир., с.), 1615 (с.), 1400 (с.), 1110 (сл.), 1040 (сл.). Их положение соответствует наличию С-Н, О-Н, С-N и N-H (в аммонийной форме) связей.
При кратковременном нагревании компонентов данной фракции при 180 °С вместо одной широкой полосы при 3140 см –1 появляются две (3430 и 3135 см –1 ), что, возможно, вызвано разложением менее устойчивого, чем хлорид аммония, органического соединения, содержащего в своем составе аммонийные группы.
В спектре 1 Н ЯМР ингибитора в D2O (рис. 4) присутствуют дублет при 1,38 м. д. и мультиплет
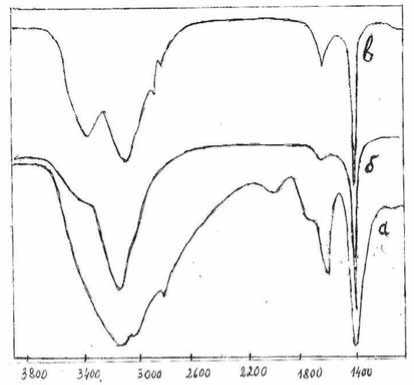
Рис. 3. ИК-спектры в KBr фракции 1.1.3 (а), NH4Cl (б) и фракции 1.1.3, прогретой 20 секунд при 180 °С (в)
в области 3,31–3,82 м. д. (за счет электроотрицательных атомов, например азота и кислорода, дезэкранирующих протоны). Наличие широкого и мощного пика в области 4,0–5,5 м. д. обусловлено примесью HOD и H2O в дейтерированном растворителе. Этот факт не позволил сделать однозначный вывод о наличии или отсутствии гидроксильных групп в исследуемом образце.
Спектр 13 С ЯМР фракции 1.1.3 в D 2 O (рис. 5) содержит четыре сигнала при 20,66, 63,11, 69,02 и 72,68 м. д. (четыре типа атомов углерода); слабая интенсивность поглощения в ИК-спектре в области, соответствующей валентным колебаниям С-Н связей (рис. 5), свидетельствует об их малом количестве. Регистрация спектра 13 С ЯМР в режиме dept 135 указывает на отсутствие четвертичных атомов углерода и позволяет сигнал при 63,11 м. д. приписать СН 2 группе, а остальные сигналы – СН и СН3 группам.
Данные спектроскопии 13 С ЯМР однозначно указывают на то, что молекула ингибитора не содержит двойные связи и ароматические кольца ввиду отсутствия сигналов в соответствующих им слабых полях, но не исключают наличия гидроксильных, простых эфирных или аминогрупп, а также дизамещенной тройной связи. Однако поскольку все известные к настоящему времени природные ацетиленовые соединения имеют растительное происхождение, а мы выделили ин-
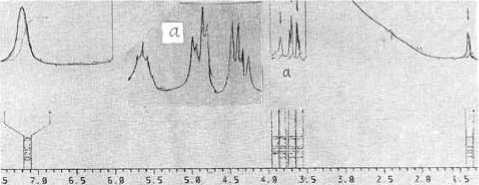
Рис. 4. Спектр протонного магнитного резонанса фракции 1.1.3 в D 2 O
гибитор из мозга животных, присутствие в нем тройной связи кажется маловероятным. Кроме того, нагревание водного раствора ингибитоpа на кипящей водяной бане с 6N HCl в течение 30 мин. не приводит к изменениям в его хроматографическом поведении в тонком слое (ТСХ). Это указывает на отсутствие в молекуле фрагментов, способных к гидролизу или реакциям электрофильного присоединения (для ацетиленовых соединений характерны реакции АЕ с галогенводородными кислотами).
Методом гель-хроматографии на молселекте Г-10 нам удалось освободиться от хлорида аммония во фракции 1.1.3 и оценить молекулярную массу ингибитора (около 200 Да). В качестве реперных веществ использовали глутатион, углекислый натрий и глицин.
После обработки 4 кг мозга крупного рогатого скота нами было выделено около 2 мг белого твердого вещества, содержащего активное начало фракции 1.1.3 и обладающего выраженной способностью ингибировать Na,K-АТФазу. Индивидуальность данного соединения доказана методами ТСХ, ВЭЖХ и гель-хроматографии. Оно хорошо растворимо в воде и метаноле и очень плохо в хлороформе.
Нами также были зарегистрированы масс-спектры самого ингибитора и его силилиро-ванного аналога (рис. 6), в которых не удалось идентифицировать пики молекулярных ионов. Интерпретация этих спектров согласуется с приведенными выше данными, а соотношение количеств изотопов кремния 28 Si, 29 Si и 30 Si указывает на то, что силилированию в молекуле исследуемого соединения, по-видимому, подверглись три функциональные группы.
Суммируя имеющиеся данные, мы склонны считать, что выделенный ингибитор содержит
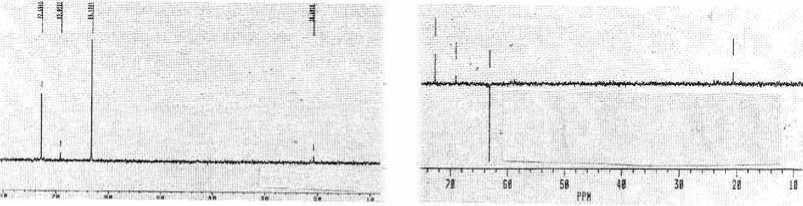
Рис. 5. Спектры 13С ЯМР в обычных условиях (слева) и в режиме dept 135
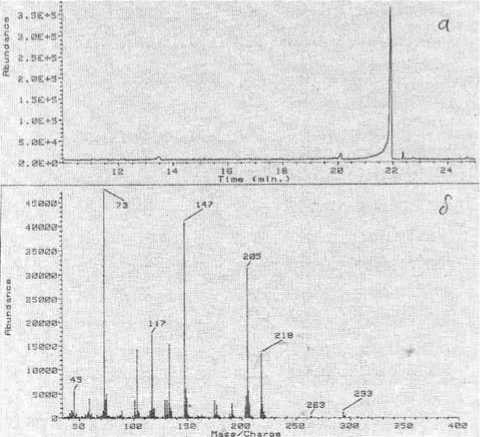
Рис. 6. Хроматограмма силилированного ингибитора (а) и его масс-спектр (б)
как минимум четыре атома углерода, тpи амино- (в аммонийной форме) и гидроксильн(ую)ые группы. Возможно, он является ациклическим аминоспиртом или его производным, содержащим простую эфирную связь.
К настоящему времени известны различные эндогенные ингибиторы Nа,К-АТФазы – катионы Ca 2+ [16], [18], ванадат-ион [20], нейромедиаторы (ацетилхолин, норадреналин и др. [1], [3], [9], [12], [18]), гистидил-пролилдикетопиперазин [20] и «уабаинподобные» гликозиды [25]. В работе Елаева и Байгильдиной [14] сообщалось об эндогенном ингибиторе с молекулярной массой около 190 Да, который, по мнению авторов, является амидом, содержащим морфолиновую структуру.
Анализ полученных нами данных позволяет сделать вывод о том, что выделенный нами из мозга крупного рогатого скота ингибитор [4] Nа,К-АТФазы не имеет аналогов в литературе. Выяснение в деталях его структурной формулы, а также механизмов биосинтеза и взаимодействия с Na,K-АТФазой является предметом дальнейших наших исследований.
Кроме того, мы исследовали способность влиять на активность Nа,К-АТФазы некоторых других кислород- и азотсодержащих экзогенных соединений.
Гетероароматические N-оксиды показывают широкий спектр биологической активности и образуются в организме животных и человека при инактивации гетероциклических соединений. Однако их влияние на Na,K-АТФазу практически не исследовалось. Мы нашли лишь несколько работ, в которых они используются как лекарственные препараты [1] и при изучении ЭПР-спек-тров (например, 5,5-диметил-1-пирролин N-оксид [25]), а N-оксид 2-гептил-4-гидроксихинолина применяют как ингибитор цитохромных систем [21], [22].
Ввиду того, что нами в последние годы синтезировано большое количество гетероароматичес-ких N-оксидов (I–V), мы проверили способность соединений этого класса в физиологических концентрациях (10 –4 –10 –10 М) изменять in vitro активность Na,K-АТФазы мозга крупного рогатого скота.
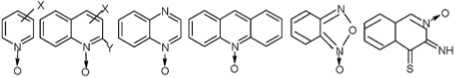
1ф.в-ж,с-у.х Пб-г,е,ж,к-Р.у-м III IVs.n V VI
Y =H X = H(a), 2-Ме(б), 4-Ме(в), 4-MeO(r), 4-Вг(д). 4-SH(e), 4-МО2(ж). Э-МСОД, 9-С1(и), 4-ЗАд(к). 4-Мз(л). 4-(3-NO2Ph), 4-SPh(2.4-NO2XH). 4-SCH,CH2OH(O), 4-CH=CHPh(4-OMe)(T), 4-CH=CHPh(2.4-OMe(y). 2-CH=CHPh(4-NMe2)(0). 4-CH=CHPh(4-NNMe2Mx). 2-CH=NPh(4-NMe2X4)
Y = Me. X = NO^m)
N-оксиды 4-метокси- и 4-бромпиридина, 2-ме-тил, 4-метокси-, 4-меркапто-, 3-нитрофенокси, 4-стирил и 2-стирилхинолина, моно-N-оксида хиноксалина и соединение IV в концентрации 10 –4 М не изменяли (n = 10) активность, и поэтому для них при более низких концентрациях исследования не проводили. Данные для других соединений представлены в табл. 4.
Полученные результаты [5] показали, что 16 из них являются ингибиторами (на 67–20 %) Na,K-АТФазы даже при концентрациях 10 –8 М, что сопоставимо или превышает эффективность строфантинов К и G. Активность 15 ингибиторов (за исключением № 9) сохраняется постоянной в диапазоне концентраций 10 –4 –10 –8 М и только при дальнейшем уменьшении их концентрации претерпевает изменения. По-видимому, этот феномен можно объяснить образованием прочных комплексов N-оксидов с Na,K-АТФазой. Так, если предположить существование таких аддуктов состава 1 : 1, то до тех пор, пока число молекул N-оксида будет превышать число центров связывания фермента, его ингибирование не должно изменяться. Это мы и наблюдаем в указанном диапазоне концентраций. Как только число молекул N-оксида станет меньше числа молекул фермента, не связанные с ингибитором молекулы Na,K-АТФазы будут повышать общую активность энзима, и тем в большей степени, чем больше будет соотношение фермент / N-оксид. В этом случае даже двукратное изменение указанного соотношения должно приводить к заметным изменениям активности фермента. Например, для соединений № 5–7, 14, 20 при переходе от 10 –8 к 10 –9 М ингибиторный эффект пропадает полностью и только для № 14 активен даже при 10 –10 М. Активирующее действие соединения № 9 при 10 –4 М, по-ви-димому, является неспецифическим и может быть обусловлено значительной концентрацией ионов Ag + .
Особо следует отметить резко выраженный (180–190 %) активирующий эффект соединения
Таблица 4
Влияние гетероароматических N-оксидов на активность Na,K-АТФазы микросом
|
Активность фермента, % от контроля |
|
|
№ Х |
Концентрация N-оксида |
|
10–4 М 10–6 М 10–8 М 10–9 М 10–10 М |
PyO
|
1 |
4-Me |
78 ± 1 (10)*** |
81 ± 2 (10)*** |
83 ± 1 (10)*** |
||
|
2 |
4-NO 2 |
91 ± 2 (9)*** |
||||
|
3 |
4-[CH=CHC 6 H 5 (4-OCH 3 )] |
63 ± 2 (10)*** |
83 ± 1 (10)*** |
80 ± 1 (10)*** |
||
|
4 |
2-[CH=CHC 6 H 5 (4-OCH 3 )] |
96 ± 1 (10)** |
||||
|
5 |
4-[CH=CHC 6 H 3 (2,4-OCH 3 )] |
34 ± 3 (9)*** |
34 ± 1 (10)*** |
37 ± 1 (10)*** |
97 ± 2 (10) |
97 ± 4 (15) |
|
6 |
4-[CH=CHC 6 H 4 (4-N(CH3) 2 ] |
22 ± 2 (20)*** |
29 ± 1 (9)*** |
37 ± 1 (10)*** |
97 ± 2 (10) |
102 ± 2 (10) |
QO
|
7 |
H |
39 ± 3 (10)*** |
22 ± 2 (10)*** |
27 ± 3 (10)*** |
99 ± 2 (10) |
93 ± 5 (10) |
|
8 |
4-Me |
104 ± 1 (10)** |
||||
|
9 |
4-SAg |
170 ± 5 (9)*** |
76 ± 3 (10)*** |
74 ± 3 (9)*** |
||
|
10 |
4-N 3 |
64 ± 1 (10)*** |
72 ± 1 (10)*** |
65 ± 9 (7)** |
||
|
11 |
4-Clа |
68 |
72 |
77 |
76 |
|
|
12 |
4-Brа |
75 |
77 |
85 |
82 |
|
|
13 |
4-NO2 |
33 ± 2 (9)*** |
32 ± 1 (10)*** |
33 ± 1 (10)*** |
101 ± 4 (10) |
|
|
14 |
2-Me-4NO 2 |
41 ± 1 (10)*** |
43 ± 1 (10)*** |
46 ± 1 (10)*** |
94 ± 2 (10)* |
90 ± 4 (15)* |
|
15 |
4-SC 6 H 4 (2,4-NO 2 ) |
62 ± 3 (10)*** |
72 ± 1 (10)*** |
73 ± 1 (9)*** |
||
|
16 |
4 –SCH 2 CH 2 OH |
91 ± 2 (10)** |
||||
|
17 |
4- [CH=CHC 6 H 3 (2,4-OCH 3 )] |
56 ± 4 (10)*** |
188 ± 2 (10)*** |
179 ± 1 (10)*** |
108 ± 2 (10)** |
100 ± 2 (10) |
|
18 |
4-[CH=CHC 6 H 4 (4- (CH 3 ) 2 ] |
47 ± 1 (10)*** |
44 ± 1 (10)*** |
50 ± 1 (10)*** |
96 ± 4 (10) |
|
|
19 |
2-[CH=CHC 6 H 4 (4-N(CH 3 ) 2 ] |
59 ± 2 (10)*** |
58 ± 2 (10)*** |
69 ± 3 (10)*** |
104 ± 3 (10) |
|
|
20 |
2-[CH=NC 6 H 4 (4-N(CH 3 ) 2 ] |
56 ± 2 (10)*** |
60 ± 1 (10)*** |
57 ± 1 (10)*** |
98 ± 2 (10) |
90 ± 2 (15)** |
AcrO
|
21 |
9-NO2 |
87 ± 3 (10)** |
104 ± 4 (10) |
98 (10) |
111 ± 5 (15)* |
|
|
22 |
9-Cl |
108 ± 4 (15)* |
99 ± 4 (10) |
114 ± 5 (15)* |
97 ± 2 (10) |
Другие соединения
|
23 |
Фуроксан IV |
66 ± 1 (10)*** |
65 ± 1 (10)*** |
64 ± 1 (10)*** |
97 ± 3 (10) |
|
|
24 |
V |
28 ± 1 (10)*** |
29 ± 1 (10)*** |
31 ± 1 (10)*** |
99 ± 2 (9) |
|
|
25 |
Фталимид |
39 ± 3 (10)*** |
22 ± 2 (10)*** |
27 ± 3 (10)*** |
99 ± 2 (10) |
93 ± 5 (10) |
Примечание.а Данные работы [15], n = 10, Р < 0,05. * - Р < 0,05; ** - Р < 0,01; *** - Р < 0,001; в скобках - число опытов.
№ 17 (№ 22 – менее активен), так как в настоящее время неизвестны вещества, обладающие подобным действием на фермент. Ввиду того что данное воздействие вызывается очень низкими его концентрациями (10 –6 –10 –8 М), можно предположить, что в составе Na,K-АТФазы имеется, по крайней мере, один особый центр, ответственный за взаимодействие с соединениями, активирующими фермент. Таким образом, следует ожидать открытия и других эндогенных активаторов данного энзима. Ингибирующая способность соединения № 17 при более высокой концентрации (на 42 % при 10 –4 М), по-видимому, является неспецифической.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Выделение эндогенного ингибитора Nа,К-АТФазы
2 кг мозга, полученного на Петрозаводском мясокомбинате [4] в день забоя животных, гомогенизировали в дистиллированной воде (из расчета 1 мл на мозг). Гомогенат центрифугировали 15 мин. при
12 000 g, супернатант диализовали против 10 объемов дистиллированной воды в течение 12 ч. при +4 ° C. Полученный диализат концентрировали в вакууме при 30-35 ° C до объема 10 мл и использовали для дальнейших исследований. Материал, не прошедший через мембраны, центрифугировали 60 мин. при 30 000 g. Осадок микросом суспензировали в 0,05 М трис-HCl (pH 7,55) и хранили при -20 ° C (в течение 1 месяца активность Nа,К-АТФазы оставалась почти неизменной). Определение способности выделенных соединений модифицировать активность Nа,К-АТФа-зы осуществляли, как описано ранее [12]. Выделение ингибитора из диализата состояло из следующих этапов.
-
1. В колонку диаметром 20 мм, содержащую 20 г силикагеля L 100/250 мкм фирмы Chemapol, вносили 1 мл диализата от 200 г мозга и элюировали водой, собирая аликвоты объемом 5 мл. Содержимое фракций анализировали методом ТСХ на си-луфоле (подвижная фаза – вода, проявление 0,1 % спиртовым раствором нингидрина, рис. 1а).
-
2. Материал первой фракции концентрировали до обьема 1 мл, наносили на 20 г силикагеля L 40/100, помещенного в колонку диаметром 20 мм, и элюировали системой растворителей хлороформ – этанол – вода (5 : 13 : 5). Анализ содержимого фракций осуществляли методом ТСХ на силуфо-ле (подвижная фаза хлороформ – этанол – вода (5 : 13 : 5), проявление 0,1 % спиртовым раствором нингидрина, рис. 1б). Для дальнейшей работы использовали непроявляемую нингидрином фракцию 1.1.
-
3. Содержимое фракции 1.1 высушивали в вакууме. Сухой остаток растворяли в 0,5 мл H 2 O и разделяли методом ТСХ на силуфолах (нанесение полоской, подвижная фаза хлороформ – этанол – вода (13 : 20 : 5), рис. 1в). После «бокового» проявления парами йода вещества с пластинки элюировали водой и анализировали их способность модифицировать активность Nа,К-АТФазы.
-
4. Содержимое фракции 1.1.3 высушивали в вакууме, сухой остаток растворяли в 1 мл H 2 O и вносили в колонку (2 × 75 см) с гелем молселект Г-10 (тонкий), уравновешенный дистиллированной водой. Элюирование проводили со скоростью 15 мл/ч, аликвоты обьемом 2 мл отбирали с помощью коллектора фракций.
Доказательство индивидуальности выделенных веществ
Об индивидуальности выделенного нами ингибитора Nа,К-АТФазы свидетельствует наличие лишь одного регистрируемого компонента при использовании описанных ниже хроматографических методов разделения.
-
1. ТСХ на силуфолах и на силикагеле L 5/40 (фирмы Chemapol) с 13 % гипса. Использовали следующие системы растворителей: хлороформ – этанол – вода (13 : 20 : 5, 5 : 13 : 5), бензол – этанол (2 : 1), бутанол – уксусная кислота – вода (4 : 1 : 1). Проявление пластинок во всех случаях осуществляли парами йода.
-
2. ВЭЖХ (насос HPP-5001, УФ-детектор LCD 2040, самописец TZ 4620, фирмы Laboratorni pristroje, Praha, A = 235 нм). Хроматографирование осуществляли с использованием колонок Separon C 18 , CN, NH 2 и следующих систем растворителей: ацетонитрил – вода (84 : 16), вода, хлороформ – этанол – вода (13 : 20 : 5), хлороформ – этанол (10 : 1).
-
3. Газожидкостная хроматография:
-
а) Силилирование.
Смесь 0,2 мг сухого остатка (фракции 1.1.3), 1 мкл пиридина и 100 мкл N-метил-N-(триметилсилил) трифторацетамида (MSTFA) нагревали при 60 ° C в течение 20 мин.
-
б) Условия ГЖХ-анализа.
Газовый хроматограф HP 5890 фирмы Hewlett-Packard (USA), оснащенный пламенно-ионизационным детектором и кварцевой капиллярной колонкой 12,5 м × 0,2 мм (внутренний диаметр), неподвижная фаза HP-1 с толщиной слоя 0,33 мкм.
Расход газа-носителя (гелий) – 1,5 см3/мин, водорода и воздуха к детектору – 25 и 250 см3/мин соответственно. Температуру колонки изменяли от 40 до 280 ° C со скоростью 10 °C/мин. Температура испарителя и детектора - 250 и 300 ° C соответственно. Объем вводимых проб составлял 0,5–1,0 мкл в режиме разделения потока 1 : 10. Регистрацию результатов проводили с использованием интегратора HP 3396A фирмы Hewlett-Packard (USA) .
Исследование структуры ингибитора Na,K-АТФазы
ИК-спектр соединения, представленного фракцией 1.1.3, снимали в KBr на приборе Specord M 80, ПМР-и 13С ЯМР-спектры в D 2 O – на приборе Bruker AM (500 Мгц), масс-спектр ингибитора – на приборе МХ 1321 (70 eV), а его силилированного производного – на хромато-масс-спектрометре GC/MS 5988A (70 eV) фирмы Hewlett-Packard (кварцевая капиллярная колонка 25 м х 0,32 мм, толщина пленки неподвижной фазы HP-1–0,52 мкм. Температуру колонки программировали от 40 до 270 ° C со скоростью 4 °C/мин. Остальные условия аналогичны тем, которые описаны в разделе ГЖХ).
Гетероароматические N-оксиды были синтезированы в соответствии с методами, описанными в работах [1], [6], [7], [8]. Их способность in vitro модифицировать активность Na,K-АТФазы была исследована, как описано в работах [1], [2]. Написание данной статьи отчасти вызвано тем, что в работах [8], [15] были использованы экспериментальные данные, касающиеся выделения и характеристики ингибитора Na,K-АТФазы и влияния полученных нами гетеро-ароматических N-оксидов на его активность, без разрешения авторов и без ссылок на соответствующие работы [4], [5].
* Работа выполнена при поддержке Программы стратегического развития ПетрГУ в рамках реализации комплекса мероприятий по развитию научно-исследовательской деятельности на 2012–2016 гг.
Список литературы Эндогенные и экзогенные модификаторы активности Na,К-АТФазы
- Андреев В. П. Молекулярные комплексы гетероароматических N-оксидов и ацетиленовых аминов с v-акцепторами как модель исследования нуклеофильности и основности соединений с пространственно доступными реакционными центрами: Дисс.. д-ра химич. наук. Петрозаводск, 2007. 427 с.
- Андреев В. П., Елаев Н. Р., Унжаков А. Р. Регуляция норадреналином биосинтеза Na,К-АТФазы и ее низкомолекулярного ингибитора//Нейрохимия. 1984. Т. 3. № 4. С. 443.
- Андреев В. П., Елаев Н. Р., Унжаков А. Р. Регуляция норадреналином биосинтеза nA,К-АТФазы и ее низкомолекулярного ингибитора. Деп. в ВИНИТИ 12.11.84, № 7248-84.
- Андреев В. П., Платонов А. В. Выделение и характеристика нового эндогенного низкомолекулярного ингибитора Na,K-ATPaзы из мозга крупного рогатого скота. Деп. в ВИНИТИ 02.04.97, № 1066-В97.
- Андреев В. П., Корвачева Е. Г, Нижник Я. П. О влиянии N-оксидов пиридина и хинолина на активность Na,К-АТФазы микросом мозга крупного рогатого скота//Химико-фармацевтический журнал. 2006. Т. 40. № 6. С. 96-97.
- Андреев В. П., Батоцыренова Е. Г., Рыжаков А. В., Родина Л. Л. Процессы внутримолекулярного переноса заряда в ряду стирильных производных N-оксидов пиридина и хинолина//Химия гетероциклических соединений. 1998. № 8. C. 1093-1102.
- Андреев В. П., Рыжаков А. В., Теканова С. Г. Стирильные производные N-оксида хинолина//Химия гетероциклических соединений. 1995. № 4. C. 518-521.
- Батоцыренова Е. Г. Влияние эндогенных и экзогенных модификаторов на активность Na,К-АТФазы: Автореф. дисс.. канд. биол. наук. СПб., 2005. 23 с.
- Голиков С. Н., Долго-Сабуров В. Б., Елаев Н. Р., Кулешов В. И. Холинергическая регуляция биохимических систем клетки. М.: Медицина, 1985. 224 c.
- Елаев Н. Р. О характере синаптической регуляции синтеза белков в нервных клетках//Доклады АН СССР. 1975. Т. 222. № 6. С. 1477-1479.
- Елаев Н. Р. Норадреналин как регулятор синтеза РНК и Na,К-АТФазы в нервных клетках//Проблемы эндокринологии. 1981. Т. 27. № 1. С. 58-62.
- Елаев Н. Р., Андреев В. П., Шаврина Н. В. Эндогенные ингибиторы и активаторы Na,К-АТФазы//Бюллетень экспериментальной биологии и медицины. 1983. Т. 95. № 2. С. 40-42.
- Елаев Н. Р., Рылеева Е. А., Судакова Н. М., Онегина Л. К. Регуляция уровня АХЭ микросом печени и мозга как проявление трофической функции ацетилхолина//Физиологический журнал СССР. 1983. Т. 69. № 4. С. 554-556.
- Елаев Н. Р., Байгильдина А. А. Ингибитор №,К-АТФазы из мембраны нервных клеток. Выделение и общие характеристики//Биохимия. 1994. Т. 59. № 3. C. 389-394.
- Комов В. П., Батоцыренова Е. Г. Влияние гетероароматических N-оксидов на активность мембранной Na+, К+-AТФазы//Вопросы биологической, медицинской и фармацевтической химии. 2008. № 2. С. 32-34.
- Петруняка В. В., Панюшкина Е. А., Северина Е. П. Активация и ингибирование Na,К-АТФазы мембран эритроцитов эндогенными Ca2+-зависимыми регуляторами. Ca2+-зависимое действие уабаина на Ca2+-АТФазу//Биологические мембраны. 1990. Т. 7. № 4. С. 352.
- Резников А. А., Муликовская Е. П. Методы анализа природных вод. М., 1954. 135 c.
- Abashidze S., Jariashvili T., Kometiani Z. The effect of EGTA and Ca++ in regulation of the brain Na,K-ATPase by noradrenaline//BMC Biochemistry. 2001. Vol. 2. № 8. URL: http://biomedcentral.com/471-209/2/8
- Adams M., Heffron J. J. Na+-K+-ATPase content of fast-and slow-twitch muscle fibres//Biochem. Soc. Trans. 1981. Vol. 9. № 2. P. 220.
- Battani F., Peterkofsky A.//Biochem. Biophis. Res. Comm. 1980. Vol. 94. № 1. P. 240.
- D ibr o v P. A., Lazarova R. L., Skulachev V. P., Verkhovskaya M. L. The sodium cycle. I. Na+-dependent motility and modes of membrane energization in the marine alkalotolerant vibrio Alginolyticus//Biochim. Biophys. Acta. 1986. Vol. 850. № 3. P. 449-457.
- Dibrov P. A., Lazarova R. L., Skulachev V. P., Verkhovskaya M. L. The sodium cycle. II. Na+-coupled oxidative phosphorylation in Vibrio alginolyticus cells//Biochim. Biophys. Acta. 1986. Vol. 850. № 3. P. 458-465.
- Goodfrain T., de Poyer A., Lutete D. N. Identification with potassium and vanadate of two classes of specific ouabain binding sites in a Na+, K+-ATPase preparation from the guinea-pig heart//Biochem. Pharmacol. 1980. Vol. 29. № 8. P. 1195-1199.
- Taga R., Okabe E. Hydroxyl radical participation in the in vitro effects of gram-negative endotoxin on cardiac sarcolemmal Na,K-ATPase activity//Jpn J. Pharmacol. 1991. Vol. 55. № 3. P. 339-349.
- Schneider R., Wray V., Nimtz M., Lehmann W. D., Kirch U., Antolovic R. Schoner Bovine adrenals contain, in addition to ouabain, a second inhibitor of the sodium pump//The Journal of Biological Chemistry. 1998. Vol. 273. № 2. P. 784-792.
- To r d a C. Effect of convulsion inducing agents on the acetylcholine content and on the electrical activity of the brain//Am. J. Physiol. 1953. Vol. 173. № 1. P.179-183.
- X i e Z., Askari A. Na+-K+-ATPase as a signal transducer//Eur. J. Biochem. 2002. Vol. 269. P. 2434-2439.


