Эндогенный SEMA4D в контроле пролиферации и апоптоза Т-лимфоцитов
Автор: Валиева Ю.В., Некрасова И.В., Куклина Е.М.
Журнал: Вестник Пермского университета. Серия: Биология @vestnik-psu-bio
Рубрика: Медико-биологические науки
Статья в выпуске: 3, 2018 года.
Бесплатный доступ
Семафорин IV класса Sema4D - молекула, широко представленная в иммунной системе. Она конститутивно экспрессируется Т-лимфоцитами, а при активации переходит в растворимую форму, не теряя функциональной активности. Свои эффекты в иммунной системе данная молекула реализует, как правило, через Sema4D/CD72-зависимую регуляцию клеток-мишеней. В настоящей работе мы показали, что Т-лимфоциты могут выступать не только как источник семафорина, но и как мишень для него. В частности, продемонстрировано стимулирующее действие эндогенного Sema4D на пролиферативный ответ Т-клеток и, напротив, ингибирующее - в отношении апоптоза этих клеток. Выявленные эффекты указывают на непосредственное участие эндогенного семафорина в контроле ранних этапов активации Т-лимфоцитов.
Т-лимфоциты, иммунный ответ, пролиферация, апоптоз
Короткий адрес: https://sciup.org/147227036
IDR: 147227036 | УДК: 612.018
Текст научной статьи Эндогенный SEMA4D в контроле пролиферации и апоптоза Т-лимфоцитов
Sema4D, или CD100, – молекула, принадлежащая IV классу семафоринов [Semaphorin …, 1999]. Подобно другим членам семафоринового семейства, она участвует в процессах аксонального наведения в ходе роста нейронов [Kolodkin, Matthes, Goodman, 1993]. Наряду с этим, Sema4D широко представлен в иммунной системе и играет важную роль в ее функционировании. Он конститутивно экспрессируется на мембране Т-лимфоцитов [Bougeret et al., 1992], а при активации клеток усиливает экспрессию и переходит в растворимую форму за счет протеолитического отщепления, сохраняя при этом функциональную активность [Hérold et al., 1995; Wang et al., 2001; Elhabazi et al., 2001]. В связи с этим, Т-лимфоцит рассматривался традиционно исключительно как источник
Sema4D в иммунной системе, растворимого или мембранного, а мишенями его действия считали клетки, экспрессирующие низкоаффинный сема-фориновый рецептор CD72 [Kumanogoh, Kikutani, 2001; Mizui et al., 2009].
Однако в недавней работе показано [Куклина, Некрасова, Валиева, 2017], что Т-лимфоциты несут на мембране высокоаффинный рецептор для Sema4D, плексин В1, экспрессия которого ранее приписывалась исключительно неиммунным тканям [Takamatsu et al., 2010; Zhang et al., 2013]. Помимо этого, Sema4D может выступать не только как лиганд, но и как рецептор, проводя сигнал в клетку, на которой экспрессирован [Hérold et al., 1995; Zhang et al., 2013]. В связи с этим можно предположить, что Т-лимфоциты являются не только источником, но и мишенью действия
Sema4D. Целью работы было определение роли эндогенного Sema4D в активации Т-лимфоцитов.
Материалы и методы
В работе использовали лейкоциты здоровых доноров. ( n =10). От всех доноров получено информированное согласие на участие в исследовании. Лейкоциты выделяли из гепаринизированной венозной крови центрифугированием в градиенте плотности фиколла-верографина (1.077 г/см3) («Pharmacia»). В работе использовали CD3+Т-лимфоциты, фракционированные на иммуномаг-нитных частицах с помощью соответствующей системы для выделения (“R&D Systems”). Т-клетки в концентрации 1 × 106 клеток/мл (для оценки пролиферации) или 2 × 106 клеток/мл (для оценки апоптоза) культивировали 72 или 24 ч., соответственно, в среде RPMI 1640 (“Gibco. Thermo Fisher Scientific”) с добавлением 10%-ной эмбриональной телячьей сыворотки (Serva), 1 мМ HEPES (“Sigma-Aldrich”), 300 мг/мл L-глутамина (“Serva”) и 100 мг/мл гентамицина (“Pharmacia”) при 37оС и 5% СО 2 в условиях поликлональной активации (система для активации на основе моноклональных антител к CD3/CD28, “Invitrogen”).
Изучение роли эндогенного Sema4D в регуляции ранних этапов активации лимфоцитов проводили с учетом не только основного варианта ответа клеток на стимуляцию, пролиферации, но и альтернативного – апоптоза (программированной клеточной гибели). Пролиферативный ответ оценивали по включению в клетки синтетического аналога тимидина, 5-бром-2’-дезоксиуридина (BrdU), с помощью набора для иммуноферментного анализа (Amersham). BrdU добавляли в образцы за 18 ч. до окончания культивирования. Апоптоз Т-лимфоцитов оценивался по экспрессии на мембране фосфатидилсерина (маркер раннего апоптоза) – с помощью соответствующего лиганда, аннексина V, меченого флуоресцеинизотиоцианатом (AnnV*FITC, “R&D Systems”), и по включению в клетку пропидия йодида (PI, маркер позднего апоптоза) флуоресцентного ДНК- интеркалирую-щего красителя (“Sigma-Aldrich”). Оценка проводилась методом проточной цитометрии. Источником эндогенного Sema4D в культуре служили сами Т-лимфоциты [Hérold et al., 1995; Wang et al., 2001; Elhabazi et al., 2001].
Для оценки роли Sema4D в активации лимфоцитов использовали его блокаду анти-Sema4D антителами (10 μg/mL, Santa Cruz Biotech), которые добавляли в культуру за 1 ч. до активации лимфоцитов. Статистическая обработка проводилась с использованием t-критерия Стьюдента.
Результаты и их обсуждение
Исследование показали непосредственное участие Sema4D в пролиферативном ответе Т-лимфоцитов на поликлональную активацию (анти-CD3/CD28): при блокаде Sema4D наблюдалось статистически значимое снижение индекса пролиферации как для CD4, так и для CD8 Т-
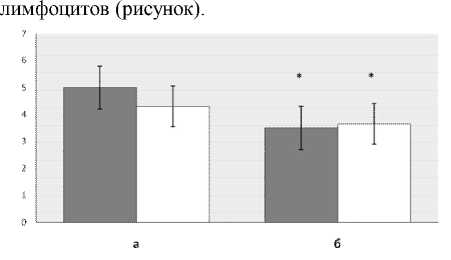
Роль Sema4D в пролиферативном ответе Т- лимфоцитов на поликлональную активацию: а) без блокады Sema4D, б) на фоне блокады Sema4D. * - p < 0.05 (в сопоставлении с соответствующим показателем без блокады); заштрихованный столбец – CD4+Т-лимфоциты, незаштрихованный – CD8+Т-лимфоциты
Уровень активационно-индуцированного апоптоза, напротив, возрастал в случае блокады Sema4D, как для CD4+, так и для CD8+Т-лимфоцитов (таблица), указывая на антиапоптоти-ческую активность семафорина.
Роль Sema4D в регуляции апоптоза Т-лимфоцитов
|
Условия экспрессии |
Процент Ann V-связывающих Т-лимфоцитов |
||
|
CD4+Т-лимфоциты |
CD8+Т-лимфоциты |
||
|
Монокультура Т-лимфоцитов |
Без блокады |
6.7±1.7 |
6.6±0.8 |
|
На фоне блокады |
8.8±3.1 |
5.4±1.5 |
|
|
Совместная культура Т/В-лимфо-цитов |
Без блокады |
5.3±1.1 |
5.4±1.5 |
|
На фоне блокады |
10.9±3.1* |
8.8±2.9* |
|
Примечание. * - p < 0.05 (в сопоставлении с соответствующим показателем без блокады).
Эти изменения касались не только экспрессии раннего маркера апоптоза, фосфатидилсерина (рецептора аннексина V), но и содержания Т-лимфоцитов, находящихся в поздней фазе апоптоза (позитивных и по аннексину V, и по PI), Важно отметить, что данные эффекты блокатора Sema4D выявлены в Т-лимфоцитах только в присутствии аутологичных В-клеток, тогда как в монокультуре Т-лимфоцитов уровень апоптоза имел лишь тенденцию к повышению.
По-видимому, для эффективной реализации ан-тиапоптотического действия Sema4D требуется кооперативное взаимодействие Т-лимфоцитов с другими клетками, на которых уровень экспрессии рецепторов для него существенно выше – В-лимфоцитами или дендритными клетками.
Заключение
В целом, полученные результаты показали следующее: 1) Sema4D контролирует пролиферативный ответ Т-лимфоцитов на активацию, выступая как позитивный регулятор; 2) Sema4D также участвует в регуляции альтернативного пути ответа клеток на стимуляцию – активационно-индуцированного апоптоза, играя негативную роль в этом процессе.
Реципрокный эффект Sema4D в отношении пролиферации и апоптоза Т-лимфоцитов должен усиливать активацию Т-клетки в ответ на антиген. Данный эффект может достигаться при действии как мембран-связанного семафорина, так и растворимого, причем растворимый Sema4D в ходе активации лимфоцита может действовать как аутокринный или паракринный фактор, подобно интерлейкину 2.
Работа поддержана грантом РФФИ № 15-0405694.
Список литературы Эндогенный SEMA4D в контроле пролиферации и апоптоза Т-лимфоцитов
- Куклина Е.М., Некрасова И.В., Валиева Ю.В. Участие семафорина Sema4D в Т-зависимой активации В-лимфоцитов // Бюллетень экспериментальной биологии и медицины. 2017. Т. 163, № 4. С. 444-448.
- Bougeret C. et al. Increased surface expression of a newly identified 150-kDa dimer early after human T lymphocyte activation. // J. Immunol. 1992. Vol. 148. P. 318-323.
- Elhabazi A. et al. Biological activity of soluble CD100. I. The extracellular region of CD 100 is released from the surface of T lymphocytes by regulated proteolysis // J. Immunol. 2001. Vol. 166. P. 4341-4347.
- Herold C. et al. Activation signals are delivered through two distinct epitopes of CD100, a unique 150 kDa human lymphocyte surface structure previously defined by BB18 mAb // Int. Immunol. 1995. Vol. 7. P. 1-8.
- Kolodkin A., Matthes D., Goodman C. The sema-phorin genes encode a family of transmembrane and secreted growth cone guidance molecules // Cell. 1993. Vol. 75. P. 1389-1399.
- Kumanogoh A., Kikutani H. The CD100-CD72 interaction: a novel mechanism of immune regulation // Trends Immunol. 2001. Vol. 22. P. 670-676.
- Mizui M. et al. Immune semaphorins: novel features of neural guidance molecules // J. Clin. Immunol. 2009. Vol. 29. P. 1-11.
- Semaphorin Nomenclature Committee. Unified nomenclature for the semaphorins/collapsins // Cell. 1999. Vol. 97. P. 551-552.
- Takamatsu H. et al. Roles of Sema4D-plexin-B1 interactions in the central nervous system for patho-genesis of experimental autoimmune encephalo-myelitis // J. Immunol. 2010. Vol. 184. P. 1499-1506.
- Wang X. et al. Functional soluble CD100/Sema4D released from activated lymphocytes: possible role in normal and pathologic immune responses // Blood. 2001 Vol. 97. P. 3498-3504.
- Zhang Y. et al. Sema 4D/CD100-plexin B is a multifunctional counter-receptor // Cell Mol. Immunol. 2013. Vol. 10. P. 97-98.


