Эндометриоз-ассоциированные опухоли яичника: морфологические и иммуногистохимические особенности
Автор: Байрамова Н.Н., Протасова А.Э., Раскин Г.А., Собивчак М.С., Ярмолинская М.И.
Журнал: Злокачественные опухоли @malignanttumors
Рубрика: Собственные исследования
Статья в выпуске: 2 т.9, 2019 года.
Бесплатный доступ
Актуальность. В 2016 Всемирная Организация Здравоохранения обновила классификацию опухолей яичника и представила новую группу эндометриоз-ассоциированных опухолей. Проблема поиска предикторов злокачественной трансформации эндометриоза до сих пор не решена. Цель исследования. Поиск гистологических и иммуногистохимических маркеров малигнизации эндометриоза. Материал и методы. В исследование были включены 28 женщин с диагнозом эндометриодный рак яичника и 11 больных светлоклеточным раком яичника. Гистологическое и иммуногистохимическое исследования проводились по стандартной методике. Иммуногистохимическим методом определялся рецепторный статус опухоли: экспрессия рецепторов стероидных гормонов, экспрессия BAF250a (ARID1A), PTEN, β-катенин, MSH6, PMS2, р-53, WT-1, индекс пролиферации (Ki-67). Молекулярно-генетический анализ MSI проводился по стандартному протоколу. Результаты. При морфологическом исследовании во всех случаях рака яичника присутствовал один из признаков эндометриоза...
Рак яичника, эндометриоз-ассоциированные опухоли, атипический эндометриоз, микросателлитная нестабильность
Короткий адрес: https://sciup.org/140243817
IDR: 140243817 | DOI: 10.18027/2224-5057-2019-9-2-12-19
Текст научной статьи Эндометриоз-ассоциированные опухоли яичника: морфологические и иммуногистохимические особенности
Согласно новой классификации, выделяется группа эндометриоз — ассоциированных опухолей яичника, которые включают эндометриоидные, светлоклеточные и серомуцинозные карциномы, а также соответствующие им пограничные опухоли. В структуре новообразований яичника эти опухоли составляют около 20%. Они менее агрессивны и чаще диагностируются на ранних стадиях развития. [1]
Цель исследования. Поиск гистологических и иммуногистохимических маркеров малигнизации эндометриоза.
Материалы и методы. Исследование проведено на основании клинико-анамнестических и морфологических данных 28 больных с диагнозом эндометриоидный рак яичника (ЭРЯ) и 11 больных светлоклеточным раком яичника (СРЯ); диагноз установлен в период с августа 2013 г. по сентябрь 2017 г.
Морфологическое исследование опухолей яичника проводилось на основании критериев ВОЗ 2014 года. По микропрепаратам определялся гистологический тип опухоли Иммунногистохимическое исследование выполнено по стандартному протоколу с определением рецепторного статуса опухоли: экспрессии рецепторов эстрогенов и прогестерона, экспрессии BAF250a ( ARID1А ), PTEN , β-катенина, MSH6, PMS2, р-53, WT-1, индекса пролиферации Ki-67.
Молекулярно-генетический анализ MSI оценивался по стандартному протоколу с использованием маркера BAT26. Позитивным считался образец, демонстрирующий изменение длины микросателлитной последовательности.
Стадирование РЯ проводилось согласно классификации TNM (7-ое издание 2010), FIGO 2012 и 2014 гг.
Статистическая обработка данных проведена с использованием пакета прикладных программ Microsoft Excel 2010 (Microsoft Corporation, USA), пакета прикладных программ Statistica v 7.0 (Statsoft, Inc., USA).
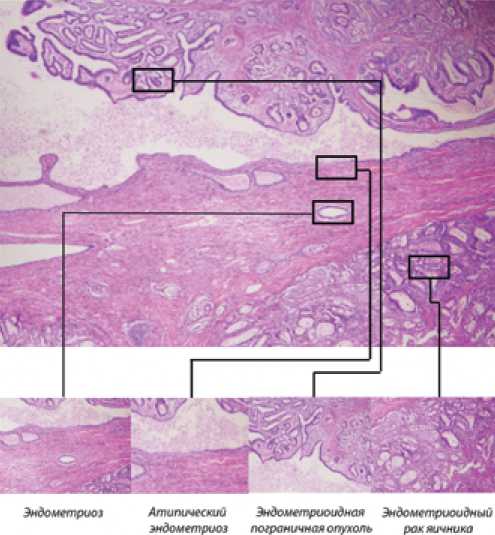
Рисунок 2. Микропрепарат ЭРЯ, окраска гематоксилином и эозином, × 200.
Результаты
Средний возраст больных ЭРЯ (n=28) составил 53±13 года, CРЯ (n=11) равнялся 58 ±9 лет.
Распределение по клиническим стадиям заболевания представлено на рис. 1. У исследуемых женщин преобладали начальные стадии (I–II) заболевания (до 86% в группе ЭРЯ и до 82% в СРЯ).
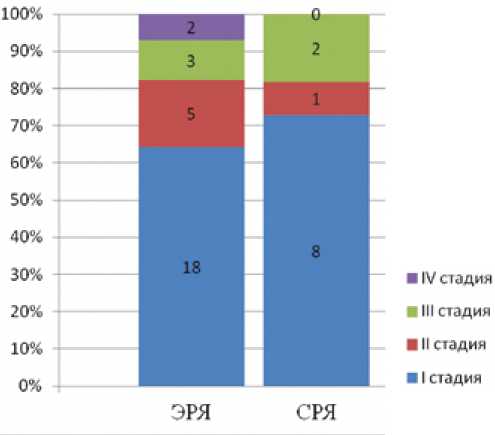
Рисунок 1. Распределение больных с эндометриоз-ассоциированными опухолями яичника в зависимости от клинической стадии заболевания.
Морфологическая верифицикация эндометриоза в анамнезе произведена у 11 % (3/28) женщин с ЭРЯ. Однако при гистологическом исследовании во всех случаях ЭРЯ и СРЯ присутствовали признаки эндометриоза и опухоли в пределах одного яичника (рис. 2).
К гистологическим признакам эндометриоз-ассоции-рованных опухолей относились:
-
• плоскоклеточная метаплазия;
-
• эндометриоидная строма и / или эндометриоидные железы;
-
• аденофиброматозный фон — кистозные эндометриоидные железы, окруженные фиброзной стромой;
-
• пограничный эндометриоидный или смешанный мюллеровский компонент;
-
• атипический эндометриоз (клеточная атипия с аномальным ядерно-цитоплазматическим соотношением (негиперпластический тип) или скопление желез и клеточная стратификация (гиперпластический тип). Атипический эндометриоз обнаружен в 39% (11/28) случаев ЭРЯ и в 27% (3/11) СРЯ (рис. 3).
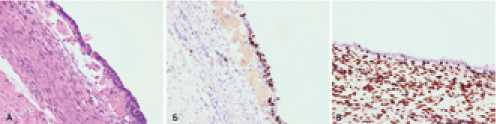
Рисунок 3. Микропрепарат атипического эндометриоза в ЭРЯ:
3а) окраска гематоксилином и эозином, × 400;
3б) экспрессия Ki-67, × 400;
3в) экспрессия BAF250a ( ARID1A ), × 400.
Таблица 1. Морфологический иммунологический профиль компонентов ЭРЯ
|
Компоненты опухоли ЭРЯ |
ER, экспрессия, % |
PR, экспрессия, % |
Индекс Ki-67, экспрессия, % |
PTEN , потеря экспрессии |
β-катенин, ядерная экспрессия |
BAF250a ( ARID1a ), потеря экспрессии |
PMS2, потеря экспрессии |
MSH6, потеря экспрессии |
|
Неизмененный эндометриоз (n=22) |
86±5,4 |
74±4,8 |
1,9±0,6 |
0 |
0 |
0 |
0 |
0 |
|
Атипический эндометриоз (n=11) |
82±5,6 |
71±4,3 |
15,7±2,4 |
3 |
4 |
2 |
0 |
0 |
|
Пограничная опухоль (n=23) |
80±3,2 |
68±3,7 |
24,7±3,3 |
7 |
9 |
4 |
1 |
1 |
|
ЭРЯ (n=28) |
74±7,8 |
67±5,4 |
68,2±3,7 |
8 |
9 |
4 |
1 |
1 |
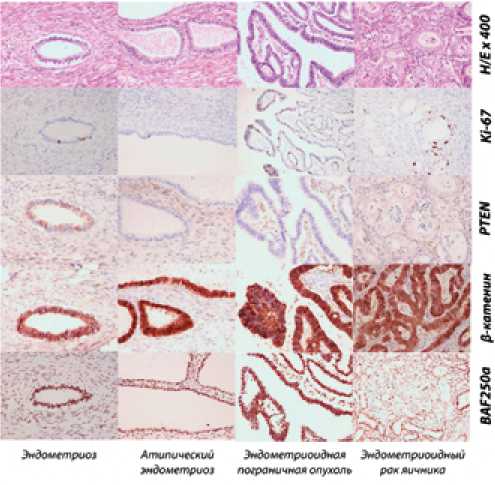
Рисунок 4. Микропрепараты ЭРЯ, ув. × 400, окраска гематоксилином и эозином, экспрессия Ki-67, PTEN, β-катенина, BAF250a ( ARID1A ).
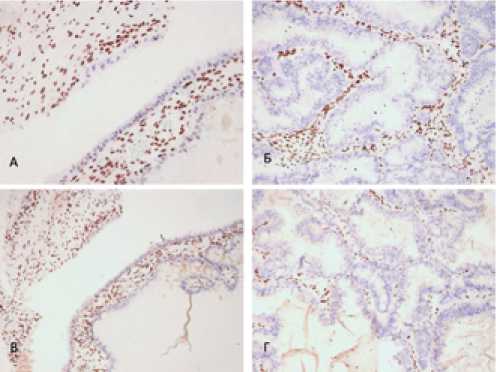
Рисунок 5. Микропрепарат ЭРЯ:
5а) стадия пограничной опухоли, экспрессия BAF250a
( ARID1A ), × 200;
5б) стадия рака, экспрессия BAF250a ( ARID1A ), × 200;
5в) стадия пограничной опухоли, экспрессия MSH6, × 200;
5 г) стадия рака, экспрессия MSH6, × 200.
Иммуногистохимическое исследование ЭРЯ выявило позитивную реакцию к рецепторам стероидных гормонов — ER (74±7,8 %) и PR (67±5,4 %), индекс Ki-67 составил 68,2±3,7%, потеря экспрессии BAF250а ( ARID1A ) выявлена в 14% (4/28), потеря PTEN — в 29 % (8 / 28), ядерная экспрессия β-катенина отмечена в 32% (9/28) случаев.
Изменения характера экспрессии маркеров наблюдались уже на стадии атипического эндометриоза и атипической пролиферативной (пограничной) опухоли (табл. 1, рис. 4).
Потеря экспрессии белков MMR выявлена в 7% (2/28) случаев СРЯ. Негативная реакция на MSH6 (1/28) и PMS2 (1/28) наблюдалась со стадии пограничной опухоли и только в тех случаях, когда определялась потеря экспрессии BAF250а ( ARID1A ) (рис. 5).
MSI выявлена только у одной пациентки, в опухоли которой наблюдалась потеря экспрессии BAF250а ( ARID1A ) и MSH6. Стоит отметить, что тест на MSI оказался положительным как в образце эндометриоза, так и в ЭРЯ.

Рисунок 6. Микросателлитная нестабильность (MSI) 6а) здоровый донор;
6б) положительный контроль;
6в) эндометриоз;
6г) ЭРЯ.
СРЯ демонстрировали во всех случаях негативную реакцию на рецепторы стероидных гормонов и WT-1, позитивную реакцию на BAF250a ( ARID1A ), MSH6, PMS2, цитоплазматическую реакцию на β-катенин, индекс Ki-67 составил 72,3±4,7%. Потеря экспрессии PTEN и экспрессия мутантного типа p53 наблюдались только в 1 случае при III стадии заболевания, поэтому можно предположить, что данные изменения коррелируют с распространением опухолевого процесса.
Обсуждение
ЭРЯ составляет 10–15% в структуре злокачественных эпителиальных опухолей яичников, что представляет собой вторую по распространенности форму РЯ. ЭРЯ чаще всего поражает женщин перименопаузального возраста, средний возраст больных составляет 58 лет, что несколько ниже, чем при серозном раке яичника высокой степени злокачественности [2,3]. В большинстве случаев эти опухоли представлены высокодифференцированными формами, имеют латентное течение и диагностируются на ранних стадиях, ограничены одним яичником в 83% случаев [3], что также демонстрируют результаты нашего исследования.
До 42% случаев ЭРЯ ассоциированы с эндометриозом ипсилатерального яичника или с эндометриозом тазовой брюшины, в 15–20% сосуществуют с карциномой эндометрия [3]. Пациентки, чьи опухоли встречаются в сочетании с эндометриозом, в среднем на 5–10 лет моложе, чем пациентки без эндометриоза [2].
Одним из ранних событий в патогенезе ЭРЯ являются потеря функции PTEN вследствие мутации или делеции гена и мутации гена β-катенина ( CTNNB1 ) [4]. Потеря PTEN запускает PI3K-сигнальный путь, мутация β-катенина активирует Wnt/β-катениновый сигнальный путь. Мутации C TNNB1 встречаются в 38–50% случаев и связаны с относительно благоприятным прогнозом [5, 6]. Мутация PTEN встречается примерно в 20% случаев и в 46% случаев в сочетании с утратой гетерозиготности в локусе 10q23 [4]. Кроме PTEN PI3K/AKT-сигнальный путь может быть активирован вследствие мутации PIK3CA , гена каталитической субъединицы PI3K, встречающейся в 20% случаев ЭРЯ и СРЯ. Активация этого сигнального пути имеет негативное прогностическое значение [7].
Наиболее важным нарушением при (эндометриоз-ассо-циированных опухолях (ЭАОЯ), в частности ЭРЯ является инактивирующая мутация гена ARID1A [8]. ARID1A является опухолевым супрессором, кодирующим один из белков SWI-SNF-A комплекса, участвующего в ремоделировании хроматина [9]. Потеря экспрессии белка BAF250a, кодируемого геном ARID1A , происходит в 21–33% случаев ЭРЯ [8, 10, 11].
В нашем исследовании потеря BAF250a обнаружена в 14%, PTEN в 29 % (8/28), ядерная экспрессия β-катени-на в 32% случаев ЭРЯ, что сопоставимо с результатами, представленными в литературе.
Активация мутаций в KRAS и BRAF также отмечена при ЭРЯ, но частота мутаций в этих генах была обнаружена в менее чем 7% опухолей [5, 12].
Известно, что микросателлитная нестабильность (MSI) встречается в 13–20% случаев ЭРЯ и связана с нарушением функций генов hMSH2 , hMLH1 , hPMS2 и hMSH6 , осуществляющих репарацию неспаренных нуклеотидов ДНК (MMR) [4, 13, 14].
Необходимо отметить, что в нашем исследовании MSI выявлена только у одной пациентки, в которой наблюдалась потеря экспрессии BAF250а ( ARID1A ) и MSH6, при этом тест на MSI оказался положительным как в образце эндометриоза, так и в ЭРЯ. Согласно недавнему исследованию J. Shen и соавторов, инактивация гена A RID1A приводит к дефекту MMR и усилению мутагенеза. В эксперименте опухоли, образованные линией клеток РЯ с дефектным ARID1A у мышей, демонстрировали высокую мутационную нагрузку, повышенное количество опухоль-инфильтри-рующих лимфоцитов и экспрессию PD–L1 (Programmed cell death 1 — белок запрограммированной гибели клеток). Авторы отмечают, что лечение анти-PD–L1-антителом снижает нагрузку на опухоль и увеличивает выживаемость мышей с мутантным типом A RID1A в сравнении с диким типом ARID1A . Таким образом, авторы предполагают, что мутация ARID1A способствует дефекту MMR и может являться важным прогностическим фактором развития рака и предиктивным фактором для ингибиторов иммунных контрольных точек [15].
СРЯ встречаются в 10% случаев карцином яичника, обычно выявляются на первой или второй стадиях заболевания [3] и в 50–70% случаев ассоциированы с эндометриозом [8]. СРЯ, возникший на фоне эндометриоза, имеет относительно благоприятный прогноз. Эти опухоли обычно односторонние, средние размеры составляют до 15 см [3].
СРЯ демонстрируют неспецифичную положительную реакцию на CK7/CK20 и отрицательную на PAX8 в отличие от большинства ЭАОЯ. СРЯ обычно проявляют негативную или фокально положительную реакцию к рецепторам стероидных гормонов (эстрогенов и прогестерона). К специфичными маркерами СРЯ относятся HNF1b, напсин A и альфа-метилацил коэнзима-рацемазы (AMACR) [16].
В светлоклеточных опухолях яичника маловероятна дисфункция BRCA , хромосомная нестабильность и многие другие изменения, присущие серозному раку высокой степени злокачественности (high-grade) [3]. Кроме того, мутации TP53 , которые являются характерными для серозного рака высокой степени злокачественности, отсутствуют в СРЯ, что вероятно свидетельствует о других антиапоптотических механизмах, участвующих в развитии СРЯ. Потеря экспрессии PTEN была обнаружена у 40% больных ранними стадиями СРЯ, а инактивация мутаций — в 8% случаев. С другой стороны, активирование мутаций в PIK3CA происходит в 33% случаев [10]. Около половины светлоклеточных карцином (46–57%) имеют мутации ARID1A , приводящие к отсутствию функции белка BAF250a
-
[8] . Считается, что мутация ARID1A является одним из ранних событий злокачественной трансформации, ведущей к СРЯ. В отдельных опухолях встречаются мутации KRAS , BRAF и TP53 , но их частота низка [12].
В отличие от ЭРЯ, соматические мутации β-катенина ( CTNNB1 ) и MSI редко определяются при СРЯ [6]. Тем не менее, MSI недавно была описана в небольшом числе случаев СРЯ (<10%) у больных с наследственным синдромом Линча, как результат герминальной мутации в системе репарации неспаренных нуклеотидов ДНК (MMR). Это происходит примерно в 1–2% от всех случаев РЯ, большинство из которых представлены ЭРЯ или СРЯ [17]. Поэтому, всем больным ЭРЯ и СРЯ рекомендовано тестирование на MSI с целью выявления синдрома Линча. Эти пациенты могут иметь более благоприятный прогноз, даже если их опухоли обнаружены на поздних стадиях [18, 19]
В нашем исследовании в СРЯ, несмотря на то что были выявлены гистологические критерии эндометриоза, не были обнаружены изменения экспрессии иммуногистохимических маркеров, характерные для ЭАОЯ. Можно предположить, что это связано с малой группой и требуются дальнейшие исследования.
Для СРЯ именно стадия заболевания является значимым прогностическим фактором [20]. Данная группа опухолей считается более агрессивными. Только больные с IA стадией распространенности опухолевого процесса имеют относительно благоприятный прогноз с показателем 5-летней выживаемости до 90%. Поздние стадии заболевания малочувствительны к платиносодержащей химиотерапии и прогноз их неблагоприятный [21]. Однако, как указывалось ранее, больные с MSI или с синдромом Линча даже в поздней стадии болезни, могут иметь высокие показатели выживаемости [19].
СРЯ с MSI являются высокоиммуногенными, демонстрируют повышенное количество опухоль-инфильтрирующих лимфоцитов и экспрессию PD–L1 и, таким образом, могут быть чувствительными для ингибиторов иммунных контрольных точек [18]. В недавнем клиническом исследовании II фазы по лечению платинорезистентного РЯ два из двадцати случаев с полным ответом на анти-PD-1-антитело отмечены у больных СРЯ [22].
В настоящее время в соответствии с классификацией ВОЗ 2014 года выделена новая группа ЭАОЯ — серомуцинозных опухолей [1, 23]. Однако многие авторы предполагают, что серомуцинозный РЯ является эндометриоидной карциномой с муцинозной дифференцировкой, поэтому эту группу предлагают ограничить пограничными опухолями [3, 24, 25, 26].
Атипический эндометриоз рассматривается как морфологическая форма предрака для большинства ЭАОЯ, который формируется, как предполагается, под влиянием стероидных гормонов, воспалительных цитокинов, оксида-тивного стресса и генетических альтераций. Считается, что у 2–8% больных наружным генитальным эндометриозом выявляют очаги атипического эндометриоза, в то время как частота обнаружения атипического эндометриоза в ЭАОЯ варьирует в пределах 20–80% [11]. Причинами такого разброса данных являются как отсутствие четких диагностических критериев атипического эндометриоза, так и редкость патологии.
К гистологическим критериям атипического эндометриоза относятся клеточная атипия с аномальным ядерно-цитоплазматическим соотношением (негиперпластический тип) скопление желез и клеточная стратификация (гиперпластический тип, аналогичный атипической гиперплазии эндометрия) [11]. К гистологическим критериям атипического эндометриоза относятся клеточная атипия с аномальным ядерно-цитоплазматическим соотношением (негиперпластический тип); скопление желез и клеточная стратификация (гиперпластический тип, аналогичный атипической гиперплазии эндометрия) [11]. Атипический эндометриоз может быть установлен только при гистологическом исследовании, а в ряде случаев с применением иммуногистохимического анализа, так как данная форма заболевания не имеет характерных клинических признаков [27].
Как видно из результатов нашего исследования, изменение экспрессии маркеров, характерное для ЭРЯ, наблюдалось уже на стадии атипического эндометриоза. Атипический эндометриоз был обнаружен в 39% (11/28) ЭРЯ. Потеря BAF250a выявлена в 18 % (2 / 11), потеря PTEN в 27% (3/11), β-катенина в 36% (4/11) случаев атипического эндометриоза, ассоциированного с ЭРЯ.
В работе J.P. Stamp и соавторов были изучены 35 эн-дометриоз-ассоциированных карцином и 8 случаев атипического эндометриоза вне опухоли. Атипический эндометриоз был выявлен в 23 образцах (66%) ЭАОЯ. Потеря экспрессии BAF250a обнаружена авторами в 14 случаях рака. Атипический эндометриоз присутствовал в 10 из этих случаев, 6 из которых показали негативную реакцию BAF250a (60%). Во всех 8 случаях атипического эндометриоза, не ассоциированного с опухолью яичника, наблюдалась положительная реакция на BAF250a [11].
Заключение
Результаты данного исследования позволяют предположить, что aтипический эндометриоз может являться морфологическим предшественником эндометриоидного и светлоклеточного рака яичника. Потеря экспрессии BAF250а ( ARID1A ), β-катенина, PTEN , дефект системы MMR могут рассматриваться как начальные признаки злокачественной трансформации эндометриоз — ассоциированных опухолей яичника. Комплексная оценка экспрессии панели маркеров BAF250a ( ARID1A ), β-катенина, PTEN , p53, индекса Ki-67, PMS2 и MSH6 позволит улучшить диагностический поиск атипического эндометриоза и эндометриоз — ассоциированных опухолей яичника.
Список литературы Эндометриоз-ассоциированные опухоли яичника: морфологические и иммуногистохимические особенности
- Kurman R.J., Shih I.M. The dualistic model of ovarian carcinogenesis revisited, revised, and expanded//Am. J. Pathol. American Society for Investigative Pathology, 2016. Vol. 186, № 4. P. 733-747.
- Storey D.J. et al. Endometrioid epithelial ovarian Cancer: 20 years of prospectively collected data from a single center//Cancer. 2008. Vol. 112, № 10. P. 2211-2220.
- Prat J., D'Angelo E., Espinosa I. Ovarian carcinomas: at least five different diseases with distinct histological features and molecular genetics//Hum. Pathol. 2018. Vol. 80. P. 11-27.
- Catasús L. et al. Molecular genetic alterations in endometrioid carcinomas of the ovary: Similar frequency of betacatenin abnormalities but lower rate of microsatellite instability and PTEN alterations than in uterine endometrioid carcinomas//Hum. Pathol. 2004. Vol. 35, № 11. P. 1360-1368.
- Wu R. et al. Mouse Model of Human Ovarian Endometrioid Adenocarcinoma Based on Somatic Defects in the Wnt/β-Catenin and PI3K/Pten Signaling Pathways//Cancer Cell. 2007. Vol. 11, № 4. P. 321-333.
- Willner J. et al. Alternate molecular genetic pathways in ovarian carcinomas of common histological types//Hum. Pathol. 2007. Vol. 38, № 4. P. 607-613.
- Catasus L. et al. PIK3C A mutations in the kinase domain (exon 20) of uterine endometrial adenocarcinomas are associated with adverse prognostic parameters//Mod. Pathol. 2008. Vol. 21, № 2. P. 131-139.
- Wiegand K.C. et al. ARID1A Mutations in Endometriosis-Associated Ovarian Carcinomas//N. Engl. J. Med. 2010. Vol. 363, № 16. P. 1532-1543.
- Guan B. et al. Roles of deletion of Arid1a, a tumor suppressor, in mouse ovarian tumorigenesis//J. Natl. Cancer Inst. 2014. Vol. 106, № 7. P. 9-12.
- Yamamoto S. et al. Loss of ARID1A protein expression occurs as an early event in ovarian clear-cell carcinoma development and frequently coexists with PIK3CA mutations//Mod. Pathol. Nature Publishing Group, 2012. Vol. 25, № 4. P. 615-624.
- Stamp J.P. et al. BAF250a Expression in Atypical Endometriosis and Endometriosis-Associated Ovarian Cancer//Int. J. Gynecol. Cancer. 2016. Vol. 26, № 5. P. 825-832.
- Mayr D. et al. KRAS and BRAF mutations in ovarian tumors: A comprehensive study of invasive carcinomas, borderline tumors and extraovarian implants//Gynecol. Oncol. 2006. Vol. 103, № 3. P. 883-887.
- Liu J. et al. Microsatellite instability and expression of hMLH1 and hMSH2 proteins in ovarian endometrioid cancer//Mod. Pathol. 2004. Vol. 17, № 1. P. 75-80.
- Rambau P.F. et al. Significant frequency of MSH2/MSH6 abnormality in ovarian endometrioid carcinoma supports histotype-specific Lynch syndrome screening in ovarian carcinomas//Histopathology. 2016. Vol. 69, № 2. P. 288-297.
- Shen J. et al. checkpoint blockade. 2018. Vol. 24, № 5. P. 556-562.
- Kaspar H.G., Crum C.P. The utility of immunohistochemistry in the differential diagnosis of gynecologic disorders//Arch. Pathol. Lab. Med. 2015. Vol. 139, № 1. P. 39-54.
- Chui M.H. et al. The Histomorphology of Lynch Syndrome -associated. 2014. Vol. 38, № 9. P. 1173-1181.
- Howitt B.E. et al. Clear cell ovarian cancers with microsatellite instability: A unique subset of ovarian cancers with increased tumor-infiltrating lymphocytes and PD-1/PD-L1 expression//Oncoimmunology. Taylor & Francis, 2017. Vol. 6, № 2. P. 1-4.
- Stewart C.J. R. et al. Long-term survival of patients with mismatch repair protein-deficient, high-stage ovarian clear cell carcinoma//Histopathology. 2017. Vol. 70, № 2. P. 309-313.
- Anglesio M.S. et al. Clear cell carcinoma of the ovary: A report from the first Ovarian Clear Cell Symposium, June 24th, 2010//Gynecol. Oncol. Elsevier Inc., 2011. Vol. 121, № 2. P. 407-415.
- Bennett J.A. et al. Clear cell carcinoma of the ovary: Evaluation of prognostic parameters based on a clinicopathological analysis of 100 cases//Histopathology. 2015. Vol. 66, № 6. P. 808-815.
- Oda K. et al. Genomics to immunotherapy of ovarian clear cell carcinoma: Unique opportunities for management//Gynecol. Oncol. Elsevier Inc., 2018. № xxxx.
- Kurman R.J., Shih I.M. Seromucinous tumors of the ovary. What»s in a name?//Int. J. Gynecol. Pathol. 2016. Vol. 35, № 1. P. 78-81.
- Hauptmann S. et al. Ovarian borderline tumors in the 2014 WHO classification: evolving concepts and diagnostic criteria//Virchows Arch. Virchows Archiv, 2017. Vol. 470, № 2. P. 125-142.
- Rambau P.F. et al. Morphologic reproducibility, genotyping, and immunohistochemical profiling do not support a category of seromucinous carcinoma of the ovary//Am. J. Surg. Pathol. 2017. Vol. 41, № 5. P. 685-695.
- Taylor J., Glenn McCluggage W. Ovarian seromucinous carcinoma: Report of a series of a newly categorized and uncommon neoplasm//Am. J. Surg. Pathol. 2015. Vol. 39, № 7. P. 983-992.
- Байрамова Н.Н., Протасова Л.Э., Раскин Г.А. и др. Атипический эндометриоз мочевого пузыря//Doctor.Ru. 2018. Т.6,№ 150. C.61-66. .


